泰泽隐孢子虫CP15基因的原核表达及抗血清制备
宋 悦,米荣升,赵 权,薛方民,苏庆美,黄 燕,游艳敏,陆 珂,韩先干,陈兆国
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所 农业部动物产品质量安全生物性危害因子风险评估实验室(上海) 农业部动物寄生虫学重点开放实验室,上海 200241;3. 山东英才学院,济南 250104;4. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
泰泽隐孢子虫CP15基因的原核表达及抗血清制备
宋 悦1,2,米荣升2,4,赵 权1,薛方民3,苏庆美2,黄 燕2,4,游艳敏2,陆 珂2,4,韩先干2,陈兆国2,4
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所 农业部动物产品质量安全生物性危害因子风险评估实验室(上海) 农业部动物寄生虫学重点开放实验室,上海 200241;3. 山东英才学院,济南 250104;4. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
将泰泽隐孢子虫(Cryptosporidium tyzzeri)CP15基因从pMD18-T-CP15重组质粒中切下,连接至pET-28a(+)原核表达载体,经酶切和测序鉴定正确后,转化到大肠埃希菌BL21(DE3)中进行诱导表达,表达产物进行SDS-PAGE和Western blot分析,并将纯化的重组蛋白免疫ICR小鼠制备多克隆抗体。结果显示,重组表达载体pET-28a-CP15在大肠杆菌中以可溶形式表达,表达蛋白分子量约为17 kDa。Western blot显示重组蛋白能被泰泽隐孢子虫感染小鼠血清所识别。ELISA结果显示重组蛋白免疫小鼠血清能和泰泽隐孢子虫卵囊可溶性抗原特异性反应,表明获得的重组蛋白具有较好的抗原性。
泰泽隐孢子虫;CP15;原核表达;多克隆抗体
1 材料与方法
1.1 实验材料 TaKaRa LA Taq酶、T4 DNA连接酶、限制性内切酶EcoR Ⅰ、Hind Ⅲ购自TaKaRa公司;dNTP、Agarose、EasyBlot ECL化学发光显色试剂盒购自上海生工生物工程有限公司;DNA Marker和四甲基联苯胺(TMB)购自天根生化科技(北京)有限公司;胶回收试剂盒DNA Gel Extraction K it购自Bay Gene Inc;蛋白分子量标准购自美国Thermo Fisher 公司,His树脂购自美国Novagen公司;弗氏完全佐剂、弗氏不完全佐剂、抗His单抗、HRP标记的兔抗鼠IgG、HRP 标记的兔抗牛IgG购自美国SIGMA公司;异丙基-β -D-硫代半乳糖苷(IPTG)购自上海拜力生物科技有限公司。质粒pET-28a(+)、大肠杆菌DH5α、BL21(DE3)、泰泽隐孢子虫感染的 ICR 小鼠血清、SPF小鼠血清、微小隐孢子虫感染的犊牛血清及微小隐孢子虫卵囊为中国农业科学院上海兽医研究所动物源性病原生物学及食品安全创新团队保存提供;含泰泽隐孢子虫CP15 基因的重组质粒pMD18-T-CP15 由中国农业科学院上海兽医研究所动物源性病原生物学及食品安全创新团队构建;其他试剂均为国产分析纯。
1.2 原核表达质粒的构建及鉴定 将鉴定正确的重组质粒pMD18-T-CP15 和原核表达载体pET-28a(+)分别用EcoR Ⅰ 和Hind Ⅲ进行双酶切,切胶回收目的片段,经T4 DNA连接酶连接后,将连接产物转入大肠杆菌DH5α感受态细胞中,用EcoR Ⅰ和Hind Ⅲ对抽提的重组质粒进行双酶切鉴定并送Invitrogen公司测序。鉴定正确后再转入大肠杆菌BL21(DE3)感受态细胞。
1.3 重组质粒的诱导表达及纯化 将鉴定正确的BL21 (DE3)转化菌经37℃、200 r/min 培养至OD600为0.5左右时,加入IPTG至终浓度为0.5 mmol/L,16℃、200 r/min诱导培养12 h。培养后取一小部分,冰浴超声裂解,裂解上清液用于分析重组蛋白的存在形式;其余用1×结合缓冲液(0.5 mol/L NC、20 mmol/L Tris-HCl、5 mmol/L咪唑,pH 7.9)充分悬浮诱导表达菌体,10 000×g离心30 min ,冰浴超声裂解,0.45 μ m滤膜过滤后的上清经Ni-NTA His Bind Resin 层析柱分步洗脱,收集目的蛋白洗脱液,SDS-PAGE分析重组蛋白的存在形式,并用BandScan软件分析蛋白的纯度。
1.4 重组蛋白的Western blot分析 纯化的重组蛋白经SDS-PA GE 电泳后,电转移至硝酸纤维素(PVDF)膜上。将PVDF膜浸在含5%脱脂奶粉的磷酸缓冲液PBST(含0.1 % Triton X-100 的PBS)中室温封闭2 h;经PBST洗涤3次,每次8 min,将PVDF膜与泰泽隐孢子虫感染小鼠血清(1:100 稀释)4℃过夜孵育,并以抗His单抗(1:1 000稀释)及未感染泰泽隐孢子虫的SPF小鼠血清(1:100稀释)作对照;PBST洗涤后再与HRP标记的兔抗鼠IgG(浓度均为1:1000)温育1 h,并用EasyBlot ECL化学发光显色试剂盒显色。
1.5 与抗微小隐孢子虫血清交叉反应的ELISA检测
将10 μ g/mL 的重组蛋白包被酶标板后4℃过夜,用含5%脱脂奶粉的PBS于37℃封闭2 h。然后与不同稀释度的微小隐孢子虫(C. parvum)感染犊牛血清37℃温育1 h,再与HRP 标记的兔抗牛IgG二抗(1: 1000稀释)于37℃温育1 h,用四甲基联苯胺底物缓冲液(TMB-H2O2)于37℃反应15 min,以2 mol/L H2SO4终止反应,测定吸光度(OD450),观察与感染微小隐孢子虫的犊牛血清的交叉反应情况。
1.6 小鼠抗重组CP15蛋白血清的制备 用纯化的重组蛋白皮下多点免疫16只ICR小鼠,首免取100 μ g重组蛋白加等量的完全弗氏佐剂充分乳化后免疫ICR小鼠;2周后二免,取首免剂量的1/2与等量的不完全弗氏佐剂充分乳化后加强免疫;再过2周进行三免,与二免方式完全相同。三免后7 d采血,按常规方法分离血清,置-20℃保存备用。
1.7 抗血清效价的测定 将纯化的泰泽隐孢子虫卵囊冰浴超声10 min,再反复冻融3次,以10 800×g离心30 min后取上清,进行SDS-PAGE电泳。然后用ELISA法检测抗血清的效价,其中包被抗原为30 μ g/mL泰泽隐孢子虫卵囊可溶性抗原;一抗为不同稀释倍数的鼠抗重组CP15(rCP15)多抗血清,并以不同稀释倍数的SPF ICR小鼠血清作对照;二抗为HRP标记的兔抗小鼠IgG抗体(1:1000),其他方法同1.5。组间差异利用SPSS 21软件,以单因素方差分析法进行统计学差异分析。
2 结果
2.1 重组质粒pET-28a(+)-CP15的双酶切鉴定 将含泰泽隐孢子虫CP15基因的重组质粒pET-28a(+)-CP15 用EcoR Ⅰ和Hind Ⅲ进行双酶切,得到两条带,其中目的片段大小约为392 bp,与预期大小一致(图1)。将测序结果与pMD18-T-CP15序列测定结果进行比对,结果外源基因序列完全一致。
人工受精实验室,与胚胎实验室的功能不同,在布局的过程当中,设计人员要打造一个功能更为完整的实验室区域保证人工受精实验室中的取精室与精液处理室不能够同时使用,而患者通道、医生通道与术后休息场所能够共同使用[2]。
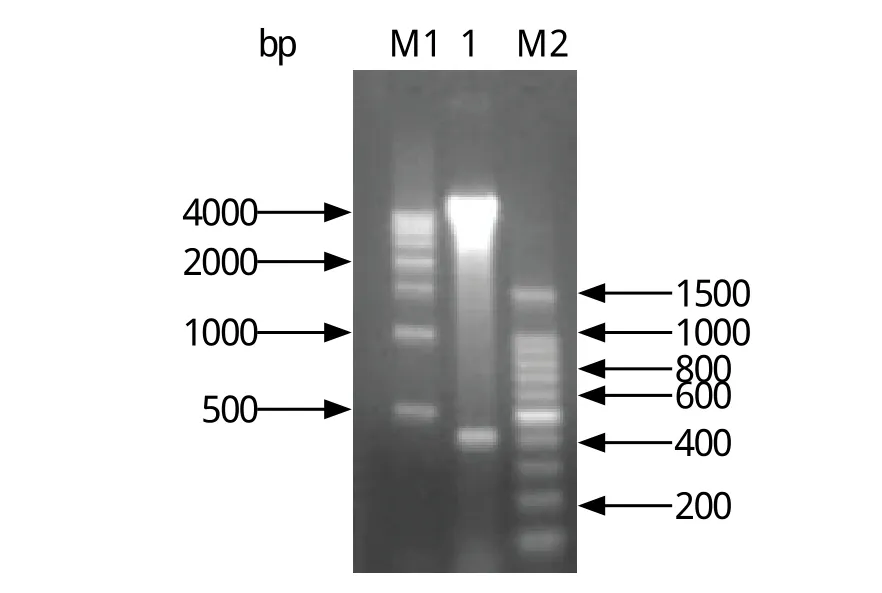
图1 重组质粒pET-28a(+)-CP15双酶切产物电泳结果Fig.1 Identification of recombinant pET-28a (+)-CP15 plasmid digested by restriction enzymes1: 重组质粒pET-28a(+)-CP15双酶切产物; M1: DNA分子量标准(500 bp); M2: DNA分子量标准(100 bp)1: Recombinant plasmid pET-28a(+)-CP15 digested with restriction enzymes; M1: DNA Ladder(500 bp); M2: DNA Ladder(100 bp)
2.2 重组质粒转化菌的诱导表达及表达产物的纯化
将重组质粒pET-28a(+)-CP15 转化入大肠杆菌BL21 (DE3),用IPTG 在16℃条件下诱导表达12 h,His树脂亲和纯化产物进行SDS-PAGE,出现1 条大小约为17 kDa目的条带(图2),与预期结果相符。表达形式分析结果显示,该蛋白为可溶性表达。
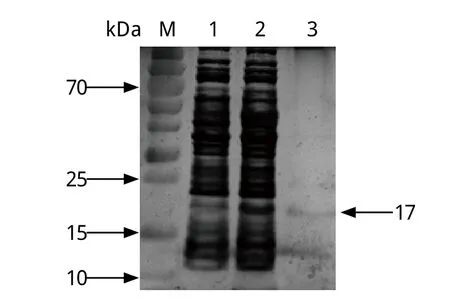
图2 重组CP15表达产物的SDS-PAGE电泳Fig.2 SDS-PAGE analysis of recombinant CP15 proteinM: 蛋白质分子量标准; 1: 未诱导的pET-28a(+)-CP15转化菌裂解产物; 2: 诱导的pET-28a(+)-CP15转化菌裂解上清液; 3: 纯化的重组蛋白M: Low range protein ladder; 1: Lysate of recombinant plasmid pET-28a(+)-CP15 transferred bacteria before induction; 2: Supernate of recombinant plasmid pET-28a(+)-CP15 transferred bacteria induced with IPTG for 12 h; 3: Purified recombinant protein
2.3 Western blot分析 将纯化的重组蛋白分别与泰泽隐孢子虫感染血清和抗His单抗作用,结果显示,rCP15与泰泽隐孢子虫感染小鼠阳性血清及抗His单抗均发生反应,而不与未感染泰泽隐孢子虫的小鼠血清发生反应(图3)。
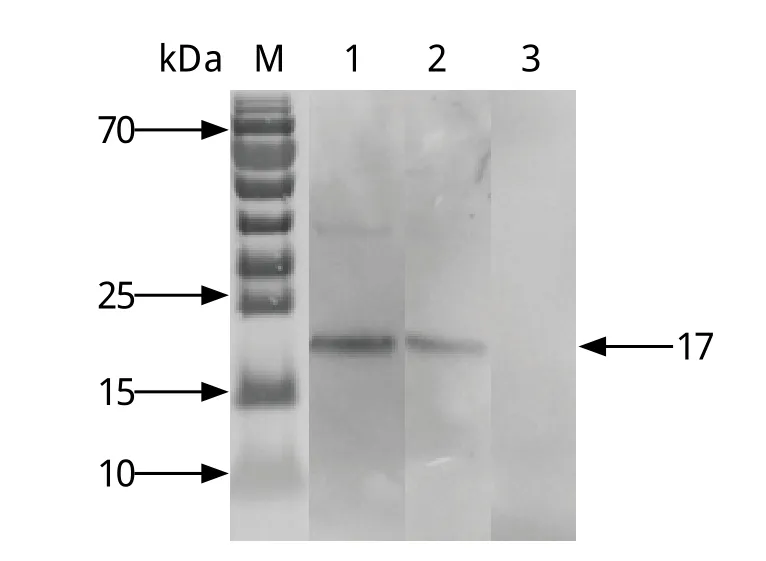
图3 重组表达产物的Western blot分析Fig.3 Western blot analysis of the expressed products M: 蛋白质分子量标准; 1: 抗His单抗; 2: 泰泽隐孢子虫感染鼠血清; 3: 未感染泰泽隐孢子虫的SPF鼠血清M: Low range protein ladder; 1: Anti-His monoclonal antibody;2: Sera from mouse infected with C. tyzzeri; 3: Sera from SPF mouse without infection with C. tyzzeri
2.4 与微小隐孢子感染血清的交叉反应 用纯化的rCP15包被酶标板,对微小隐孢子感染的犊牛血清进行ELISA检测。结果显示,rCP15能与微小隐孢子虫感染血清反应,血清经1:1600稀释后,感染组OD450值仍高于未感染对照组,差异具有极显著统计学意义(p < 0.001)(表1)。
2.5 多克隆抗体的制备 以泰泽隐孢子虫卵囊可溶性抗原(图4)包被酶标板,用纯化的rCP15 免疫的小鼠血清进行ELISA检测。结果显示,经纯化的重组蛋白3次免疫后,小鼠产生了较高效价的抗血清,血清经1:1600稀释后,OD450仍高于阴性对照组(P < 0.001),差异具有极显著统计学意义(表2)。
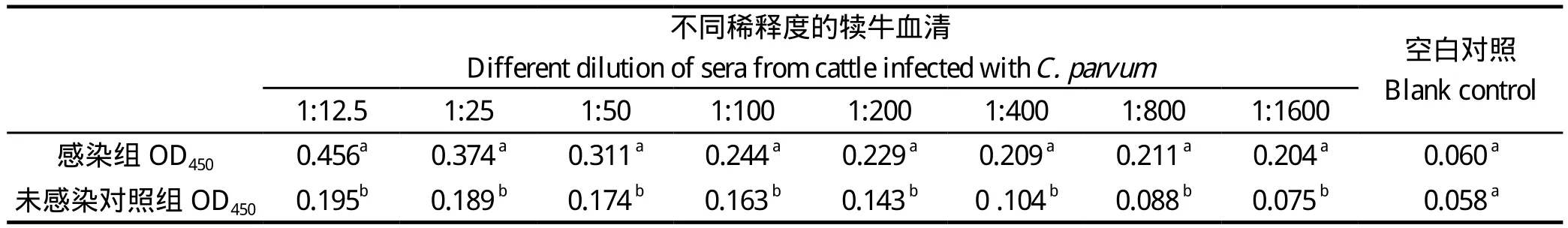
表1 与感染C. parvum犊牛血清交叉反应的ELISA检测Table 1 ELISA result of cross-reaction of sera from C.parvum infected cattle with rCP15
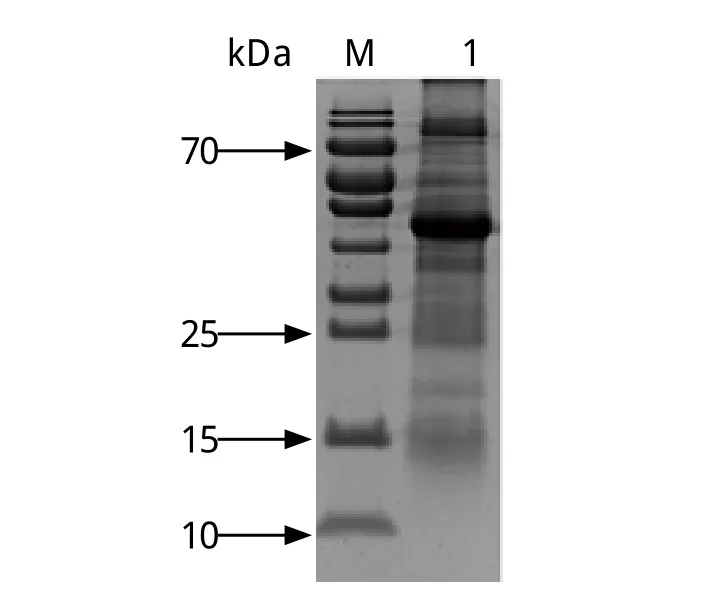
图4 泰泽隐孢子虫卵囊可溶性抗原的SDS-PAGE分析Fig. 4 SDS-PAGE of soluble antigen of C. tyzzeri oocystsM: 蛋白质分子量标准; 1: 泰泽隐孢子虫卵囊可溶性抗原(8 μ g/孔)M: Low molecular protein Marker; 1: Soluble antigen of C. tyzzeri oocysts(8 μ g/Well)
3 讨论
隐孢子虫病是一种具有重要公共卫生意义的人兽共患病,迄今尚无有效的治疗药物和疫苗,因此,发展诊断和预防技术具有重要意义。传统的隐孢子虫检测方法主要为染色后镜检或直接镜检法,不仅费时费力,且检出率低。分子生物学方法如PCR等,具有较高的敏感性和特异性,但对仪器设备的要求高,基层难以推广。免疫学方法,如ELISA、免疫荧光等,具有特异性和敏感性高、操作简便的特点,适合现场推广。大量制备高质量、高免疫原性的诊断抗原是建立灵敏性高、特异性强的免疫学方法的关键,也是研发高效疫苗的基础。由于隐孢子虫的体外培养迄今仍不成熟,繁殖卵囊仍主要依赖于动物感染,不仅费时、费力,且生产成本很高,不适宜于大规模生产。通过体外表达获得重组诊断抗原,不仅具有高敏感性、特异性,还具有明显的省时、省力、经济、易于控制抗原质量等优势。
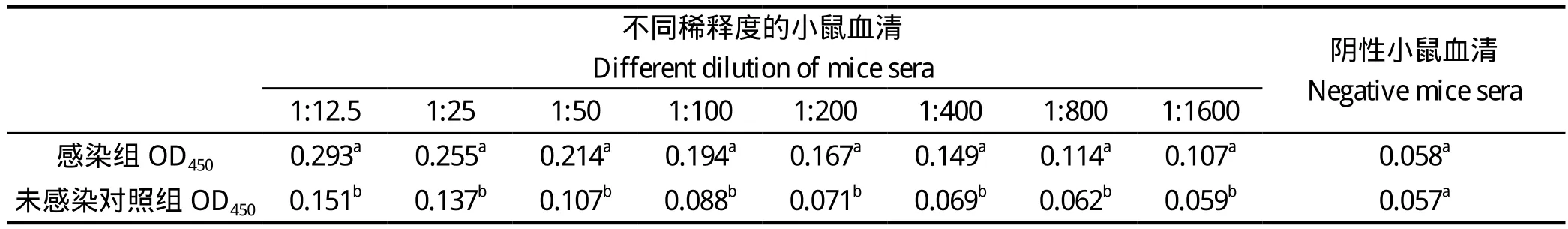
表2 免疫小鼠血清抗体效价的ELISA检测Table 2 ELISA detection of antibody titer of immunized mice sera
米荣升等[11]研究发现,与微小隐孢子虫CP15基因核苷酸序列相比,泰泽隐孢子虫CP15基因仅存在3个碱基的变异,同源性为99.23%,而且这3个碱基的差异并没有导致密码子的改变,推测氨基酸序列的同源性为100%;与兔隐孢子虫、母猪隐孢子虫相比,也仅存在8和5个碱基的变异,编码氨基酸的同源性分别为97.96%和98.72%。可见,CP15蛋白在不同隐孢子虫种间高度保守,利用该抗原作为诊断和疫苗候选分子,具有显著的优势。
微小隐孢子虫CP15基因已有克隆、表达的报道[12],但尚未见泰泽隐孢子虫CP15基因表达的报道。本研究将从上海市分离的泰泽隐孢子虫卵囊DNA扩增的CP15基因亚克隆到pET-28a(+)中,序列测定显示,其插入方向与蛋白读码框均正确,His-标鉴位于重组蛋白的N端,编码区下游含有终止密码子TAA。将构建的重组质粒转入大肠杆菌中,在低温状态下诱导,结果成功地实现了可溶性表达,表达产物的分子量约为17 kDa,与预期大小一致。Western blot分析结果表明,低温诱导表达的可溶性重组蛋白具有良好的反应原性,能被泰泽隐孢子虫感染的小鼠血清所识别。采用间接ELISA方法对微小隐孢子虫感染犊牛血清进行交叉反应检测,结果表明,纯化的重组蛋白能与微小隐孢子虫感染的犊牛血清发生反应,且感染血清的效价明显高于阴性血清的效价。经单因素方差分析,感染组各稀释度血清与未感染组相比, 差异均具有极显著统计学意义( P < 0.001),提示重组蛋白在不同种间存在交叉反应现象,此结果也进一步证实了米荣升等[11]研究结果,即在不同隐孢子虫种间,CP15抗原是一个保守蛋白的预测。因此,该蛋白具有检测隐孢子虫属其他种的潜力。同时,由于微小隐孢子虫表面抗原CP15 是一个较好的疫苗侯选抗原,那么泰泽隐孢子虫CP15也可能对其他隐孢子虫种具有交叉免疫保护作用,这为开展泰泽隐孢子虫rCP15的免疫保护研究打下了基础。
本研究将重组蛋白免疫ICR小鼠制备了抗rCP15的血清。间接ELISA方法检测显示,制备的抗血清能与泰泽隐孢子虫卵囊可溶性抗原反应。经单因素方差分析,各稀释度免疫血清与未免疫组相比, 差异均具有极显著统计学意义( P < 0.001),该抗血清的制备,为下一步开展隐孢子虫诊断、检测,以及开展CP15定位、功能和特性研究提供了重要材料。
综上所述,本研究构建了泰泽隐孢子虫CP15基因的原核表达载体,成功实现了该基因的可溶性原核表达,表达产物具有良好的免疫原性,并与微小隐孢子虫具有交叉反应,为进一步开展CP15功能和特性,以及利用该重组蛋白进行免疫预防研究奠定了基础。
[1] O’Donoghue P J. Cryptosporidium and Cryptosporidiosis in man and animals[J]. Int J Parasitol, 1995, 25(2): 139~195.
[2] Saviolo L, Smith H, T hompson A. Giardia and Cryptosporidium join the‘Neglected Diseases Initiative’[J]. Trends Parasitol, 2006, 22(5): 203-208.
[3] 石凯, 江克君. 隐孢子虫病的防治[J]. 中国动物检疫, 2014, 31(5): 37~40.
[4] Reperant JM, Naciri M, Chardes T, et al. Immunological characterization of a 17-kD a antigen from Cryptosporidium parvum recognized early by mucosal IgA antibodies[J]. FEMS Microbiol Lett, 1992, 78(1): 7~14.
[5] Tilley M, Upton S J. Both CP15 and CP25 are left as trails behind gliding sporozoites of Cryptosporidium parvum (Apicomplexa)[J]. FEMS Microbiol Lett, 1994, 120(3): 275~278.
[6] Jenkin M C, Fayer R. Cloning and expression of cDNA encoding an antigenic Cryptosporidium parvum protein[J]. Mol Biochem Parasitol, 1995, 71(1): 149~152.
[7] Sagodira S, Iochmann S, Mevelec MN, et al. Nasal immunization of mice with Cryptosporidium parvum DNA induces systemic and intestinal immune responses[J]. Parasite Immunol, 1999, 21(10): 507-516.
[8] Moss D M, Chappell C L, Okhuysen P C, et al. The antibody response to 27-, 17-, and 15-kDa Cryptosporidium antigens following experimental infection in humans[J]. J Infect Dis, 1998, 178(3): 827-833.
[9] Sagodira S, Buzoni-Gatel D, Iochmann S, et al. Protection of kids against Cryptosporidium parvum infection after immunization of dams with CP15-DNA[J]. V accine, 1999, 17(19): 2346-2355.
[10] J enkins M C. Present and future control of cryptosporidiosis in humans and animals[J]. Expert Rev Vaccines, 2004, 3(6): 669-671.
[11] 米荣升, 陈兆国, 岳城, 等. 微小隐孢子虫子孢子表面抗原CP1 5基因的克隆及核苷酸序列分析[J]. 中国兽医寄生虫病, 2007, 15(3): 1-6.
[12] 满达, 兰丽, 王艳霞, 等. 牛微小隐孢子虫表面抗原CP15基因原核表达及其表达产物的鉴定[J]. 中国畜牧兽医, 2012, 39(6): 50-53.
PROKARYOTIC EXPRESSION AND ANTISERUM PREPARATION OF CRYPTOSPORIDIUM TYZZERI CP15
SONG Yue1,2, MI Rong-sheng2,4, ZHAO Quan1, XUE Fang-min3, SU Qing-mei2, HUANG Yan2,4, YOU Yan-min2, LU Ke2,4, HAN Xian-gan2, CHEN Zhao-guo2,4
(1. Animal Science and Technology College, Jilin Agricultural University, Changchun 130118, China; 2. Key Laboratory of Animal Parasitology of Ministry of Agriculture, Laboratory of Quality and Safety Risk Assessment for Animal Products on Biohazards (Shanghai) of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3. Shandong Yingcai University, Jinan 250104, China; 4. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
In order to express CP15 gene of Cryptosporidium tyzzeri in prokaryotic expression system, CP15 gene was digested from recombinant pMD18-T-CP15 and cloned to the prokaryotic expression vector pET-28a(+). The recombinant pET-28a-CP15 was identified with restrict enzyme digestion and sequencing and then transfected into E. coli BL21 (DE3). The protein expression was induced with IPTG and visualized in SDS-PAGE and Western blot. The results showed that the plasmid pET-28a-CP15 was expressed in E. coli BL21 (DE3) and recombinant CP15 protein (rCP15) was soluble. The recombinant rCP15 was measured to be about 17 kDa in SDSPAGE and reacted with positive mouse antiserum in Western blot. The purified rCP15 was used to immunize ICR mice to preparepolyclonal antibodies, which reacted in ELISA with soluble antigen of C. tyzzeri oocysts. These results showed that the rCP15 had a good antigenicity.
Cryptosporidium tyzzeri; CP15; prokaryotic expression; polyclonal antibody
S852.723
A
1674-6422(2017)02-0066-06
2016-11-11
上海市科技兴农重点攻关项目(沪农科攻字(2015)第1-10号,(2005)第3-4号);国家农产品质量安全风险评估项目(GJFP201600703,GJFP201700703);国家自然科学基金项目(31302083);中央级公益性科研院所基本科研业务费(2016JB13);闵行区高层次人才科研项目团队资助
宋悦,女,硕士研究生,预防兽医学专业
赵权,E-mail:zhaoquan0825@163.com;陈兆国,E-mail:zhaoguochen@shvri.ac.cn

