PRRSV强弱毒体外诱导IL-10产生差异的分子基础研究
夏天奇,姜一峰,虞凌雪,周艳君,杨 莘,高 飞,李丽薇,曲泽慧,童光志,2
(1.中国农业科学院上海兽医研究所,上海200241;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
PRRSV强弱毒体外诱导IL-10产生差异的分子基础研究
夏天奇1,姜一峰1,虞凌雪1,周艳君1,杨 莘1,高 飞1,李丽薇1,曲泽慧1,童光志1,2
(1.中国农业科学院上海兽医研究所,上海200241;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染后能够引发机体产生免疫抑制,IL-10在病毒介导的免疫抑制中起重要作用。PRRSV HuN4株感染PAM细胞后能够诱导IL-10高水平表达,而其传代致弱毒株HuN4-F112感染PAM细胞后IL-10表达水平很低。本研究以PRRSV HuN4株及HuN4-F112株为研究对象,对其感染PAM细胞后IL-10上游关键因子表达差异进行研究,揭示诱导IL-10产生差异的分子基础。结果显示,PRRSV强弱毒感染PAM细胞后,强毒HuN4株诱导TLR2与TLR4转录水平显著高于弱毒HuN4-F112株,TLR3、TLR7和TLR9转录水平则无显著差异;强毒HuN4株感染PAM细胞后,其p38磷酸化水平显著高于弱毒HuN4-F112株,而ERK磷酸化水平差异不具备显著统计学意义。结果提示,PRRSV强弱毒株感染PAM细胞诱导IL-10表达水平的差异推测是由于强弱毒诱导p38 MAPK磷酸化水平差异造成的。
PRRSV;IL-10;PAMs;p38 MAPK
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是有囊膜的单股正链RNA病毒[1]。PRRSV基因组含有10个开放阅读框,可形成至少14种非结构蛋白(Nsp1α、Nsp1β、Nsp1~Nsp6,Nsp7α,Nsp7β、Nsp8~Nsp12)和8种结构蛋白(GP2a、E、GP3、GP4、GP5、GP5a、M和N蛋白)[2, 3]。
2006年中国爆发了由高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)引起的高致病性猪繁殖与呼吸综合征,给养猪业造成巨大经济损失[4]。HPPRRSV与经典PRRSV相比,致病性和传播能力更强,可引发机体产生更严重的免疫抑制和炎性反应[5]。检测PRRSV感染后的PAM细胞、外周血单核细胞、成熟的树突状细胞IL-10基因和蛋白表达水平均呈上升趋势[6-8]。IL-10是重要的免疫调节因子,能够抑制炎性因子IL-1α、IL-1β、IL-6、IL-12、IL-18和TNF-α的分泌,以及抑制细胞因子IL-2、IL-4、IL-5、IFN-γ的产生,同时还可以调节T细胞和巨噬细胞的分化[9]。PRRSV感染引起的对免疫系统的抑制与IL-10的表达水平密切相关,IL-10的升高往往与低水平的IFN-γ表达相互关联[10]。本实验室前期研究显示,强毒株HuN4及其传代致弱病毒HuN4-F112体内感染猪后,HuN4株能够诱发高水平的IL-10表达,而HuN4-F112感染后IL-10表达水平则很低。为探究PRRSV强弱毒感染后诱导IL-10产生的分子机理,以PRRSV HuN4株强毒以及HuN4-F112株弱毒为研究对象,对其感染PAM细胞后IL-10上游关键因子表达差异进行研究。
1 材料和方法
1.1 病毒株、细胞及主要试剂 PRRSV HuN4强毒株由本实验室分离并保存;弱毒株HuN4-F112是由PPRSV 强毒株HuN4在MARC-145细胞上连续传代112代获得的;14日龄PRRSV抗原抗体阴性,猪瘟病毒(Classical swine fever virus,CSFV)、伪狂犬病病毒(Pseudorabies virus,PRV)和猪圆环病毒2型(Porcine circovirus type 2,PCV2)抗原阴性仔猪购自上海周边猪场;RNA 提取试剂盒 RNeasy mini kit 购自Qiagen 公司;RevertAid First Strand cDNA Synthesis Kit 购自Thermo 科技公司;SYBR® Premix Ex Taq(Tli RNaseH Plus)购自TaKaRa公司;Swine IL-10 ELISA试剂盒购于Invitrogen公司; Amicon ultra-0.5 mL离心超滤管-蛋白浓缩管购于前程生物科技有限公司;磷酸酶抑制剂 Cocktail和蛋白酶抑制剂Cocktail购于Biotool公司;抗磷酸化p38 MAPK、抗磷酸化Erk1/2以及Erk1/2非磷酸化隆抗体购于Cell Signaling公司;脱脂牛奶和牛血清白蛋白(BSA)购于Sigma-Aldrich公司;增强型ECL发光试剂盒和RIPA细胞裂解液购于Thermo Fisher公司。
1.2 猪肺泡巨噬细胞(Porcine aweolar macrophage,PAM)的获取 选取14日龄左右的PRRSV抗原抗体阴性仔猪,前腔动脉放血致死,无菌取出肺脏,用含2%双抗的PBS反复冲洗肺脏。将获得的灌洗液室温400×g离心10 min,弃掉上清沉淀用适量含2%双抗和10%胎牛血清的RPMI 1640培养基重悬后计数,按5×106/孔的细胞数铺于6孔板中,置37℃含5 % CO2培养箱中连续培养24 h。
1.3 病毒感染 用无血清RPMI 1640培养基洗涤培养24 h后的PAM细胞2次,以2 MOI/孔剂量接种病毒HuN4和HuN4-F112,同时设置无病毒感染PAM细胞的空白对照。病毒吸附1 h后用无血清RPMI 1640培养基洗涤2次,加入含1% 双抗和2%胎牛血清的RPMI 1640培养基于37℃含5% CO2的培养箱中继续培养。在PRRSV感染PAM细胞后4、8、12、16、20、24 h,分别收取细胞和细胞上清样品,进行总RNA提取,Western blot分析并检测IL-10的RNA转录水平和蛋白含量。
1.4 细胞总RNA的提取及cDNA合成 按照QIAGEN
RNeasy mini kit说明书提取总RNA。以总RNA为模板反转录体系按照Thermo Scientific RevertAid First Strand cDNA Synthesis Kit试剂盒说明书操作合成cDNA。
1.5 实时荧光定量PCR 参照说明书推荐的25 μ L反应体系:SYBR® Premix Ex Taq(Tli RNaseH Plus)12.5 μ L、上下游引物(10 pmol/μ L)各0.5 μ L、 cDNA 2 μ L,加ddH2O补至25 μ L。每个样品做3个重复,并选择3孔不加样品只加水作为阴性对照。各管充分混匀置于Eppendorf Mastercycler ep realplex 4荧光定量PCR仪中。反应条件:95℃预变性30 s;95℃变性5 s;60℃退火34 s,共40个循环。mRNA的相对表达水平采用2-△△Ct计算分析。引物序列由Invitrogen上海公司合成,见表1。
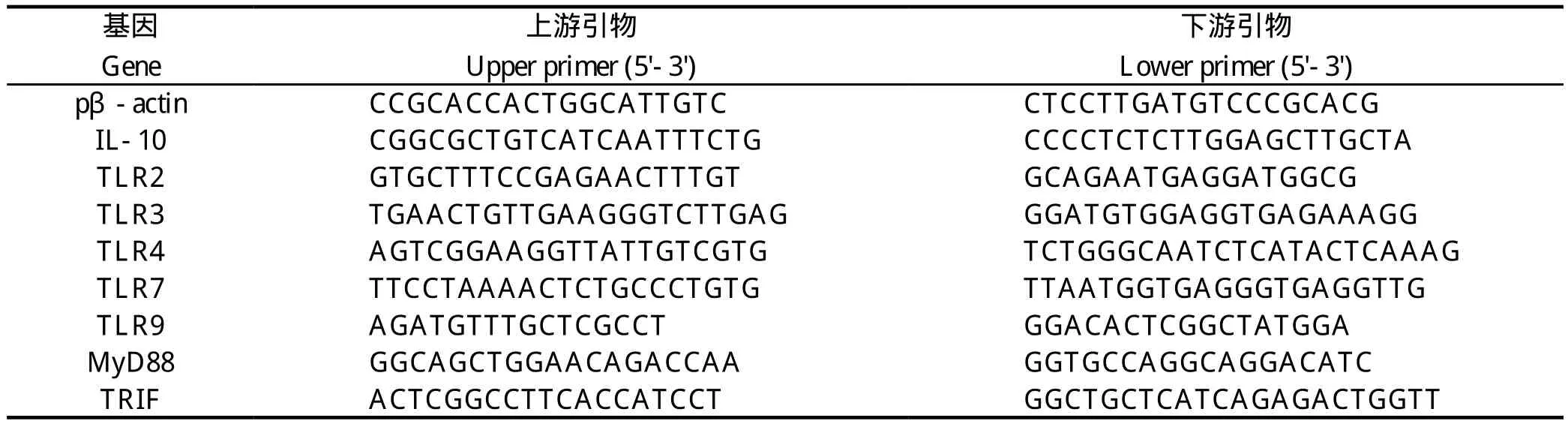
表1 荧光定量引物序列Table 1 The sequences of primers used in this study for Real-time RT-PCR
1.6 ELISA检测IL-10蛋白 取500 μ L PAM细胞培养上清置于离心超滤管10 800×g离心10 min,弃掉滤液,再加500 μ L PAM细胞培养上清,10 800×g离心10 min,弃掉滤液,再重复1次,获得浓缩的PAM细胞培养上清后用商品化的Invitrogen swine IL-10 ELISA试剂盒检测IL-10蛋白含量,严格按照说明书进行操作。
1.7 裂解细胞和Western blot分析 用含有蛋白酶抑制剂Cocktail和磷酸酶抑制剂 Cocktail的RIPA细胞裂解液裂解PRRSV感染不同时间段的PAM细胞,收集细胞样品进行SDS-PAGE凝胶电泳后,用Bio-rad的半干转膜仪转到PVDF膜上,用p38以及ERK的抗体进行Western blot分析。很低,与细胞对照组的差异不具备显著统计学意义(图1)。
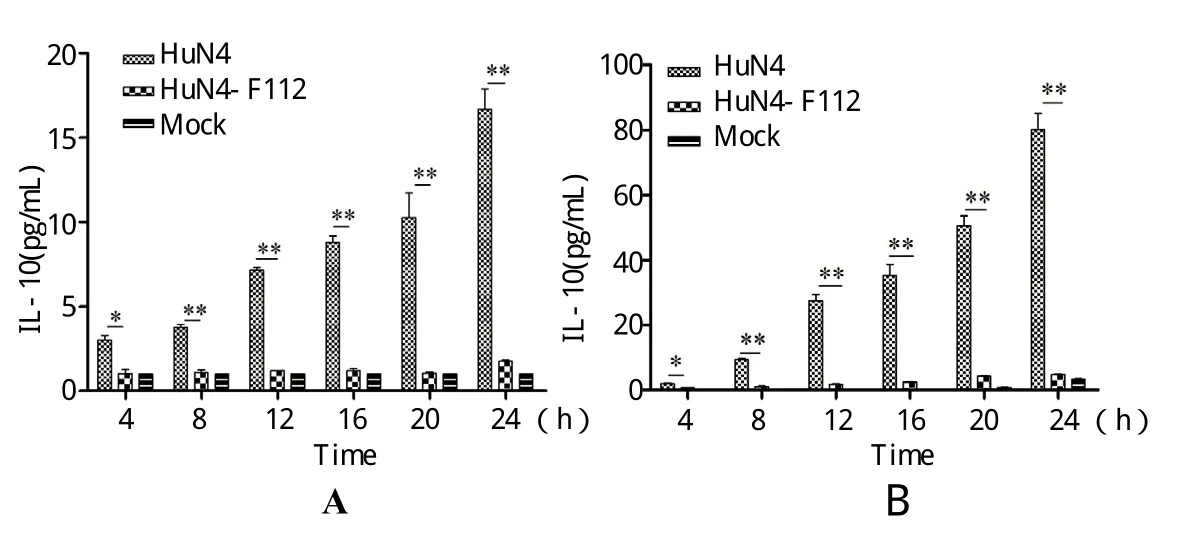
图1 PRRSV HuN4株感染PAM细胞后IL-10的表达Fig.1 IL-10 expression in PAMs infted with PRRSV HuN4(* P<0.05; ** P<0.01)A: 上调IL-10 mRNA水平; B: 上调IL-10蛋白水平A: Up-regulated IL-10 mRNA level; B: Up-regulated IL-10 protein level
2 结果
2.1 PRRSV强弱毒感染PAM细胞后IL-10的表达水平存在明显差异 实时荧光定量RT-PCR和ELISA检测结果显示,HuN4强毒株感染后8 h,IL-10表达水平显著升高,明显高于弱毒株HuN4-F112和细胞对照差异具有显著统计学意义。HuN4-F112弱毒株感染PAM细胞后,Il-10表达在mRNA水平和蛋白水平都
2.2 PRRSV强弱毒感染PAM细胞TLR出现差异表达
在巨噬细胞中,IL-10的表达受TLR依赖途径调控。我们对TLR依赖途径中的TLR2、TLR3、TLR4、TLR7和TLR9的转录水平进行研究。结果显示,HuN4感染PAM细胞后相对于HuN4-F112,TLR2与TLR4显著上调,而TLR3、TLR7和TLR9差异不具备显著统计学意义(图2)。
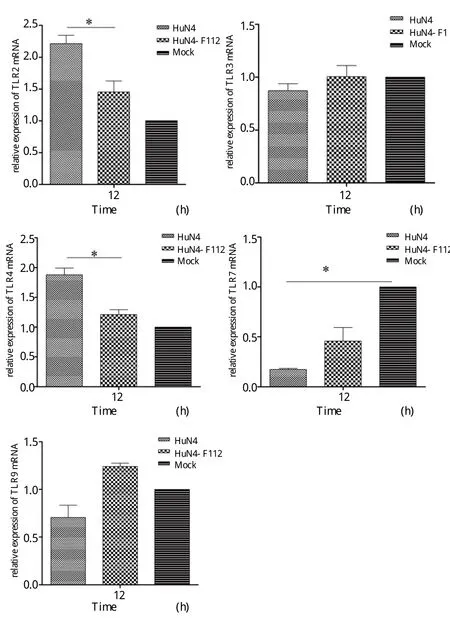
图2 PRRSV HuN4株和HuN4-F112株感染PAM细胞后TLR的表达(* P<0.05)Fig.2 TLR expressions in PAMs infected with HuN4 and HuN4-F112 in PAMs(* P<0.05)
2.3 PRRSV强弱毒感染PAM细胞后MyD88和TRIF表达不同 对TLRs下游的重要调节因子MyD88和TRIF表达水平检测结果显示,HuN4感染PAM细胞后相对于HuN4-F112,TRIF转录水平显著上调,而MyD88转录水平差异不具备显著统计学意义(图3)。
2.4 PRRSV强毒感染PAM细胞后激活p38MAPK通路对IL-10通路TLR下游重要的调控因子ERK及p38进行Western blot检测。结果显示,无论是PRRSV强毒株HuN4还是弱毒株HuN4-F112,感染后均未对ERK表达水平的产生影响,但强毒HuN4感染后相对于弱毒感染和空白对照,p38磷酸化水平显著上调而弱毒感染后p38磷酸化水平未见明显上调(图4、5)。
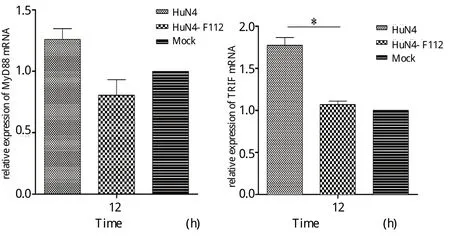
图3 PRRSV感染PAM细胞后MyD88和TRIF受体的表达(* P<0.05)Fig.3 Activation of MyD88 and TRIF after infected with HuN4 and HuN4-F112 in PAMs (* P<0.05)
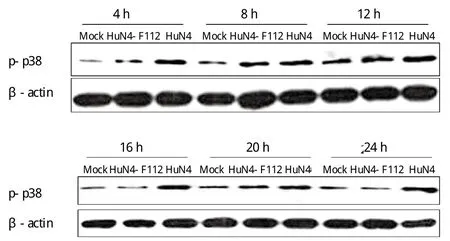
图4 HuN4感染PAM细胞后激活的p38 MAPK信号通路Fig.4 p38 MAPK signaling pathway in PAMs activated by PRRSV HuN4 infection
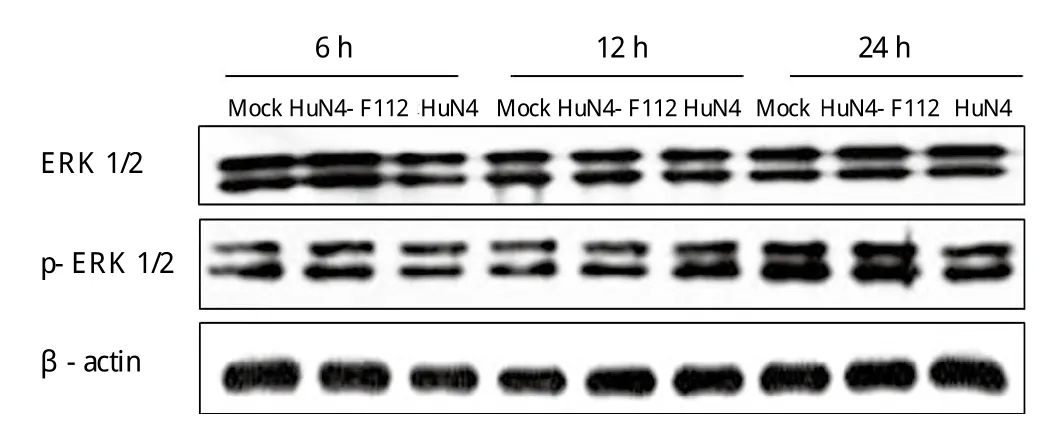
图5 HuN4感染PAM细胞后未激活ERK信号通路Fig.5 Unactivated ERK signaling pathway in PAMs by PRRSV HuN4 infection
3 讨论
PRRSV通过对机体免疫系统的调节、延迟或者降低相关细胞因子的表达水平以及中和抗体产生时间和强度,这种调节的结果导致免疫抑制,使病毒获得免疫逃避,引发持续感染和继发感染成为困扰PRRSV防控的重要问题[11]。
研究结果显示PRRSV感染引起的对免疫系统的抑制与IL-10的表达水平密切相关[10,12]。IL-10属于Ⅱ型细胞因子,主要由DC细胞、T细胞、B细胞、单核细胞以及刺激后的巨噬细胞产生[13],能够抑制炎性因子IL-1α、IL-1β、IL-6、IL-12、IL-18、TNF-α的分泌,以及抑制细胞因子IL-2、IL-4、IL-5、IFN-γ的产生,同时还可以调节T细胞和巨噬细胞的分化[8],IL-10通过对细胞因子和细胞分化的调节实现机体的免疫抑制。本实验室前期结果证实,PRRSV HuN4强弱毒株体内感染猪后诱导IL-10产生水平不同,强毒株HuN4能够诱导高水平的IL-10表达,而弱毒株HuN4-F112诱导IL-10产生水平很低。为探寻PRRSV强弱毒株诱导IL-10产生差异的分子机制,本试验在体外对PRRSV HuN4强、弱毒感染PAM后诱导IL-10产生情况进行了研究。结果表明,与体内试验结果相似,PRRSV HuN4株强弱毒株感染PAM细胞后,诱导IL-10产生水平存在明显差异,强毒株感染后IL-10转录和表达水平均有显著上调,而弱毒株感染后则无明显变化。继而,我们对强、弱毒株感染PAM细胞后IL-10通路调节情况进行研究。IL-10的诱导表达有TLR依赖途径和非依赖途径[14]。在巨噬细胞中主要是TLR依赖途径,TLRs的活化从而导致ERK、p38、NF-κ B通路的活化进而诱导IL-10的表达,在巨噬细胞中参与IL-10表达的TLR受体有TLR2、TLR3、TLR4、TLR9[15]。本研究结果显示HuN4感染PAM细胞12 h后,相对于HuN4-F112和空白细胞对照,TLR2与TLR4上调,TLR7下调,而TLR3和TLR9没有明显差异,提示TLR2和TLR4可能参与了PRRSV感染PAM细胞后IL-10的上调表达有报道显示在PRRSV感染外周血单核细胞中也得到了相似结果[7]。MAPKs家族对病毒诱导IL-10的表达至关重要,不同的病毒通过不同的MAPKs通路调控IL-10的表达。先前有研究证实PRRSV诱导IL-10的产生与p38信号通路有关,而与JNK和ERK1/2通路无关[14, 15]。本研究也发现强毒HuN4感染PAM细胞后能够显著激活p38磷酸化水平株,而弱毒株感染后p38磷酸化水平未见明显改变。强、弱毒ERK 1/2磷酸化水平未见明显变化,说明HuN4感染PAM细胞有可能通过p38途径上调IL-10的表达而不是ERK途径,这个结果与Song等[15]的研究结果相一致,但本研究中PRRSV感染PAM细胞12 h后未检测到MyD88显著上调,而TRIF却是上调的,这可能与毒株特异性有关。本研究进一步发现强、弱毒引起IL-10表达水平差异同样与p38 MAPK磷酸化水平差异有关。细胞信号通路的调控机制非常复杂,关于PRRSV HuN4株强弱毒体外诱导IL-10产生差异的机制需要后续进行更深入的探讨。
[1] Snijder E J, Meulenberg J J. The molecular biology of arteriviruses[J]. J Gen Virol, 1998, 79 ( Pt 5): 961-979.
[2] Music N, Gagnon C A. The role of porcine reproductive and respiratory syndrome (PRRS) virus structural and non-structural proteins in virus pathogenesis[J]. Anim Health Res Rev, 2010, 11(2): 135-163.
[3] Firth A E, Zevenhoven-Dobbe J C, Wills N M, et al. Discovery of a small arterivirus gene that overlaps the GP5 coding sequence and is important for virus production[J]. J Gen Virol, 2011, 92(pt5): 1097-1106.
[4] Tong G Z, Zhou Y J, Hao X F, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J]. Emerg Infect Dis, 2007, 13(9): 1434-1436.
[5] 童光志, 周艳君, 郝晓芳, 等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J]. 中国预防兽医学报, 2007 (5): 323-327.
[6] Gomez-L aguna J, Salguero F J, Barranco I, et al. Cytokine expression by macrophages in the lung of pigs infected with the porcine reproductive and respiratory syndrome virus[J]. J Comp Pathol, 2010, 142(1): 51-60.
[7] Suradhat S, Thanawongnuwech R, Poovorawan Y. Upregulation of IL-10 gene expression in porcine peripheral blood mononuclear cells by porcine reproductive and respiratory syndrome virus[J]. J Gen Virol, 2003, 84(pt10): 453-459.
[8] Flores-Mendoza L, Silva-Campa E, Resendiz M, et al. Porcine reproductive and respiratory syndrome virus infects mature porcine dendritic cells and up-regulates interleukin-10 production[J]. Clin V accine Immunol, 2008, 15(4): 720-725.
[9] Zhang W, X u W, X iong S. Macrophage differentiation and polarization via phosphatidylinositol 3-kinase/Akt-ERK signaling pathway conferred by serum amyloid P component[J]. J Immunol, 2011, 187(4): 1764-1777.
[10] Barranco I, Gomez-Laguna J, Rodriguez-Gomez I M, et al. Immunohistochemical expression of IL-12, IL-10, IFN-alpha and IFN-gamma in lymphoid organs of porcine reproductive and respiratory syndrome virusinfected pigs[J]. V et Immunol Immunopathol, 2012, 149(3-4): 262-271.
[11] Mateu E, Diaz I. The challenge of PRRS immunology[J]. Vet J, 2008, 177(3): 345-351.
[12] Gomez-L aguna J, Salguero F J, Barranco I, et al. Cytokine expression by macrophages in the lung of pigs infected with the porcine reproductive and respiratory syndrome virus[J]. J Comp Pathol, 2010, 142(1): 51-60.
[13] Saraiva M, O'Garra A. The regulation of IL-10 production by immune cells[J]. Nat Rev Immunol, 2010, 10(3): 170-181.
[14] Hou J, Wang L, Quan R, et al. Induction of interleukin-10 is dependent on p38 mitogen-activated protein kinase pathway in macrophages infected with porcine reproductive and respiratory syndrome virus[J]. Virol J, 2012, 9: 165.
[15] Song S, Bi J, Wang D, et al. Porcine reproductive and respiratory syndrome virus infection activates IL-10 production through NF-kappaB and p38 MAPK pathways in porcine alveolar macrophages[J]. Dev Comp Immunol, 2013, 39(3): 265-272.
MOLECULAR MECHANISM OF DIFFERENTIAL ABILITY FOR IL-10 EXPRESSION INDUCED BY HIGH AND LOW VIRULENT PRRSV IN VITRO
XIA Tian-qi1, JIANG Yi-feng1, YU Ling-xue1, ZHOU Yan-jun1, YANG Shen1, GAO Fei1, LI Li-wei1, QU Ze-hui1, TONG Guang-zhi1,2
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
Porcine reproductive and respiratory syndrome virus (PRRSV) could induce serious immune suppression after infection, as an important immuno-regulatory cytokine, IL-10 plays an important role in virus mediated immune suppression. Previous study suggested that the IL-10 expression level existed a big difference during PRRSV HuN4-F5 and HuN4-F112 infection, high level of IL-10 was found when PAMs infected with rHuN4-F5, while the level of IL-10 in PAMs infected with rHuN4-F112 was very low. To further investigate the difference of IL-10 expression during PAMs infected with HuN4 or HuN4-F112, we measured key cytokines involved in IL-10 pathway. The results showed that the expression of TLR2 and TLR4 in PAMs infected with HuN4 were significantly higher than that of infected with HuN4-F112, while the expression of TLR3, TLR7, and TLR9 showed no difference between them. The phosphorylation of p38 and ERK were further tested, and significantly higher phosphorylation of p38 was found when PAMs was infected with HuN4 than thatof HuN4-F112. No difference of ERK phosphorylation was found between the two groups. All these results indicated that HuN4 could induce significantly higher IL-10 expression in PAMs than that of HuN4-F112, the difference expression of IL-10 between HuN4 and HuN4-F112 infection was relative to the different phosphorylation of p38 in MAPK pathway which was beneficial for IL-10 expression. Key words: PRRSV; IL-10; PAMs; p38 MAPK
S852.659.5
A
1674-6422(2017)02-0043-06
2016-10-22
“十二五”农村领域国家科技支撑计划(2015BAD12B01);国家自然科学基金面上项目(31670158)
夏天奇,男,硕士研究生,预防兽医学专业
童光志,E-mail:gztong@shvri.ac.cn

