黑曲霉中β-葡萄糖苷酶的发酵优化及纯化研究
高 倩,秦小明,钟赛意,陈建平
(广东海洋大学食品科技学院,广东湛江 524088)
黑曲霉中β-葡萄糖苷酶的发酵优化及纯化研究
高 倩,秦小明*,钟赛意,陈建平
(广东海洋大学食品科技学院,广东湛江 524088)
为研究黑曲霉CICC 2475产β-葡萄糖苷酶的发酵条件及其分离纯化过程。利用JMP 7.0中的神经网络平台,对黑曲霉CICC 2475产β-葡萄糖苷酶的发酵条件进行了优化。通过硫酸铵分级盐析,DEAE-52阴离子交换层析和Sephacryl S-300 High resolution对粗酶液进行纯化,采用SDS-PAGE凝胶电泳测定其分子量。实验结果表明,黑曲霉产酶的最佳发酵条件:接种量11.0%、初始pH5.6、发酵时间130.0 h、装液量70.0 mL,在该条件下所产β-葡萄糖苷酶的酶活力达118.73 U/mL;经离子交换和凝胶色谱层析可有效纯化β-葡萄糖苷酶,得其分子量约为1.3×105。
黑曲霉CICC2475,β-葡萄糖苷酶,神经网络,纯化
β-葡萄糖苷酶(EC 3.2.1.21,β-glucosidase)是一种纤维素酶类水解酶,广泛存在于各类生物体中,作用于芳基或羟基与糖基原子团之间的糖苷键,生成β-D-葡萄糖及相应配基[1]。β-葡萄糖苷酶是纤维素酶中的一种,可促进纤维二糖的水解,提高纤维素酶系的水解活性,在纤维素降解过程中发挥着关键作用[2],同时在食品[3-5]、医药[6-7]、烟草[8]、农业[9]等领域具有重要的作用。
研究学者先后从各种植物和微生物中分离纯化出β-葡萄糖苷酶,并研究其生物化学特性[10-12],但是国内研究所纯化出的β-葡萄糖苷酶酶活力较低、成本高,且来源不同、培养条件不同所产生的不同分子量的β-葡萄糖苷酶结构和组成研究不足等问题仍然是目前β-葡萄糖苷酶的研究瓶颈。因此需要在产酶的条件优化及其分离纯化技术的研究上取得突破。
黑曲霉发酵周期较短,安全可靠,无有毒物质,其所产β-葡萄糖苷酶的安全性是国际公认的[13],广泛应用于发酵工业。本文利用JMP 7.0中的神经网络,在接种量、初始pH、发酵时间和装液量等四个方面对黑曲霉CICC 2475发酵产β-葡萄糖苷酶工艺条件进行优化,并先后通过硫酸铵分级盐析、阴离子交换层析、凝胶过滤层析,对该酶进行分离纯化,以获得酶活力较高及纯度较好的β-葡萄糖苷酶,为后续研究该酶的结构组成及酶解机制提供理论基础。
1 材料与方法
1.1 材料与仪器
黑曲霉(Aspergillusniger)CICC 2475,购于中国工业微生物菌种保藏管理中心。将菌种接入PDA斜面培养基中,25 ℃活化5 d。
种子培养基:种子培养基(g/L):可溶性淀粉20,葡萄糖10,MgSO4·7H2O 1,KH2PO41,酵母膏5,自然pH(不加调整),121 ℃灭菌20 min;
液体发酵培养基(g/L)[14]:麸皮20,硫酸铵1.5,KH2PO42,MgSO4·7H2O 1,吐温-80 2 mL,pH5.6,121 ℃灭菌20 min。
DEAE-52,SDS-PAGE凝胶配制试剂盒 购于广州鼎国生物科技有限公司;对硝基苯β-D-葡萄糖苷(pNPG),Sephacryl S-300 High resolution 购于上海源叶生物科技有限公司;考马斯亮蓝 购于南京建成生物科技有限公司;柠檬酸,柠檬酸钠,无水碳酸钠、硫酸铵均为国产分析纯。
SW-CJ-270净化工作台 上海博讯实业有限公司医疗设备厂;SPX-250B-Z恒温培养箱 上海博讯实业有限公司医疗设备厂;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;UV-3200PC紫外可见分光光度计 上海精密科学仪器有限公司;HZQ-A全温培养摇床 苏州威尔实验用品有限公司;高速落地离心机 Thermo Lynx6000,Thermo Scientific;冷冻干燥机 KA1013,韩国;pHS-2C pH计 德国赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1β-葡萄糖苷酶活性测定 1.8 mL、0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH5.0)中加入0.1 mL、10 mmol/L对硝基苯β-D-葡萄糖苷(pNPG)作为反应底物,加入0.1 mL酶液,45 ℃反应30 min后加入2 mL、1 mol/L Na2CO3终止反应并显色,在410 nm处测定吸光值。45 ℃时,每分钟每毫升酶液酶解1 μmol pNPG的酶活力为一个酶活单位(U/mL)。
1.2.2 蛋白含量的测定 蛋白含量的测定采用考马斯亮蓝法。
1.2.3 酶蛋白纯度的测定 酶蛋白纯度的测定采用SDS-PAGE法。
1.2.4 粗酶液的制备 在PDA斜面培养基中取一环菌种,接种于装有200 mL种子培养液的500 mL摇瓶中,28 ℃下培养48 h,按一定接种量接种于发酵培养液中,28 ℃,170 r/min下培养,4500 r/min条件下离心10 min,取上清液。柠檬酸-柠檬酸钠缓冲液(pH5.0)稀释5倍,用于酶活性的测定。
1.2.5 神经网络模型建立 本研究以接种量(X1)、初始pH(X2)、发酵时间(X3)、装液量(X4)4个实验因素为主,以酶活(U/mL)为响应因素。采用Box-Behnken设计因素水平编码表(表1)。采用JMP 7.0数据处理软件中的神经网络平台,建立神经网络模型及对产酶工艺条件的优化分析。
在经过多次对交叉验证组数K及隐藏节点的神经网络训练之后,确定交叉验证组数K值为5,采用4×5×1结构的三层神经网络(图1)。设置隐藏节点数5,过拟合罚项0.001,历程数16,最大迭代数50,收敛准则0.00001,交叉验证组数K为5,执行神经网络模型的拟合迭代过程,拟合决定系数R2值为0.99以上。

表1 因素水平编码表

图1 神经网络结构图Fig.1 Structure of artificial neural network
1.2.6 酶的分离纯化 利用优化后的产酶参数进行发酵实验,离心得到粗酶液。将一定体积的粗酶液分成15份,每份50 mL,分别加入硫酸铵使硫酸铵饱和度分别为20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%,4 ℃条件下静置过夜后10000 r/min离心10 min。分离沉淀和上清,沉淀溶于50 mL柠檬酸-柠檬酸钠缓冲溶液中,分别测定上清和沉淀的相对酶活,确定硫酸铵的分级饱和度。经初步纯化后的样品依次经过DEAE-52阴离子交换柱及Sephacryl S-300 High resolution层析,收集活性部分用SDS-PAGE电泳检测纯度。
2 结果与讨论
2.1 产酶工艺条件优化
2.1.1 Box-Behnken设计及实验 结果如表2。

表2 Box-Behnken设计及结果

图2 接种量、初始pH、发酵时间和装液量对产酶的影响Fig.2 Effect of inoculation amount、fermentation pH、fermentation time and broth content on production of enzymes
2.1.2 神经网络模型分析 固定接种量(X1)、初始pH(X2)、发酵时间(X3)和装液量(X4)四个因素中的两个因素为中间水平,作三维曲面图,将得到四个因素对黑曲霉发酵产β-葡萄糖苷酶的酶活力的影响规律进行预测分析,结果见图2。
从图2a、图2b、图2c中可以看出,在pH约低于5.5时,酶活逐渐增加;而高于5.5后,酶活逐渐降低,可见环境的酸碱程度会明显影响酶的活力。菌体的生长及产物的合成都有一个最适的酸碱环境,偏酸或偏碱的环境会改变膜的通透性,进而影响黑曲霉的正常生长,进而导致产酶量及酶活力降低[15]。
图2a、图2d和图2e中显示,随着发酵时间的延长,酶活明显增加,在发酵时间达到约130 h后逐渐平稳。这是因为在一定的发酵时间内,产酶量逐渐增加,随着发酵时间的延长,培养基内的营养逐渐减少,这导致菌体停止产酶并开始衰亡。
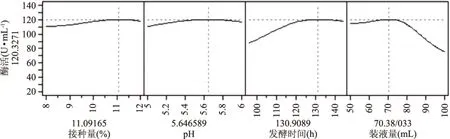
图3 神经网络模型的预测刻画器Fig.3 Prediction plot of the neural network
从图2b、图2d和图2f中显示出酶活随着接种量的增加,呈现出先增加后降低的趋势。接种量过低,产酶活力则低;接种量过大,可能会使菌体的浓度增大,培养液对菌体的供养不足,则产酶降低[16]。图中显示在约小于11%时,酶活逐渐增加;当约大于11%后,酶活逐渐下降,这说明接种量存在一个最适值。
从图2c、图2e和图2f中可以看出,装液量对黑曲霉产酶的影响显著,在装液量大于约70 mL时,酶活有显著下降的趋势。这是因为黑曲霉为好氧微生物,装液量过大,则溶氧量减少,致使菌体的生长缓慢,产酶随之降低[17]。
根据接种量、初始pH、发酵时间和装液量四个因素对黑曲霉产β-葡萄糖苷酶的影响规律,采用JMP 7.0软件中的预测刻画器,优化黑曲霉产酶的条件,预测刻画见图3。
从图3中得出,在接种量为11.09%,初始pH为5.65,发酵时间为130.91 h,装液量为70.38 mL时,黑曲霉发酵生产β-葡萄糖苷酶的预测酶活值达到最大。考虑到实验条件的可控性,确定在接种量11.0%,初始pH5.6,发酵时间130 h,装液量70 mL条件下进行产酶实验,该条件下预测酶活值120.24 U/mL,实验得到的平均酶活118.73 U/mL,相对误差0.63%,说明可利用神经网络模型对黑曲霉产β-葡萄糖苷酶进行预测分析。
2.2 硫酸铵分级盐析
不同百分饱和度的硫酸铵盐析曲线如图4。

图4 硫酸铵分级盐析曲线Fig.4 Precipitation fractional curve by saturated ammonium sulfate注:相同小写字母和大写字母分别表示上清液相对酶活 和沉淀相对酶活在不同硫酸铵饱和度之间的 差异不显著(p>0.05),否则差异显著(p<0.05)。
由图4可知,当硫酸铵饱和度在0~35%时,上清和沉淀的相对酶活差异性不显著,说明在此区间内,硫酸铵对酶的作用很小;当硫酸铵饱和度在35%~60%时,上清和沉淀的相对酶活开始出现显著差异,但曲线相对平稳,原因是此阶段盐离子与溶液中的自由态水分子结合,对酶表面的水分子影响较小[18],当硫酸铵饱和度在60%~80%时,盐析作用增强,原因可能是在该浓度下,盐离子大量争夺酶表面的水分子,破坏了酶表面水化膜,暴露出疏水区域,降低溶解度[19];当硫酸铵饱和度大于80%时,虽然上清液相对酶活存在差异,但沉淀相对酶活差异性不显著。从以上分析来看,先选用饱和度为35%的硫酸铵除去杂蛋白,再采用80%饱和度的硫酸铵沉淀酶蛋白。
2.3 离子交换层析
盐析后的蛋白沉淀溶于柠檬酸-柠檬酸钠缓冲溶液中,4 ℃下透析脱盐,样品经0.22 μm的水系微孔滤膜过滤除去杂质,上样至DEAE-52阴离子交换层析柱中。依次用pH为5.0的20 mmol/L柠檬酸-柠檬酸钠缓冲液、含0.1 mol/L NaCl的缓冲液、0.3 mol/L NaCl的缓冲液梯度洗脱,流速为1.0 mL/min,每8 mL收集1管。洗脱得到3个蛋白峰如图5。

图5 β-葡萄糖苷酶DEAE-52阴离子交换层析Fig.5 The ion-exchange chromatography for β-glucosidase on DEAE-52
从图中可以看出,β-葡萄糖苷酶经过离子交换层析后在280 nm下检测出现3个峰。收集各峰组分在410 nm下检测则出现2个明显的峰,且峰值较高,其中第1个蛋白峰在410 nm时没有吸收峰,可以断定该峰为杂蛋白峰,峰2比酶活相对较低,且收集量较少。因此收集第3峰的酶液进行后续分离纯化。
2.4 凝胶柱层析

表3 β-葡萄糖苷酶纯化及结果
将离子交换层析后收集到的样品经蒸馏水透析,冷冻干燥浓缩及0.22 μm的水系微孔滤膜过滤,上样于Sephacryl S-300 High resolution中层析,用pH为5.0的20 mmol/L柠檬酸-柠檬酸钠缓冲液洗脱,流速为0.5 mL/min,每4 mL收集1管。洗脱结果如图6。

图6 β-葡萄糖苷酶Sephacryl S-300 High resolution层析Fig.6 The chromatography for β-glucosidase by Sephacryl S-300 High resolution
凝胶柱层析的结果如图所示,经过Sephacryl S-300 High resolution层析后,样品得到两个蛋白峰。经过酶活力测定后发现峰1相比峰2酶活性较高且蛋白量较多,从经济方面考虑收集第1个峰的蛋白组分进行后续应用研究。
2.5 纯度检测及得率
将收集得到的各纯化步骤的葡萄糖苷酶进行SDS-PAGE电泳,结果如图7。

图7 SDS-PAGE电泳结果Fig.7 SDS-PAGE result of β-glucosidase注:1.蛋白Marker;2.粗酶液;3.盐析透析液; 4.离子后收集液;5.凝胶后收集液。
经过SDS-PAGE电泳后可看出,每步的分离纯化均达到了一定的纯化效果且纯化后酶液呈单一条带,说明纯化的程度较高。与蛋白Marker相比较,纯化后的酶液蛋白分子量约为1.3×105Da。
经过硫酸铵分级盐析,DEAE-52阴离子交换层析及Sephacryl S-300 High resolution凝胶柱层析后,β-葡萄糖苷酶的比活力从初始的481.15提高到854.57,纯化倍数逐渐增加到1.78,最终得率为27.94%。
3 结论
本研究利用JMP 7.0软件中的神经网络模型,从接种量、初始pH、发酵时间及装液量四个方面优化了黑曲霉CICC 2475产β-葡萄糖苷酶的发酵工艺,得到最佳发酵工艺条件为接种量11.0%,初始pH5.6,发酵时间130 h,装液量70.0 mL,制备的β-葡萄糖苷酶的最大酶活力平均为118.73 U/mL。同时经过分级盐析及柱层析对该酶进行分离纯化,得到分子量约为1.3×105Da的β-葡萄糖苷酶,为β-葡萄糖苷酶的提取纯化、结构性质及应用研究提供进一步实验基础。
[1]Mei C,Qin Y,Liu Z,et al. Isolation and characterization of aβ-glucosidase from Penicillium decumbens,and improving hydrolysis of corncob residue by using it as cellulase supplementation[J]. Enzyme & Microbial Technology,2010,46(6):444-449.
[2]Kolbe J,Kubicek C P. Quantification and identification of the main components of the Trichoderma,cellulase complex with monoclonal antibodies using an enzyme-linked immunosorbent assay(ELISA)[J]. Applied Microbiology & Biotechnology,1990,34(1):26-30.
[3]Ren J N,Yang Z Y,Tai Y N,et al. Characteristics ofβ-glucosidase from oranges during maturation and its relationship with changes in bound volatile compounds[J]. Journal of the Science of Food & Agriculture,2015,95(11):2345-2352.
[4]Agrawal R,Verma A K,Satlewal A. Application of nanoparticle-immobilized thermostableβ-glucosidase for improving the sugarcane juice properties[J]. Innovative Food Science & Emerging Technologies,2016,33:472-482.
[5]Vernocchi P,Patrignani F,Ndagijimana M,et al. Trebbiano wine produced by usingSaccharomycescerevisiaestrains endowed withβ-glucosidase activity[J]. Annals of Microbiology,2015:1-7.
[6]Lima F S D,Ida E I. Optimization of soybean hydrothermal treatment for the conversion ofβ-glucoside isoflavones to aglycones[J]. Food Science and Technology,2014,56(2):232-239.
[7]Singh N D,Kumar S,Daniell H. Expression ofβ-glucosidase increases trichome density and artemisinin content in transgenic Artemisia annua plants[J]. Plant Biotechnology Journal,2016,14(3):1034-1045.
[8]DongHeng Guo,YanShan Xu,YaJun Kang,et al. Synthesis ofoctyl-β-D-glucopyranoside catalyzed by Thai rosewoodβ-glucosidase-displaying Pichia pastoris in an aqueous/organic two-phase system[J]. Enzyme Microbial Technology,2016,85:90-97.
[9]Li D,Li X,Dang W,et al. Characterization and application of an acidophilic and thermostableβ-glucosidase from Thermofilum pendens[J]. Journal of Bioscience and Bioengineering,2013,115(5):490-496.
[12]Narasimha Golla,Sridevi Ayla,Ramanjaneyulu Golla,et al. Purification and characterization ofβ-glucosidase fromAspergillusniger[J]. International Journal of Food Properties,2016,19(3):652-661.
[13]先天敏,陈介南,张林. 黑曲霉改良株C112产β-葡萄糖苷酶的诱导及条件优化[J]. 中南林业科技大学学报,2013,11:154-161.
[14]徐星,肖华,黄琳琳,等. 黑曲霉胞外β-葡萄糖苷酶的纯化及酶学性质的研究[J]. 天津科技大学学报,2015,05:15-19.
[15]Oncu S,Tari C,Unluturk S. Effect of Various Process Parameters on Morphology,Rheology,and Polygalacturonase Production by Aspergillus sojae,in a Batch Bioreactor[J]. Biotechnology Progress,2007,23(23):836-45.
[16]马旭光,张宗舟,霍建泰,等. 航天诱变黑曲霉ZM-8发酵玉米秸秆粉产β-葡萄糖苷酶的培养基组分优化[J]. 食品工业科技,2012,33(6):236-239,243.
[17]王蕊,王林风,闫德冉,等. 毕赤酵母表达β-葡萄糖苷酶中试条件优化[J]. 食品科技,2015,12:15-19.
[18]杨亚东. 凡纳滨对虾肠道产蛋白酶菌株的筛选鉴定及酶学性质研究[D]. 湛江:广东海洋大学,2015.
[19]朱丽萍,颜世敢,李雁冰,等. 硫酸铵盐析条件对多管藻R-藻红蛋白和R-藻蓝蛋白得率和纯度的影响[J]. 科技导报,2010(4):37-41.
Study on the fermentation conditions and purification ofβ-glucosidase fromAspergillusniger
GAO Qian,QIN Xiao-ming*,ZHONG Sai-yi,CHEN Jian-ping
(College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China)
To find the conditions of fermentation and purification process ofβ-glucosidase fromAspergillusnigerCICC 2475. The fermentation conditions ofβ-glucosidase fromAspergillusnigerCICC 2475 were optimized by artificial neural network in JMP 7.0. The crude enzyme was precipitated with ammonium sulfate,purified with DEAE-52 anion exchange chromatography and Sephacryl S-300 High resolution,and the enzyme molecular weights were identified by SDS-PAGE. The results showed that,the optimal fermentation conditions were as follows,inoculation amount 11.0%,initial pH5.6,fermentation time 130 h and broth content 70.0 mL,at this point,the enzyme activity reached 118.73 U/mL. Theβ-glucosidase could be efficiently purify by anion exchange chromatography and gel chromatography,and the enzyme molecular weights were about 1.3×105.
AspergillusnigerCICC2475;β-glucosidase;artificial neural network;purification
2016-09-13
高倩(1990-),女,在读硕士研究生,研究方向:农产品加工与贮藏,E-mail:spygaoqian2010@sina.com。
*通讯作者:秦小明(1964-),男,博士,教授,研究方向:亚热带食品新资源开发与利用,E-mail:xiaoming0502@21cn.com。
亚热带果蔬加工与利用技术研究(广东省教育厅创新强校工程项目2013050214)。
TS201.3
A
1002-0306(2017)05-0174-06
10.13386/j.issn1002-0306.2017.05.024

