大米蛋白的BN大鼠致敏动物模型建立
王一侠,尹 曼,马 涛,鲁 军,蔡木易,谷瑞增
(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京 100015)
大米蛋白的BN大鼠致敏动物模型建立
王一侠,尹 曼,马 涛,鲁 军,蔡木易,谷瑞增*
(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京 100015)
以大米蛋白为过敏原,腹腔注射致敏雌性棕色挪威大鼠(BN大鼠),建立大米蛋白过敏BN大鼠动物模型。观察BN大鼠全身主动过敏反应及体重、体温、免疫脏器指数变化,检测其血清特异性IgG、总IgE和特异性Ig E水平,并测定血浆组胺释放水平及各组大鼠的血象变化。结果显示,实验第42 d大米蛋白激发实验后,实验组大鼠全部呈过敏反应阳性,且体温降低,脾脏指数显著增大(p<0.01),体内白细胞和嗜酸粒细胞数目升高(p<0.05);实验组血清特异性IgG显著升高(p<0.01),总IgE以及血浆组胺释放量均高于对照组(p<0.05),实验第14 d和42 d血清特异性IgE高于对照组,第28 d无明显变化(p<0.05)。本实验结果证明BN大鼠是评价大米蛋白致敏性较为理想的动物模型。
大米蛋白,食物过敏原,动物模型,抗体,组胺
近年来,随着食物过敏发生率的不断增加,食物过敏已成为一个食品安全和公共卫生问题。大米是是重要的粮食作物之一,全球半数以上的人口以大米为主食[1]。大米蛋白含有丰富的必需氨基酸,其氨基酸组成模式与WHO/FAO推荐的模式接近,易于被人体消化吸收,且生物效价及蛋白质利用率均较高。
最新研究表明,大米中含有一些过敏蛋白,包括14~16、26、33、56、60 ku等不同分子质量大小的蛋白,其中研究较普遍的是14~16 ku的α-淀粉酶/胰蛋白酶抑制剂和33 ku具有乙二醛酶Ⅰ活性的蛋白[2]。国内外的研究大多集中在过敏原提取纯化方面,只有很少研究关注建立大米过敏动物模型,如XiaoWei Chen[3]等利用BALB/c小鼠灌胃大米蛋白致敏,以期建立大米蛋白过敏动物模型。但同时有研究证明BALB/c小鼠并不适合作为食物过敏的动物模型,且灌胃易产生口服耐受[4]。BN大鼠是具有高IgE反应性的种系动物,有过敏反应倾向,根据部分研究及国家标准显示,雌性BN大鼠较雄性BN大鼠更易致敏[5-6]。因此,

表1 过敏反应级数
本研究以提取纯化并经SDS-PAGE蛋白凝胶电泳和基质辅助激光解吸附飞行时间质谱(MALDI-TOF-MS)共同验证的相对分子质量为14.4~18.4 ku的大米过敏原球蛋白为致敏原,对雌性棕色挪威大鼠(BN大鼠)进行腹腔注射致敏处理,观察其全身主动过敏反应,并检测特异性抗体、组胺、血象变化等相应过敏指标,初步建立大米蛋白致敏动物模型,为下一步建立大米蛋白致敏细胞模型和深入了解大米过敏引发的免疫反应机制提供基础。
1 材料与方法
1.1 材料与仪器
雌性棕色挪威大鼠(BN大鼠),4~6周龄,12只,体重(40~60 g),由维通利华动物公司提供,许可证号为SCXK(京)2012-0001;大米 超市。
大鼠IgE酶联免疫试剂盒和大鼠组胺试剂盒 上海酶联免疫生物公司;辣根过氧化物酶标记的山羊抗大鼠IgG 北京中杉金桥生物有限公司;四甲基联苯胺(TMB) Sigma公司;弗氏完全佐剂和不完全佐剂 Sigma公司,Tris Amresco公司;氯化钠、固体硫酸铵、盐酸、磷酸氢二钠、磷酸二氢钠试剂均为分析纯 北京化工厂。
1.2 实验方法
1.2.1 大米球蛋白的制备 干燥大米粉碎得到大米粉末,以浓度为1.0 mol/L,料液比1∶5(g/mL)的NaCl溶液盐提,室温震荡提取16 h,8000 r/min离心20 min,上清液加入固体硫酸铵至溶液饱和度为50%,4 ℃冰箱盐析,离心,沉淀以50 mmol/L Tris-HCl(pH9.0)缓冲液复溶,离心,上清调pH至4.02,4 ℃静置过夜,离心,上清以20 mmol/L PBS(pH7.4,含0.15 mol/L NaCl)缓冲液透析并冻干[7]。
1.2.2 动物分组及处理 12只雌性BN大鼠随机分为对照组和实验组,每组6只[8-10]。实验前采集BN大鼠血清作为对照。采取腹腔注射方式致敏,分别于第1、5、10 d分别腹腔注射1 mL 浓度为1 mg/mL大米过敏蛋白(含弗氏佐剂,大米过敏蛋白和弗氏佐剂体积比为1∶1;第一次致敏为弗氏完全佐剂,第二次和第三次致敏为弗氏不完全佐剂),第42 d注射大米过敏蛋白进行激发,对照组注射同等剂量的PBS缓冲液(pH7.4)。分别于第14、28、42 d内眦静脉取血,离心分离血清,用于特异性抗体IgG、IgE和总IgE测定;于第14、21、35 d天内眦静脉取血,加入抗凝剂EDTA-2K,离心分离血浆,用于测定组胺。
1.2.3 BN大鼠全身主动过敏反应评价 在第42 d对BN大鼠腹腔注射1 mL浓度为4 mg/mL的大米过敏蛋白进行激发,在激发实验前后40 min分别测量各组BN大鼠体温,计算BN大鼠在激发前后体温变化;腹腔激发后,观察各BN大鼠反应症状并参考何仁静等[11]评分系统按照表1进行评分:
若平均反应达到2级即认为发生了过敏反应[12],其中平均过敏级数及过敏率按下列公式计算:


其中:n′:发生过敏的动物总数;RA:过敏率。
1.2.4 BN大鼠体重、免疫脏器指数测定 饲喂期间,每周称体重两次,计算平均体重,激发取血后处死BN大鼠,无菌取出胸腺和脾脏,计算免疫脏器指数[13]
1.2.5 BN大鼠免疫过程血液生化指标检测 实验第14、28、42 d抗凝管取血后,血浆上血球分析仪测定。
1.2.6 血清总IgE、特异性IgE、特异性IgG、血浆组胺含量测定 血清特异性IgG(IgE)测定:采用间接ELISA法进行检测,用浓度为50 μg/mL的大米蛋白进行包被,4 ℃过夜;0.05% PBST洗涤三次,0.5%明胶37 ℃封闭1 h;洗涤三次,每孔加100 μL按1∶100稀释的待测血清,37 ℃孵育1 h;洗涤三次,每孔加100 μL按1∶20000稀释的HRP标记的山羊抗大鼠IgG或HRP标记山羊抗大鼠IgE),37 ℃保湿1 h;洗涤三次,每孔加100 μL底物显色液,37 ℃反应15 min,每孔加50 μL l 2 mol/L H2SO4终止反应,用酶标仪在450 nm测OD值[14]。
血清总IgE测定和血浆组胺测定均按照ELISA试剂盒操作进行。
1.2.7 统计学分析 用Mircrosoft Excel 2007及SPSS20.0进行数据统计分析,组间检验采用t检验,p<0.01具有极显著差异;p<0.05具有显著差异。
2 结果与分析
2.1 BN大鼠全身主动过敏反应结果及体温变化
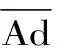

表2 过敏反应结果与评分结果
注:对照组BN大鼠在第35 d取血后中因体弱死亡一只;实验数据除第42 d对照组为5只动物数据外,其余均为6只动物实验数据。

表5 不同时期BN大鼠血象水平变化(±s,N1=6,n1=5,n2=6)
注:**:与对照组比,p<0.01,差异极显著;*:p<0.05,差异显著,表6、表7同;对照组大鼠只数:第14、28 d N1=6,第42 d n1=5;实验组大鼠只数:第14、28、42 d n2=6,表6、图2、图3同。由表3可知,激发前两组BN大鼠的体温没有明显差异,对照组体温在激发前后也没有明显变化,而实验组BN大鼠与激发前相比体温却明显下降(p<0.01),由此说明大米蛋白致敏BN大鼠时会引起其体温迅速下降。

表3 激发前后BN大鼠体温变化(±s,n1=5,n2=6)
注:**:p<0.01时,显著极差异;n1:对照组动物数;n2:实验组动物数,图1、表4同。
2.2 BN大鼠体重和免疫脏器指数变化
2.2.1 BN大鼠体重变化 实验期间,每周称量BN大鼠体重两次取平均值,结果如图1所示,两组BN大鼠体重均较为平衡的增长,组间没有显著差异(p>0.05),可见大米过敏蛋白致敏BN大鼠对其体重没有明显的影响。
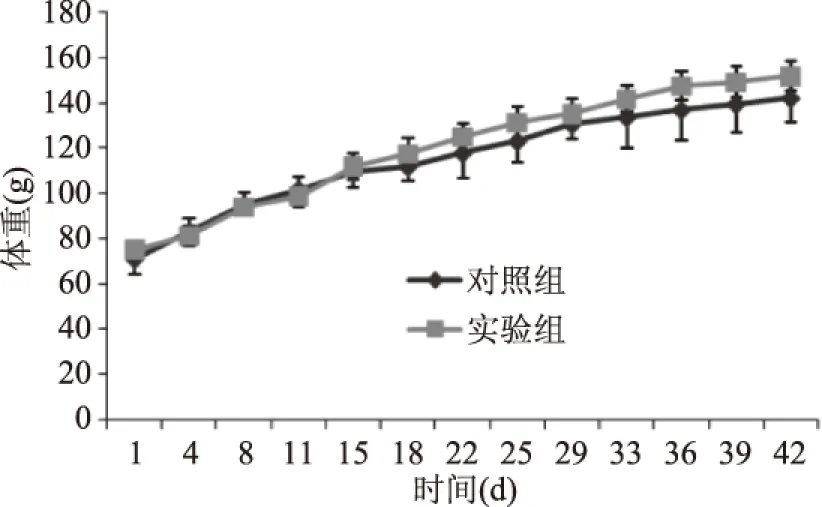
图1 实验期间各组BN大鼠体重变化(±s,n1=5,n2=6)Fig.1 Body weight changes of BN rats during the experiment(±s,n1=5,n2=6)
2.2.2 BN大鼠免疫脏器指数变化 如表4所示,两组BN大鼠的胸腺指数无差异,而实验组大鼠的脾脏指数却有显著升高(p<0.01)。过敏反应是机体对抗原强烈的免疫应答反应,免疫防御功能过高,易于发生过敏反应,大米过敏蛋白激发后BN大鼠的脾脏指数明显增大说明大米蛋白已引发BN大鼠发生过敏反应[15]。
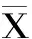
表4 大米过敏蛋白对BN大鼠脾脏指数
2.3 BN大鼠血象指标变化
过敏反应发生时,机体细胞会发生一系列应急反应,这些刺激会引起机体各类细胞、血小板等数目和种类发生变化。白细胞是机体抵御异物入侵的主要防线,由粒细胞、淋巴细胞和单核细胞组成。由表5可知,免疫第14 d,中性粒细胞数目极显著增多,(p<0.01)单核细胞数目显著增多(p<0.05),淋巴细胞数目变化幅度不大;第42 d,白细胞数目迅速上升(p<0.01),说明BN大鼠正处于过敏阶段;食物过敏能引起嗜酸粒细胞增多,嗜酸粒细胞能够拮抗和调节速发型超敏反应,具有吞噬能力,且能释放组胺酶灭活组胺,抑制细胞脱颗粒[16]。但本实验第14、28 d时嗜酸粒细胞并没有明显变化,只在第42 d嗜酸粒细胞数目有明显升高。有研究表明,过敏反应期间存在不同的凝血因子紊乱,其中包括血小板的募集及活化,血小板可能作为抗原直接活化的效应细胞参与不同的超敏反应[17],在本实验中,实验第14 d,实验组的血小板数量相比于对照组明显升高(p<0.05),而第28 d与第42 d血小板的数量明显下降,具体原因还有待进一步研究。
2.4 BN大鼠血清特异性IgG、总IgE和特异性IgE水平变化

表6 实验期间BN大鼠血清总IgE变化(μg/mL)(±s,N1=6,n1=5,n2=6)
2.4.1 BN大鼠血清特异性IgG测定结果 不同时期大鼠血清特异性IgG水平变化如图2所示,对照组在致敏不同时期血清特异性IgG无明显变化;与对照组相比,实验组BN大鼠在第14、28、42 d的血清特异性IgG抗体水平显著升高(p<0.01)。

图2 实验期间BN大鼠血清特异性 IgG变化(±s,N1=6,n1=5,n2=6)Fig.2 Changes in Serum specific IgG of BN rats during the experiment(±s,N1=6,n1=5,n2=6)
2.4.2 BN大鼠血清总IgE测定结果 不同时期BN大鼠血清总IgE水平变化如表6所示,实验第14、28 d实验组BN大鼠血清总IgE抗体浓度与对照组相比显著提高(p<0.05),42 d激发实验后实验组血清总IgE有极为显著的提高(p<0.01),平均可达到4.032 μg/mL。IgE是介导Ⅰ型超敏反应(过敏反应)的主要抗体,包括总IgE和特异性IgE,总IgE水平的测定可用来鉴别超敏反应与非超敏反应[18]。实验不同时期,实验组与对照组相比均有显著差异,说明BN大鼠发生了过敏反应。
2.4.3 血清特异性IgE测定结果 不同时期BN大鼠血清特异性IgE水平变化如图3所示,血清特异性IgE抗体的测定,可以明确过敏反应是由哪种致敏原引起的(18(,实验第14 d和42 d实验组BN大鼠血清特异性IgE抗体浓度与对照组相比显著提高(p<0.05),说明大鼠发生的过敏反应是由大米蛋白引起的,而实验第28 d两组BN大鼠血清特异性IgE抗体浓度无显著差异,可能是由于过敏反会随时间延长而逐渐弱化,导致血清特异性IgE抗体浓度降低;第42 d进行高浓度蛋白激发后,实验组大鼠过敏反应剧烈,与对照组相比,血清特异性IgE抗体浓度显著升高(p<0.05)。

图3 实验期间BN大鼠血清特异性 IgE变化(±s,N1=6,n1=5,n2=6)Fig.3 Changes in Serum specific IgG of BN rats during the experiment(±s,N1=6,n1=5,n2=6)
2.5 组胺测定结果
由表7可知,在致敏第14、21、35 d,实验组BN大鼠血浆组胺释放量均显著高于对照组(p<0.05)。

表7 实验期间BN大鼠组胺变化(μg/L)(±s,n=6)
3 结论与讨论
动物模型是食物致敏原检测最直接的办法,迄今为止报道过的用于食物过敏的动物有狗、幼猪、豚鼠、Balb/c小鼠、C3H/HeJ小鼠、BN大鼠等[19],常用的致敏方式有灌胃、腹腔注射和皮下注射,这三者均有优缺点。目前国际上尚未建立标准的食物过敏动物模型。理想的过敏动物模型,不仅仅是动物暴露于食物致敏原后产生过敏反应,在暴露于无致敏史食物时也应不产生过敏反应,且过敏症状应与人类相似[20]。经研究发现,BN大鼠在致敏原刺激下,能产生较高水平的特异性IgE、IgG抗体,具有较强的致敏免疫反应[21],且相比于灌胃,腹腔注射能够克服口服耐受的缺点,是评价食物致敏原合适的动物模型。Nakase[22]、Hidehiko[23]、Yumiko[24]等对大米过敏蛋白进行过研究,结果表明相对分子质量为14~16 ku和 33 ku的大米蛋白为致敏蛋白,可引起IgE介导的过敏反应。本实验以提取的大米过敏蛋白为致敏原致敏大鼠,通过全身主动过敏反应判断过敏反应发生率为100%,且脾脏指数明显增大,嗜酸粒细胞数目明显升高。综合以上指标初步确定大米过敏动物模型建立成功。
动物体内的特异性抗体IgG、总IgE和特异性IgE水平与致敏原敏感性相关。在食物过敏中,特异性抗体IgG的出现,往往提示该蛋白质具有免疫原性[25]。在本实验中对sIgG抗体检测,实验组抗体水平明显高于对照组,验证了大米蛋白首先具有免疫原性,而血清总IgE、sIgE抗体和组胺水平的检测证明该大米蛋白不仅具有致敏性,且能引起BN大鼠发生过敏反应,这也与陈如程等[14]的研究相一致。然而,同一物种不同个体对过敏原的过敏性存在差异,不同物种间差异更大,仅用动物模型来评价大米蛋白的过敏性仍存在一定的局限,因此在今后的研究中将利用大鼠RBL-2H3细胞等多种模型进一步评价大米蛋白的过敏性。
[1]李 明,李赟高,高红艳. 大米蛋白研究进展[J]. 粮食与油脂,2006,(8):3-5.
[2]李海飞,高金燕,袁娟丽,等. 大米过敏蛋白的研究进展[J]. 食品科学,2014,35(23):308-312.
[3]CHEN XiaoWei,Ken Wan-Keung Lau,YANG fan,et al. An adjuvant free mouse model of oral allergenic sensitization to rice seeds protein[J]. BMC Gastroenterology,2011,11:62.
[4]黄建芳,王彩霞,向军俭. 食物过敏动物模型的研究进展[J]. 食品科学,2014,35(3):280-284.
[5]孙拿拿. 转基因食品致敏性评价啮齿类动物模型(BN大鼠和C3H/HeJ小鼠)研究[D]. 北京:中国农业科学院,2010.
[6]农业部1782号公告-13-2012. 转基因生物及其产品食用安全检测挪威棕色大鼠致敏实验方法[S].
[7]Tsukasa Matsuda,Makoto Sugiyama,etc. Purification and Properties of an Allergenic Protein in Rice Grain[J]. Agric. Food Chem.,1988,52(6):1465-1470.
[8]Tsukasa matsuda Rieko nomura,Makoto Sugiyama,et al. Immunochemical Studies on Rice Allergenic Proteins[J]. Agricultural and Biological Chemistry,1991,55(2):S9-S13.
[9]H. A. C. Atkinson,I. T. Johnsonf,J. M. Geet,F. Griroriadou,et al. Brown Norway Rat Model of food allergy:Effect of Plant components on the Development of Oral Sensitization[J]. Food & Chemical Toxicology,1999,34(1):27-32.
[10]Hiroshi Akiyama,Reiko Teshima,Jun-ichiro Sakushima,et al. Examination of oral sensitization with ovalbumin in Brown Norway rats and three strains of mice[J]. Immunology Letters,2001,78:1-5.
[11]何静仁. 银杏酸的变应原性及致过敏作用机制研究[D]. 武汉:华中农业大学,2003
[12]杨剑婷. 白果过敏蛋白及其致敏机理的研究[D]. 南京:南京林业大学,2003.
[13]王思芦,汪开毓,赵玲,等. 鸡枞菌多糖对免疫抑制小鼠免疫功能的影响[J]. 中国药理学通报,2013,29(1):59-63.
[14]陈如程,李娜,樊柏林,等. BN大鼠致敏动物模型研究[M]. 中国食品卫生杂志,2014,26(1):14-17.
[15]夏春丽,舒刚,李艳华. 几种补益方剂对雏鸡生长性能和免疫脏器指数的影响(A]. 安全优质的家禽生产—第十五次全国家禽学术讨论会论文集[C].广东:华南理工大学出版社,2011.522-526.
[16]龚非力. 医学免疫学[M]. 北京:科学出版社,2009.113.
[17]王德录,吴学忠. 过敏反应中血小板功能的研究进展[J]. 临床输血与检验,2012,14(1):92-94.
[18]刘俊红. 食物过敏幼鼠模型的建立与评价[D]. 福建:福建医科大学,2012.
[19]黄建芳,王彩霞,向军俭,等. 虾过敏C57/BL6 小鼠动物模型的建立[J]. 食品工业科技,2012,33(23):358-361.
[20]孙佳益,王锡昌,李振兴,等. 虾类原肌球蛋白的Balb/c小鼠致敏动物模型构建研究[J]. 免疫学杂志,2013,29(2):161-164.
[21]孙拿拿,张倩男,贾旭东,等. BN 大鼠经口致敏动物模型研究[J]. 中国食品卫生杂志,2013,25(3):214-217.
[22]Masayuki Nakase,Takahiro Adachi,etc,et al. Rice(Oryza sativa L.)α-amylase inhibitors of 14-16 kDa are potential Allergens and Products of a Multigene Family[J]. Journal of Agricultural and Food Chemistry,1996,44(9):2624-2628.
[23]Hidehiko Izumi,Minoru Sugiyama. Structural characterization of the 16-kDa allergen,RA17,in rice seeds. Prediction of the secondary structure and identification of intramolecular disulfide bridges.[J]. Bioscience,Biotechnology,and Biochemistry,1999,63(12):2059-2063.
[24]Yumiko Usui,Masayuki Nakase. A 33-kDa Allergen from Rice(Oryza sativa L. Japonica)cDNA cloning,expression,and Identification as a novel glyoxalase[J]. The Journal of Biological Chemistry,2001,6(14):11376-11381.
[25]陈晨. 转基因食品致敏性评价Balb/c小鼠模型和RBL-2H3细胞模型研究[D].北京:中国疾病预防控制中心,2013.
Establishment of a rice protein sensitization animal model based on BN rat
WANG Yi-xia,YIN Man,MA Tao,LU Jun,CAI Mu-yi,GU Rui-zeng*
(Beijing Engineering Research Center of Protein & Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing 100015,China)
In order to establish a sensitization animal model of rice protein,the sensitinogen was intraperitoneal injected to female Brown-Norway(BN)rat. The general allergic reactions and the changes of weight,body temperature,immune organ index were observed,the level of antibody(specific IgG and IgE,total IgE)in sera,histamine and blood picture in plasma were measured to verify the animal model. Results showed that the general allergic reactions in each rat of experimental group were positive,the body temperature was decreased and the spleen index was increased significantly(p<0.01),and white blood cells and acidophilic granulocyte number were increased(p<0.05)after stimulated by rice protein at the time of 42nd day. Meanwhile,the level of specific IgG was increased significantly(p<0.01),total IgE and plasma histamine was increased(p<0.05)compared to the control group,on the 14th and 42nd days,the level of specific IgE was increased while it did not show obvious difference at the time of 28th day(p<0.05). This study indicates that the Brown Norway(BN)rat is a suitable animal model for evaluating rice protein allergenicity.
rice protein;food allergen;animal model;antibody;histamine
2016-08-19
王一侠(1990-),女,硕士,研究方向:食物过敏原,E-mail:wyx0105@126.com。
*通讯作者:谷瑞增(1973-),男,本科,教授级高级工程师,研究方向:食源性低聚肽,E-mail:guruizeng@163.com。
国家高技术研究发展计划(863 计划)项目(2013AA102205-02);十三五国家重点研发计划(2016YFD0400604)。
TS201.4
A
1002-0306(2017)05-0345-05
10.13386/j.issn1002-0306.2017.05.057

