头孢克肟诱导肠道菌群紊乱动物模型的建立
李 静,吕晓玲,吕冬雪,王梦姝,赵胜男,赵焕焦
(天津科技大学 食品工程与生物技术学院,天津 300457)
头孢克肟诱导肠道菌群紊乱动物模型的建立
李 静,吕晓玲*,吕冬雪,王梦姝,赵胜男,赵焕焦
(天津科技大学 食品工程与生物技术学院,天津 300457)
目的:构建头孢克肟诱导的小鼠肠道菌群紊乱模型。方法:将40只体重18~22 g的SPF级BALB/c雌性小鼠随机分为正常对照组、头孢克肟低剂量组、中剂量组、高剂量组,每组10只。灌胃剂量分别为187.75 mg/(kg·d),375.50 mg/(kg·d),563.25 mg/(kg·d),正常对照组灌胃相同剂量的蒸馏水。连续灌胃7 d后颈椎脱臼处死并收集盲肠内容物,采用传统培养结合聚合酶链式反应-变性梯度凝胶电泳技术(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)观察和分析头孢克肟对小鼠肠道菌群的影响。结果:高剂量组小鼠粪便中乳酸杆菌数量在所选稀释度下降至30CFU以下,而肠球菌数量上升至1.26×105CFU,大肠杆菌数量上升至1.86×106CFU。与空白对照组相比,模型组小鼠肠道菌群总体多样性和细菌种类显著降低。结论:中剂量和高剂量头孢克肟均能不同程度的诱导小鼠肠道菌群紊乱模型,并且肠道菌群紊乱程度随灌胃剂量的增加而加重,模型成功建立。
头孢克肟,肠道菌群,聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)
肠道菌群研究进入大人群时代,人们已经发现肠道微生物在机体生理活动中扮演着越来越重要的作用,肠道菌群的多样性和机体健康之间存在着良好的关联,包括肥胖、癌症、自闭症等在内的50多种疾病都与肠道菌群紊乱有关[1-5]。抗生素的主要功能是对抗细菌感染[6],一旦被滥用就会刺激胃肠系统,进而造成肠道菌群紊乱[7]。因此由抗生素引起的肠道菌群紊乱动物模型,常用于对新型微生态制剂以及食品调节肠道菌群功能性的研究。目前模型制备使用的抗生素主要有头孢曲松[8],氯霉素,阿莫西林[9]等,头孢曲松和头孢克肟均为第三代头孢菌素,药理作用相同,具有第三代头孢菌类抗菌谱广的特性,然而头孢曲松半衰期约为7~8 h,而头孢克肟半衰期为3~4 h,半衰期反映了药物在体内的消除速度。考虑半衰期的不同将会影响其对肠道微生物的作用效果,因此本文利用传统培养结合聚合酶链式反应-变性梯度凝胶电泳技术(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)[10-11]探讨不同剂量头孢克肟对肠道菌群紊乱模型的制备效果,并研究其诱导肠道菌群紊乱动物模型建立的条件,为进一步用于评价食品成分对肠道菌群的影响奠定基础。
1 材料与方法
1.1 材料与仪器
SPF级别,BALB/c雌性小鼠40只,体重18~22 g 中国人民解放军军事医学科学院实验动物中心(动物合格证号:SCXK-(军)2012-0004)。头孢克肟分散片 广东先强药业股份有限公司;蛋白酶K,溶菌酶,RNaseA,PCR 引物,2×Taq PCR Master Mix,去离子甲酰胺,TEMED,过硫酸胺(APS) 北京鼎国昌盛生物技术有限责任公司;丙烯酰胺,甲叉双丙烯酰胺,尿素(分析纯);伊红美蓝琼脂培养基、LBS琼脂培养基、肠球菌琼脂培养基 青岛高科园海波生物技术有限公司。
Applied Biosystems ProFlexTMPCR仪(ProFlex 3 x 32 well PCR system);凝胶成像系统(Molecular Imager ChemiDocTM XRS+ System);DGGE电泳仪(Bio-Rad,DCodeTM System);Sorvall Legend Micro 17R Centrifuge(上海夏夷实业有限公司);微型分光光度计(GENEQUANT pro);琼脂糖凝胶电泳仪(DYY-8C)。
1.2 实验方法
1.2.1 实验动物 将40只体重18~22 g的SPF级BALB/c雌性小鼠适应环境饲养2 d,随机分为4组,分别为正常对照组、头孢克肟低剂量组、中剂量组、高剂量组,每组10只。根据《药理实验方法学》[12]计算小鼠的等效剂量,实验以10倍成人剂量为中剂量,则头孢克肟剂量组分别为187.75,375.5,563.25 mg/(kg·d),正常对照组灌胃相同剂量的灭菌蒸馏水。在灌胃期间观察精神状态,体重变化以及排便情况,对所有实验小鼠进行促进排便实验并用高压灭菌的2 mL EP管及时收集新鲜粪便,立即于-80 ℃冻存。在灌胃最后一天颈椎脱臼处死并测量全小肠、结肠长度,称量盲肠重量,同时无菌收集结盲肠内容物。
1.2.2 小鼠粪便活菌记数 将0.1 g粪便用0.9%生理盐水进行10倍系列稀释,选择2~3个稀释度分别接种于伊红美蓝琼脂培养基、乳酸杆菌选择性琼脂培养基、Pfizer肠球菌选择性琼脂培养基上,37 ℃有氧培养48 h后利用公式计算每克湿便中的菌落数:
其中N为样品中菌落数CFU;∑C为菌落数之和CFU;n1为低稀释倍数的菌落个数CFU;n2为高稀释倍数的菌落个数C;d为稀释因子即第一稀释度。
肠道菌群紊乱标准:双歧杆菌和/或乳酸杆菌下降,肠杆菌和/或肠球菌增加,或下降比例低于双歧杆菌与乳杆菌的下降比例。
1.2.3 肠道细菌微生物区系的PCR-DGGE分析
1.2.3.1 粪便微生物区系总DNA的粗提 取100 mg小鼠粪便于2 mL EP管中,加入1 mL PBS(pH7.5,0.1 mol/L)离心得沉淀;加1 mL PBS微离心取上清;离心得沉淀。
1.2.3.2 粪便微生物区系总DNA的提取 向沉淀中加入0.8 mL溶菌酶pH8.0水浴震荡1 h;加入10 μL蛋白酶K,0.3 mL PBS,10 uL异戊于65 ℃水浴1 h;加入0.6 mL酚∶氯仿∶异戊醇(25∶24∶1)涡旋振荡10 min,4 ℃ 12000 r/min离心得上清;加入等量的氯仿离心得上清;加入等体积的冷异丙醇冰浴过夜后离心得沉淀;冷乙醇清洗沉淀;加入200 μL TE缓冲液和RNase置于-20 ℃冰箱中保存,用微型分光光度计检测[13-15]。
1.2.3.3 PCR扩增 本实验主要是以16SrDNA基因的可变区V3 区序列作为靶标进行扩增[16]。16S rDNA 基因的可变区V3区序列PCR扩增上游引物和下游引物[17]分别为V3-F338-GC和V3-R518。
PCR扩增体系(50 μL):2×Taq PCR Green Mix 25 μL;模板DNA 2 μL;上游引物F(10 μM)1 μL;下游引物R(10 μM)1 μL;ddH2O补充至50 μL。
PCR扩增程序:94 ℃预变性4 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min 30循环;72 ℃延伸7 min。用1.5%的琼脂糖凝胶电泳检测PCR产物并立即进行DGGE电泳实验。
1.2.3.4 DGGE电泳及染色 聚丙烯酰胺胶浓度为8%(w/v),变性梯度为30%~60%。胶液配置为:15 mL 30%和60%的变性溶液,37 μL的10%过硫酸铵,57 μL的TEMED,混匀,灌胶。电泳条件:200 V,10 min预电泳;75 V,14 h。电泳完毕后进行EB染色20 min,照胶并用Quantity One分析[18]:香农指数Shannon-Wiener index(H′)=-∑Pi lnPi,Pi 为第i条带的峰值与该泳道所有条带峰值总和的比值;均匀度Evenness(E)=H′/H′max,(H′max=ln S(S为丰富度,即DGGE图谱每条泳道上的条带数))。
2 结果与分析
2.1 抗生素头孢克肟对实验小鼠的宏观影响
2.1.1 各受试物对小鼠体重的影响 灌胃前后,头孢克肟对所有小鼠体重的影响结果见表1。
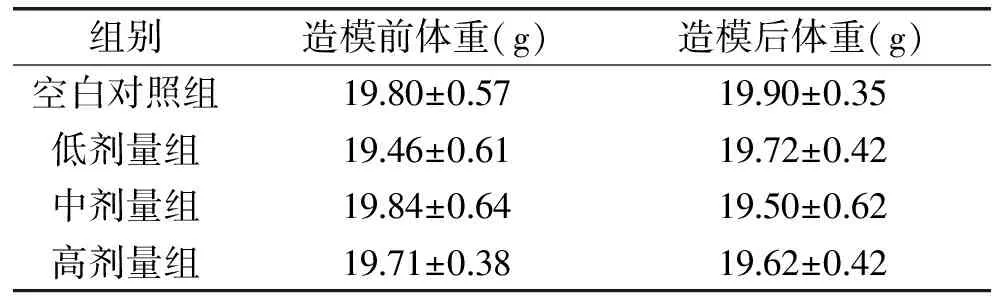
表1 各受试物对实验小鼠体重的影响
通过表1可以看出,与空白对照组相比,造模前各组小鼠的体重没有显著差异(p>0.05),说明小鼠属于随机分组并且分组具有良好的均衡性。造模后各剂量组与空白对照组相比,小鼠体重没有显著性差异(p>0.05),说明抗生素对小鼠体重没有显著影响。
2.1.2 受试物对实验小鼠体征指标的影响 灌胃后,受试物对小鼠的盲肠重量、全小肠长度和结肠长度的影响结果见表2和图1。
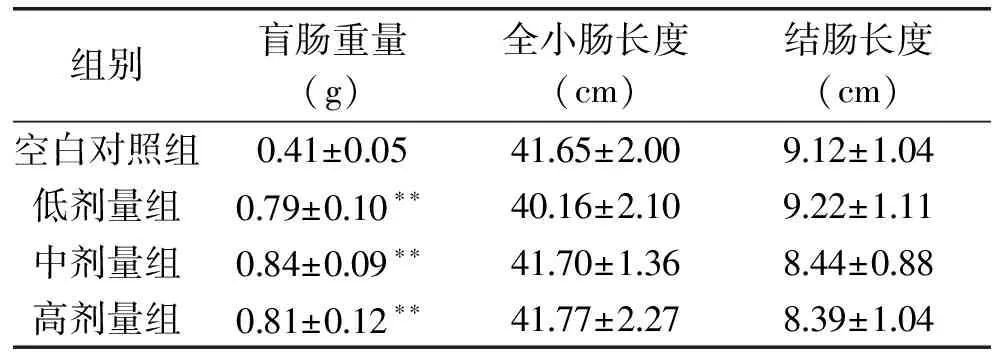
表2 受试物对实验小鼠盲肠重量、全小肠长度和结肠长度的影响
注:**表示与空白对照组比较,有极显著性差异(p<0.01)。
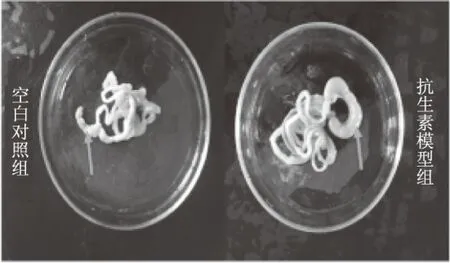
图1 空白对照组和抗生素模型组小鼠盲肠Fig.1 The cecums of control mouse and model mouse
通过表2和图1可以看出,与空白对照组相比,经抗生素造模后低剂量组、中剂量组、高剂量组盲肠重量有极显著差异(p<0.01),说明抗生素使小鼠盲肠极显著肥大,有研究显示,无菌小鼠的盲肠明显肥大,这是由于无菌小鼠肠道菌群缺失导致的,本实验抗生素组小鼠出现了盲肠肥大并可见盲肠内容物稀薄现象,这可能是由维持肠道水分传输功能的细菌数量下降,大量水分滞留于盲肠造成的,表明其肠道菌群的缺失与紊乱。但全小肠长度、结肠长度在各组间没有显著差异。
2.2 传统微生物培养检测小鼠肠道菌群结果
按菌落计数原则数出每个粪便样品的菌落数,可以得到头孢克肟对小鼠肠道微生物(乳酸杆菌、肠球菌和大肠杆菌)的影响,实验结果如表3所示。
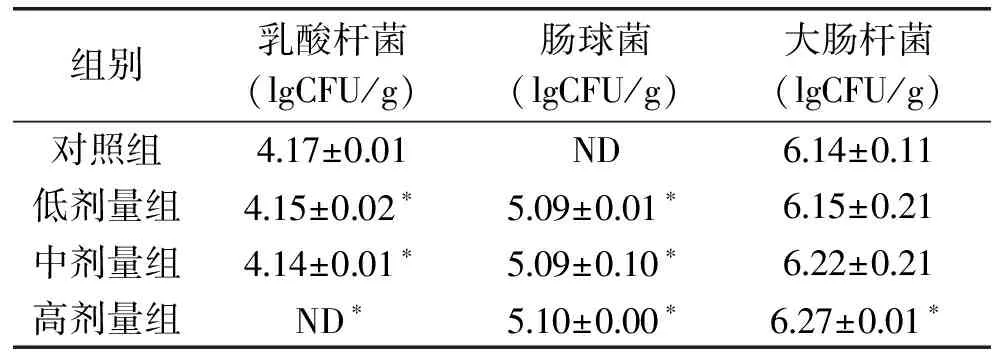
表3 受试物对小鼠粪便乳酸杆菌、肠球菌和大肠杆菌的影响
注:ND:未检测到(<30 CFU);*表示与空白对照组比较,有显著性差异(p<0.05)。
通过表3可以看出,头孢克肟低剂量组、中剂量组、高剂量组小鼠肠道中乳酸杆菌的数量显著低于正常水平(p<0.05),肠球菌的数量显著高于正常水平(p<0.05),高剂量组小鼠大肠杆菌数量显著高于正常水平(p<0.05),说明头孢克肟低中高剂量组均能对小鼠肠道菌群造成一定的影响。
2.3 肠道细菌微生物区系的 PCR-DGGE分析结果
2.3.1 肠道细菌微生物区系总DNA的提取结果 取1μL溶菌酶法提取得到的DNA片段用微型分光光度计测定其DNA浓度与纯度。记录在260 nm/280 nm处的OD值及浓度,结果如表4。取3.5 μL DNA加1.5 μL 6×lording buffer用1%的琼脂糖凝胶电泳检测,检测结果如图2。
表4 DNA纯度和浓度检测结果
由表4可以看出实验所提DNA OD260/OD280大部分都在1.8~2.0之间,纯度符合要求,只有空白对照组OD值较高,可能有较少的蛋白质残留,但从DNA质量浓度和得率来看,较少的蛋白质残留不影响后续实验,可进一步实验。
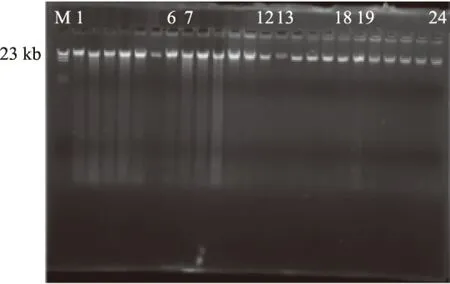
图2 粪便细菌总基因组电泳图Fig.2 Agarose gel electrophoresis of total DNA of fecal microorganism注:正常对照组(1~6),抗生素低剂量组(7~12), 中剂量组(13~18)和高剂量组(19~24)。
由图2可知,各个泳道上的主条带清晰且亮度较高,整个泳道上无杂带和拖尾现象,表明提取效果较好,可以进行后续实验。
2.3.2 PCR扩增 利用通用引物338F和518R扩增各组小鼠盲肠内容物的16S rDNA V3区基因。目的条带片段长度约260 bp(图3)。
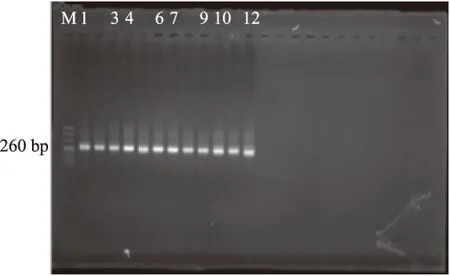
图3 16S rDNA V3区基因扩增产物电泳图Fig.3 Agarose gel electrophoresis of amplified bacterial 16S rDNA注:正常对照组(1~3),抗生素低剂量组(4~6), 中剂量组(7~9)和高剂量组(10~12),图4同。
2.3.3 DGGE结果 各受试组小鼠总肠道菌群的DGGE图谱(图3)显示,各个泳道均匀性较好,肉眼可见第1~3泳道条带数大于4~12泳道条带数。因此对DGGE图谱采用quantity one软件进行相似性聚类分析,结果如图4显示,正常对照组(1~3)为一类,抗生素模型组(3~12)为一类,如果忽略相对较小的个体差异,头孢克肟剂量组之间小鼠肠道菌群种类的差异较小。由表5可以看出,中剂量组和高剂量组菌群丰富度与正常对照组有极显著差异(p<0.01),中剂量组和高剂量组菌群多样性与正常对照组有显著差异,各剂量组的菌群均匀性与正常对照组没有显著差异。
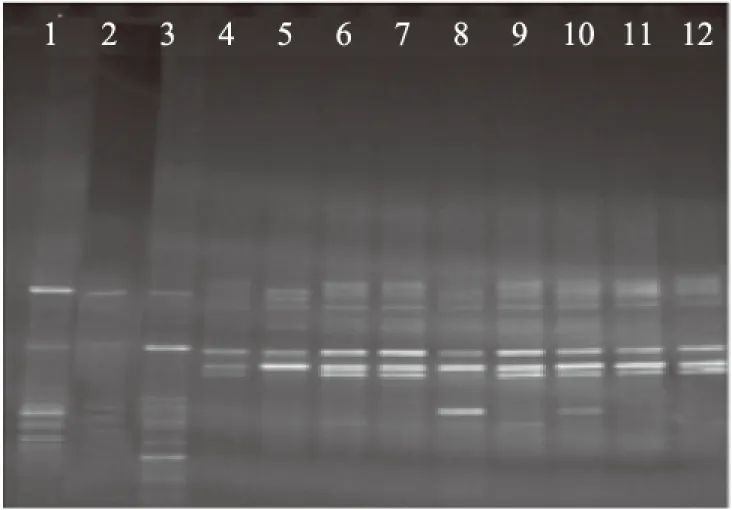
图4 粪便细菌的DGGE图谱Fig.4 Denaturing Gradient Gel Electrophoresis of fecal microorganism
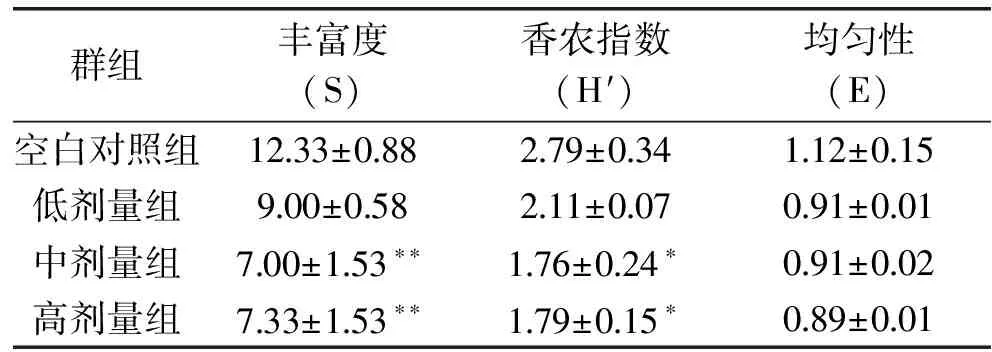
群组丰富度(S)香农指数(H′)均匀性(E)空白对照组1233±088279±034112±015低剂量组900±058211±007091±001中剂量组700±153∗∗176±024∗091±002高剂量组733±153∗∗179±015∗089±001
注:* 表示与空白对照组比较,有显著性差异(p<0.05),** 表示与空白对照组比较,有极显著性差异(p<0.01)。
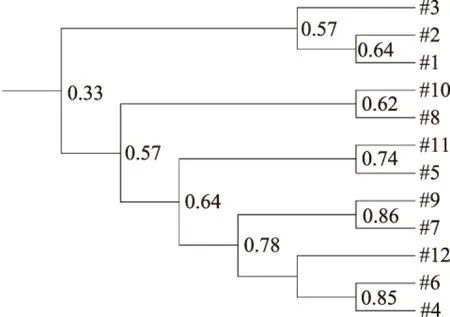
图5 小鼠肠道菌群UPGMA相似性聚类分析Fig.5 UPGMA cluster analysis for similarity coefficients of DGGE profile
传统微生物培养结果表明,头孢克肟可以使小鼠粪便中乳酸杆菌数量显著降低,肠球菌数量显著升高。根据肠道菌群紊乱标准:双歧杆菌和/或乳杆菌下降,肠杆菌和/或肠球菌增加,或下降比例低于双歧杆菌与乳杆菌的下降比例可以判断肠道菌群紊乱,说明肠道菌群失调动物模型成功建立。PCR-DGGE结果表明,空白对照组聚为一族,头孢克肟剂量组聚为一族,中剂量组和高剂量组小鼠肠道菌群总体多样性和细菌种类显著降低。PCR-DGGE结果作为对传统微生物培养结果的补充,可以进一步说明头孢克肟诱导的肠道菌群紊乱动物模型成功建立,为评价食品成分对肠道菌群的影响奠定基础。
3 结论
近年来,肠道菌群与健康的关系已经成为当前热门研究领域之一。肠道是人体内最大且主要的“免疫器官”,研究发现肠道菌群的失衡与机体多种疾病和精神上的疾病密切相关[19-20]。
本文通过传统培养结合PCR-DGGE技术探讨不同剂量的头孢克肟对小鼠肠道菌群的影响。传统培养结果表明头孢克肟导致肠道主要益生菌数量下降,而原本不是优势菌群的耐药肠球菌在药物处理后得以增殖。PCR-DGGE技术表明采用溶菌酶法提取得到的粪便微生物基因组达到了预期效果,可以进行后续实验;采用适当的扩增体系和扩增程序对基因组中16SrDNA片段进行PCR扩增,对扩增产物进行DGGE实验,结果表明使用不同剂量的头孢克肟作用小鼠后,各剂量组条带的丰度和亮度与正常对照组相比有显著差异,但剂量组之间的条带丰度没有显著差异。
PCR-DGGE的结果作为对传统培养结果的补充,证实了小鼠肠道菌群在头孢克肟的长时间作用下发生了紊乱,使小鼠粪便中乳酸杆菌数量显著降低,肠球菌数量显著升高,并且肠道菌群的种类和数量明显降低。中剂量组和高剂量组均成功诱导出小鼠肠道菌群紊乱模型,因此可以将中剂量头孢克肟(375.5 mg/(kg·d))诱导肠道菌群紊乱动物模型用于新型微生态制剂以及食品调节肠道菌群功能性的研究。
[1]Xiao S,Fei N,Pang X,et al. A gut microbiota-targeted dietary intervention for amelioration of chronic inflammation underlying metabolic syndrome[J]. FEMS Microbiol Ecol,2014,87(2):357-367.
[2]Khazaie K,Zadeh M,Khan M W,et al. Abating colon cancer polyposis by Lactobacillus acidophilus deficient in lipoteichoic acid[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(26):10462-10467.
[3]Zhang C,Yin A,Li H,et al. Dietary Modulation of Gut Microbiota Contributes to Alleviation of Both Genetic and Simple Obesity in Children[J]. EBioMedicine,2015,2(8):968-984.
[4]Ahn J,Sinha R,Pei Z,et al. Human gut microbiome and risk of colorectal cancer,a case-control study[J]. CANCER RESEARCH,2013,731(8).
[5]Alderton G K. Tumour immunology:Intestinal bacteria are in command[J]. Nature Reviews Immunology,2015,16(1):5.
[6]于守汎. 头孢克肟[J]. 国外医药(抗生素分册),1995(5):339-343.
[7]Vangay P,Ward T,Gerber J S,et al. Antibiotics,Pediatric Dysbiosis,and Disease[J]. Cell Host & Microbe,2015,17(5):553-564.
[8]谢彩虹,袁静,王瑞君,等. 嗜酸乳杆菌对抗生素诱导小鼠肠道菌群失调的作用[J]. 肠外与肠内营养,2007,14(3):132-136.
[9]Ladirat S E,Schols H A,Nauta A,et al. High-throughput analysis of the impact of antibiotics on the human intestinal microbiota composition[J]. Journal of Microbiological Methods,2013,92(3):387-397.
[10]程翔. 采用PCR-DGGE方法测定枸杞多糖对小鼠肠道菌群失调的调整作用[D]. 佳木斯大学,2013.
[11]Muyzer G,de Waal E C,Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993,59(3):695-700.
[12]药理实验方法学(第三版)[J].
[13]MG LaMontagne,FC Michel Jr,PA Holden,et al. Evaluation of extraction and purification methods for obtaining PCR-amplifiable DNA from compost for microbial community analysis[J]. J Microbiol Methods,2002,49(3):255-264.
[14]Masci A,Coccia A,Lendaro E,et al. Evaluation of different extraction methods from pomegranate whole fruit or peels and the antioxidant and antiproliferative activity of the polyphenolic fraction[J]. Food Chemistry,2016,202:59-69.
[15]More M I,Herrick J B,Silva M C,et al. Quantitative cell lysis of indigenous microorganisms and rapid extraction of microbial DNA from sediment[J]. Applied and Environmental Microbiology,1994,60(5):1572-1580.
[16]Yu Z T,Morrison M. Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-denaturing gradient gel electrophoresis[J]. Applied and Environmental Microbiology,2004,70(8):4800-4806.
[17]江杨洋,王旭东,王冰,等. 有机食物与麦粒灸对大鼠肠道菌群多样性的影响[J]. 世界华人消化杂志,2014(31):4800-4806.
[18]Yu Z T,Morrison M. Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-denaturing gradient gel electrophoresis[J]. Applied and Environmental Microbiology,2004,70(8):4800-4806.
[19]Arthur J C,Perez-Chanona E,Muhlbauer M,et al. Intestinal Inflammation Targets Cancer-Inducing Activity of the Microbiota[J]. Science,2012,338(6103):120-123.
[20]谷琳琳,姜海龙,王鹏,等. 添加抗生素对动物肠道健康的影响[J]. 养猪,2015(3):125-128.
Establishment of mice model for intestinal dysbacteria induced by cefixime dispersible tablets
LI Jing,LV Xiao-ling*,LV Dong-xue,WANG Meng-shu,ZHAO Sheng-nan,ZHAO Huan-jiao
(College of Food Engineering and Biotechnology,Tianjin University of Science& Technology,Tianjin 300457,China)
Objective:To produce the mouse models of intestinal dysbacteria which induced by cefixime dispersible tablets. Methods:female SPF grade BALB/c 36,weight 18~22 g,intestinal dysbiosis mice treated with cefixime dispersible tablets,low dose(187.75 mg/(kg· d)),medium dose(375.5 mg/(kg·d))and high dose(563.25 mg/(kg·d)). Control mice received sterile deionized water by oral gavage. On the 8th day,the mice were euthanized by cervical dislocation. The caecum contents were collected in a sterile 2 mL centrifuge tube. Compare the shift in the intestinal microbial by vital cell counting and polymerase chain reaction-denaturing gradient gel electrophoresis(PCR-DGGE)analysis. Result:TheEnterococcusandE.coliwere promoted andLactobacilluswas suppressed. The reduction of diversity and abundance was shown in middle and higher doses group. Conclusion:The model of intestinal dysbacteria builded successfully.
cefixime dispersible tablets;intestinal microflora;polymerase chain reaction-denaturing gradient gel electrophoresis(PCR-DGGE)
2016-09-09
李静(1991-),女,在读硕士研究生,研究方向:食品添加剂与功能配料,E-mail:marissa19910204@163.com。
*通讯作者:吕晓玲(1960-),女,硕士,教授,主要从事食品添加剂与功能配料的研究,E-mail:lxling@tust.edu.cn。
国家科技支撑计划项目(2011BAD23B02)。
TS201.4
A
1002-0306(2017)05-0361-05
10.13386/j.issn1002-0306.2017.05.060

