Cardio-facio-cutaneous综合征2例报告并文献复习
张欢欢李 牛郁婷婷胥雨菲李国强王秀敏,3沈亦平,4王 剑,3
1.上海交通大学医学院附属上海儿童医学中心医学遗传科(分子诊断实验室)(上海 200127);2.上海交通大学医学院附属同仁医院检验科(上海 200336);3.上海交通大学医学院附属上海儿童医学中心内分泌遗传代谢科(上海 200127);4.美国哈佛大学医学院附属波士顿儿童医院基因诊断实验室(美国波士顿 02115)
Cardio-facio-cutaneous综合征2例报告并文献复习
张欢欢1,2李 牛1郁婷婷1胥雨菲1李国强1王秀敏1,3沈亦平1,4王 剑1,3
1.上海交通大学医学院附属上海儿童医学中心医学遗传科(分子诊断实验室)(上海 200127);2.上海交通大学医学院附属同仁医院检验科(上海 200336);3.上海交通大学医学院附属上海儿童医学中心内分泌遗传代谢科(上海 200127);4.美国哈佛大学医学院附属波士顿儿童医院基因诊断实验室(美国波士顿 02115)
目的探讨Cardio-facio-cutaneous综合征(CFC)的临床表型及基因变异特征。方法提取2例CFC患儿及其父母外周血DNA,采用靶向基因高通量测序技术检测变异基因,并运用Sanger测序进行验证。结果2例患儿均为汉族女性,分别为13个月和7岁半,有内眦赘皮、鼻梁塌平、头发稀疏等相似的颅面部特征,均伴有生长发育迟缓及癫痫发作史。1例心电图有T波变化,P-R间期正常高限;另1例心电图正常。基因检测显示,2例患儿在MAP2K1基因3号外显子上各有一处杂合的错义变异,分别为 c.383G>T,p.Gly128Val 和 c.389A>G,p.Tyr130Cys,且均为新生突变(de novo),均系文献报道过的CFC变异位点。结论2例为国内首次报道CFC病例,且均为MAP2K1基因突变型。因既往报道CFC患儿大多合并心脏病变,2例患儿均继续随访心脏功能。
Cardio-facio-cutaneous综合征; MAP2K1基因; 靶向基因测序技术; 新生突变
Cardio-facio-cutaneous 综合征(CFC)与 Noonan综合征 (NS)、Costello 综合征 (CS)一起被归类为“RAS心肌病群”[1]。该病群临床表现复杂,既有很多相似的表型也有各自相对特异性的表征。该病群患者均可出现不同程度的心脏发育异常、精神发育迟滞及身材矮小等临床特征[1],CFC与NS患者都可出现上睑下垂、睑裂下斜、内眦赘皮褶皱、塌鼻梁、鼻孔前倾等颅面特征以及多发雀斑、毛发稀疏等皮肤特征[2]。CS患者则表现出更严重的面部畸形,并在婴儿期有明显的心律失常[3],CFC患者在婴幼儿期即可出现婴儿痉挛症或其他类型癫痫发作,这一点不同于NS与CS患者[1]。该病群的各种临床表现会随着年龄增长发生改变,仅凭表型进行诊断十分困难。目前根据不同情况可选用高通量测序等[4,5]分子诊断技术,结合临床表现和基因检测结果来确诊CFC及其他RAS心肌病。本文报道2例有特殊颅面特征及癫痫发作史的患儿,分别运用靶向基因高通量测序方法进行测序分析明确诊断。
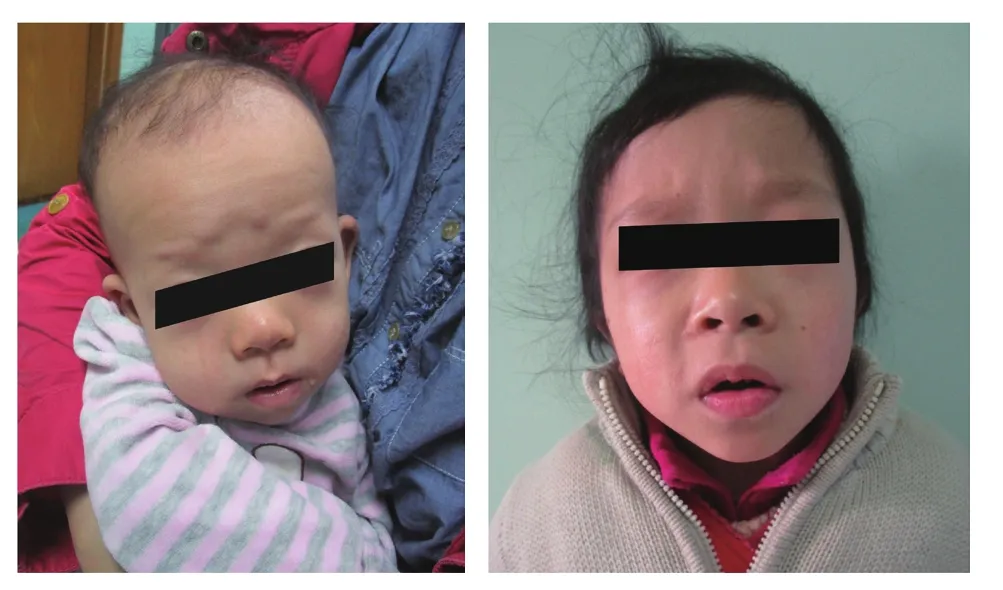
图1 患儿面部特征图
1 临床资料
例1,女,13个月,汉族。因惊厥间断发作3 d至上海儿童医学中心神经内科就诊。就诊过程中惊厥发作,呈双上肢屈曲强直,右下肢强直,眼睛眨动,伴哭闹,持续约2 min左右,发作后疲软无力,易入睡。患儿无发热,无咳嗽流涕。患儿系G2P2,有宫内窘迫史,有脐带扭转史,36周早产,产时有窒息,出生体质量3.75 kg。母乳喂养,按时按序添加辅食。生长发育迟缓,不能坐起,不会翻身,不会爬,不能抬头,不会叫喊父母;既往有屏气发作病史。父母体健,否认近亲结婚,否认遗传病史。体格检查:体质量7.4 kg,身高75 cm;内眦赘皮,眼距稍宽,鼻梁塌平,面色苍白,头发稀疏(图1);四肢末梢偏凉,稍苍白;心率106次/ min,律齐,无杂音,双侧呼吸音清,未及啰音。外院头颅MRI提示脑白质发育不良;心电图示T波变化,P-R间期正常高限。初步诊断为继发性癫痫。
例2,女,7岁半,汉族,因生长发育迟缓至上海儿童医学中心遗传门诊就诊。患儿系G1P1,足月顺产,出生体质量3.1 kg,身高46 cm,出生时Apgar评分1分钟9分,5分钟9分。出生时因反复上肢抖动被诊断为“高酮戊二酸血症、HIE伴左侧脑室出血”。出院后偶有抽搐发作,曾口服抗癫痫药物治疗2年,4岁以后抽搐未再发作。曾于3岁2个月查脑电图为异常脑电图、脑电地形图。父母非近亲结婚,否认家族史。患儿运动发育滞后,说话少,5个月抬头,3岁多可独走,可有意识叫喊父母。体格检查:体质量13 kg,身高105 cm;眼距稍宽,鼻梁塌平,鼻孔朝前,外侧眼角偏下,口唇稍干燥,面部皮肤局部粗糙,牙齿排列不齐、大小不一,上颌前正中方向牙齿较短,头发稀疏(图1);呼吸平稳,心率100次/min,律齐,未闻及明显杂音;肌力可,精神运动较差。
经医院伦理审核及父母知情同意后,采集患儿及父母外周血各2 mL,置含乙二胺四乙酸(EDTA)抗凝试管充分混匀。取200 μL全血,使用德国Qiagen公司QIAamp DNA Blood Mini Kit试剂盒提取基因组DNA,用NanoDrop 2000分光光度计测所提DNA浓度及比值(OD260/280比值在1.8~2.0之间)。取患儿基因组DNA 3 μg,经美国Covaris®公司M220打断仪处理后得到150~200 bp的DNA片段,使用Agilent SureSelect XT 试剂盒制备测序文库,捕获探针为Agilent Inherited Disease panel(包括2 742个基因,目标区域约为12 Mbp)。使用美国Illumina公司HiSeq 2500 System进行高通量测序。测序数据经Illumina Sequence Control Software(SCS)评估合格后,使用NextGENe®软件(美国SoftGenetics公司)读取数据,上传到Ingenuity®Variant Analysis™ 软件(美国Ingenuity Systems公司)进行生物信息学分析。
Sanger 测序验证候选基因 MAP2K1变异:采用 UCSC 在线软件(http://genome.ucsc.edu/index. html)设计用于扩增MAP2K1(GenBank序列号:NM_002755.3)基因序列的引物。针对3号外显子变异位点的引物序列:正向引物(E 3 F)5’-GCCAATGCCTGCCTTAGTAC -3’,反向引物(E3R)5’-TTAGACTTCCCAGATGCCCC-3’。分别取2例患儿及其父母的基因组DNA 20 ng进行PCR扩增,产物纯化后使用ABI3730测序仪上机测序,测序数据采用MutationSurveyor®软件(美国SoftGenetics公司)进行分析。
2例患儿及其父母的高通量测序数据首先经 Next Gene®软件分析单核苷酸变异(SNVs),并比对实验室前期已积累的对照测序数据进行分析。最终结果显示:例1的15号染色体上q22.31区域MAP2K1基因发生杂合错义突变c.383G>T,使128位密码子由GGC变为GTC,甘氨酸替换为缬氨酸,即p.Gly128Val,人类基因突变数据库(HGMD)上将其列为致病性突变;例2的15号染色体上q22.31区域MAP2K1基因发生杂合错义突变c.389A>G,使130位密码子由TAT变为TGT,酪氨酸替换为半胱氨酸,即p.Tyr130Cys,HGMD上将其列为致病性突变;未发现其他与2例患儿临床症状相关的可疑或致病性 SNVs。进一步Sanger测序结果表明:2例患儿各自父母在MAP2K1基因3号外显子上相应位点均为野生型,2例患儿在该基因上分别产生的突变c.383G>T 及 c.389A>G均为新生突变(de novo)。见图2。
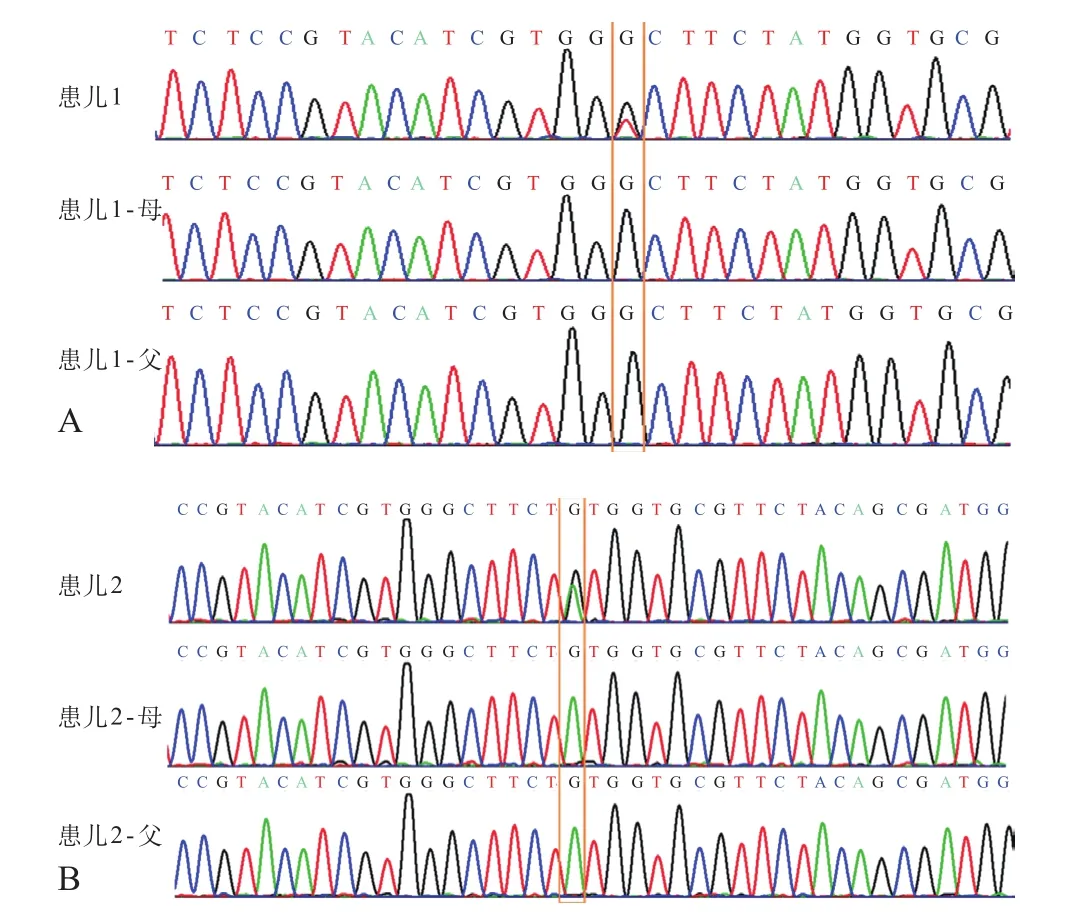
图2 Sanger 法测序结果
2 讨论
CFC 是一种极罕见的常染色体显性遗传病,完全外显,最早由Reynolds等[6]于1986年报道。目前CFC在全世界范围内的发病率不详,日本约为1/810 000[7]。CFC患儿通常伴有特征性异常面容,如相对大头畸形、额头高大、双颞侧变窄、下巴小,上睑下垂、睑裂下斜、内眦赘皮褶皱,鼻子基底部过宽、球状鼻头、鼻孔前倾,嘴大、人中沟深,耳朵低垂、后翻等;可合并出现咬合不良、高唇系带、高颚弓等牙齿表型及斜视、屈光不正、眼球震颤、视神经发育不全等眼科症状;同时还可出现肺动脉瓣狭窄、肥厚性心肌病、房间隔缺损、室间隔缺损等不同种类的心血管疾病及多发的色素痣、皮肤过度角化、黑棘皮病等不同程度的皮肤病变[8,9]。除颅面、心脏、皮肤的异常改变外,CFC患儿还普遍存在生长发育迟缓和智能障碍,出现神经系统异常且严重程度不一。据统计,约40%~50%的CFC患儿有各种各样的癫痫症状[10],癫痫类型包括混合型、全身强直-阵挛型、失神发作/婴儿痉挛症。部分CFC患者还可发生肾脏/泌尿生殖系统病变,也有少数CFC患者可伴发肿瘤[8,11]。
CFC主要有4种基因突变型,分别为BRAF、MAP2K1、MAP2K2和KRAS[8,12]。其发病机制为基因突变导致Ras/Raf/MAPK信号通路持续活化[13],干扰细胞的增殖、分化、运动、凋亡及衰老的正常过程,从而引起患者心脏缺陷、面容改变、外胚层异常。由于Ras/Raf/MAPK 通路在胰岛素样生长因子(IGF-1)的细胞内信号转导通路中也起有重要作用,而IGF-1可以介导生长激素(GH)的生长效应;同时MAPK的激活在调节垂体生长激素的合成和释放过程有重要作用,这些因素共同作用会导致患儿出现生长缓慢及身材矮小。
目前研究显示,CFC患者的4种基因突变型别中近75%为BRAF杂合基因突变,近25%为MAP2K1和MAP2K2杂合基因突变,约2%~3%为KRAS杂合基因突变[8,12-15]。MAP2K1和MAP2K2是一对异构体,两者均为苏氨酸/酪氨酸激酶,具有磷酸化激活ERK1、ERK2的功能,构成MAPK级联反应。MAP2K1激活ERK1/2后,活化的ERK1/2可以入核激活cJun、cMyc、Elk1、PPc-fos、c-Jun、Elk-1、c-myc和ATF2等多种核转录因子和核蛋白,促进细胞的殖和分化,ERK1/2还可磷酸化胞浆内的细胞骨架成份,如微管相关蛋白MAP-1、MAP-2和MAP-4,参与细胞形态的调节及细胞骨架的重分布。基因突变可以引起MAP2K1活性增加,保持MAPK通路的持续活化状态,引起细胞异常增殖及凋亡障碍,从而产生一系列细胞生物学反应。MAP2K1基因定位于人类15号染色体长臂上(15q22.1-q22.33),基因全长104 kb,包含11个外显子。据 HGMD 统计,目前在人类MAP2K1基因中发现了14种不同的突变形式,几乎都是以错义突变的形式存在,突变发生区域集中在第2、3、6外显子区域。
本文2例患儿均在MAP2K1基因3号外显子区域发生新生杂合突变,其中例2 MAP2K1基因上的新生杂合错义突变c.389A>G是目前明确的致病突变,也是MAP2K1基因上最常见的错义突变,早在2006年Rodriguez-Viciana等[12]在Science上就报道过此位点变异的CFC病例。例1 MAP2K1基因上的新生杂合错义突变c.383G>T目前被列为可疑致病/致病(likely pathogenic/ pathogenic)突变,已有文献报道其可引起CFC综合征[16]。根据患儿的临床表型,结合分子诊断资料,本文2例患儿均被诊断为 CFC综合征。此为国内首次报道的CFC病例,也是国内首次报道的MAP2K1基因突变的CFC病例。
本文中2例患儿被确诊时分别是13个月和7岁半,年龄差距较大,表型上有一些相似的地方,如特征性面容、皮肤毛发异常、生长发育滞后、智力落后、癫痫发作等,与已有的报道相符。例1的心电图提示T波变化和P-R间期正常高限,未发现其他心脏相关指标异常;例2尚未观测到心脏结构功能改变。现有的 CFC基因型和表型关联研究资料表明,MAP2K1基因型CFC患儿先天性心脏病发生率(62%)略低于BRAF基因型(74%)[8,14,15]。对于CFC患儿心脏病的自然病史及其伴发肥厚性心肌病的年龄进展规律目前还不明确,因此有待于对2例患儿进行长期随访,定期评估其心脏功能。
[1]Myers A, Bernstein JA, Brennan ML, et al. Perinatal features of the RASopathies: Noonan syndrome, cardio-faciocutaneous syndrome and Costello syndrome [J]. Am J Med Genet A,2014, 164A (11):2814-2821.
[2]Tidyman WE, Rauen KA. Mutational and functional analysis in human Ras / MAP kinase genetic syndromes. [J]. Methods Mol Biol, 2010, 661:433-447.
[3]Lin AE, Grossfeld PD, Hamilton RM, et al. Further delineation of cardiac abnormalities in Costello syndrome [J]. Am J Med Genet, 2002, 111(2):115-129.
[4]S,ims,ek-Kiper PÖ, Alanay Y, Gülhan B, et al. Clinical and molecular analysis of RASopathies in a group of Turkish patients [J]. Clin Genet, 2013, 83(2):181-186.
[5]Lepri FR, Scavelli R, Digilio MC, et al. Diagnosis of Noonan syndrome and related disorders using target next generation sequencing [J]. BMC Med Genet, 2014, 15:14.
[6]Reynolds JF, Neri G, Herrmann JP, et al. New multiple congenital anomalies/mental retardation syndrome with cardio-facio-cutaneous involvement--the CFC syndrome [J]. Am J Med Genet. 1986, 25(3): 413-427.
[7]Abe Y, Aoki Y, Kuriyama S, et al. Prevalence and clinical features of Costello syndrome and cardio-faciocutaneous syndrome in Japan: findings from a nationwide epidemiological survey [J]. Am J Med Genet A, 2012, 158A(5): 1083-1094.
[8]Rauen KA. Cardio-facio-cutaneous syndrome [EB/OL]. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2017. 2007 Jan 18 [updated 2016 Mar 3].
[9]Siegel DH, McKenzie J, Freiden IJ, et al. Dermatological fi ndings in 61 mutation-positive individuals with cardio-faciocutaneous syndrome [J]. Br J Dermatol, 2011, 164(3):521-529.
[10]Yoon G, Rosenberg J, Blaser S, et al. Neurological complications of cardio-facio-cutaneous syndrome [J]. Dev Med Child Neurol, 2007, 49(12): 894-899.
[11]Ohtake A, Aoki Y, Saito Y, et al. Non-hodgkin lymphoma in a patient with cardiofaciocutaneous syndrome. [J]. J Pediatr Hematol Oncol, 2011, 33(8):e342-346.
[12]Rodriguez-Viciana P, Tetsu O, Tidyman WE, et al. Germline mutations in genes within the MAPK pathway cause cardiofacio-cutaneous syndrome [J]. Science, 2006, 311(5765):1287-1290.
[13]Rauen KA, Banerjee A, Bishop WR, et al. Costello and cardiofacio-cutaneous syndromes: moving toward clinical trials in RASopathies [J]. Am J Med Genet C Semin Med Genet, 2011, 157C (2):136-146.
[14]Dentici ML, Sarkozy A, Pantaleoni F, et al. Spectrum of MEK1 and MEK2 gene mutations in cardio-facio-cutaneous syndrome and genotype-phenotype correlations [J]. Eur J Hum Genet, 2009, 17(6):733-740.
[15]Allanson JE, Annerén G, Aoki Y, et al. Cardio-facio-cutaneous syndrome: does genotype predict phenotype? [J]. Am J Med Genet C Semin Med Genet, 2011, 157C(2):129-135.
[16]Schulz AL, Albrecht B, Arici C, et al. Mutation and phenotypic spectrum in patients with cardio-facio-cutaneous and Costello syndrome [J]. Clin Genet, 2008, 73(1):62-70.
The clinical feature and gene analysis of Cardio-facio-cutaneous syndrome in children: a report of 2 cases and literature review
ZHANG Huanhuan1,2, LI Niu1, YU Tingting1, XU Yufei1, LI Guoqiang1, WANG Xiumin1,3, SHEN Yiping1,4, WANG Jian1,3
(1. Department of Medical Genetics (Molecular Diagnostic Laboratory), Shanghai Children's Medical Center, Shanghai Jiao Tong University School of Medicine, Shanghai 200127, China; 2. Department of Clinical Laboratory, Tongren Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200336, China; 3. Department of Endocrine and Genetic Metabolic, Shanghai Children's Medical Center, Shanghai Jiao Tong University School of Medicine, Shanghai 200127, China; 4. Department of Gene Diagnostic Laboratory, Boston Children's Hospital, Harvard Medical School, Boston, 02115, USA)
ObjectiveTo explore the clinical phenotype and gene variation features of Cardio-facio-cutaneous syndrome (CFC).MethodDNA were extracted from peripheral blood in 2 children with CFC and their parents, and the mutation gene were detected by high throughput sequencing of target gene and veri fi ed by Sanger sequencing.ResultsTwo patients were Han nationality females and aged 13 months and 7.5years respectively. Both of them showed craniofacial features of epicanthus, fl at nose and scant hair, and had history of growth retardation and epileptic seizure. The electrocardiogram in one case showed that there was a change in T wave and P-R interval reached the normal high limit. The electrocardiogram in the other case was normal. Genetic detection revealed that there were two heterozygous missense mutation in the third exon of MAP2K1, c.383G>T, p.Gly128Val and c.389A>G, p.Tyr130Cys, which were new mutations (de novo) and CFC mutation sites reported in the literature.ConclusionThe two cases of CFC were fi rst reported in China and both had MAP2K1 mutations. The children with CFC were reported to be mostly complicated with heart disease, thus these 2 patients should be followed up for cardiac function.
cardio-facio-cutaneous syndrome; MAP2K1 gene; targeted gene sequencing; de novo mutation
10.3969/j.issn.1000-3606.2017.04.011
2016-10-18)
(本文编辑:蔡虹蔚)
国家自然科学基金项目(No.81472051);上海市科委国际合作项目 (No.15410722800);上海市教委高峰计划项目(No.20152529)
王剑 电子信箱:wangjian@scmc.com.cn

