孕酮对新生鼠脑室周围白质软化模型脑白质少突细胞标记物O1和O4表达的影响
雷贤明 杨 洁 曹云涛
遵义医学院附属医院新生儿科(贵州遵义 563000)
孕酮对新生鼠脑室周围白质软化模型脑白质少突细胞标记物O1和O4表达的影响
雷贤明 杨 洁 曹云涛
遵义医学院附属医院新生儿科(贵州遵义 563000)
目的探讨孕酮对新生鼠脑室周围白质软化(PVL)动物模型脑室周围白质O1和O4表达的影响。方法2日龄新生SD大鼠随机分为模型组、实验组、假手术组。模型组和实验组结扎左侧颈总动脉并吸入低氧气源(8%O2+92%N2)0.5 h制备PVL动物模型,实验组脑缺氧缺血后立即腹腔注射孕酮 10 mg/(kg·d);假手术组只分离左侧颈总动脉不结扎、不缺氧。术后1、4、7、14天比较三组脑组织病理改变,免疫组织化学染色方法检测三组大鼠各个时点脑室旁白质区O1、O4表达。结果
孕酮; 脑室周围白质软化; 少突细胞标记物O4; 少突细胞标记物O1; 新生大鼠
随着新生儿重症监护病房(NICU)救治水平的提升,极低出生体质量儿、超低出生体质量儿的存活率提高,早产儿脑损伤发病率也逐渐增加。脑室周围白质软化(periventricular leukomalacia,PVL)是早产儿脑损伤的主要形式,是导致早产儿神经发育、行为障碍及脑瘫的主要原因[1]。PVL发病与脑缺氧缺血关系密切。本实验通过脑缺氧缺血制备新生大鼠脑室周围白质软化模型,早期给予孕酮干预,观察新生大鼠脑室周围白质病理改变及晚期少突胶质细胞前体标记物O1(oligodendrocyte marker O1)和O4的表达变化,探讨孕酮对新生大鼠脑室周围白质软化动物模型的神经保护作用。
1 材料与方法
1.1 实验动物及分组
2日龄清洁级SD大鼠,体质量(7.65±0.12)g,雌雄不拘。亲代雌鼠及雄鼠购买于第三军医大学医学实验动物中心,编号:scxk(渝)2012-0005。纳入实验动物120只,每组40只,保证各时点有8只大鼠成功造模。实验中共死亡大鼠25只,死亡大鼠另行补充。
将新生SD大鼠随机分为模型组、实验组及假手术组。模型制备参照Taniguchi等[2,3]大鼠经10%水合氯醛腹腔注射麻醉后,分离并结扎左侧颈总动脉,术后室温中恢复1 小时,随后吸入8%O2+92%N2低氧混合气体0.5小时。假手术组只分离左侧颈总动脉,不结扎、不缺氧;给药参照Li等[4]模型组及假手术组腹腔注射芝麻油0.1 mL,实验组腹腔注射0.5 g/L的孕酮溶液10 mg/kg,间隔24小时1次,连续3次,用药完毕后送回母鼠身边喂养。
1.2 方法
1.2.1 脑组织病理切片制备 三组大鼠于术后1、4、7、14天各取8只,4%多聚甲醛穿心注射处死,制作脑组织标本,进行石蜡包埋切片和苏木精-伊红(HE) 染色。脑组织自丘脑中1/3平面开始连续冠状切片,片厚4μm,切面包括脑室、胼胝体、脑室周围白质等部位,常规HE染色观察三组脑室周围白质病理改变。
1.2.2 脑室周围白质O4和O1表达检测 经丘脑中1/3平面开始连续冠状切片,通过免疫组织化学法(SP染色)检测脑室周围白质O1和O4的表达,操作按说明书进行。一抗(兔来源,O1稀释度1:100,O4稀释度1:100,均购买于R&D USA),二抗(羊抗兔抗体,均购买于上海基因科技有限公司)。O1、O4染色均以细胞膜着色呈黄色或棕色为阳性细胞。每只大鼠随机选取3张切片,在400倍光镜下随机选取脑室周围白质3个检测面积相同的阳性细胞区域由Image-Pro Plus 6.0细胞图像分析软件完成图像采集并处理数据。1.3 统计学分析
采用SPSS 17.0统计软件进行数据处理。正态分布计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法;以P<0.05为差异有统计学意义。
2 结果
2.1 三组新生鼠的一般情况
模型组、实验组新生大鼠结扎左侧颈总动脉后出现不同程度的发绀、皮肤苍白、呼吸减慢;在缺氧舱中缺氧期间,新生大鼠表现为烦躁不安,时有阵发性点头状、上肢屈曲及下肢伸直状抖动,全身皮肤苍白、青紫,缺氧结束后10~30 min,皮肤青紫逐渐好转,其他症状均于术后1天内消失,实验中模型组和实验组大鼠共死亡25只。假手术组无青紫、皮肤苍白、烦躁及四肢抖动等症状。
2.2 三组新生鼠脑组织病理改变
假手术组在术后各时间点脑室周围白质区细胞排列整齐,结构完整,双侧脑室对称。术后1天模型组及实验组大鼠均出现脑室周围白质神经细胞稀疏、水肿、排列紊乱;术后4天模型组脑室周围白质区组织结构疏松明显,出现细胞水肿、坏死、核固缩,小胶质细胞较多;术后7天模型组脑室周围白质区有液化性坏死,有筛孔状坏死灶及囊腔形成,左侧侧脑室稍扩大;术后14天模型组左侧侧脑室进一步扩大,脑室周围出现软化灶,白质区出现新生血管、胶质细胞增生;术后4、7、14天实验组脑室周围白质病变与模型组病理改变相似,但较轻,新生血管、胶质细胞增生明显。见图1。
2.3 三组新生大鼠脑室旁白质区O4表达变化
三组大鼠在术后不同时间点(1、4、7和14天)脑室旁白质区O4阳性细胞的IOD值差异有统计学意义(F= 220.37~500.29,P均<0.001);术后1、4、7天脑室旁白质区O4阳性细胞IOD值逐渐增加,术后7天达高峰,术后14天较7天明显下降。在不同时间点,三组大鼠之间O4阳性细胞的IOD值差异有统计学意义(F=341.53~624.33,P均<0.001);在各个时间点,模型组与实验组O4阳性细胞的积分光密度(IOD)值均较假手术组低,模型组更低于实验组,差异均有统计学意义(P<0.01)。见表1、图2。
2.4 三组新生大鼠脑室旁白质区O1表达变化
三组大鼠在术后不同时间点(1、4、7和14天)脑室旁白质区O1阳性细胞的IOD值差异有统计学意义(F=351.48~790.49,P均<0.001);脑室旁白质区O1阳性细胞IOD值于术后1、4、7天逐渐上升,术后7天达最高值,术后14天阳性表达减少。在不同时间点,三组大鼠之间O1阳性细胞的IOD值差异有统计学意义(F=155.46~447.11,P均<0.001);在各个时间点,模型组与实验组O1阳性细胞的IOD值均较假手术组低,模型组更低于实验组,差异均有统计学意义(P<0.01)。见表2、图3。
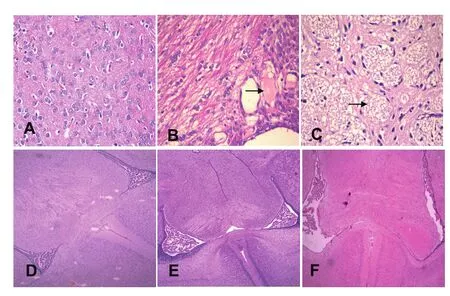
图1 三组术后7天脑组织病理改变和14天脑室大小变化
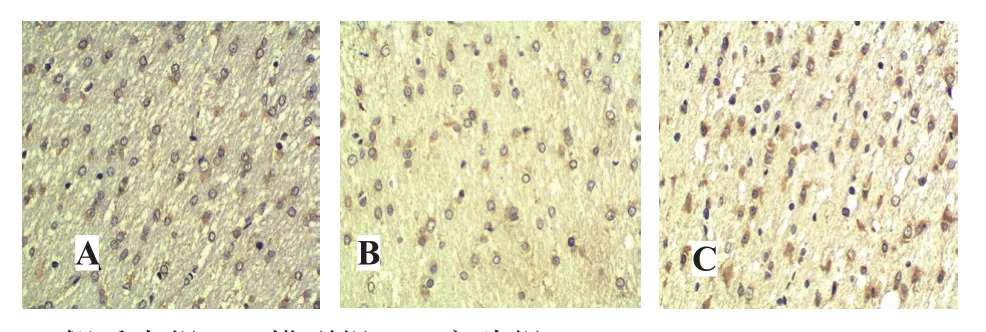
图2 三组大鼠术后7天脑室周围白质区O4表达(SP×400)
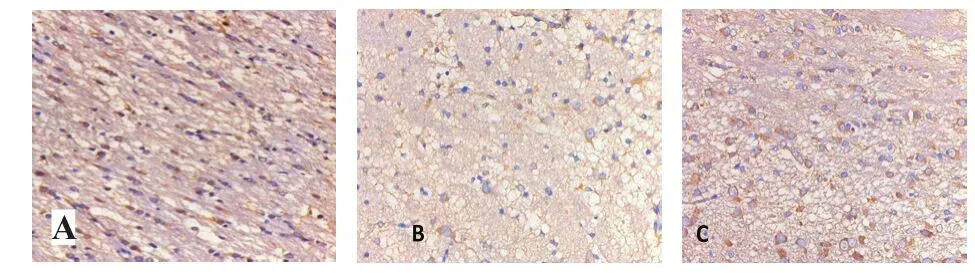
图3 三组大鼠术后7天脑室周围白质区O1表达(SP×400)
表1 不同时间三组大鼠脑室旁白质区O4阳性细胞IOD值比较 (n=8,±s)

表1 不同时间三组大鼠脑室旁白质区O4阳性细胞IOD值比较 (n=8,±s)
注:1)与假手术组比较,P<0.01;2)与模型组比较,P<0.01
组 别 术后1 天 术后4 天 术后7天 术后14 天 F值 P假手术组 30 718.23±1 369.60 34 572.70±1 338.35 41 599.70±1 805.57 35 618.67±1 383.31 220.37 <0.001模型组 18 689.76±959.211) 25 495.60±1 132.271)29 894.43±1 107.931)24 722.16±949.431) 500.29 <0.001实验组 24 939.86±1 173.741)2)29 730.60±1 129.481)2)38 855.97±1 048.041)2)33 581.87±1 708.761)2) 470.93 <0.001 F值 624.33 341.53 483.03 421.38 P<0.001 <0.001 <0.001 <0.001

表2 不同时间三组大鼠脑室旁白质区O1阳性细胞IOD值比较 (n=8,x±s)
3 讨论
早产儿脑损伤主要是脑白质损伤和脑室周围-脑室内出血,脑白质损伤包括PVL和弥漫性脑白质损伤,是导致早产儿神经系统发育障碍的主要原因[5],其发生与早产儿脑血管解剖的特殊性、压力被动性脑血流、晚期少突胶质细胞前体对缺氧缺血高度敏感及宫内感染有关。生后1~5天新生SD大鼠少突胶质细胞以晚期少突胶质细胞前体细胞为主,主要分布于脑室周围白质、胼胝体和皮质下白质,2日龄SD大鼠的晚期少突胶质细胞前体数量最多,易受缺氧缺血或感染损伤。本研究实验动物选用2日龄SD大鼠,与人类24~32周早产儿发生PVL的时间窗一致[6]。经脑组织HE染色病理检查证实,本研究中新生2日龄鼠脑缺氧缺血后脑室周围白质区、皮质下白质神经细胞出现水肿,细胞间隙增宽;随着日龄增加,可见液化性坏死灶,有筛孔状坏死灶及囊腔形成,左侧侧脑室稍扩大,到术后14天时PVL模型组左侧脑室进一步扩大,脑室周围出现软化灶,与早产儿PVL的病理改变相符,说明选择2日龄新生SD大鼠经脑缺血缺氧后成功制作PVL模型。
研究表明,晚期少突胶质细胞前体的特异性标记抗原O4(+),未成熟的少突胶质细胞O4(+)、O1(+),晚期少突胶质细胞前体受损后发育成为未成熟少突胶质细胞的数量减少,从而使O4、O1阳性细胞的表达减少[7]。因此检测脑室周围白质中O4、O1阳性细胞的表达情况可反映少突胶质细胞的受损以及发育成熟程度。本研究三组新生大鼠术后4天开始O1阳性细胞逐渐增多、7天达高峰、14天开始下降,符合新生鼠出生少突胶质细胞分化成熟过程和特点。各个时点O1和O4的表达均以假手术组最多、实验组次之、模型组最少,提示2日龄新生鼠脑缺氧缺血导致晚期少突胶质细胞前体受损,使未成熟的少突胶质细胞减少,导致O1阳性和O4阳性细胞减少;外源性应用孕酮后可减轻新生鼠脑缺氧缺血所致脑室周围白质病理损害,提示外源性孕酮可促进脑室周围白质O1和O4的表达,使晚期少突胶质细胞前体向未成熟少突胶质细胞发育和分化,促进髓鞘形成,对脑白质损伤起到保护作用[8]。
孕酮除在卵巢和胎盘可合成外,在神经系统的星型胶质细胞、少突胶质细胞、小胶质细胞中也能合成,其受体主要位于海马、大脑皮质、小脑、下丘脑、嗅球等部位[9],孕酮与少突胶质细胞的分化成熟、髓鞘形成,以及神经发育有关[10]。生理水平的孕激素在体内和体外均有神经保护作用,脑损伤后其血中水平迅速增加,与受损神经修复有关,对神经损伤有明显的保护作用。动物实验表明,孕酮可通过减轻脑细胞水肿、调节炎症反应、抑制凋亡、改善神经元存活等途径,发挥对创伤性脑损伤、缺血性脑损伤、脊髓病变、周围神经病变、脱髓鞘病变等的神经保护作用[11]。临床上已开始应用孕酮治疗脑损伤并取得了一定疗效[12]。本研究观察脑组织病理改变和脑白质O1、O4表达,结果提示孕酮对新生鼠脑室周围白质软化有神经保护作用,为临床上应用孕酮防治早产儿脑白质损伤提供了新的思路。
[1]Serenius F, Källén K, Blennow M, et al. Neurodevelopmental outcome in extremely preterm infants at 2.5 years after active perinatal care in Sweden [J]. JAMA, 2013, 309(17):1810-1820.
[2]Taniguchi H, Andreasson K. The hypoxic-ischemic encephalopathy model of perinatal ischemia [J]. J Vis Exp, 2008, (21). pii: 955. doi: 10.3791/955.
[3]Choi EK, Park D, Kim TK, et al. Animal models of periventricular leukomalacia [J]. Lab Anim Res, 2011, 27(2): 77-84.
[4]Li X, Zhang J , Zhu X, et al. Progesterone reduces inflammation and apoptosis in neonatal rats with hypoxic ischemic brain damage through the PI3K/Akt pathway [J]. Int J Clin Exp Med, 2015, 8(5):8197-8203.
[5]陈惠金,范秀芳,高喜容,等. 6家医院147例脑损伤早产儿的多中心随访报告 [J]. 中国当代儿科杂志, 2009, 11(3):166-172.
[6]Craig A, Ling Luo N, Beardsley DJ, et al. Quantitative analysis of perinatal rodent oligodendrocyte lineage progression and its correlation with human [J]. Exp Neurol, 2003, 181(2):231-240.
[7]Yang Y, Lewis R, Miller RH. Interactions between oligodendrocyte precursors control the onset of CNS myelination [J]. Dev Biol, 2011, 350(1): 127-138.
[8]Kaur P, Jodhka PK, Underwood WA, et al. Progesterone increases brain-derived neuroptrophic factor expression and protects against glutamate toxicity in a mitogen-activated protein kinase- and phosphoinositide-3 kinase-dependent manner in cerebral cortical explants [J]. J Neurosci Res, 2007, 85(11):2441-2449.
[9]Meffre D, Labombarda F, Delespierre B, et al. Distribution of membrane progesterone receptor alpha in the male mouse and rat brain and its regulation after traumatic brain injury [J]. Neuroscience, 2013, 231:111-124.
[10]Kelleher MA, Palliser HK, Walker DW, et al. Sex-dependent effect of a low neurosteroid environment and intrauterine growth restriction on foetal guinea pig brain development [J]. J Endocrinol, 2011, 208(3):301-309.
[11]Deutsch ER, Espinoza TR, Atif F, et al. Progesterone's role in neuroprotection, a review of the evidence [J]. Brain Res, 2013, 1530:82-105.
[12]Robertson CL, Fidan E, Stanley RM, et al. Progesterone for neuroprotection in pediatric traumatic brain injury [J]. Pediatr Crit Care Med, 2015, 16(3):236-244.
Effect of progesterone on the expression of O4 and O1 in the white matter of neonatal rat model with periventricular leukomalacia
LEI Xianming, YANG Jie, CAO Yuntao
(Department of Neonatology, Af fi lated Hospital of Zunyi Medical College, Zunyi 563000, Guizhou, China)
ObjectiveTo explore the effect of progesterone on the expression of O4 and O1 in the white matter of neonatal rat model with periventricular leukomalacia (PVL).Methods2-day-old neonatal SD rats were randomly divided into model group, experimental group, and sham operation group. Rats' left common carotid artery was ligated and exposed to hypoxia (8%O2+92%N2) for 0.5 h in both the model group and experimental group to build the PVL animal model. The rats in experimental group was injected intraperitoneally with progesterone 10 mg/(kg·d) immediately after cerebral hypoxia ischemia. In sham operation group, rats' left common carotid artery was only isolated without ligation and hypoxia. 1, 4, 7, and 14 days after operation, the pathological changes of brain tissue were compared among three groups. Immunohistochemical staining was used to detect the expression of O1 and O4 in the cerebral cortex of rats in three groups at different time points.ResultsThere were no abnormal pathological changes in the white matter in the sham operation group at each time point. The left ventricular enlargement and periventricular leukomalacia were found in both model and experimental groups, while the pathological damages of white matter in experimental group were signi fi cantly lighter than those in model group at each time point. The integral optical density (IOD) of O1 and O4 positive cells in the cerebral cortex of the three groups was gradually increased at day 1, day 4, and day 7 after operation and reached the peak level at day 7 , then was decreased at day 14 after operation. There was statistically signi fi cant difference (P<0.01). At day 1, day 4, day 7, and day 14, the integral optical density (IOD) of O1 and O4 positive cells in the cerebral cortex of sham operation group was highest, followed by experimental group and model group, and there was signi fi cant difference (P<0.01).ConclusionProgesterone can reduce the pathological damage in the cerebral cortex in neonatal rats with PVL, and promote the expression of O1 and O4 in the periventricular white matter, which can promote the differentiation and maturation of oligodendrocytes.
progesterone; periventricular leukomalacia; oligodendrocyte marker O4; oligodendrocyte marker O1; neonatal rat
10.3969/j.issn.1000-3606.2017.04.018
2016-09-23)
(本文编辑:蔡虹蔚)
贵州省卫计委资助课题(No.gzwjkj2014-1-072);遵义医学院硕士点基金资助课题(No.2C2201603186)
曹云涛 电子信箱:cyto827@aliyun.com
假手术组各时点脑白质区未见异常病理改变;模型组和实验组均出现左侧脑室扩大和脑室周围白质软化灶等病理改变,但实验组各时点脑白质病理改变均明显轻于模型组。三组大鼠脑室旁白质区O1、O4阳性细胞的积分光密度(IOD)在术后1、4、7天的表达逐渐增加,第7天达高峰,第14天下降,差异有统计学意义(P均<0.01)。在术后1、4、7、14天,三组脑室旁白质区O1、O4阳性细胞IOD在同一时间点均以假手术组最多,实验组其次,模型组最少,差异有统计学意义(P<0.01)。结论孕酮可减轻新生大鼠PVL模型动物脑室旁白质区病理损伤,促进脑室周围白质O1、O4表达,促进少突胶质细胞分化成熟。

