两性霉素B脂质体治疗儿童耐锑剂黑热病1例并文献复习
袁传杰 朱 渝
四川大学华西第二医院儿科/出生缺陷与相关妇儿疾病教育部重点实验室(四川成都 610041)
两性霉素B脂质体治疗儿童耐锑剂黑热病1例并文献复习
袁传杰 朱 渝
四川大学华西第二医院儿科/出生缺陷与相关妇儿疾病教育部重点实验室(四川成都 610041)
目的探讨儿童耐锑剂黑热病的治疗。方法回顾分析1例耐锑剂黑热病患儿的临床资料,并复习相关文献。结果患儿,男,2岁5个月。1年半前因发热、血三系降低、肝脾肿大等经骨髓检查确诊黑热病,予足量锑剂治疗好转,以后复发2次,均予足量锑剂治疗好转。第3次复发,考虑为耐锑剂黑热病,经两性霉素B脂质体(第1天1mg/kg,第2天2mg/kg,第3~7天及第10天3mg/kg,累计剂量21mg/kg)治疗好转,随访1年未复发。结论两性霉素B脂质体可治疗儿童耐锑剂黑热病。
两性霉素B脂质体; 黑热病; 治疗; 儿童
黑热病(Kala-Azar)又称内脏利什曼病(Visceral leishmaniasis),是由利什曼原虫引起的以白蛉为传播媒介的寄生虫病,本病呈全球性分布,我国目前仅在新疆、甘肃、四川、陕西、山西和内蒙古6省小范围流行,黑热病治疗首选药物为五价锑,其他治疗药物主要包括两性霉素B、两性霉素B脂质体、喷他脒(pentamidine)、米替福新(miltefosine)和巴龙霉素(paromomycin)。四川大学华西第二医院感染儿科收治1例耐锑剂黑热病患儿并予两性霉素B脂质体成功治疗,现报告如下。
1 临床资料
患儿,男,2岁5个月。患儿于2014年2月(1年半前)反复发热16天,于当地医院查血常规示三系降低,肝脾肿大,抗感染无效,骨髓检查后诊断黑热病。给予锑剂(3mL,6支,1800mg)、输血等治疗后好转出院。2014年8月(1年前)患儿再次反复发热,血常规示三系降低,兰州某医院骨髓检查后诊断黑热病,予锑剂(4mL,12支,4800mg)治疗好转出院。2015年2月患儿再次发热,血常规示三系降低,未做骨髓检查,考虑黑热病,予锑剂(4.5 mL,18支,8100mg)、输血后好转。2015年8月患儿再次发热,最高体温38.5℃,口服退热药后可降至正常,约3次/天,伴流涕及面色苍黄,来四川大学华西第二医院就诊,门诊查血常规白细胞计数2.4×109/L,中性粒细胞0.17,血红蛋白52g/L,血小板70×109/L,C反应蛋白63.0mg/L,以黑热病、重度贫血收入院。患儿出生于甘肃省陇南市宕昌县,当地有黑热病流行史,家住农村,居家周围有林区,易被蚊虫叮咬。入院体格检查:体质量14kg,体温36.6℃,心率120次/min,呼吸28次/min。贫血面容,皮肤苍黄,口唇、甲床苍白。双侧颈部淋巴结扪及肿大淋巴结,左侧最大2枚直径约1.5cm,右侧最大约1.0cm,肝脏肋下5cm、剑突下4cm,脾脏Ⅰ线8cm、Ⅱ线10cm、Ⅲ线0cm,余无异常。血培养、肥达-外斐试验均无异常。
入院后予头孢曲松抗感染7天,输红细胞2天各1.5U。患儿仍反复发热。行骨髓检查(8月28日)提示:黑热病(全片易见利-杜氏小体)。遂于2015年9月1日至14日予葡萄糖酸锑钠静滴14天,累计剂量294mg/kg(体质量14.0 kg),治疗3天左右体温基本正常。治疗期间血常规中性粒细胞上升欠佳(表1),血红蛋白进行性下降,于9月9日予重组人粒细胞刺激因子升粒细胞,9月11日再输注红细胞悬液1.5U。再次骨髓检查(9月15日)仍可见利-杜氏小体。因患儿既往规范予锑剂治疗,复发3次,故考虑为耐锑剂黑热病。于9月16日开始两性霉素B脂质体治疗,第1天1mg/kg,第2天2mg/kg,第3~7天及第10天3mg/ kg,累计剂量21mg/kg,同时予水化、补充电解质、氢化可的松减轻不良反应。患儿输注两性霉素B脂质体过程中无发热、寒战等不良反应,监测肝、肾功能及电解质均正常。2015年9月28日好转出院,查体:口唇及面色善红润,双侧颈部淋巴结可触及,腹软,肝脏肋下3cm、剑突下4cm,脾脏Ⅰ线7cm、Ⅱ线9cm、Ⅲ线0cm;复查血常规白细胞计数5.4×109/L,中性粒细胞绝对值 1.85×109/L,血红蛋白91g/L,血小板计数117×109/L,C反应蛋白10.0mg/L。1年后电话随访,患儿无发热等表现,血常规三系无异常。
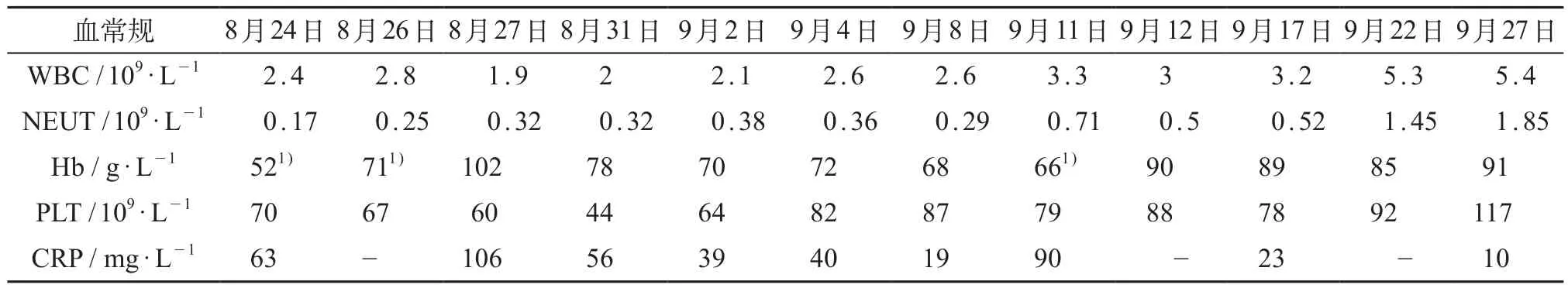
表1 患儿血常规变化情况
2 讨论
黑热病主要是由杜氏利什曼原虫(Leishmaniadonovani)和婴儿利什曼原虫(Leishmaniainfantum)所致的传播性原虫感染,中东的热带利什曼原虫(Leishmaniatropica)和南美地区的亚马孙利什曼原虫(Leishmaniaamazonensis)偶尔也能致病[1]。传播媒介主要有长管白蛉、吴氏白蛉、亚历山大白蛉和中华白蛉等[2]。黑热病的全球患病率约为1 200万例,而每年新增20万~40万例,全球超过90%的病例主要分布于印度、孟加拉国、苏丹、南苏丹、巴西和埃塞俄比亚这6个国家[3]。我国至20世纪70年代末,大部分流行区的内脏利什曼病已告消除,目前,新疆、甘肃、四川、陕西、山西和内蒙古等西部6省(区)有黑热病流行或散发[2]。
从1940s开始,五价锑用于黑热病治疗,目前仍是世界上绝大部分地区治疗黑热病的一线用药,主要形式包括葡萄糖酸锑钠及葡甲胺锑[4]。对于成人,五价锑的总剂量逐年增加,1982年世界卫生组织(WHO)建议锑剂治疗剂量为20mg/(kg·d),总量不超过850 mg/ d;1992年WHO推荐锑剂剂量为20 mg/(kg·d),无每日总量限制,疗程28~30天[5]。对于儿童,有文献回顾分析阿尔巴尼亚1995-2009年1210例0~14岁住院黑热病儿童使用锑剂治疗,五价锑每天剂量20mg/kg,持续疗程21~28天,治愈率达到99%[6]。我国儿童黑热病的一线治疗也是锑剂[7]。1991年及以前采用传统剂量与用法,儿童整个疗程锑剂总量150~200 mg/kg,平分6剂,疗程为6~10 d,1991年后增大整个疗程锑剂总量,体质量<20 kg,总量220~240 mg/kg;体质量20~40 kg,总量200~220 mg/kg;体质量>40 kg,总量180~200 mg/kg;疗程为连用8~15 d。经锑剂治疗后,第1次复发,治疗剂量在总剂量基础上增加1/6;第2次复发,在总剂量基础上增加1/3;而第3次复发,则视为锑剂耐药。
黑热病在给予锑剂治疗后部分存在复发。国内研究表明,12岁以下儿童、锑剂治疗不规范等为黑热病复发的高危因素[7]。国外研究认为,诊断时间超过3个月、血红蛋白<60g/L、年龄<1岁为黑热病复发的高危因素[8]。因此,儿童黑热病易复发可能与儿童特别是婴幼儿免疫系统不完善,免疫记忆及免疫应答能力弱有关。本例患儿入院前已予3次足量葡萄糖酸锑钠治疗,入院后再次予锑剂治疗无效,考虑为锑剂耐药,予二线药物两性霉素B脂质体治疗,取得良好的治疗效果,随访1年无复发。目前国内仅有数例关于两性霉素B治疗成人耐锑剂黑热病的文献[9-12],而对于儿童抗锑剂黑热病的治疗,国内尚未见文献报道。黑热病主要流行国家和地区锑剂耐药率较高,印度北部地区锑剂耐药率高达50%~65%[13]。黑热病耐药机制多种多样,最具代表性的机制是原虫细胞膜表面ABC(ATP-binding cassette)转运蛋白家族介导的锑剂排泄,包括MPRA、ABCC3、ABCI4、ABCG2、LABCG2等转运蛋白[14]。利什曼原虫特有的耐药基因也参与其中,有报道利什曼原虫34号染色体末端的端粒基因族可导致锑剂耐药[15]。
早在20世纪60年代开始,两性霉素B就应用于黑热病治疗,不同国家及地区用法不一。在印度,剂量为1mg/(kg·d),隔日1次,共30天(累计剂量为15mg/ kg);或1mg/(kg·d)持续20天(累计剂量为20mg/kg);或0.75mg/kg,隔日1次,共30天(累计剂量11.25mg/ kg)[16,17]。在乌干达,剂量为1mg/(kg·d),隔日1次,共30天(累计剂量为15mg/kg),治愈率为92.4%[18]。在突尼斯,剂量为0.5~1mg/(kg·d),连续25天每天输注(累计12.5~25mg/kg),治愈率达100%[19]。2010年WHO建议的两性霉素B用法为0.75~1mg/(kg·d),每天或隔天加入5%葡萄糖溶液中静脉输注4小时以上,共15~20次,治愈率可达99%[4]。总之,两性霉素B需小剂量、长疗程使用。由于两性霉素B的不良反应以及长疗程,导致其在临床应用中受到一定限制。
两性霉素B脂质体较两性霉素B不良反应小,且其药代动力学以及生物利用度均优于两性霉素B,已成为许多地区治疗黑热病的一线药物以及治疗耐锑剂黑热病的首选药物[20]。有研究比较单剂15mg/kg两性霉素B脂质体与两性霉素B 1mg/(kg·d)连续20天每天输注治疗黑热病,治愈率均为100%[21]。印度报道,予单剂10mg/kg两性霉素B脂质体和予两性霉素B 1mg/(kg·d)累积15mg/kg治疗黑热病的治愈率分别为96.3%及95.7%,无明显差异。单剂10mg/kg两性霉素B不良反应包括输注过程中发热及寒战(40%),贫血或血小板减少(2%),肝、肾损害的发生率<1%[22]。孟加拉国报道,予单剂10mg/kg两性霉素B脂质体治疗黑热病的治愈率为97%,不良反应主要为输注时的发热(26%)、发热伴寒战(36%)以及低血压(19%)等,无严重不良反应[23]。孟加拉国推荐两性霉素B脂质体5mg/(kg·d),连续3天输注为治疗黑热病的一线治疗方案[24]。WHO推荐在南亚(主要为孟加拉国、印度、不丹、尼泊尔)两性霉素B脂质体治疗黑热病的用法为3~5mg/(kg·d),连续3~5天输注(累积剂量15mg/ kg),或者单剂10mg/kg输注[4]。欧美国家基于用药安全考虑,两性霉素B脂质体使用单次剂量小,时间相对较长。意大利两性霉素B脂质体标准用法为3mg/ (kg·d),在1~5天及第10天给药,累积剂量为18mg/ kg[25]。而美国FDA推荐用法为3mg/(kg·d),在1~5天、第14天及第21天给药,累积剂量为21mg/kg[26]。与两性霉素B输注方案相比,两性霉素B脂质体短疗程方案更加方便,实用性强。参考上述推荐治疗方案,采用累积21mg/kg的剂量治疗本例耐锑剂黑热病患儿,输注过程中无明显不良反应,治疗后随访1年无复发。
综上所述,两性霉素B脂质体可以作为儿童耐锑剂黑热病的治疗药物,疗效肯定,不良反应小,安全可靠。关于我国两性霉素B脂质体治疗儿童耐锑剂黑热病的有效治疗剂量、合理的治疗疗程以及安全性评估,仍需进一步大样本、多中心的临床研究。
[1]van Griensven J, Diro E. Visceral leishmaniasis [J]. Infect Dis Clin North Am, 2012, 26(2): 309-322.
[2]管立人.我国内脏利什曼病的现状和对防治工作的展望[J].中国寄生虫学与寄生虫病杂志, 2009, 27(5): 394-397.
[3]Alvar J, Vélez ID, Bern C, et al. Leishmaniasis worldwide and global estimates of its incidence [J]. PLoS One, 2012, 7(5): e35671.
[4]World Health Organization. Control of the leishmaniases [J]. World Health Organ Tech Rep Ser, 2010, (949): xii-xiii, 1-186.
[5]HerwaldtBL, BermanJD.Recommendations for treating leishmaniasis with sodium stibogluconate (Pentostam) and review of pertinent clinical studies [J]. Am J Trop Med Hyg, 1992, 46(3): 296-306.
[6]Petrela R, Kuneshka L, Foto E, et al. Pediatric visceral leishmaniasis in Albania: a retrospective analysis of 1, 210 consecutive hospitalized patients (1995-2009) [J]. PLoS Negl Trop Dis, 2010, 4(9). pii: e814.
[7]张富南,张丽萍.四川省黑热病复发和死亡原因分析[J].预防医学情报杂志, 2010, 26(12): 961-965.
[8]Kajaia M, Morse DL, Kamkamidze G, et al. Risk factors for relapse of visceral leishmaniasis in Georgia [J]. Trop Med Int Health, 2011, 16(2): 186-192.
[9]王新宇, 卢洪洲, 潘孝彰, 等.二性霉素B治疗黑热病一例 [J].中华传染病杂志, 2002, 20(4): 228.
[10]陈生邦, 杨成明, 张丑吉, 等. 国产两性霉素B治愈抗锑性内脏利什曼病1例[J].中国寄生虫学与寄生虫病杂志, 2007, 25(3):封2.
[11]袁巧荣. 国产两性霉素B治愈耐锑剂内脏利什曼病2例[J].中国寄生虫学与寄生虫病杂志, 2010, 28(3): 209-213.
[12]杨启明, 袁巧荣, 尹芳娟,等. 两性霉素治愈耐锑剂黑热病1例 [J]. 地方病通报, 2009, 24(3):111.
[13]Sundar S. Drug resistance in Indian visceral leishmaniasis [J]. Trop Med Int Health, 2001, 6(11): 849-854.
[14]Perea A, Manzano JI, Castanys S, et al. The LABCG2 transporter from the protozoan parasite leishmania is involved in antimony resistance [J]. Antimicrob Agents Chemother, 2016, 60(6): 3489-3496.
[15]Tejera Nevado P, Bifeld E, Höhn K, et al. A telomeric cluster of antimony resistance genes on chromosome 34 of leishmania infantum [J]. Antimicrob Agents Chemother, 2016, 60(9): 5262-5275.
[16]Olliaro PL, Guerin PJ, Gerstl S, et al. Treatment options for visceral leishmaniasis: a systematic review of clinical studies done in India, 1980-2004 [J]. Lancet Infect Dis, 2005, 5(12): 763-774.
[17]Sundar S, Chakravarty J, Rai VK, et al.Amphotericin B treatment for Indian visceral leishmaniasis: response to 15 daily versus alternate-day infusions [J]. Clin Infect Dis, 2007, 45(5): 556-561.
[18]Sundar S, Singh A, Agarwal D, et al. Safety and efficacy of high-dose infusions ofa preformed amphotericin B fat emulsion for treatment of Indian visceral leishmaniasis [J]. Am J Trop Med Hyg, 2009, 80(5): 700-703.
[19]Toumi A, Kilani B, Ammari L, et al. Demographic,clinical and therapeutic features of adult visceral leishmaniasis at the Rabta hospital in Tunis (tunisia) from 1983 to 2002 [J]. Bull Soc Pathol Exot, 2007, 100(4): 282-286.
[20]Gradoni L, Soteriadou K, Louzir H, et al. Drug regimens for visceral leishmaniasis in Mediterranean countries [J]. Trop Med Int Health, 2008, 13(10): 1272-1276.
[21]Thakur CP. A single high dose treatment of kala-azar with Ambisome (amphotericin B lipid complex): a pilot study [J]. Int J Antimicrob Agents, 2001, 17(1): 67-70.
[22]Sundar S, ChakravartyJ, Agarwal D, et al. Single-dose liposomal amphotericin B for visceral leishmaniasis in India [J]. N Engl J Med, 2010, 362(6): 504-512.
[23]Mondal D, Alvar J, Hasnain MG, et al.Efficacy and safety of single-dose liposomal amphotericin B for visceral leishmaniasis in a rural public hospital in Bangladesh: a feasibility study [J]. Lancet Glob Health, 2014, 2(1): e51-57.
[24]Lucero E, Collin SM, Gomes S, et al. Effectiveness and safety of short course liposomal amphotericin B (AmBisome) as fi rst line treatment for visceral leishmaniasis in Bangladesh [J]. PLoS Negl Trop Dis, 2015, 9(4): e0003699.
[25]Gradoni L, Gramiccia M, Scalone A. Visceral leishmaniasis treatment, Italy [J]. Emerg Infect Dis, 2003, 9(12): 1617-1620. [26]Pearson RD, Jeronimo SM, Lareau SM. US Food and Drug Administration Approval of liposomal amphotericin B for the treatment of visceral leishmaniasis: a model for orphan drug development [J]. Curr Infect Dis Rep, 1999, 1(5): 415-416.
Liposomal amphotericin B successfully in treatment of Kala-Azar with antimonial resistance in a child: a case report and literature review
YUAN Chuanjie, ZHU Yu (Department of Pediatrics, The West China Second University Hospital of Sichuan University, Key Laboratory of Birth Defects and Related Diseases of Women and Children
(Sichuan University), Ministry of Education, Chengdu 610041, Sichuan, China)
ObjectiveTo explore the treatment of kala-azar with antimonial resistance in children.MethodThe clinical data of antimony resistant Kala Azar in a child was analyzed retrospectively, and the related literature were reviewed.ResultsA 2-year- and 5-month-old boy, suffered from fever, pancytopenia and hepatosplenomegaly. He was diagnosed with kala-azar by bone marrow examination, and improved after the treatment of adequate antimonial. Later, he relapsed twice and the treatment of adequate was effective.. This was the third relapse, and was considered as antimonial resistance. Liposomal amphotericin B (1 mg/kg on day 1, 2 mg/kg on day 2, 3mg/kg on day 3~7 and day 10, with accumulated dose of 21 mg/kg) was used and effective. The child improved and no relapse in one-year follow-up.ConclusionLiposomal amphotericin B can be used in the treatment of kala-azar with antimonial resistance in children.
liposomal amphotericin B; kala-azar; treatment; child
10.3969/j.issn.1000-3606.2017.04.017
2016-10-28)
(本文编辑: 梁 华)
朱渝 电子信箱:1392634080@qq.com

