低分化心内膜肉瘤1例报告
朱呈光何学华*袁勇华祝益民刘丽萍刘震宇朱潜力周文武李艳春
湖南省人民医院1.儿童医学中心,2.心外科,3.病理科(湖南长沙 410005)
低分化心内膜肉瘤1例报告
朱呈光1何学华1*袁勇华1祝益民1刘丽萍1刘震宇1朱潜力1周文武2李艳春3
湖南省人民医院1.儿童医学中心,2.心外科,3.病理科(湖南长沙 410005)
目的探讨低分化心内膜肉瘤的诊断与治疗。方法回顾分析1例低分化心内膜肉瘤患儿的临床资料。结果患儿,女,1岁,因腹泻、气促、发绀和咳嗽入院。听诊有异常心音。心电图示Ⅱ、Ⅲ、aVF导联P波高尖。经超声心动图和心脏术后病理检查确诊为低分化心内膜肉瘤。出院3个月后患儿在家中突然出现昏迷并死亡。结论低分化心内膜肉瘤的诊断主要依据临床表现、脏超声心动图及病理学检查,治疗以外科手术切除为首选,化疗和放疗有辅助治疗作用,但目前无治愈方法。
低分化心内膜肉瘤; 诊断; 治疗; 儿童
原发性心脏肿瘤少见,早年发病率在0.0017% ~0.19%。20世纪80年代后在儿科超声心电图诊断中,心脏肿瘤占0.17%~0.20%。原发性儿童心脏肿瘤中约90%为良性,而心脏恶性肿瘤如肉瘤、恶性畸胎瘤等均非常少见[1]。在心脏恶性肿瘤中,根据组织学可以分为血管肉瘤、横纹肌肉瘤、纤维肉瘤、平滑肌肉瘤以及未分化肉瘤等,其中未分化肉瘤仅占2%,大多数心脏肉瘤位于左心房,预后极差[2]。湖南省人民医院儿童医学中心收治1例低分化心内膜肉瘤患儿,现报告如下。
1 临床资料
患儿,女,1岁,因腹泻9天、气促7天、发绀5天、咳嗽3天收入院,有精神差,食纳差。平时体健,否认气促、发绀、晕厥和抽搐等病史,家族史无异常。入院体格检查:体温38.2℃,心率160次/min,呼吸50次/ min,血压98/60 mmHg,体质量8.5 kg;神志清楚,发育正常,营养良好,急性病容,表情痛苦;头颅无畸形,前囟1 cm×1 cm,平坦,张力不高,双瞳孔对光反射正常。唇周轻度发绀,咽部黏膜充血,颈无抵抗,颈动脉搏动正常,颈静脉正常,气管居中,肝颈静脉回流征阴性;胸廓无畸形,呼吸促,可见轻度三凹征,双肺叩诊清音,呼吸音粗,未闻及明显干湿啰音,无胸膜摩擦音;心前区无隆起,心尖搏动无弥散,心界稍扩大,心律齐,各瓣膜听诊区未闻及杂音,有异常心音,心音有力,无心包摩擦音;腹软,无包块,肝脏肋下2 cm,质软,边锐,脾脏未触及,无移动性浊音;无下肢静脉曲张及杵状指/趾,甲床苍白稍发绀,下肢无浮肿。入院后实验室检查:肝肾功能、心肌酶、电解质、血糖、血沉、超敏C反应蛋白、降钙素原、微量元素、免疫全套、EV71、TORCH、EBV抗体、肺炎支原体及衣原体、胸部CT、血常规、大小便常规、血培养、痰培养、遗传代谢性筛查等结果均未见明显异常;血气分析中氧分压42.7 mmHg,剩余碱-10.3 mmol/ L,氧饱和度81.9%;凝血功能中APTT >150 s,余正常。心电图:窦性心动过速,Ⅱ、Ⅲ、aVF的P波形态高尖。CT平扫:①脑干混杂密度灶,性质待定(占位性并钙化?出血?);②左顶叶低密度灶,性质待定(图1)。彩色超声心动图:三尖瓣隔瓣及十字交叉处中等回声团块,性质待查,考虑占位;三尖瓣口狭窄,三尖瓣轻度反流,卵圆孔未闭(右向左分流),右心增大(图2)。入院后次日在体外循环下开胸行心内肿物切除术。经右房切口探查发现巨大肿瘤占据大部分右心房、跨过三尖瓣,右室流出道和室间隔也见肿物,肿瘤有蒂与三尖瓣以及房室间隔相连,形态有圆形以及长条形(图3);肿瘤未侵犯心外膜及心包腔。手术彻底切除肿瘤。病理检查示:瘤体带蒂,外观分叶状,大小不等,中央可见出血及坏死。光镜检查可见瘤细胞呈弥漫性、条索状、巢状排列,血管腔不典型。免疫组化检查:CD56-、GFAP-、SMA-、S-100-、Ki-67 +60%、CD1a-、CD31血管+、CD34 +、CK(pan)部分+、Desmin-、EMA部分+、M.C-、Calretinin+、Melan-A-、Melanoma-、Myoglobin-、Myogenin-、NSE+、p 53 ++、Vimentin +、WT-1-、CK 7-、CD117-、CD45灶状+、DOG1-,特殊染色中VG +、Bcl-2-、CD99+,显示大量形状不规则、细胞质稀疏、胞核突出、多型的新生细胞,有丝分裂活跃,考虑(右心房肿瘤)恶性肿瘤,结合免疫组化考虑低分化心内膜肉瘤(图4)。患儿术后病情恢复顺利。术后第9天彩色超声心动图:右心内占位切除术后,室间隔修补、房间隔术后声像改变;三尖瓣中度反流,主动脉瓣轻度反流,左心功能测值正常范围。出院前行胸腹部CT复查未见异常。患儿家属因故拒绝术后化疗及放疗,于术后13天出院。出院后3个月患儿在家中突然出现昏迷,因呼吸心跳骤停死亡。
2 讨论
由于儿童心脏肉瘤的发生率低,原发性心脏恶性肿瘤又无特异性症状,故很难早期发现。本例患儿以腹泻等常见的消化系统表现起病,但无低血容量休克或脓毒症,与心脏肿瘤的临床表现相去甚远;同时,患儿的气促、发绀和咳嗽等表现与心功能下降有关,而与肺部体征和肺部CT改变不符合,患儿异常心音和心电图的巨大P波,是提示有心血管疾病的主要线索。
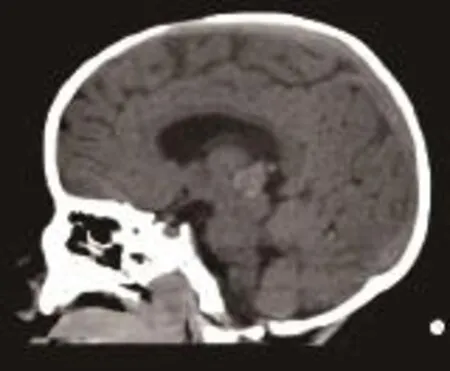
图1 头颅CT
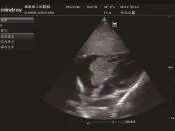
图2 彩色超声心动图
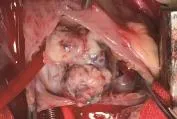
图3 手术所见
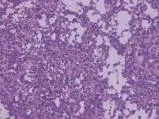
图4 免疫组化检查(×400)
原发性心脏肿瘤患者的症状与肿瘤的大小、位置以及组织学类型有关,但大多数患者无特殊症状。彩色超声心动图检查对心脏肿瘤的早期发现、明确诊断和随访有非常重要的价值,其能准确显示肿瘤大小、数目、形状、部位、附着及移动状态、肿瘤大致结构对血流动力学的影响。实时动态三维超声比二维超声在形态、大小及结构比邻评估方面更优。在产前胎儿超声心动图检查时,对胎儿生长迟缓、水肿、心律失常等情况应仔细评估,可尽早发现心脏肿瘤。
原发性低分化心内膜肉瘤恶性程度高,常常累及多个心腔,并且可破坏瓣膜。本例患儿肿瘤累及右心房、右心室和三尖瓣,导致三尖瓣口狭窄和活动障碍,并影响右心室流出道的血流,造成右房右室增大,右心衰等,在感染等情况发生时,心力衰竭更为明显。
心脏肉瘤的治疗包括手术切除、化疗以及放疗,以外科手术切除为首选。就诊时达80%的患者已出现远处转移[3],但即使有转移,为了获得相对正常的血流动力学状态,也可积极予以手术治疗[4]。本例患儿于入院后第2天予手术治疗,术后超声评估切除肿瘤后室间隔和房间隔修补无残余分流,三尖瓣修复后有中度反流,主动脉瓣轻度反流,但心功能正常。提示即时手术效果满意。
对于手术切除彻底的患者术后是否需要辅助化疗或放疗,目前尚无统一意见。有学者认为对原发性心脏恶性肿瘤切除后的早期化疗应持积极态度[5]。在化疗方面,常用的药物有环磷酰胺、阿霉素、长春新碱、氮烯咪胺、异环磷酰胺、甲氨蝶呤、顺铂及紫杉醇类等,但疗效不一[6,7]。有报道在化疗中联合使用白介素2也有助于提高治疗效果,延长生存期[8]。
有报道在原发肿瘤切除后,给予辅助放疗有助提高局部控制率,降低术后复发率[9]。但由于心肌细胞及心脏位置的特殊性,常规剂量放疗(60~70 Gy)往往造成心脏本身及周围组织明显副损伤,故主张控制总剂量在40~50 Gy,并采用分割的方式进行(1.8~2 Gy/d)。但有报道当放疗剂量达40 Gy时,心包炎的发生率会增至40%,部分患者可出现心电图改变。临床尽量采用三维适形放疗,以保证靶区放疗剂量分布均匀,同时减少心脏损伤和保护肺、脊髓等重要组织。Baay等[10]报道对1例34岁心脏血管肉瘤患者术前进行化疗(氮烯脒胺、吡柔比星、异环磷酰胺、美司纳)及放疗(总剂量2 600 Gy),再行异体心脏移植,术后继续予原方案化疗2个疗程,观察33个月未见肿瘤复发。Centella等[11]报道采用肿瘤切除联合辅助化疗(多柔比星、甲氨蝶呤、异环磷酰胺)治疗1例原发心脏血管肉瘤,患者存活4年。但由于临床治疗的病例数少,放化疗联合手术治疗方法的效果有待进一步观察。
心脏肉瘤预后不良且生存期短。影响远期生存的因素包括心功能状况、病变位置、是否存在坏死或转移等。原发性心脏肉瘤在发现时有转移者,提示多处于进展明显的阶段,预后极差,平均存活时间9~11个月[12]。本例患儿入院时头部CT提示有脑干混杂密度灶和左顶叶低密度灶,考虑为心内膜肉瘤的远处转移所致。出院3个月后,患儿在家中突然出现昏迷并死亡,推测主要与心内膜低分化肉瘤转移侵犯神经系统加重,导致脑水肿及颅高压加剧所致。
本例患儿的诊治过程,可对今后的工作带来一些启示:①儿童心脏肿瘤发病率很低,加之经验不足,临床容易漏诊或误诊。②疾病可能合并存在,一种疾病的出现可能有助于另一种疾病的暴露,该患儿因有腹泻,检查时才发现心脏肿瘤存在。③应善于从复杂的表象中抓住关键点(如异常心音和心电图改变),密切追踪,才能比较准确而全面地把握病情。④多学科的合作对于疾病的诊疗非常重要,临床、超声心动图、心外科、病理科等学科的共同努力,才使得疾病得以明确。⑤原发性低分化心内膜肉瘤的恶性程度高,并可迅速经循环系统播散到脑组织,是影响预后及生存的重要因素。
[1]杨思源, 陈树宝. 小儿心脏病学 [M]. 4版. 北京:人民卫生出版社,2012.
[2]Zhang PJ, Brooks JS, Goldblum JR, et al.Primary cardiac sarcomas:a clinicopathologic analysis of aseries with follow-up information in 17 patients and emphasis on longterm survival [J].Hum Pathol, 2008, 39(9):1385-1395.
[3]李辉, 闫玉生. 原发性心脏血管肉瘤的诊疗进展 [J]. 医学综述, 2012, 18(3): 365-367.
[4]郭长升. 心脏右心室未分化肉瘤1例 [J]. 第三军医大学学报, 2011, 33(13): 1357-1361.
[5]Reinecke P, Steckstor M, Schmitz M, et al. Chemotherapeutic potential of plant alkaloids and multidrug resistance mechanisms in malignant fi brous histiocytoma of the heart [J]. Oncol Rep, 2004, 11(3): 641-645.
[6]Asmane I, Litique V, Heymann S, et al. Adriamycin, cisplatin, ifosfamide and paclitaxel combination as frontline chemotherapy for locally advanced and metastatic angiosarcoma. Analysis of three case reports and review of the literature [J]. Anticancer Res, 2008, 28(5B):3041-3045.
[7]Kodali D, Seetharaman K. Primary cardiac angiosarcoma [J]. Sarcoma, 2006, 2006: 39130.
[8]Kakizaki S, Takagi H, Hosaka Y. Cardiac angiosarcoma responding to multidisciplinary treatment [J]. Int J Cardiol, 1997, 62(3): 273-275.
[9]Movsas B, Teruya-Feldstein J, Smith J, et al. Primary cardiac sarcoma: a novel treatment approach [J]. Chest, 1998, 114(2): 648-652.
[10]Baay P, Karwande SV, Kushner JP, et al. Successful treatment of a cardiac angiosarcoma with combined modality therapy [J]. J Heart Lung Transplant, 1994,13(5): 923-925.
[11]Centella T, Oliva E, García Andrade I, et al. A patient with cardiac angiosarcoma who survived for four years. Case report and literature review [J]. Rev Esp Cardiol, 2005, 58(3): 310-312.
[12]Kim CH,Dancer JY,Coffey D,et al.Clinicopathologic study of 24 patients with primary cardiac sarcomas:a 10-years in single institution experience [J].Hum Pathol,2008, 39(6): 933-938.
Poorly differentiated endocardial sarcoma: a case report
ZHU Chenguang1, HE Xuehua1, YUAN Yonghua1, ZHU Yimin1, LIU Liping1, LIU Zhenyu1, ZHU Qianli1, ZHOU Wenwu2, LI Yanchun3
(1. Children's Medical Center, 2. Department of Cardiac Surgery, 3. Department of Pathology, Hunan People's Hospital, Changsha 410005, Hunan, China)
ObjectiveTo explore the diagnosis and treatment of poorly differentiated endocardial sarcoma.MethodThe clinical data of a child with poorly differentiated endocardial sarcoma was retrospectively analyzed.ResultsOne-year-old girl was admitted for diarrhea, polypnea, cyanosis, and cough. Abnormal heart sound was found by auscultation. Leads Ⅱ, Ⅲ, and aVF of ECG showed high peaked P wave. The diagnosis of poorly differentiated endocardial sarcoma was con fi rmed by echocardiography and pathology after cardiac operation. Three months after discharge from the hospital, the patient suddenly came into coma and died.ConclusionThe diagnosis of poorly differentiated endocardial sarcoma is mainly based on clinical manifestations, echocardiography and pathology. Surgical resection is the fi rst choice and chemotherapy and radiotherapy play a supporting role. However, there is no cure for it currently.
poorly differentiated endocardial sarcoma; diagnosis; treatment; child
10.3969/j.issn.1000-3606.2017.04.012
2016-10-20)
(本文编辑:蔡虹蔚)
何学华 电子信箱:he_xh101@163.com
*并列第一作者

