儿童肝炎相关再生障碍性贫血5例分析
李 向 赵晓明 盛光耀
郑州大学第一附属医院儿科(河南郑州 450052)
儿童肝炎相关再生障碍性贫血5例分析
李 向 赵晓明 盛光耀
郑州大学第一附属医院儿科(河南郑州 450052)
目的探讨儿童肝炎相关再生障碍性贫血(HAAA)的临床特点、治疗及预后。方法回顾分析5例HAAA患儿的临床资料。结果5例患儿,男4例、女1例,中位年龄为10岁(7~13岁);5例患儿急性肝炎期间甲、乙、丙、戊肝炎病毒检测均为阴性,其中2例行微小病毒B19抗体、EB病毒检测均为阴性;T淋巴细胞亚群示CD4+T细胞比例、CD4+/CD8+比值降低,CD8+T细胞比例升高。3例以抗胸腺细胞球蛋白联合环孢素免疫抑制治疗2例完全缓解,1例死于肺部真菌感染;1例单用环孢素免疫抑制治疗,部分缓解;1例放弃治疗后失访。结论儿童HAAA可由病毒血清学阴性的肝炎引起,存在T淋巴细胞免疫紊乱,免疫抑制治疗有效。
肝炎; 再生障碍性贫血; 儿童
肝炎相关再生障碍性贫血(hepatitis associated aplastic anemia,HAAA)是在急性肝炎后2~3个月内发生的骨髓衰竭和全血细胞减少[1]。儿童相关报道较少,本文就郑州大学第一附属医院2011年3月至2016年4月收治的5例儿童HAAA的起病过程、临床特征及诊治情况作一报告。
1 临床资料
5例HAAA,男4例,女1例。中位年龄为10岁(7~13岁)。均无输血、血液制品及特殊用药史,无肝炎、血液系统相关家族病史。
5例HAAA在血细胞减少前2个月内均有明确的急性肝炎病史。肝炎至发生血细胞减少中位时间间隔为37天(27~50天)。5例均有不同程度贫血、皮肤黏膜出血及发热症状。1例肝炎恢复期发病的肝、脾肋下1 cm,肝功能正常时肝、脾缩至正常。
血常规示中性粒细胞中位数为0.3×109/L [(0~0.4)×109/L]、血小板中位数为3×109/L [(1~20)×109/L],网织红细胞为10×109/L [(1~19)×109/L]。髂后骨髓细胞学及活检示增生减低至极度减低,造血面积15%~30%,粒系比值均减低,红系比值正常3例,减低2例,未见巨核细胞或罕见巨核细胞,均可见组织嗜碱细胞,1例可见网状细胞团。5例患儿中,3例为极重型再生障碍性贫血,2例为重型再生障碍性贫血。
患儿急性肝炎期间,谷氨酸氨基转移酶(ALT)1 141 U/L(394~2 024 U/L),天冬氨酸氨基转移酶(AST)726 U/L(588~1 389 U/L),总胆红素(TBIL)194.4 mmol/L(125.5~299.6 mmol/L),直接胆红素(DBIL)153.6 mmol/L(82.8~271.2 mmol/L)均异常偏高,经保肝治疗后肝酶明显下降,AST中位数为43 U/L(7~578 U/L),AST为32 U/L(9~367 U/L)。其中2例肝酶未降至正常时出现血小板减少,后逐渐出现全血细胞减少。行免疫抑制治疗未见肝功能损伤加重(表1)。5例患儿肝炎时,甲、乙、丙、戊肝炎病毒均为阴性。2例行微小病毒B19抗体、EB病毒检测亦均为阴性。1例血细胞减少时查巨细胞病毒IgM阳性,DNA定量正常。
5例HAAA患儿CD4+T细胞比例、CD4+/CD8+比值降低,CD8+T细胞比例升高,B淋巴细胞及自然杀伤(NK)细胞比例基本正常(表1)。例2在肝炎至诊断再生障碍性贫血的过程中动态监测T淋巴细胞亚群,均存在CD4+T细胞比例、CD4+/CD8+比值降低,CD8+T细胞比例升高。
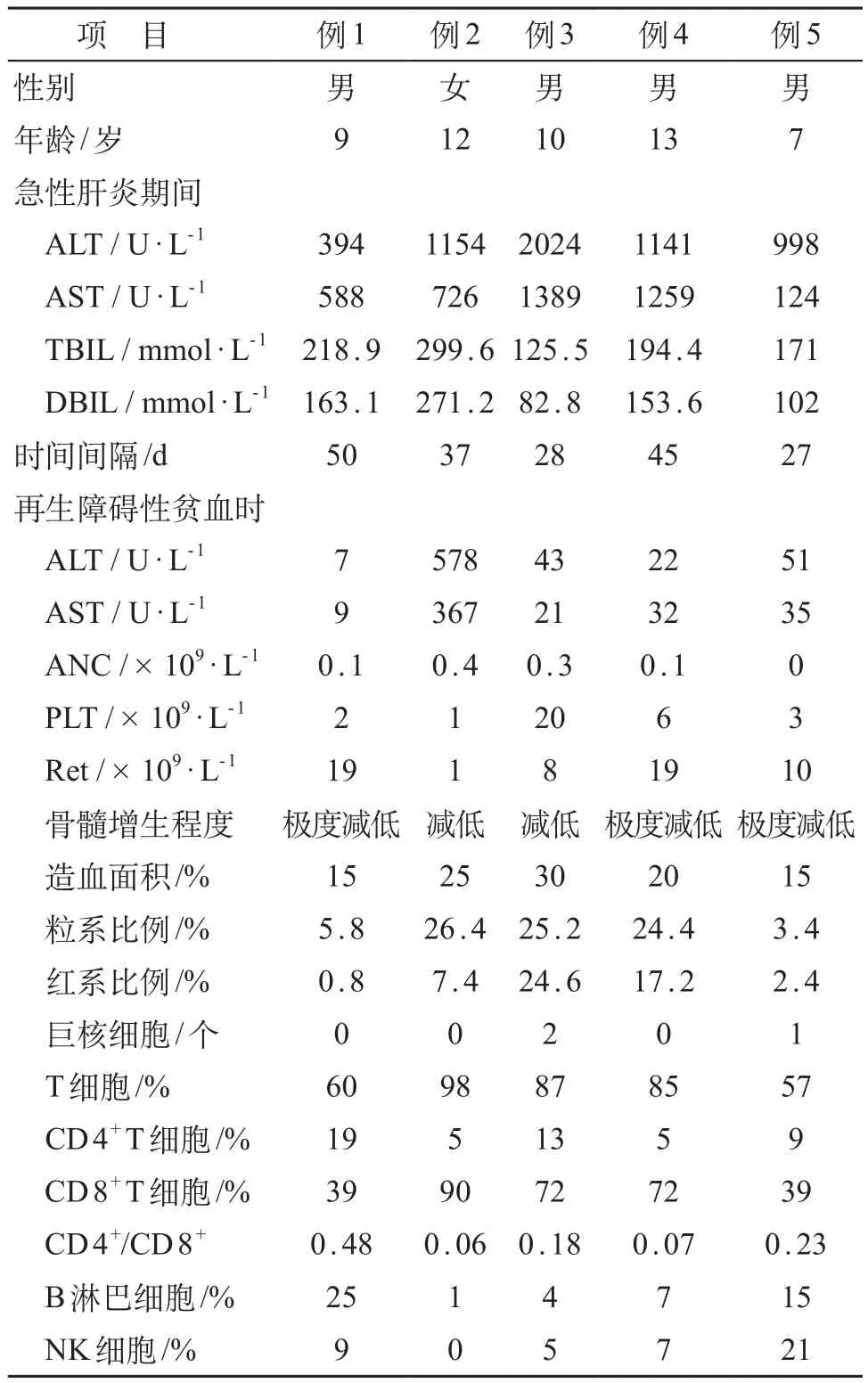
表1 5例HAAA患儿的临床资料
5例患儿于确诊再生障碍性贫血后,3例以抗胸腺细胞免疫球蛋白(ATG)联合环孢素A(CsA)治疗,随访至2016年11月,完全缓解2例,其中1例已停用药物半年,复查血常规基本正常,1例CsA减量中;1例死于肺部真菌感染。1例CsA治疗,部分缓解,血常规示白细胞2.3×109/L,血红蛋白103 g/L,血小板59×109/L,中性粒细胞1.0×109/L。1例放弃治疗后失访。疗效标准参考中华医学会儿童再生障碍性贫血儿童获得性再生障碍性贫血诊疗建议[2]。
2 讨论
儿童HAAA是肝炎后以贫血、出血、感染为表现的继发性骨髓衰竭综合征,多数病情重,较为少见。近30余年国内文献报道50例儿童HAAA[3],以青少年和青年男性多见。目前资料显示,儿童HAAA因甲、乙型肝炎病毒感染所致较少,微小病毒B19、EB病毒、巨细胞病毒、戊型肝炎病毒、输血传播病毒均有报道,但HAAA病因多数最终不能明确[3-5]。发生在肝炎恢复期的再生障碍性贫血一般起病隐匿,逐渐出现全血细胞的降低,容易延诊,因此建议在肝炎恢复期或肝炎恢复后至少2个月内监测血常规的变化,必要时行骨髓细胞学检查,以期早发现、早治疗。
HAAA的诊断标准为急性肝炎后2~3个月内发生再生障碍性贫血,需同时符合再生障碍性贫血标准[2]及急性肝炎的诊断标准,急性肝炎为血清转氨酶水平增加至正常范围上限的至少3倍[1]。本研究5例患儿临床表现、肝炎与再生障碍性贫血的时间间隔及检查结果符合HAAA的诊断;再生障碍性贫血发生在肝炎恢复期2例,肝炎与再生障碍性贫血发生时间间隔为27~50天,5例均为重型或极重型再生障碍性贫血,与文献报道一致[3,5]。本组患儿中1例在出现血细胞减少后,检测巨细胞病毒IgM阳性,DNA定量正常,提示存在近期感染,但患儿未再复查相关指标,尚不能确定是引起HAAA的病原体。
HAAA的发病机制可能为某种病毒作用于机体导致T淋巴细胞介导的免疫损伤肝脏及骨髓造血干细胞。HAAA的免疫异常体现在T淋巴细胞亚群的紊乱、细胞毒性T细胞激活及功能亢进、T淋巴细胞受体亚家族的偏态现象、肝脏活检细胞中大量T淋巴细胞的浸润及外周血中细胞因子TNF-α、INF-γ、IL-2升高等[1,6]。研究报道,HAAA患者的CD8+T细胞比例增高,CD4+/ CD8+比例降低,且免疫抑制治疗后CD8+T细胞比例逐渐下降,停止免疫抑制剂后CD8+T细胞比例逐渐上升[5]。本组5例患儿均存在CD8+T细胞比例增高,CD4+/CD8+比值降低,且免疫抑制治疗有效,提示HAAA的发病与免疫异常有关。有研究比较10例HAAA(端粒缩短程度尚未达典型先天性角化不良)与19例非HAAA患儿的淋巴细胞亚群及外周血中淋巴细胞端粒长度,发现HAAA患儿淋巴细胞端粒长度较非HAAA患儿明显缩短,且端粒长度与淋巴细胞的数目呈正相关,提示HAAA患儿淋巴细胞亚群的紊乱可能与淋巴细胞端粒缩短有关[7]。HAAA发病率低,HAAA的发病机制尚需进一步研究。
同胞全相合造血干细胞移植是治疗HAAA的有效方法,但儿童HAAA进展快,短期内难以找到合适的供体,因此该方法受到一定限制。由于儿童HAAA属于获得性再生障碍性贫血,也存在细胞免疫紊乱,既往文献报道免疫抑制治疗有效[1,3]。因此对于无条件行造血干细胞移植的患儿可采用抗胸腺细胞球蛋白/抗淋巴细胞球蛋白(ATG/ALG)、CsA等联合强化的免疫抑制治疗,也有大剂量环磷酰胺治疗HAAA的报道。研究报道44例HAAA患儿行ATG联合CsA治疗,6个月时31例有效(14例完全缓解,17例部分缓解),有效率为70.4%,10年总生存率为(88.3±4.9)%[8]。研究显示,诊断至免疫抑制治疗间隔时间长明显影响患者生存,因此现多认为一旦诊断明确应及早行免疫抑制治疗。本组3例患儿诊断明确后即行ATG联合CsA治疗,2例基本缓解;另1例以CsA治疗也部分缓解,提示免疫抑制治疗有效。但研究显示,行免疫抑制治疗的HAAA感染相对非HAAA难控制,花费高[9]。本组患儿中1例ATG联合CsA治疗患儿死于严重肺部真菌感染,提示在治疗过程中需注意感染的防治。
[1]Rauff B, Idrees M, Shah SA, et al. Hepatitis associated aplastic anemia: a review [J]. Virol J, 2011, 87(8): 1722-1743.
[2]中华医学会儿科分会血液学组.《中华儿科杂志》编辑部.儿童获得性再生障碍性贫血诊疗建议 [J]. 中华儿科杂志, 2014, 52(2): 103-106.
[3]乔晓红, 谢晓恬, 石苇, 等. 儿童肝炎相关再生障碍性贫血循证医学分析 [J]. 中华实用儿科杂志, 2013, 28(15): 1155-1158.
[4]Shah SA, Lal A, Idrees M, et al. Hepatitis E virus-associated aplastic anaemia: the first case of its kind [J]. J ClinVirol, 2012, 54(1): 96-97.
[5]Brown KE, Tisdale J, Barrett AJ,et al. Hepatitis-associated aplastic anemia [J]. N Engl J Med, 1997, 336(15):1059-1064.
[6]Wang H, Tu M, Fu R, et al. The clinical and immune characteristics of patients with hepatitis-associated aplastic anemia in China [J]. PloS One, 2014, 9(5): e98142.
[7]Babushok DV, Grignon AL, Li Y, et al. Disrupted lymphocyte homeostasis in hepatitis-associated acquired aplastic anemia is associated with short telomere [J]. Am J Hematol, 2016, 91(2): 243-247.
[8]Osugi Y, Yagasaki H, Sako M, et al. Anti-thymocyte globulin and cyclosporine for treatment of 44 children with hepatitis associated aplastic anemia [J]. Haematologica, 2007, 92(12): 1687-1690.
[9]杨文睿, 井丽萍, 周康, 等. 41例肝炎相关再生障碍性贫血患者临床特征与免疫抑制治疗疗效观察 [J]. 中华血液杂志, 2016, 37(05): 399-404.
Analysis of hepatitis associated aplastic anemia in 5 children
LI Xiang, ZHAO Xiaoming, SHENG Guangyao
(Department of Pediatrics, The First Af fi liated Hospital of Zhengzhou University, Zhengzhou 450052 , Henan ,China)
ObjectiveTo explore the clinical feature, treatment and prognosis of hepatitis associated aplastic anemia (HAAA) in children.MethodThe clinical data of 5 children with HAAA were retrospectively analyzed.ResultsThere were 5 patients (4 males and 1 female) with median age of 10 years (7~13 years ). The detection of hepatitis A, B, C, and E were all negative in these 5 children during their acute hepatitis period. In 2 children, parvovirus B19 antibody and EB virus were negative and the proportion of CD4+T cells and the ratio of CD4+/CD8+ were decreased, and the proportion of CD8+T cells was increased by T-lymphocyte subsets analysis. Three children were treated with anti-thymocyte globulin combined with cyclosporine, 2 of whom achieved complete remission and 1 died of pulmonary fungal infection. One child was treated with cyclosporine only and achieved partial remission. One child lost follow-up after giving up treatment.ConclusionHAAA in children can be caused by viral seronegative hepatitis, and usually has T lymphocyte immune disorders. Immunosuppressive therapy is effective. .
hepatitis; aplastic anemia; child
10.3969/j.issn.1000-3606.2017.04.004
2016-12-08)
(本文编辑:邹 强)
盛光耀 电子信箱:shenggy2959@163.com

