不明原因新生儿高胆红素血症与UGT1A1基因突变的关系*
谈钰培,钟丹妮Δ,赵 科,谢湘芝
(1.广西医科大学第一附属医院儿科,南宁 530021;2.环江毛南族自治县人民医院儿科,河池 547199)
新生儿高胆红素血症(新生儿高胆)是新生儿期常见症状,大约80% 早产儿和50% 足月儿出生后会发生高胆红素血症[1],其发病与新生儿早期体内胆红素—尿苷二磷酸葡萄糖醛酸转移酶1A1(uridine diphosphate glucuronosyltransferase 1A1,UGT1A1)表达水平低有关。UGT1A1基因启动子区和编码区基因突变均可导致该酶活性降低或缺失,使游离胆红素的葡萄糖醛酸化过程受阻,胆红素代谢减少引起血清中游离胆红素水平升高,导致新生儿高胆。UGT1A1基因最常见突变类型为启动子区TATA盒插入突变和G71R错义突变,亚洲地区的黄种人常见为第1 外显子区G71R 错义突变为主[2-5],欧美地区高加索人及Gilbert综合征常见为启动子区TATA盒插入突变为主[6-9]。本研究旨在探讨不明原因新生儿高胆与UGT1A1基因编码启动子区TATA盒和第1外显子区基因突变类型的关系,以便为明确不明原因新生儿高胆的病因及诊治提供遗传学依据。
1 对象与方法
1.1 研究对象
选取2021 年1~12 月在广西环江毛南族自治县人民医院新生儿科和产科住院的新生儿,足月(胎龄≥37 周)出生,出生体重2 500~4 000 g。经医院伦理委员会批准,获得患儿家属知情同意。
1.2 病例纳入与排除标准
1.2.1 纳入标准 病例组:(1)黄疸发病日龄在2周内,血清胆红素升高且以游离胆红素升高为主,时龄血清总胆红素值达到或超过2014年《新生儿高胆红素血症诊断和治疗专家共识》[10]的新生儿小时胆红素列线图光疗标准;(2)经光疗及药物治疗黄疸好转出院。对照组:(1)出生后无明显黄疸或血清总胆红素值低于2014年《新生儿高胆红素血症诊断和治疗专家共识》[10]的新生儿小时胆红素列线图光疗标准;(2)均与高胆红素血症组同期、同地区出生,未经特殊治疗,临床经过良好。
1.2.2 排除标准 病例组和对照组均排除:(1)早产儿;(2)低出生体重儿;(3)足月小样儿;(4)巨大儿;(5)先天畸形者;(6)母婴血型不合导致的溶血者;(7)G6PD缺乏症者;(8)消化道畸形者;(9)红细胞增多症者;(10)败血症等病因明确的影响黄疸程度的因素。
1.3 方法
1.3.1 标本采集及DNA 提取 采集静脉血2 mL,EDTA 抗凝,应用血液基因组DNA 提取试剂盒(天根生化科技有限公司)提取DNA,于-20℃保存。
1.3.2 聚合酶链式反应(PCR)引物参照文献[11]设计。引物序列,上游引物:5’-GTC ACG TGA CAC AGT CAA AC-3’,下游引物:5’-GTC CCA CTC CAA TAC ACA C-3’,扩增片段为启动子区TATA盒及全部第1外显子,片段长度987 bp。(引物序列由上海生工生物工程技术服务公司合成)。反应体系:2xEs Taq MasterMix(Dye)(康为世纪公司)25 μL,上下游引物各2 μL,模板DNA 200 ng,去离子水补充至50 μL。PCR反应在多通道PCR仪上进行。反应程序:94 ℃预变性2 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,循环35 次,72 ℃再延伸2 min。产物置于4℃保存。
1.3.3 凝胶电泳 以2%琼脂糖凝胶电泳检测PCR产物是否为扩增目的基因片段,以100 bp Ladder DNA Marker(康为世纪公司)作为片段大小参照物,每例PCR产物取5 μL,电压120 V,电泳30 min。在紫外凝胶成像系统上对凝胶进行成像显影并观察。
1.3.4 基因测序 将合格的PCR 产物在1~2 d 寄送上海生工生物工程技术服务有限公司进行基因测序。
1.4 统计学方法 应用SPSS 20.0统计软件进行数据分析。计量资料用均数±标准差()表示,两组出生胎龄、出生体重及总胆红素值比较采用独立样本t检验;计数资料以率(%)表示,两组性别构成、分娩方式、基因型分布及等位基因频率比较采用χ2检验或Fisher确切概率法。二分类变量非条件Logistic 回归分析比较UGT1A1基因不同突变类型对不明原因新生儿高胆影响的优势比(OR)和95%可信区间(CI);以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
两组出生胎龄、出生体重、性别构成及分娩方式比较,差异均无统计学意义(均P>0.05);病例组总胆红素值高于对照组,差异有统计学意义(P<0.05),见表1。
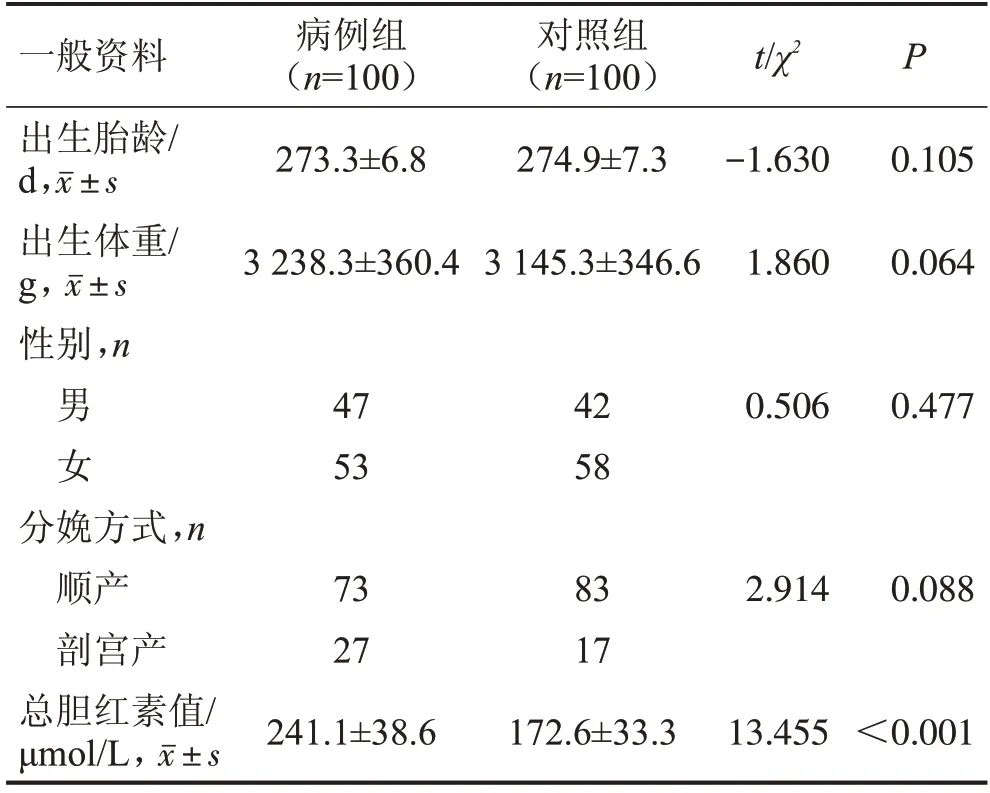
表1 两组一般资料比较
2.2 琼脂糖凝胶电泳结果
琼脂糖凝胶电泳结果显示PCR 产物呈单一条带,片段大小与目的基因相符,见图1。
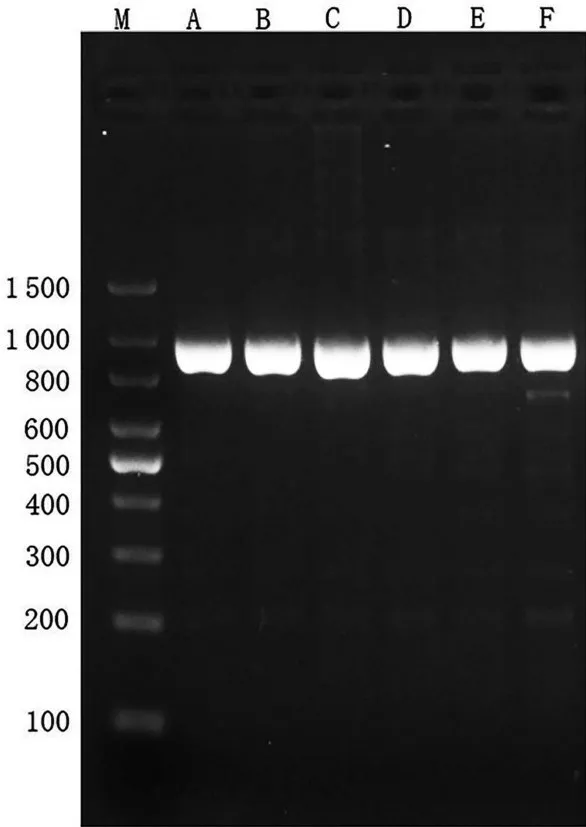
图1 PCR产物电泳图
2.3UGT1A1基因测序结果及分析
2.3.1 启动子区 在UGT1A1基因启动子区共发现TATA盒(TA)7插入突变33例,其中病例组16例,对照组17例;在病例组中发现A(TA)6TAA/A(TA)7TAA[简称(TA)6/7)]杂合插入突变14 例,A(TA)7TAA/A(TA)7TAA[简称(TA)7/7]纯合插入突变2例;对照组全部为(TA)6/7插入突变。总插入突变的基因频率分别为9.0%、8.5%,比较两组基因型分布和等位基因频率,差异均无统计学意义(P>0.05),见图2、表2。
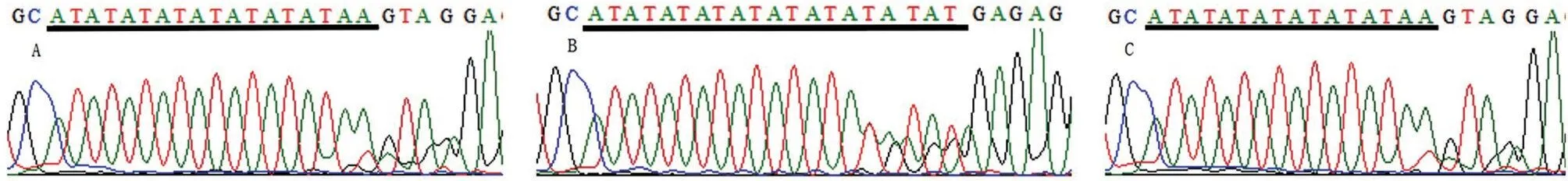
图2 UGT1A1 TATA盒插入突变位点测序图(正向测序)
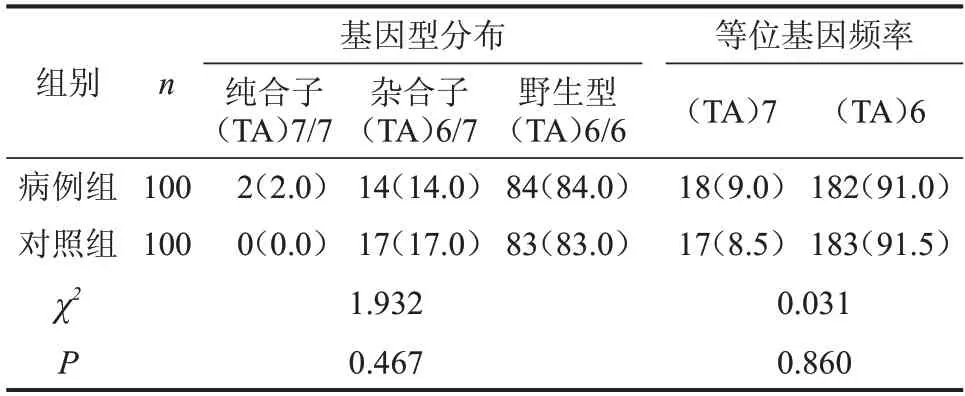
表2 两组UGT1A1 TATA盒基因型分布和等位基因频率比较n(%)
2.3.2 第1 外显子区 在UGT1A1基因第1 外显子区共发现G71R 错义突变43 例,其中病例组33 例,对照组10 例;在病例组中发现杂合子(G/A)29 例,纯合子(A/A)4例;对照组全部为杂合子。总错义突变的等位基因频率分别为18.5%、5.0%,比较两组基因型分布和等位基因频率,病例组G71R 基因型分布及等位基因频率均高于对照组,差异均有统计学意义(P<0.001),见图3、表3。
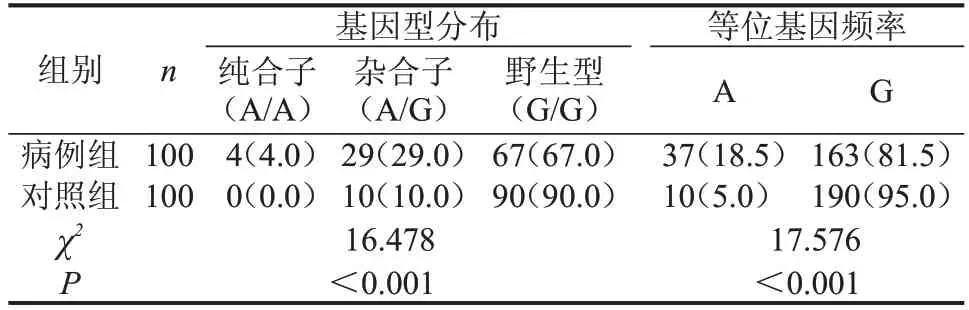
表3 两组UGT1A1 G71R基因型分布和等位基因频率比较n(%)
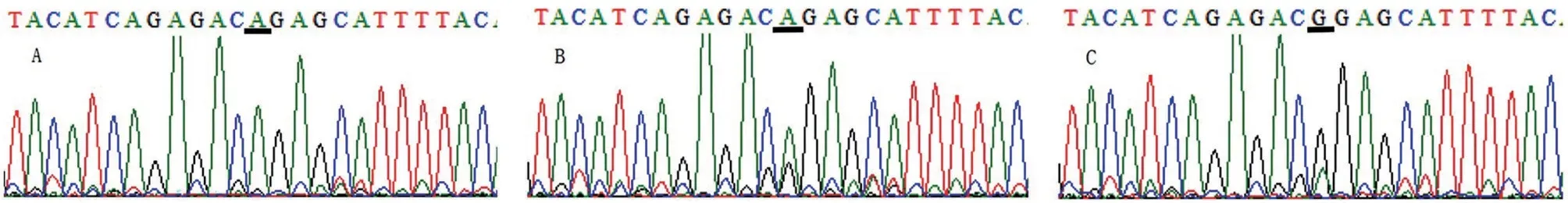
图3 UGT1A1 G71R错义突变位点测序图(正向测序)
在UGT1A1基因第1外显子区共发现P229Q错义突变8例,其中病例组3例,对照组5例;病例组和对照组均为杂合子(C/A)。总错义突变的等位基因频率分别为1.5%、2.5%,比较两组基因型分布和等位基因频率,差异均无统计学意义(P>0.05),见图4、表4。
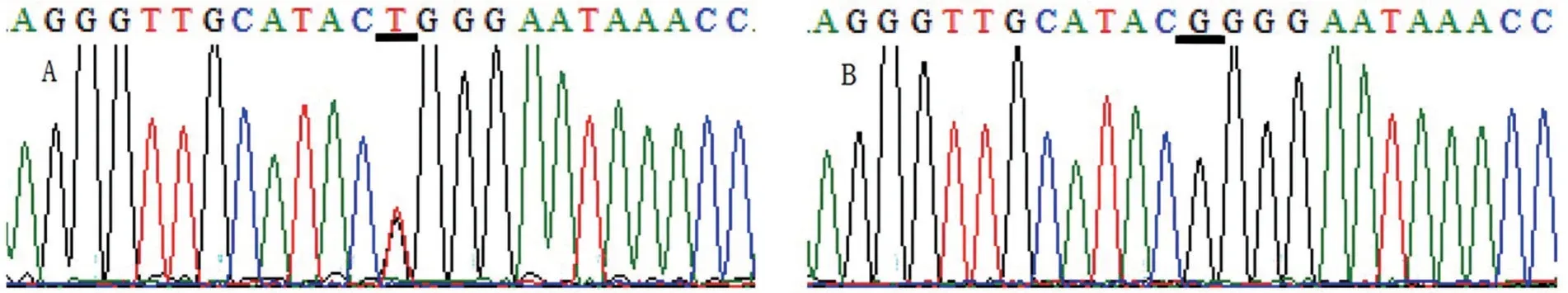
图4 UGT1A1 P229Q错义突变位点测序图(反向测序)
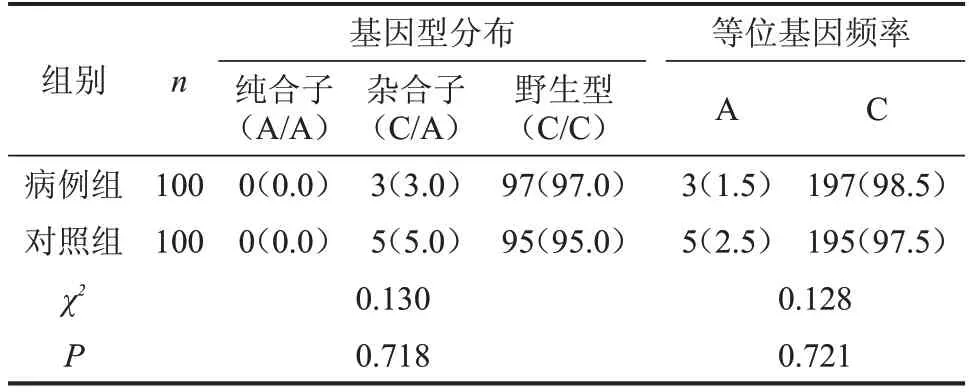
表4 两组UGT1A1 P229Q基因型分布和等位基因频率比较n(%)
2.3.3UGT1A1基因不同突变类型对不明原因新生儿高胆影响的Logistic回归分析 采用二分类变量非条件Logistic回归分析本研究发现的TATA盒、G71R 和P229Q 这3 个突变位点对不明原因新生儿高胆红素血症的影响,发现本研究中UGT1A1G71R错义突变是不明原因新生儿高胆的危险因素(P<0.001),新生儿携带有G71R 错义突变发生不明原因新生儿高胆红素血症是野生型的4.540 倍。而UGT1A1TATA 盒(TA7)插入突变和P229Q 错义突变不是不明原因新生儿高胆的危险因素(P>0.05),表5。
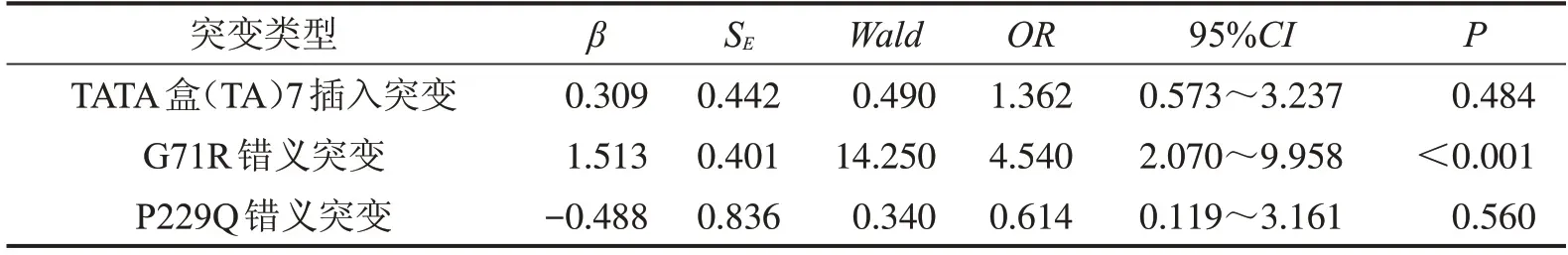
表5 UGT1A1基因不同突变类型对不明原因新生儿高胆影响的Logistic回归分析结果
3 讨论
UGT1A1由第1外显子和第2~5共同外显子编码。体外研究显示只有UGT1A1 酶结合底物是胆红素,该酶为肝脏内胆红素代谢的唯一酶[12]。除了已明确黄疸病因外,不明原因新生儿高胆发病常常与UGT1A1基因突变有关,全球范围内已发现UGT1A1基因突变类型有300 余种,突变方式包括插入突变、错义突变、缺失突变等。
本研究结果显示,两组中UGT1A1基因突变类型以G71R错义突变为主,比较两组G71R等位基因频率,病例组的等位基因频率高于对照组,差异有统计学意义,提示G71R 错义突变可能与不明原因新生儿高胆发生有关系,这与本课题组前期相关研究结果相符[13]。结合Logistic 回归分析,UGT1A1G71R错义突变是不明原因新生儿高胆发生的危险因素。UGT1A1G71R 错义突变为UGT1A1基因第1外显子区的第211位碱基由G突变为A,使该编码的密码子由甘氨酸(GGA)变为精氨酸(AGA),使UGT1A1的葡萄糖醛酸化能力下降,引起新生儿高胆。本研究病例组G71R等位基因频率高于广西黑衣壮族地区(15.5%)[14]、低于广西来宾地区不同民族间(19.0%、27.0%、20.0%)[15]、云南省(33.0%)[16]、广东汉族(29.2%)[17]、重庆地区(42.4%)[18]、越南(27.3%)[19]、日本(47.0%)[4]等。
UGT1A1启动子区TATA 盒已知突变类型为(TA)5、(TA)7、(TA)8 三种类型。在本研究中发现UGT1A1TATA盒以(TA)7插入突变为主,其突变频率仅次于G71R 错义突变,比较两组(TA)7 等位基因频率,差异无统计学意义,提示(TA)7插入突变可能与不明原因新生儿高胆红素血症发生无关系,这与Akaba 等[2]报道过UGT1A1TATA 盒(TA)7 插入突变不是亚洲地区引起新生儿黄疸的主要突变类型是一致的。结合Logistic 回归分析结果,提示(TA)7插入突变不是不明原因新生儿高胆的危险因素。Beutler 等[8]曾报道(TA)7插入突变在白人群体中的基因频率为38.7%,在亚洲人群中仅为16.0%,只有在非洲血统的人群中才发现有(TA)5和(TA)8突变类型。本研究中病例组(TA)7等位基因频率低于广西黑衣壮族地区(13.0%)[14]、亚洲人群(16.0%)[8]。
本研究在UGT1A1基因第1 外显子区共发现8例P229Q杂合突变,并同时存在有TATA盒插入突变,其中1 例为A(TA)7/7TAA-P229Q,另外7 例均为A(TA)6/7TAA-P229Q,比较两组P229Q 等位基因突变频率,差异无统计学意义,提示P229Q 错义突变可能与不明原因新生儿高胆发生无关系。结合Logistic 回归分析结果提示UGT1A1P229Q 错义突变不是不明原因新生儿高胆的危险因素。Osamu等[20]报道过UGT1A1基因第1 外显子区存在P229Q错义突变(UGT1A1*27),是引起日本Gilbert综合征(GS)和Crigler NajjarⅡ型(CN Ⅱ)患者UGT1A1酶活性下降引起高胆红素血症。中国台湾也曾报道过A(TA)6/7TAA-P229Q 的等位基因杂合突变使UGT1A1 酶活性减少,临床表现为Gilbert 综合征[21]。Kaniwa 等[9]提出在A(TA)6/7TAA-P229Q 的等位基因杂合突变的日本和中国台湾患者中观察到的高胆红素血症可主要归因于TATA盒(TA)7插入突变。这提示P229Q 错义突变对不明原因新生儿高胆影响不大,由于本研究中发现P229Q错义突变例数较少,之后需要加大样本量进一步研究验证。
本研究探讨了不明原因新生儿高胆和正常新生儿在UGT1A1基因启动子区及第1外显子区的突变情况,分析所检测到的突变类型与不明原因新生儿高胆发生的关系,明确UGT1A1G71R 错义突变与不明原因新生儿高胆发生有关系,是其危险因素,携带有该基因错义突变可能会增加新生儿高胆的发生风险。为今后不明原因新生儿高胆发生发展提供基因遗传学证据。

