粪菌移植治疗幼儿严重食物过敏性胃肠病1例并文献复习
朱忠生 郑跃杰 蔡华波 白大明 代东伶 周建利 周少明
深圳市儿童医院(广东深圳 518026)
粪菌移植治疗幼儿严重食物过敏性胃肠病1例并文献复习
朱忠生 郑跃杰 蔡华波 白大明 代东伶 周建利 周少明
深圳市儿童医院(广东深圳 518026)
目的探讨严重食物过敏性胃肠病患儿的粪菌移植治疗。方法回顾1例严重食物过敏性胃肠病患儿的粪菌移植治疗过程,并复习相关文献。结果患儿,男,2岁,以肠道感染起病,予以足疗程抗感染及对症支持治疗,腹泻仍迁延不愈,最终给予粪菌移植治疗后,好转出院,随访2个月未见不良反应。检索国外文献,儿童粪菌移植主要应用于难辨梭状芽孢杆菌感染(CDI)和炎症性肠病(IBD)中,有效率分别为90%~100%和55.6%~100%;而国内文献中,粪菌移植在儿童中主要用于CDI和抗生素相关性腹泻病中,有效率100%,均未见严重不良反应。结论粪菌移植治疗儿童严重食物过敏性胃肠病短期安全有效,但其在儿童中的应用技术还不成熟,需要更多、更深入的研究。
食物过敏性胃肠病; 粪菌移植; 治疗; 儿童
食物过敏性胃肠病(food allergic gastroenteropathy,FAG)又称胃肠道食物过敏,是由食物过敏(food allergy,FA)导致的一组胃肠道疾病,指特定食物抗原引起的可能反复发作的、免疫介导的食物不良反应[1]。其临床表现多种多样,包括腹痛、腹泻、腹胀、便秘、消化道出血、恶心、呕吐、拒奶、溢乳、喂养困难、肛瘘等,上述症状若迁延不愈可致生长发育受限、缺铁性贫血、低蛋白血症、水肿等并发症[2]。当足够的食物抗原侵入胃肠道黏膜和/或各种原因(遗传和环境因素)致机体免疫功能紊乱时,就可能引起FAG。约一半的FA可累及胃肠道,严重FAG的常规治疗方案为回避过敏食物,药物治疗包括抗组胺药物、白三烯受体拮抗剂、激素、益生菌或益生元等,无特效药物治疗,且容易复发。
粪菌移植(faecal microbiota transplantation,FMT)是将健康者粪便中的功能菌群通过鼻胃管或十二指肠管、胃镜或结肠镜移植到患者胃肠道中,重建肠道菌群的平衡,修复肠道黏膜的屏障功能,以对特定肠道内及肠道外疾病进行治疗[3]。FMT通过移植一个复杂的、更加稳定且更能定植下来的微生物群落,能够重建肠黏膜内免疫稳态[4]。本文报告1例用 FMT 治疗的严重FAG患儿的临床表现、诊疗经过、FMT 流程等,并进行相关文献复习,以期提高对儿童严重FAG的临床管理,并初步探讨 FMT 在儿科患者中的应用。
1 临床资料
患儿,男,2岁,因反复腹泻2月余,加重伴发热10余天入住深圳市儿童医院消化内科。患儿大便呈稀烂或稀水样,偶有黏液、无脓血,无发热、呕吐及腹胀等表现。曾在当地医院治疗后好转,但病情反复。入院前10余天出现发热,体温在39℃,无咳嗽、无抽搐,腹泻加重,大便呈绿色稀水样,间有黏液及血丝,每天10余次,呕吐物为胃内容物。在当地医院给予头胞曲松、利巴韦林、益生菌、蒙脱石散等药物及对症支持治疗,患儿仍有发热、腹泻,入院当天查血常规示红细胞、白细胞及血小板均低于正常值,以“感染性腹泻病”收入院。自发病以来,患儿精神状态一般,胃纳较差。入院体格检查:体温37.6℃,心率143次/min,呼吸28次/min,体质量9 kg,血压92/63 mmHg。走路不稳,营养不良貌,神志清,躯干部可见红色丘疹;口唇黏膜稍干燥,咽充血;双肺呼吸音清,未闻及啰音;心律齐,未闻及杂音;腹平软,未见肠形,全腹无拒按,无压痛、反跳痛,未触及包块,肝、脾肋下未及,肠鸣音亢进,8~10次/min;四肢肌力、肌张力稍减低;双手指端可见脱皮,臀部皮肤潮红可见脱屑。实验室检查:血常规白细胞(0.98~19.20)×109/L,红细胞(2.40~4.56)×1012/L,血红蛋白70~116 g/L,血小板(17~334)×109/L,嗜酸粒细胞6%;C-反应蛋白1.9~205.8 mg/L;降钙素原0.05~1.11 ng/ mL;血型为O型、Rh阳性;大便常规示红细胞3~7个/ HP、白细胞4~6个/HP,大便潜血阳性;红细胞沉降率6~25 mm/h;总蛋白43.2~59.0 g/L,白蛋白15.5~34.3 g/L;血钾3.20~4.65 mmol/L,钠120~144 mmol/L,氯94.1~110.0 mmol/L,钙1.73~2.22 mmol/L,碳酸氢根13.1~22.0 mmol/L;乳酸及血氨正常;肝肾功能及心肌酶谱无异常;血总胆固醇 1.08~1.19 mmol/L,三酰甘油1.40~1.44 mmol/L,高密度脂蛋白胆固醇0.26~0.46 mmol/L,低密度脂蛋白胆固醇0.78~0.84 mmol/L;肥大反应阴性;多次查肠道腺病毒、RNA病毒(诺如、星状、轮状)阴性,EV71、CA16、肠道病毒阴性;真菌D-葡聚糖阴性;艰难梭菌毒素A/B阴性;体液免疫及细胞免疫无异常;血清铁蛋白50.0~542.3 ng/mL;活化部分凝血活酶时间16.3~47.3 s,凝血酶原时间13~27 s,凝血酶时间测定11.6~16.9 s,纤维蛋白原 2.28~3.37 g/L,纤维蛋白原降解产物2.42~6.94 μg/mL,D-D二聚体264~4 408 ng/mL;血、尿、骨髓培养均阴性;抗血小板抗体检测正常;总IgE 60.27 IU/mL,蛋清sIgE 2级,其余未见异常;总IgE 24.90IU/mL;腹部超声示部分肠管壁增厚,肠蠕动减弱,腹腔积液(少量);腹部平片示小肠充气偏少,小肠结肠内较多积液,横结肠内肠见液平;胸片未见明显异常;心电图示窦性心动过速。
入院后给予双歧杆菌三联活菌、蒙脱石散、葡萄糖酸锌、多种维生素,并予输注白蛋白、血浆、静脉丙种球蛋白、红细胞悬液等对症支持治疗,头孢哌酮舒巴坦抗感染1周。患儿体温恢复正常,血常规正常,脱水及电解质紊乱基本纠正,低蛋白血症好转。但仍反复解稀水样便,间断见血丝,无粪渣,每天几十次,量多少不等。复查腹部超声示部分肠管壁增厚,肠蠕动减弱,腹腔积液(少量);大便常规示红细胞3~7个/ HP,白细胞4~6个/HP,大便隐血+。调整为环丙沙星抗感染治疗1周,大便常规偶见红细胞及白细胞;多次大便培养及大便核酸检测未检出沙门菌或志贺菌属。后停用抗生素予对症治疗,期间曾禁食数天或换成氨基酸奶粉喂养。入院第22天行肠镜检查示肠黏膜弥漫性充血水肿,散在粗颗粒结节样增生;肠黏膜病理检查示直肠黏膜固有层见嗜酸性粒细胞(达27个/HP)浸润(图1A),乙状结肠黏膜固有层见嗜酸性粒细胞(达30个/HP)浸润(图1B)。综合临床及实验室检查诊断为:①严重FAG;②脓毒症;③电解质紊乱;④代谢性酸中毒;⑤低白蛋白血症;⑥营养不良;⑦湿疹。患儿体温稳定正常,但大便次数及性状无明显改善。
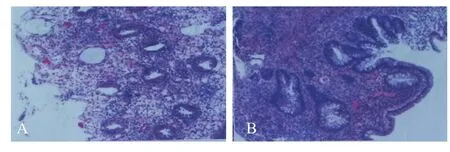
图1 患儿肠道黏膜病理检查(×50)
取得医院特殊治疗审批,与家长沟通后启动FMT流程(FMT治疗期间已停用抗生素及益生菌)。选取2岁1个月健康男孩(供者监护人签署知情同意书)为供体,其血型为O型 、Rh阳性。供体检测:甲、乙、丙肝病毒抗体阴性,血及咽拭子EBV-DNA阴性,HIV-1/ HIV-2 抗体阴性,TORCH阴性,微小病毒B19阴性,结核酶联免疫斑点试验阴性;总IgE 2.04 IU/mL,过敏原检测未见异常;体液免疫及细胞免疫正常,肝肾功能、心肌酶谱及电解质正常,血常规正常,C-反应蛋白1.5 mg/L;降钙素原0.05 ng/mL;大便常规正常,潜血阴性,大便检测诺如病毒、星状病毒、轮状病毒阴性,虫卵阴性,2次大便培养及寄生虫检测均无异常。
患儿于入院第32天起经灌肠予FMT治疗。FMT具体操作如下:供体留取1 h内的大便(约20~30 g),加50~100 mL无菌生理盐水(每克大便用2~3 mL无菌生理盐水稀释)在收集灌内混合,搅拌至混合物变成黏稠均匀的粪液并过滤;酌情予受者适度镇静,将无菌肛管插入结肠(距肛门约20~30 cm处),灌入粪便混悬液50 mL,最大程度灌入全部混悬液(目标先注入1 mL,无不良反应后,退镜过程中每次逐渐注入5~10 mL),最后留取5 mL移植粪菌行粪培养;术后抬高患儿臀部,保留粪菌在肠道内,4~6 h后恢复正常活动和饮食。患儿于FMT 当日无呕吐、腹胀等不良反应,FMT次日大便次数减少,性状好转。间隔3天后再次行FMT治疗,共3次,大便性状转为黄色糊状稀便,每天3、4次,大便常规检查未见红细胞及白细胞直至出院。半月后复查肠镜肠道黏膜病变显著好转(图2)。移植后2、4及8周随访大便均为黄色软便,每天1、2次,生长发育正常,睡眠可,体质量有增加,未见不良反应。患儿出院1个月后行开放性食物蛋白(鸡蛋白)激发试验阳性。因经费有限未行宏基因检测。
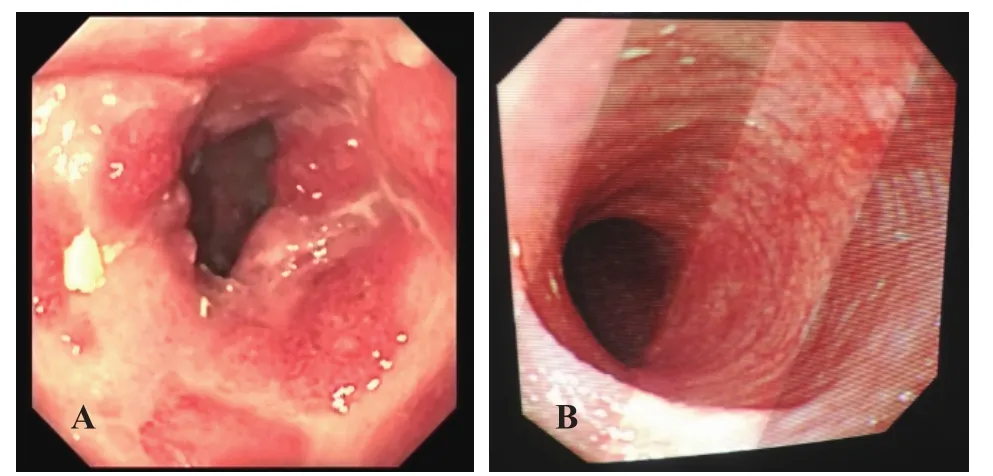
图2 患儿肠镜检查结果
2 讨论
本例患儿符合FAG的主要理由如下:①有特应性皮炎(湿疹)史;②临床表现为呕吐、迁延性腹泻、便血,伴生长落后,低蛋白血症等;③血清总IgE升高,蛋清sIgE 2级;④肠镜及病理组织检查示肠黏膜弥漫性充血水肿,伴糜烂,散在粗颗粒结节样增生;直肠及乙状结肠活检可见黏膜层及固有层嗜酸粒细胞浸润;⑤出院1个月后行开放性食物蛋白(鸡蛋白)激发试验阳性。患儿病情迁延,病程中反复查血常规见红细胞、白细胞及血小板数低于正常值,CRP及PCT明显升高,影像学检查示部分肠管壁增厚,肠蠕动减弱,部分肠管积气、积液;肠镜见肠黏膜弥漫性充血水肿,伴糜烂;伴反复发热,低蛋白血症,电解质紊乱及营养不良,提示为严重FAG;
FAG发病机制至今仍未完全阐明。Kalliomaki等[5]的一项前瞻性研究表明,在过敏性疾病发生前,肠道菌群紊乱已经存在,并非继发现象。推测婴儿肠道菌群改变与过敏的发病机制有关。通过对食物过敏儿童与正常儿童粪便培养、计数及鉴定显示,食物过敏儿童肠道中双歧杆菌、乳酸杆菌、肠杆菌数量与正常儿童差异有显著性,提示食物过敏与肠道菌群失调有密切关联[6,7]。采用直接快速涂片法检查肠道菌群及食物过敏婴儿与健康婴儿的大便也发现,食物过敏婴儿革兰阳性杆菌比例降低,革兰阴性杆菌、革兰阳性球菌比例增高,认为食物过敏婴儿肠道菌群与健康婴儿存在显著差异,肠道正常菌群的改变可能在食物过敏的发生中起一定作用[8]。提示食物过敏与非过敏婴儿间肠道菌群组成确实不同,健康的肠道菌群对促使免疫系统成熟有非常重要的作用,肠道菌群的组成和数量,在具有过敏倾向的儿童发生和发展成过敏性疾病的过程中起重要作用,肠道菌群的改变可能在食物过敏的发病机制中扮演重要角色[9]。上述研究为FMT治疗FAG提供了理论基础。
本例患儿诊断明确,常规治疗方法效果欠佳,最终给予FMT治疗后效果良好,未观察到明显的不良反应,为严重FAG的治疗提供新的方法和思路。
人的肠道微生态系统极其复杂,一个健康人的肠道内存在1 000~1 200种细菌,总数达到1014个左右[10]。肠道菌群参与维持肠道的正常生理功能和机体免疫功能。肠道菌群失调不仅与胃肠道疾病有关,还与代谢性疾病、自身免疫性疾病、变态反应性疾病及神经精神性疾病等有关[11]。因此,恢复健康的肠道菌群对与肠道菌群失衡相关的疾病是一种有前景的治疗策略。2013年,美国将FMT治疗方案列入治疗复发性难辨梭状芽孢杆菌感染(C. difficile infection,CDI)的临床指南[12]。已有大量的临床研究报道利用FMT治疗多种疾病,包括伪膜性肠炎、抗生素相关性腹泻、慢性便秘与炎症性肠病(inflammatory bowel disease,IBD)、难辨梭状芽孢杆菌肠炎等胃肠道疾病,以及肠道外疾病,如代谢综合征和肥胖、慢性疲劳综合征、多发性硬化、自闭症、肠道过敏性疾病等[13]。至今全球已治疗2 000余例病例,并已取得显著的效果。
成人的FMT应用已有相对完善的指导意见,但FMT在儿童中应用的报道很少,目前在公开发表的文献中主要为在CDI和IBD中的应用[14]。在PubMed、EMBASE、BioMed Central和中国万方数据库等医学文献数据库,分别采用fecal bacteriotherapy,fecal microbiota transplantation,fecal microbiota reconstitution,intestinal microbiota transplantation,fecal transplantation,stool transplantation,fecal flora reconstitution,human probiotic infusion;粪便移植,粪便微生物治疗,FMT为关键词进行检索。国外报道的FMT在儿童复发性CDI中的应用共10篇(表1),大部分FMT治疗的有效性为90%~100%,而治疗后仅偶见轻度的不良反应(短暂呕吐和黏液样便),未见其他严重不良反应[14]。而FMT在儿童IBD中的应用有4篇(表2),且无随机对照试验。Suskind等[25]在2014年对4例13~16岁溃疡性结肠炎(ulcerative colitis,UC)患儿经鼻胃管进行FMT,没有从中获益。Suskind等[26]又在2015年一项前瞻性研究中纳入9例12~19岁的轻中度克罗恩病(Crohn disease,CD)患儿,经鼻胃管进行FMT,随访2、6、12周结果显示,2周后78%临床症状缓解,随访至6、12周,55.6%在停用其他药物的情况下仍达到临床缓解,未见严重不良反应。Kunde等[27]对10例7~12岁中度UC的儿童和青年人进行FMT,将由实验室制备的来自健康成人供者的粪菌样本通过灌肠输入患儿肠道,取得满意效果。Kellermayer等[28]对3例14~16岁UC患儿经结肠镜灌肠行FMT,2周后内镜和组织学示100%缓解,100%症状持续缓解,撤退免疫治疗4周后仍100%症状持续缓解。另有报道FMT用于治疗儿童自闭症、慢性便秘、肠易激综合征、代谢性疾病等与肠道微生态失衡相关的疾病[29,30]。
目前我国已有数家医疗单位开展了FMT技术,在2014年中华医学会第十四次全国消化系统疾病学术会议上进行了FMT的专题报告和讨论。国内报道的儿童伪膜性肠炎、CD的FMT共3篇,有效率为100%。浙江大学儿童医院FMT治疗2例儿童伪膜性肠炎、上海交通大学附属儿童医院FMT治疗幼儿重症伪膜性肠炎1例、南京医科大学附属南京儿童医院FMT治疗2例CD患儿,均疗效显著,经随访所有病例未见任何并发症[31-33]。
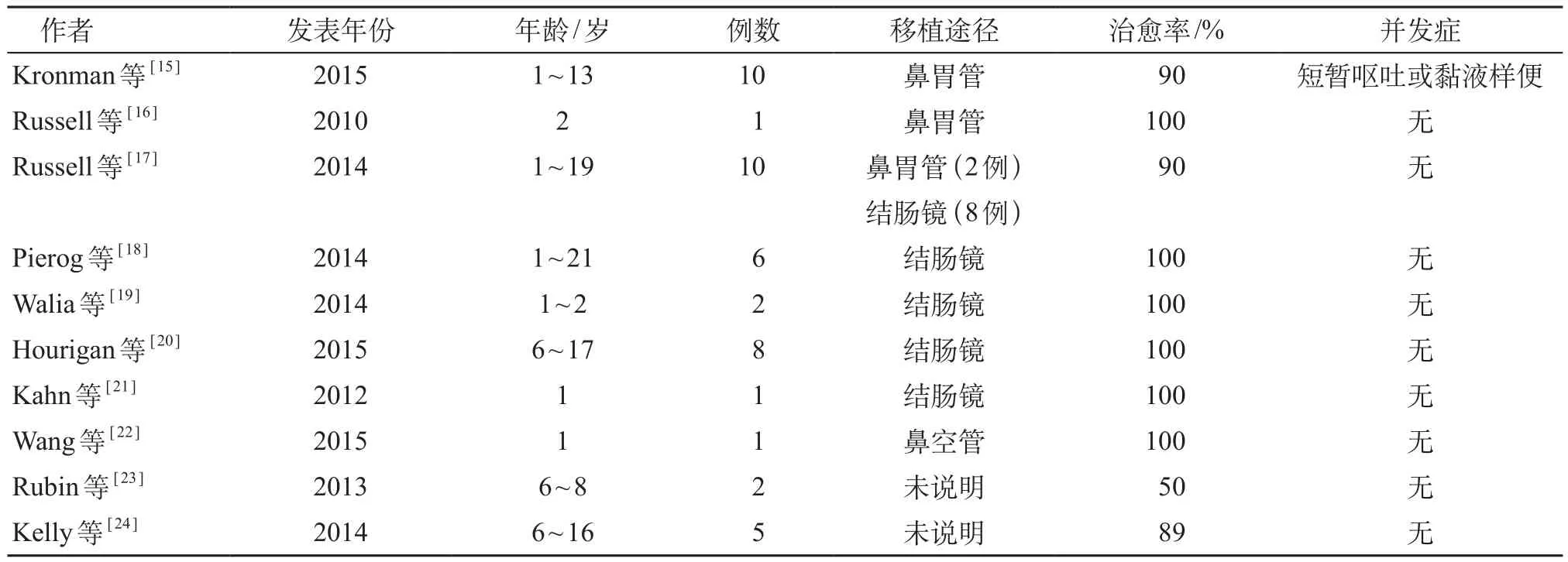
表1 FMT在儿童复发性CDI中的应用
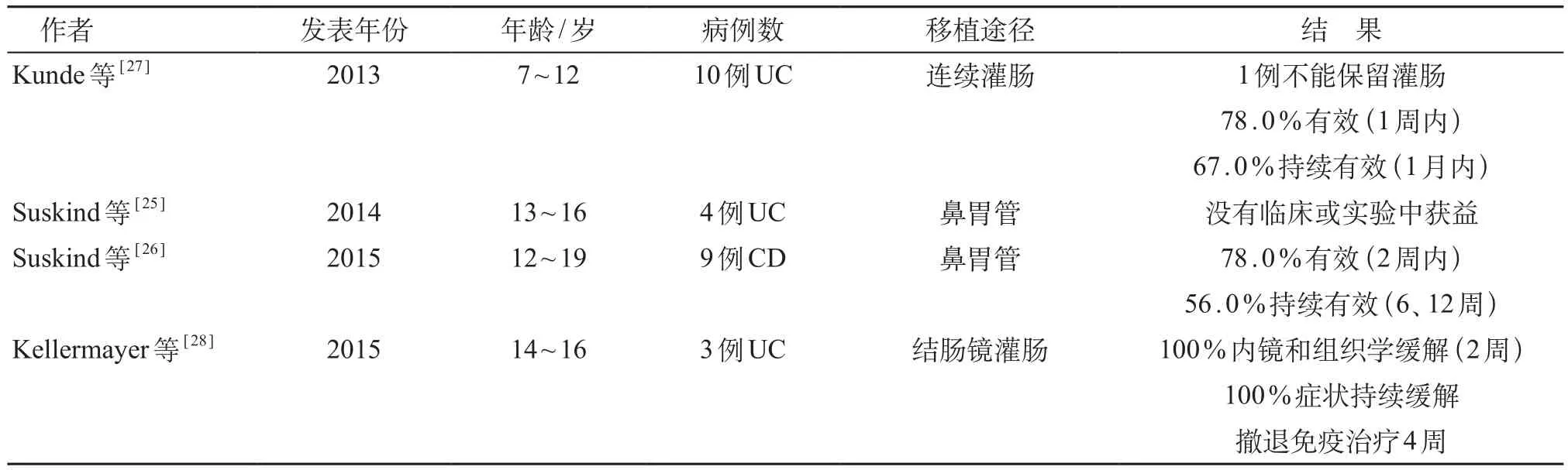
表2 FMT在儿童IBD中的应用
今后,需要开展新的移植途径来提高操作的可重复性,便利的粪便处理设备和装满粪菌悬液或冻干制剂的口服剂型将提供更高的可接受性、更大的方便和可能更高的功效。
[1]Boyce JA, Assaad A, Burks A, et al. Guidelines for the diagnosis and management of food allergy in the United States: summary of the NIAID-sponsored expert panel report [J]. Nutr Res, 2011, 31(1):61-75.
[2]陈洁. 食物过敏性胃肠病 [J]. 中国实用儿科杂志, 2011, 26(8):561-563.
[3]Borody TJ, Khoruts A. Fecal microbiota transplantation and emerging applications [J]. Nat Rev Gastroenterol Hepato1, 2011, 9(2) :88-96.
[4]Reynolds LA, Finlay BB. A case for antibiotic perturbation of the microbiota leading to allergy development [J]. Expert Rev Clin Immunol, 2013, 9(11):1019-1030.
[5]Kalliomaki M, Kirjavainen P, Eerola E, et al. Distinct patterns of neonatal gut microllora in infants in whom atopy was and was dot developing [J]. J Allergy Clin Immunol, 2001, 107(1):129-134.
[6]王挺. 食物过敏儿童肠道正常菌群的定量调查与分析 [J].中国微生态杂志, 2006, 18(5):355-356.
[7]杨成彬, 赵梅珍, 杨平常, 等. 肠道菌群与婴幼儿食物过敏的研究进展 [J]. 实用临床医学, 2014, 15(8):117-124.
[8]王念蓉, 黎海芪. 食物过敏婴儿和健康儿肠道菌群分析[J]. 中国微生态学杂志, 2006, 18(2):110-111.
[9]黄志华, 郑跃杰, 武庆斌. 实用儿童微生态学 [M]. 北京:人民卫生出版社, 2014.
[10]Sommer F, Bäckhed F. The gut microbiota-masters of host development and physiology [J]. Nat Rev Microbiol, 2013, 11(4):227-238.
[11]Gill SR, Pop M, Deboy RT, et al. Metagenomic analysis of the human distal gut microbiome [J]. Science, 2006, 312(5778):1355-1359.
[12]Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium dif fi cile infections [J]. Am J Castroehterol, 2013, 108(4):478-498.
[13]张发明,范志宁,季国忠,等.粪菌移植的概念 历史 现状和未来[J].中国内镜杂志, 2012, 18(9):930-933.
[14]Hourigan SK, Oliva-Hemker M. Fecal microbiota transplantation in children: a brief review [J]. Pediatr Res, 2016, 80(1): 2-6.
[15]Kronman MP, Nielson HJ, Adler AL, et al. Fecal microbiota transplantation via nasogastric tube for recurrent Clostridium difficile infection in pediatric patients [J]. Pediatr Gastroenterol Nutr, 2015, 60(1):23-26.
[16]Russell GH, Benor S, Silver M, et al. Shortcomings of the in fl ammatory bowel disease Serology 7 panel [J]. Pediatrics, 2010, 125(6):1230-1236.
[17]Russell GH, Kaplan JL, Youngster I, et al. Fecal transplant for recurrent Clostridium dif fi cile infection in children with and without in fl ammatory bowel disease [J]. Pediatr Gastroenterol Nutr, 2014, 58 (5):588-592.
[18]Pierog A, Mencin A, Reilly NR, et al. Fecal microbiota transplantation in children with recurrent Clostridium dif fi cile infection [J]. Pediatr Infect Dis, 2014, 33(11):1198-1200.
[19]Walia R, Garg S, Song Y, et al. Efficacy of fecal microbiota transplantation in 2 children with recurrent Clostridium dif fi cile infection and its impact on their growth and gut microbiome [J]. Pediatr Gastroenterol Nutr, 2014, 59(5):565-570.
[20]Hourigan SK, Chen LA, Grigoryan Z, et al. Microbiome changes associated with sustained eradication of Clostridium difficile after single faecal microbiota transplantation in children with and without in fl ammatory bowel disease [J]. Aliment Pharmacol Ther, 2015, 42(6):741-752.
[21]Kahn SA, Young S, Rubin DT, et al. Colonoscopic microbiota transplant for recurrent Clostridium difficile infection in a child [J]. Am J Gastroenterol, 2012,107(12):1930-1931.
[22]Wang J, Xiao Y, Lin K, et al. Pediatric severe pseudomembranous enteritis treated with fecal microbiota transplantation in a 13-month-old infant [J]. Biomed Rep, 2015, 3(2):173-175.
[23]Rubin TA, Gessert CE, Aas J, et al. Fecal microbiome transplantation for recurrent Clostridium difficile infection: report on a case series [J]. Anaerobe, 2013, 19: 22-26.
[24]Kelly CR, Ihunnah C, Fischer M, et al. Fecal microbiota transplant for treatment of Clostridium dif fi cile infection in immunocompromised patients [J]. Am J Gastroenterol, 2014, 109(7):1065-1071.
[25]Suskind DL, Singh N, Nielson H, et al. Fecal microbial transplant via nasogastric tube for active pediatric ulcerative colitis [J]. Pediatr Gastroenterol Nutr, 2015, 60(1): 27-29.
[26]Suskind DL, Brittnacher MJ, Wahbeh G, et al. Fecal microbial transplant effect on clinical outcomes and fecal microbiome in active Crohn's disease [J]. Inflamm Bowel Dis, 2015, 21(3): 556-563.
[27]Kunde S, Pham A, Bonczyk S, et al. Safety, tolerability, and clinical response after fecal transplantation in children and young adults with ulcerative colitis [J]. Pediatr Gastroenterol Nutr, 2013, 56(6):597-601.
[28]Kellermayer R, Nagy-Szakal D, Harris RA, et al. Serial fecal microbiota transplantation alters mucosal gene expression in pediatric ulcerative colitis [J]. Am J Gastroenterol , 2015, 110(4): 604-606.
[29]Chang FY. Irritable bowel syndrome: the evolution of multidimensional looking and multidisciplinary treatments [J]. World J Gastroenterol, 2014, 20(10): 2499-2514.
[30]Vrieze A, Van Nood E, Holleman F, et al. Transfer ofintestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome [J]. Gastroenterology, 2012, 143 (4): 913-916.
[31]徐建仙,徐红贞. 1例小儿伪膜性肠炎行粪菌移植的护理[J].中华护理杂志, 2015, 50(5): 638-640.
[32]肖咏梅, 王佳怡, 车艳然, 等. 粪便微生物移植治疗幼儿重症伪膜性肠炎1例并文献复习[J]. 中国循证儿科杂志, 2014, 9(1): 37-40.
[33]杨颖. 粪便菌群移植在治疗小儿克罗恩病的应用与护理[J].护理进修杂志, 2014, 29(22): 2016-2017.
Fecal bacteria transplantation for treatment of severe gastrointestinal disease caused by food allergy in children: a case report and literature review
ZHU Zhongsheng, ZHENG Yuejie, CAI Huabo, BAI Daming, DAI Dongling, ZHOU Jianli, ZHOU Shaoming
(Shenzhen Children’s Hospital, Shenzhen 518026, Guangdong, China)
ObjectiveTo explore fecal bacteria transplantation for the treatment of severe gastrointestinal disease caused by food allergy. Method The therapeutic process of fecal bacteria transplantation for treatment of severe food allergy gastrointestinal disease was retrospectively analyzed, and the related literature was reviewed.ResultsA 2-year-old boy had onset of intestinal infection and diarrhea was persistent even though he had received adequate anti-infection therapy and supportive treatment. Finally, the patient received the treatment of fecal bacteria transplantation and the symptoms were then improved. No adverse reactions were observed in 2 months of follow-up. In foreign literature, fecal bacteria transplantation in children is mainly applied to clostridium dif fi cile infection (CDI) and in fl ammatory bowel disease (IBD), with ef fi ciency of 90% - 100% and 55.6% - 100%, respectively. While in the domestic literature, fecal bacteria transplantation in children is mainly used in CDI and antibiotic associated diarrhea, and the effective rate is 100%. No serious adverse reactions were found in all the researches.ConclusionFecal transplantation is safe and effective in the treatment of children with severe gastrointestinal disease caused by food allergy, but its application in children is not yet mature and needs more in-depth researches.
gastrointestinal disease caused by food allergy; fecal transplantation; treatment; child
10.3969/j.issn.1000-3606.2017.04.002
2016-09-05)
(本文编辑:蔡虹蔚)
深圳市卫生计生系统科研项目(No.201507028)
周少明 电子信箱:zhousm15d@aliyun.com

