脂质代谢相关基因变异与肥胖儿童非酒精性脂肪肝易感性分析
代东伶周少明柳国胜文飞球周建利
1. 深圳市儿童医院(广东深圳 518036);2. 暨南大学第一医院(广东广州 510630)
脂质代谢相关基因变异与肥胖儿童非酒精性脂肪肝易感性分析
代东伶1,2周少明1柳国胜2文飞球1周建利1
1. 深圳市儿童医院(广东深圳 518036);2. 暨南大学第一医院(广东广州 510630)
目的探讨儿童脂质代谢相关基因变异与非酒精性脂肪肝(NAFLD)易感性。方法纳入6~18岁的肥胖伴脂肪肝儿童,进行超声检查、常规体检及生化检测,并提取外周血 DNA,对36个脂质代谢相关目标基因进行二代测序,分析这些基因变异与脂肪肝的相关性。结果符合纳入标准的368例肥胖儿童中检出NAFLD 183例,占比为49.7%。在肥胖儿童中随机选取NAFLD及non-NAFLD各100例,NAFLD儿童的体质量、腰围、丙氨酸氨基转移酶(ALT)、三酰甘油(TG)、胆固醇、低密度脂蛋白(LDL)和载脂蛋白B(ApoB)均高于non-NAFLD儿童,两组比较差异有统计学意义(P均<0.05);而两组间天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、载脂蛋白A1(ApoA1)、空腹血糖、胰岛素、高密度脂蛋白(HDL)、游离脂肪酸(FFA)以及稳态模型胰岛素抵抗指数(HOMA-IR)的差异均无统计学意义(P均>0.05);两组的胆红素水平均在正常范围。Logistic回归分析发现,编码微粒体三酰甘油转运蛋白(MTTP或MTP)的基因MTTP rs2306986(OR=2.70,95%CI:1.38~5.27)、MTTP rs3792683(OR=7.34,95%CI:2.04~26.50)及编码含patatin样磷脂酶域3的基因PNPLA3 rs738409位点变异(OR=2.11,95%CI:1.31~4.48)是影响NAFLD发生的独立危险因素。结论MTTP rs2306986、MTTP rs3792683、PNPLA3 rs738409基因变异可能增加儿童NAFLD易感性。
基因学; 脂质代谢; 非酒精性脂肪肝; 肥胖; 单核苷酸多态性
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一组疾病,包括单纯性脂肪肝、脂肪性肝炎、肝纤维化、肝硬化,甚至可以进展为肝细胞癌[1]。随着肥胖儿童发病率增加,NAFLD成为了儿童最常见的肝病之一[2,3]。NAFLD发病机制仍不清楚。研究显示,NAFLD具有遗传倾向[4]。尽管胰岛素抵抗、不健康的饮食及久坐等生活方式被认为与脂肪肝相关,但是针对家族的研究和种族变异等结果显示遗传因素对于儿童脂肪肝具有更重要的决定作用,因为儿童受到诸如疾病时间、不良生活习惯、其他疾病以及药物等外界因素影响更少[5]。
脂质向肝细胞内流或合成速度超过脂质流出或分解速度而导致脂肪变性的发生[6]。而脂质代谢通路涉及胰岛素抵抗,脂肪合成、分解,跨膜内流,以及脂质氧化、过氧化和炎症细胞因子释放等过程。因此,脂质代谢通路中任一环节基因变异都可能导致儿童脂肪肝的发生。为了研究脂质代谢通路相关基因变异对儿童NAFLD易感性的影响,本研究选择影响肝脏脂质代谢的重要的基因进行测序,包括影响脂质合成(ACSs、LPL、TNF、LEP、SREBP、FASN、DGAT、FDFT、PXR),肝脏脂质内流(FABP、FATP、LEP),脂质氧化(ACACB、CYP2E1、DLAT、CIC、PPARs、LEP、ADIPOQ、CPT、LIPE、LIPC、ATGL、PNPLA3、UCP2)以及脂质流出(MTTP、PEMT、ApoB100、SREBP-1c)的基因。并根据其在肝脏脂质代谢中的作用以及对相关文献进行分析后挑选出来。
1 对象与方法
1.1 研究对象
随机挑选深圳市3所小学及中学学生总共2 236名,年龄6~18岁,进行常规体检,检出肥胖儿童。然后采用随机、双盲的方法挑选出NAFLD和non-NAFLD儿童各100例。研究对象入选标准:①年龄6~18岁;②肥胖标准参照Cole等[7]制定的不同年龄及性别的体质指数(body mass index,BMI),见表1;③NAFLD的诊断标准参照Lin等[8]超声诊断标准。排除慢性肝病、长期服药引起脂肪肝、贫血、甲状腺功能低下以及其他已知的慢性疾病如乙肝、丙肝、自身免疫性疾病及Wilson病等。
本研究获得医院伦理委员会同意,并与家长签署知情同意书。
1.2 方法
1.2.1 体格测量 由经验丰富的专业人员测量身高(精确到0.1 cm)、体质量(精确到0.1 kg)、腰围(精确到0.1 cm)及血压。BMI=体质量/身高的平方(kg/m2)。1.2.2 生化指标检测 抽取清晨空腹静脉血5 mL [其中2 mL乙二胺四乙酸(EDTA)抗凝,置-20℃冰箱保存备用],检测肝功能等生化指标:丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、胆红素以及空腹血糖、胰岛素、血脂、载脂蛋白(Apo)A1、ApoB、脂蛋白水平。胰岛素抵抗是通过抗胰岛素抵抗指数稳态模式评估法检测,稳态模型胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR)=空腹胰岛素×空腹血糖/22.5。
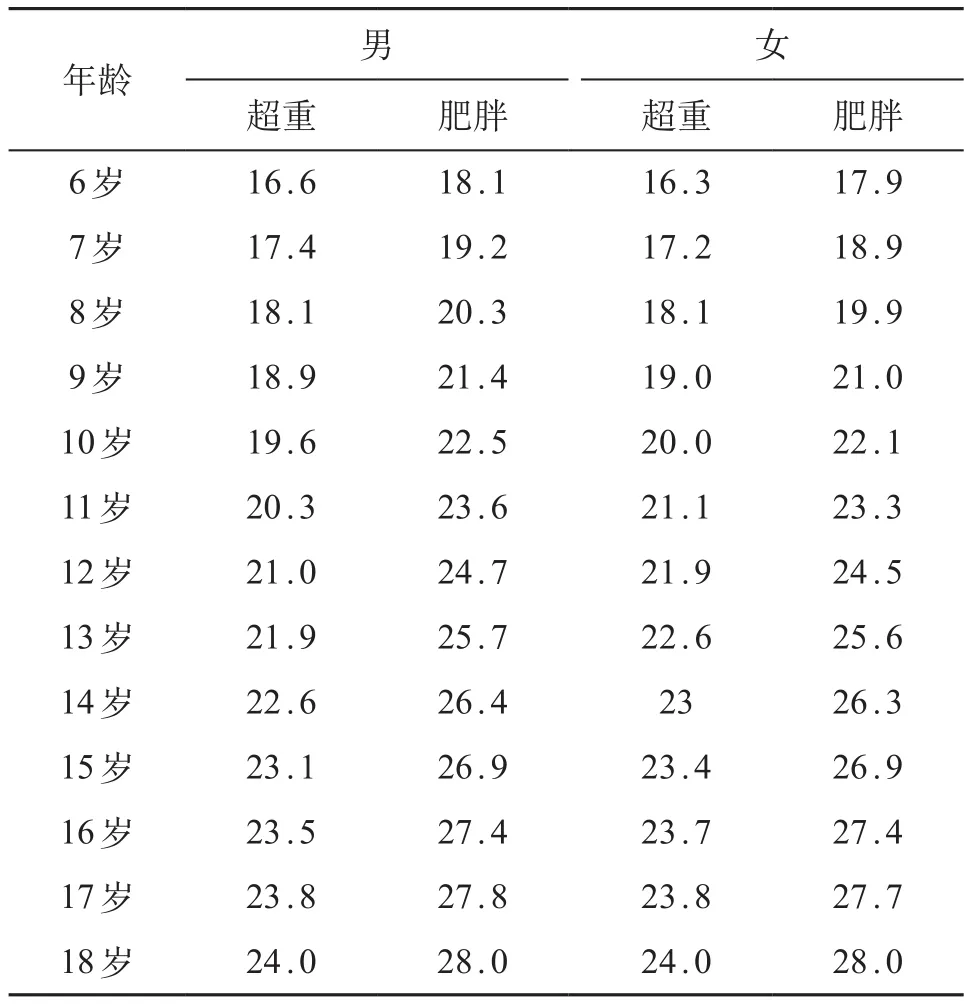
表1 中国学龄儿童青少年超重、肥胖筛查BMI分类标准 (kg/m2)
1.2.3 肝脏超声及氢质子磁共振成像检查 由同一名超声医师进行肝脏超声检查(Siemens Antares,探头为 2~5 MHz),由同一名影像科医师对超声图像进行阅图,该医师对研究对象临床及实验室结果均不知情。脂肪肝的评分根据肝脏脂肪变性及脂质浸润的特点进行诊断,包括肝脏回声质地、回声穿透深度及血管清晰度[8]。超声诊断为脂肪肝的,进一步用氢质子磁共振成像确认,方法为以肝脏为中心的标准躯干磁共振相控阵列线圈3T成像。然后有2名医师采用Osirix阅图并测算肝脏质子密度脂肪分数(proton density fat fraction,PDFF)。
1.2.4 基因检测 ①脂质代谢相关基因pane(lLMRG panel):根据基因在脂质代谢通路中的作用及对文献的分析,找出36个基因设计成panel。②目标基因捕获测序(target region sequencing,TRS):EDTA处理的外周血2 mL按照说明书(Qiagen,Valencia,CA)提取基因组DNA。将质检合格的基因组DNA打断为150~250 bp片段,并纯化,末端补平、3’端加“A”、接头连接,对连接产物进行PCR预扩增,样品与探针的杂交,利用单链DNA片段与单链RNA探针在序列上的互补配对原则,将probe对应的目标DNA形成DNARNA 杂交体(iGeneTech,China),实现目标区域的杂交,磁珠捕获,构建捕获目标区域 DNA 文库。洗涤纯化后对捕获后产物进行PCR扩增,测序采用Illumina Hiseq Xten测序仪,下机原始数据为双端100 bp序列(以下简称PE100序列),其中测序质量值>30(即正确率>99.9%)的碱基在85%以上。质量控制后的数据利用bwa mem软件与人类参考基因组(Feb. 2009,hg19,GRCh37)进行比对,生成比对BAM文件。利用GATK(Genome Analysis Toolkit)从比对的结果中进行突变筛选,最后对筛选出来的结果用ANNOVAR软件进行注释。
1.3 统计学分析
采用统计学软件SPSS 19.0进行数据分析。正态分布计量资料以均数±标准差表示,组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验。计数资料以百分比表示,组间比较采用χ2、校正χ2或Fisher精确概率法检验。以P<0.05 为差异有统计学意义。采用logistic逐步回归分析,分析影响NAFLD的主要因素。
2 结果
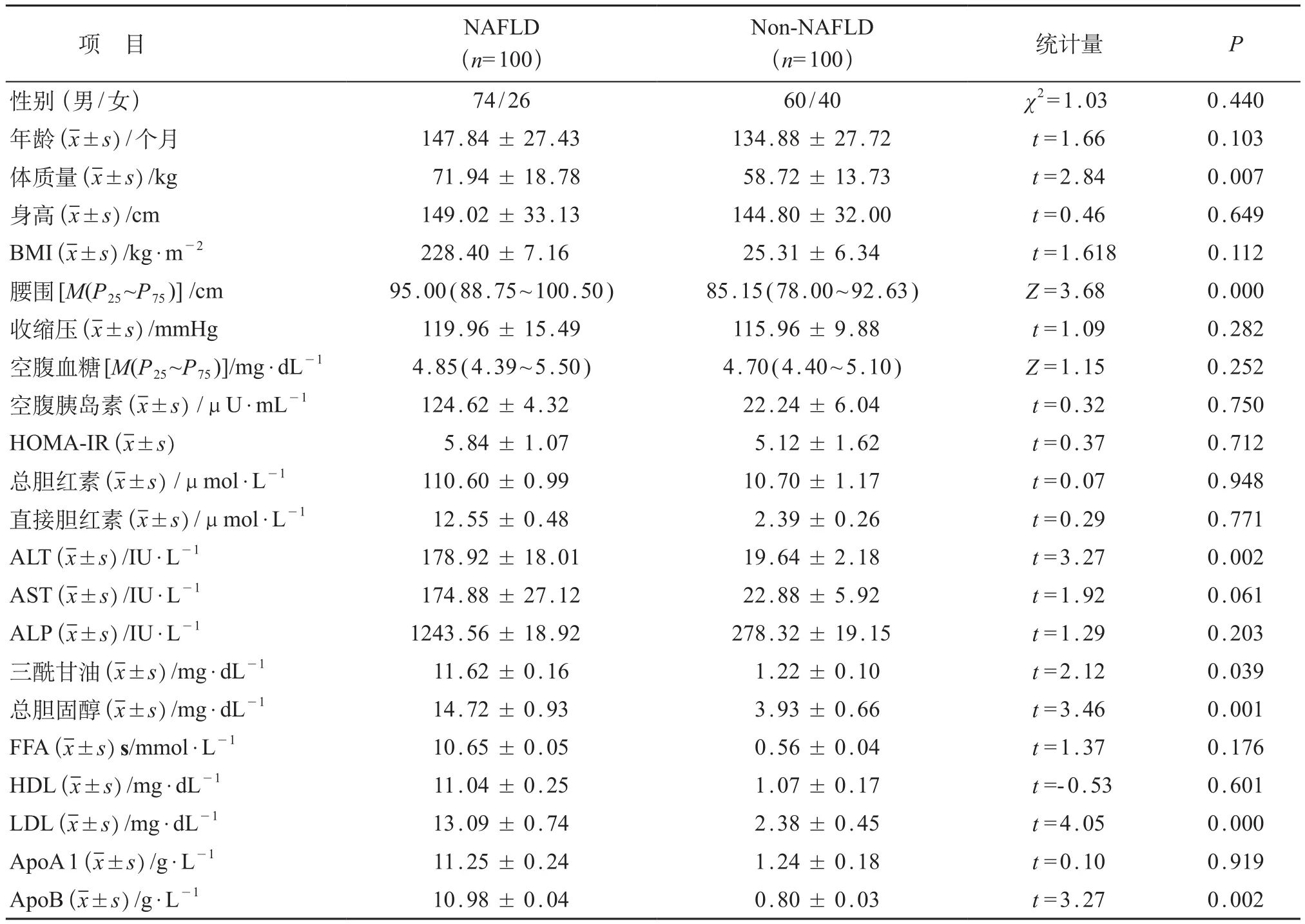
表2 两组研究对象临床资料及实验室指标比较
2.1 一般资料
共检出肥胖儿童368例,肥胖率16.46%。在肥胖儿童中进行肝脏超声检查,检出NAFLD 183例,占全体调查儿童的8.2%,占肥胖儿童的49.7%。肥胖儿童中,选择NAFLD和non-NAFLD儿童各100例,两组研究对象的一般特点及实验室结果见表2。NAFLD儿童的体质量、腰围、ALT、TG、胆固醇、LDL和ApoB均高于non-NAFLD儿童,两组比较差异均有统计学意义(P均<0.05),而两组儿童的性别、年龄、身高、收缩压、BMI以及各项检测指标(AST、ALP、ApoA1,空腹血糖、胰岛素,HDL、FFA、HOMA-IR、总胆红素和直接胆红素)的差异均无统计学意义(P>0.05)。
2.2 基因检测结果
对36个基因进行测序,共得到79个突变位点,两组间进行比较,其中3个差异具有统计学意义,即MTTP rs2306986、MTTP rs3792683和PNPLA3 rs738409。见表3。

表3 3个具有显著性差异的SNPs测序结果NAFLD和non-NAFLD两组间比较 [n(%)]
2.3 影响NAFLD发生的危险因素分析
将体质量、腰围、ALT、TG、胆固醇、LDL、ApoB、HOMA-IR,MTTP rs2306986、MTTP rs3792683、PNPLA3 rs738409基因型等变量纳入logistic逐步回归分析。结果显示PNPLA3 rs738409(OR=2.11,95%CI:1.31~4.48)、 MTTP rs2306986(OR=2.70,95%CI:1.38~5.27)和MTTP rs3792683变异(OR=7.34,95%CI:2.04~26.50)是影响NAFLD发生的独立危险因素。见表4。
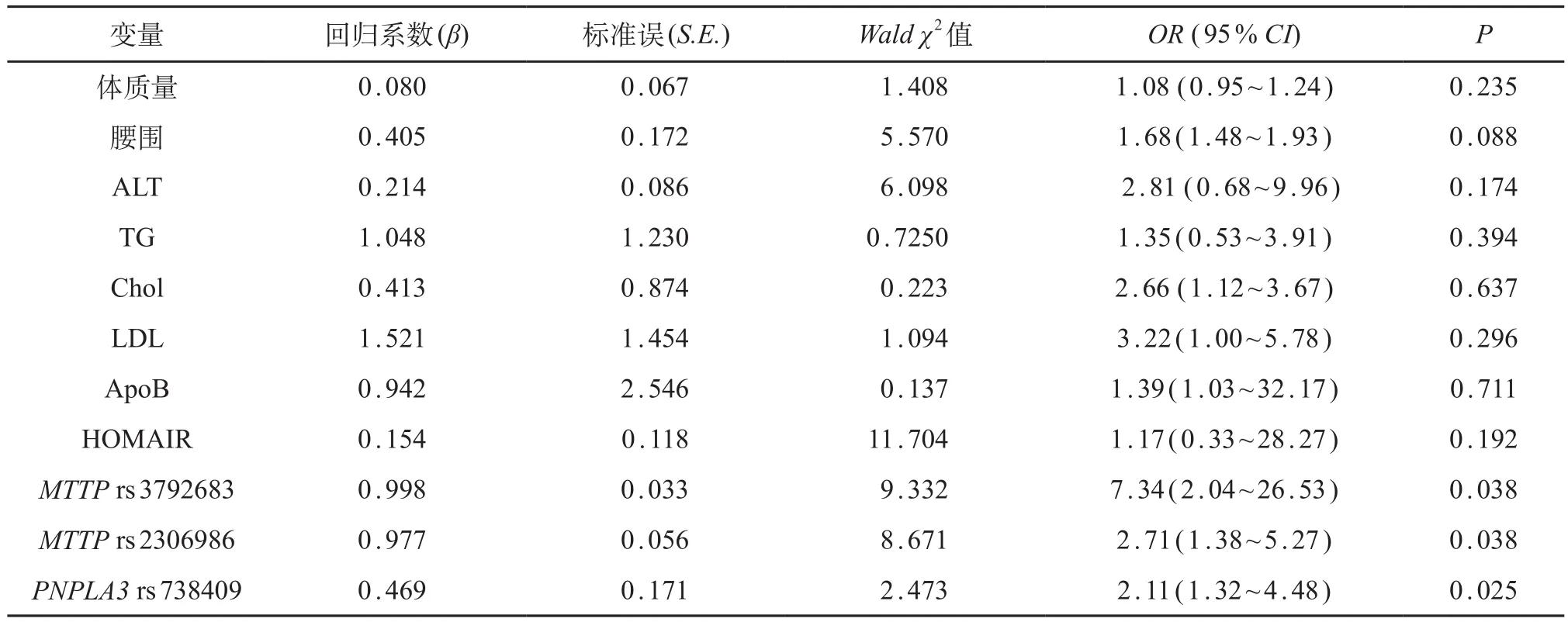
表4 基因变异对NAFLD影响的logistic回归分析
3 讨论
本研究结果显示儿童脂肪肝与体质量、腰围、ALT、TG、胆固醇、LDL及ApoB显著相关,而BMI、收缩压、HDL、FFA,胰岛素、血糖及HOMA-IR等指标无显著性差异。我们分析其原因在于本研究选取的研究对象都是肥胖儿童,因此BMI在两组没有差别,但是体质量和脂质分布仍然存在差异,所以体质量和腰围两组比较差异有统计学意义;肝细胞内TG合成后需要与Apo B、胆固醇等结合成极低密度脂蛋白(VLDL)而转运出肝脏;VLDL含三酰甘油多,LDL含胆固醇及胆固醇酯最多;VLDL和LDL之间可以相互转换。NAFLD儿童因ApoB异常而与TG及胆固醇结合形成VLDL及LDL减少,导致脂质在肝细胞内蓄积从而形成脂肪肝。本研究结果说明肥胖儿童脂肪肝的发生与机体脂质代谢关系密切,而与胰岛素抵抗及血糖水平则没有明显相关性。
目前NAFLD发病机制并不十分清楚,对于儿童NAFLD研究更少,目前学界广泛接受的“2次打击”学说认为:过多脂质在肝脏沉积、肝脂肪变性,形成第1次打击;线粒体脂质过氧化反应的增加导致大量反应性氧化物释放,线粒体DNA破坏,炎性反应细胞因子释放, 导致肝细胞损伤、炎症及纤维化形成,即第2次打击[9]。本研究结果证实,脂肪肝儿童血清TG水平明显升高,导致脂质在肝细胞内蓄积,而LDL及ApoB反馈性升高,但是并不能完全代偿脂质在肝细胞的蓄积,从而导致了脂肪肝的发生;本实验结果显示血清水平并没有随着脂质增加而增加,说明肝细胞内FFA可能通过β氧化和脂质过氧化消耗以维持平衡,该过程导致相应的氧化产物及过氧化产物增加,形成二次打击导致肝细胞损伤,ALT明显升高,但是因为儿童病程相对较短,氧化应激尚未导致肝脏线粒体破坏及毛细胆管损伤,因此AST和胆红素在两组之间并没有显著性差异。
非酒精性脂肪肝是遗传-环境-代谢应激相关性疾病,接触相似危险因素的个体间NAFLD的发病率差异较大,疾病进程亦不尽相同。近年来研究表明,儿童NAFLD主要发生于肥胖儿童。一项大型研究发现肥胖儿童脂肪肝检出率为23.33%,正常儿童脂肪肝检出率为5.26%[10]。有研究发现[11],非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和隐源性肝硬化的发生呈家族聚集现象,不同种族NAFLD发病率之间存在差异,提示单核苷酸多态性可能会增加NAFLD的易感性和严重程度。这一事实说明遗传因素及基因多态性与NAFLD发病及进程有关[12]。对于儿童患者,因为受到环境因素影响相对较小,遗传性因素影响更大,因此,研究NAFLD遗传易感性相对意义更大。
肝脏脂代谢紊乱,TG合成增加,脂肪酸分泌及氧化障碍,脂质蓄积为非酒精性脂肪肝的始动因素[13]。肝脏的脂质代谢过程会受到机体整体环境的影响,更重要的是肝脏作为一个独立的脏器,其本身的脂质代谢平衡发挥着重要的作用,可能存在某个共同的机制导致不同病理状态的个体出现脂质在肝细胞中蓄积从而形成脂肪肝。近年来基因芯片技术及高通量二代测序技术[14],在发达国家已经普遍应用于实验研究及临床诊断,已有报道应用基因芯片捕获联合二代测序技术来检测非酒精性脂肪肝相关基因。
本研究结果发现PNPLA 3 rs738409 位点变异在肥胖NAFLD儿童更为多见,与non-NAFLD儿童比较具有显著性差异,说明该位点变异可能与肥胖儿童脂肪肝发生有关。有学者证实PNPLA3 rs738409 位点变异与肝脏脂肪含量升高及NAFLD组织学严重程度有关[15],G等位基因与NAFLD儿童更早地出现症状有关[16],是亚洲人NAFLD易感性最强的危险因子,血清ALT水平更高[17]。 PNPLA3 I148M等位基因被证实增加儿童NAFLD发病风险[18-20]。
PNPLA 3基因编码产物是一种脂肪滋养蛋白(adiponutrin),在肝脏中表达最多,可调节TG的分解或合成。一项全基因组研究检测9 229个非同义突变基因,发现PNPLA3 rs738409 I148M与NAFLD进展关系最为密切[5]。成人PNPLA 3 rs738409多态性可能与肥胖个体慢性肝病发病风险增加有关[21];尽管降低中心性肥胖、BMI、血脂水平及胰岛素抵抗[22]。儿童PNPLA3 rs738409 G与肝脏脂肪变性、NASH、纤维化密切相关,且PNPLA3 148MM携带者发生NASH的风险最大,PNPLA3 148II携带者的风险最小[5]。针对多种族肥胖儿童进行研究,发现PNPLA3 G等位基因携带者的肝脏脂肪含量比C等位基因携带者高[23];皮下脂肪库储存量减少而肝脏的脂肪沉积[23]。
微粒体三酰甘油转运蛋白(MTTP)的作用为参与肝脏TG变为VLDL过程,将脂肪转运出肝脏,因此肝脏脂质排出受MTTP变化影响[24]。MTTP启动子区域-493位点G/T多态性与低水平转录相关,可以导致MTTP降低,TG无法排出肝脏促进NAFLD发病[25]。有证据显示该基因G等位基因纯合子NAFLD儿童脂肪变性及NASH病理学评分比杂合子或者T等位基因纯合子儿童均高[26]。MTTP 297H多态性可以降低血清ApoB水平,但是增加NAFLD发病风险[27]。
本研究结果证实肥胖NAFLD儿童MTTP rs2306986、MTTP rs3792683位点变异率与对照组儿童比较具有显著性差异,推测这两个位点变异可能使ApoB异常,导致肝脏脂质含量比对照组儿童高,从而增加肥胖儿童NAFLD发病风险;有报道[28]MTTP rs1800591等位基因G/T位点具有类似作用,其原因可能会使MTTP表达降低,VLDL及CM合成不足,导致ApoB降解增加,引起肝脏脂质代谢失调,从而使NAFLD发病增加[29]。因为TG转变为VLDL需要ApoB和MTTP的协同作用。ApoB是肝脏VLDL和小肠CM组装和分泌所必须的一种蛋白质[30]。 MTTP则将胆固醇、磷脂和TG转运给ApoB形成前VLDL,进而与MTTP稳态的TG融合,形成成熟的VLDL[31]。 研究报道基因分析证实了MTTP在脂质代谢中的重要作用,肝脏特异性MTTP敲除可以引起VLDL、TG显著降低并导致肝脏脂肪变性[32]。
[1]Day CP. Non-alcoholic fatty liver disease: a massive problem [J]. Clin Med (Lond), 2011, 11(2): 176-178.
[2]Alisi A, Manco M, Vania A, et al. Pediatric nonalcoholic fatty liver disease in 2009 [J]. J Pediatr, 2009, 155(4):469-474.
[3]代东伶. 儿童非酒精性脂肪肝最新研究动态 [J]. 中国当代儿科杂志, 2015, 17(1):107-112.
[4]Loomba R, Hwang SJ, O'Donnell CJ, et al. Parental obesity and offspring serum alanine and aspartate aminotransferase levels: the Framingham heart study [J]. Gastroenterology, 2008, 134(4):953-959.
[5]Valenti L, Alisi A, Galmozzi E, et al. I148M patatin-like phospholipase domain-containing 3 gene variant and severity of pediatric nonalcoholic fatty liver disease [J]. Hepatology, 2010, 52(4):1274-1280.
[6]Dai D, Wen F, Zhou S, et al. Clinical features and gene mutations in a patient with multiple aeyl-CoA dehydrogenase deficiency with severe fatty liver [J]. Zhonghua Yi Xue YiChuan Xue Za Zhi, 2016, 33(2):191-194.
[7]Cole TJ, Lobstein T. Extended international (IOTF) body mass index cut-offs for thinness, overweight and obesity [J]. Pediatr Obes, 2012, 7(4):284-294.
[8]Lin YC, Chou SC, Huang PT, et al. Risk factors and predictors of non-alcoholic fatty liver disease in Taiwan [J]. Ann Hepatol, 2011, 10(2):125-132.
[9]Portincasa P, Grattagliano I, Palmieri VO, et al. Nonalcoholic steatohepatitis: recent advances from experimental models to clinical management [J]. Clin Biochem, 2005, 38(3):203-217.
[10]李瑞珍, 马新瑜, 陈寿康, 等. 儿童单纯性肥胖与糖、脂代谢及脂肪肝 [J]. 临床儿科杂志, 2008, 26 (12):1035-1037.
[11]Sookoian S, Pirola CJ. Meta-analysis of the influence of I148M variant of patatin-like phospholipase domain containing 3 gene (PNPLA3) on the susceptibility and histological severity of nonalcoholic fatty liver disease [J]. Hepatology, 2011, 53(6):1883-1894.
[12]McCullough AJ. Pathophysiology of nonalcoholic steatohepatitis [J]. J Clin Gastroenterol, 2006, 40(Suppl 1):S17- S29.
[13]Gao X. Increased liver fat content triggers metabolic disorders [J]. Zhonghua Yi Xue Za Zhi, 2011, 91(26):1803-1804.
[14]Schuster SC. Next-generation sequencing transforms today's biology [J]. Nat Methods, 2008, 5(1):16-18.
[15]Speliotes EK, Butler JL, Palmer CD, et al. PNPLA3 variants speci fi cally confer increased risk for histologic nonalcoholic fatty liver disease but not metabolic disease [J]. Hepatology, 2010, 52(3):904-912.
[16]Rotman Y, Koh C, Zmuda JM, et al. The association of genetic variability in patatin-like phospholipase domaincontaining protein 3 (PNPLA3) with histological severity of nonalcoholic fatty liver disease [J]. Hepatology, 2010, 52(3):894-903.
[17]Zhang L, You W, Zhang H, et al. PNPLA3 polymorphisms (rs738409) and non-alcoholic fatty liver disease risk and related phenotypes: a meta-analysis [J]. J Gastroenterol Hepatol, 2015, 30(5):821-829.
[18]Goran MI, Walker R, Le KA, et al. Effects of PNPLA3 on liver fat and metabolic profile in Hispanic children and adolescents [J]. Diabetes, 2010, 59(12):3127-3130.
[19]Lin YC, Chang PF, Hu FC, et al. A common variant in the PNPLA3 gene is a risk factor for non-alcoholic fatty liver disease in obese Taiwanese children [J]. J Pediatr, 2011, 158(5):740-744.
[20]Krawczyk M, Lammert F. The PNPLA3 p.Ile148Met Variant and Obesity: brothers-in-arms: Comment on: PNPLA3 genotype increases susceptibility of nonalcoholic steatohepatitis among obese patients with nonalcoholic fatty liver disease [J]. Surg Obes Relat Dis, 2015, 11(4):894-896.
[21]Flores YN, Velazquez-Cruz R, Ramirez P, et al. Association between PNPLA3 (rs738409), LYPLAL1 (rs12137855), PPP1R3B (rs4240624), GCKR (rs780094), and elevated transaminase levels in overweight/obese Mexican adults [J]. Mol Biol Rep, 2016, 43(12):1359-1369.
[22]Park JH, Cho B, Kwon H, et al. I148M variant in PNPLA3 reduces central adiposity and metabolic disease risks while increasing nonalcoholic fatty liver disease [J]. Liver Int, 2015, 35(12):2537-2546.
[23]Santoro N, Kursawe R, D'Adamo E, et al. A common variant in the patatin-like phospholipase 3 gene (PNPLA3) is associated with fatty liver disease in obese children and adolescents [J]. Hepatology, 2010, 52(4):1281-1290.
[24]Pereira IV, Stefano JT, Oliveira CP. Microsomal triglyceride transfer protein and nonalcoholic fatty liver disease [J]. Expert Rev Gastroenterol Hepatol, 2011, 5(2):245-251.
[25]Li L, Wang SJ, Shi K, et al. Correlation between MTP -493G>T polymorphism and non-alcoholic fatty liver disease risk: a meta-analysis [J]. Genet Mol Res, 2014, 13(4):10150-10161.
[26]Bernard S, Touzet S, Personne I, et al. Association between microsomal triglyceride transfer protein gene polymorphism and the biological features of liver steatosis in patients with type II diabetes [J]. Diabetologia, 2000, 43(8):995-999.
[27]Hsiao PJ, Lee MY, Wang YT, et al. MTTP-297H polymorphism reduced serum cholesterol but increased risk of non-alcoholic fatty liver disease-a cross-sectional study [J]. BMC Med Genet, 2015, 16: 93.
[28]Siqueira ER, Oliveira CP, Correa-Giannella ML, et al. MTP -493G/T gene polymorphism is associated with steatosis in hepatitis C-infected patients [J]. Braz J Med Biol Res, 2012, 45(1):72-77.
[29]Di FM, Crehalet H, Samson-Bouma ME, et al. Molecular and functional analysis of two new MTTP gene mutations in an atypical case of a beta lipoproteinemia [J]. J Lipid Res, 2012, 53(3):548-555.
[30]Shelness GS, Sellers JA. Very-low-density lipoprotein assembly and secretion [J]. Curr Opin Lipidol, 2001, 12(2):151-157.
[31]Sparks JD, Sparks CE. Overindulgence and metabolic syndrome: is FoxO1 a missing link? [J]. J Clin Invest, 2008, 118(6):2012-2015.
[32]Raabe M, Veniant MM, Sullivan MA, et al. Analysis of the role of microsomal triglyceride transfer protein in the liver of tissue-specific knockout mice [J]. J Clin Invest, 1999, 103(9):1287-1298.
Variation in genes related to lipid metabolism and the susceptibility of nonalcoholic fatty liver disease in obese children
DAI Dongling1,2, ZHOU Shaoming1, LIU Guosheng2, WEN Feiqiu1, ZHOU Jianli1
(1. Shenzhen Children's Hospital, Shenzhen 518036, Guangdong, China;2. First Af fi liated Hospital of Jinan University, Guangzhou 510630, Guangdong, China)
ObjectiveTo explore the association between variation in genes related to lipid metabolism and the susceptibility of nonalcoholic fatty liver disease (NAFLD).MethodsObese children with fatty liver aged 6~18 years old were included. All of them got ultrasonic testing, routine examination and biochemical detection. In addition, the DNA of peripheral blood was extracted and the 36 target genes related to lipid metabolism were detected by next generation sequencing.ResultsIn 368 obese children who met the inclusion criteria, 183 children (49.7%) were detected to have NAFL . 100 children with NAFLD and 100 children without NAFLD were randomly selected from obese children. The levels of body mass, waistline, alanine aminotransferase (ALT), triacylglycerol (TG), cholesterol, low density lipoprotein (LDL) and apolipoprotein B (ApoB) in NAFLD children were all higher than those in non-NAFLD children, and there were signi fi cant differences (P all<0.05). However, the levels of aspartate aminotransferase (AST), alkaline phosphatase (ALP), apolipoprotein A1 (ApoA1), fasting blood glucose, insulin, high density lipoprotein (HDL), free fatty acid (FFA) and insulin resistance index (HOMA-IR) were not signi fi cantly different between the two groups (P all>0.05). The levels of bilirubine in the two groups were within normal range. Logistic regression analysis showed that the genes of MTTP rs2306986 (OR=2.70, 95%CI: 1.38~5.27) and MTTP rs3792683 (OR=7.34, 95%CI: 2.04~26.50) that encode microsomal triglyceride transfer protein (MTTP or MTP), and the mutation of rs738409 (OR=2.11, 95%CI:1.31~4.48) in gene PNPLA3 that encode patatin-like phospholipase domain-containing protein 3 are the independent risk factors for the occurrence of the disease.ConclusionGenovariation of MTTP rs2306986, MTTP rs3792683, and PNPLA3 rs738409 may increase susceptibility to NAFLD in children.
genetics; lipid metabolism; non-NAFLD; obesity; single nucleotide polymorphism
10.3969/j.issn.1000-3606.2017.04.001
2016-08-24)
(本文编辑:邹 强)
深圳市科创委创新基金项目(No.JCYJ20150403100317080)
周少明 电子信箱:zhousm15d@aliyun.com

