UPLC法检测HNHHJ-1菌株发酵液中2-羟基联苯含量*
张 宇,张 玥,马 宁,王志成
(黑龙江省科学院 能源环境研究院,黑龙江 哈尔滨 150090)
UPLC法检测HNHHJ-1菌株发酵液中2-羟基联苯含量*
张 宇,张 玥,马 宁,王志成**
(黑龙江省科学院 能源环境研究院,黑龙江 哈尔滨 150090)
采用超高效液相色谱法(UPLC)测定脱硫菌发酵液中2-羟基联苯(2-HBP)的含量。色谱柱为ACQVITYDPLC@BEH C18(2.1×50mm,1.7μm,Waters),流动相为甲醇∶水(90∶10,V/V),柱温30℃,流速0.2mL/min,进样量2μL,PDA检测器检测2-HBP,检测器检出限范围为0~200mg/L。结果显示2-HBP的保留时间为0.74min。利用该检测方法得到HNHHJ-1菌株培养后的发酵液中2-HBP的含量为5.35mg/L。
超高效液相色谱法;2-HBP;检测
前言
2-羟基联苯(2-biphenylol,2-HBP),又名邻苯基苯酚、邻苯基酚、(1,1’-二苯基)-2-酚、苯基苯酚。可用作阻燃剂、表面活性剂、杀菌防腐剂,还可用于医药、印染助剂和染料中间体,在日本,2-HBP及其钠盐用于柑桔的防霉,而英国、美国和加拿大允许使用的水果范围较大,还包括苹果、梨和菠萝等[1~8]。另外,2-HBP还可以用于化妆品。美国环境保护局(EPA)允许使用以邻苯基苯酚或其钠盐为主要成分的杀菌皂、杀菌除臭洗剂、防腐保鲜剂。目前,该化合物的生产都采用真空蒸馏法,而分析羟基联苯类化合物通常需要繁琐的前处理步骤,目前大多数采用比色法、同步荧光法、高效液相色谱法等。其中高效液相色谱法是最常用的方法[1,2]。
1 材料和方法
1.1 菌种、培养基和试剂
菌种:具有降解二苯并噻吩(DBT)能力的菌株HNHHJ-1,分离自大庆油田井口附近含油土壤。
培养基:基础培养基由质量浓度为8.0g/L葡萄糖,2.5g/LNH4Cl,6.5g/LKH2PO4,8.5g/LK2HPO4,0.3g/L MgCl2·6H2O,分别加入1.0mL/L微量元素溶液母液和维生素溶液母液,pH值7.0~7.2。微量元素母液由质量浓度为 0.8g/L FeCl2·4H2O,0.8g/L ZnCl2,0.8g/L MnCl2·4H2O,0.2g/LNaMoO4·2H2O,0.08g/LCuCl2,0.08g/L NaWO4·2H2O和150mmol/LHCl组成。维生素母液由质量浓度500mg/L泛酸钙,300mg/L肌醇,500mg/L烟酸,500mg/L盐酸吡哆醇,300mg/L对氨基甲苯和0.8mg/L维生素B12组成[2]。
选择性培养基:将一定浓度的DBT加入到基础培养基中。
试剂:甲醇(HPLC),二苯并噻吩(DBT),葡萄糖,氯化铵,磷酸氢二钾,磷酸二氢钾,六水氯化镁,四水氯化亚铁,氯化锌,四水氯化锰,二水钼酸钠,氯化铜,二水钨酸钠,盐酸,泛酸钙,肌醇烟酸,盐酸吡哆醇,对氨基甲苯和维生素B12。
1.2 仪器与设备
超高效液相色谱仪(包括Waters 510泵,柱温箱,Waters PDA检测器和Waters EmpowerTM)美国Waters公司;色谱柱(ACQVITY DPLC@BEH C18,50×2.1mm,1.7μm)美国Waters公司;超声波清洗机。
1.3 方法
1.3.1 超高效液相色谱条件
PDA检测器,色谱柱为ACQVITY DPLC@BEH C18,柱温30℃,流动相为甲醇∶水(90∶10,V/V),使用超声脱气,各样品均用0.22μm滤膜过滤并经过脱气处理;流速0.2mL/min,进样量2μL。
1.3.2 待测样品提取
在含有100mL分离培养基的250mL三角瓶中接种HNHHJ-1菌株,初始pH值7.0~7.2,培养温度30℃、摇瓶转速100r/min培养3d,用循环水真空过滤器进行过滤,取200mL抽滤后的发酵液,加入等体积的正己烷,振荡2min,充分混匀萃取两次,合并正己烷,旋转蒸发除去正己烷,蒸发瓶内残留物用甲醇定容至10mL,用UPLC样品过滤专用滤膜过滤后,用超高效液相色谱分析。
1.3.3 标准溶液和曲线
二苯并噻吩(DBT)标准溶液:用分析天平称量0.04gDBT,溶于100mL甲醇中,制得质量浓度为400mg/L标准溶液;
2-羟基联苯(2-HBP)标准储备液:用分析天平称量0.1g 2-HBP,溶于100mL甲醇中,制得质量浓度为1000mg/L标准溶液。
2-HBP标准曲线:分别配制质量浓度为10、15、20、40、60、80mg/L的2-HBP标准溶液。利用UPLC进行分析测定,每次进样量为2μL,以2-HBP浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.4 精密度实验
用稀释20倍的2-HBP标准储备液和质量浓度为50mg/L的2-HBP标准溶液进行精密度实验。分别吸取各溶液3份,用UPLC法进行2-HBP含量测定,比较同一样品6次检测结果的差异。
1.3.5 回收率实验
分别将一定量的2-HBP对照溶液加入到已知浓度的2-HBP发酵液中进行回收率实验,每个浓度设2个平行,用UPLC法进行2-HBP含量测定,确定其回收率。
2 结果与讨论
2.1 2-HBP超高效液相色谱检测条件的确立
由于主要以发酵液中DBT的残留量和2-HBP的生成量为检测对象,故主要是以二者的分离情况作为是否能够进行检测的标准。检测结果显示,当流动相为甲醇∶水(10∶0,V/V)时(如图1a),保留时间间隔太短,虽然二者峰型较好,但是分离效果不是很好;当流动相为甲醇∶水(90∶10,V/V)时(如图1b),DBT和2-HBP分离效果明显,而且峰型也较好,当流动相为甲醇∶水(80∶20,V/V)时(如图1C),虽然DBT和2-HBP分离效果明显,但峰型不是特别好,故选择流动相的配比为甲醇∶水(90∶10,V/V)。

图1 甲醇与水体积比对DBT(400mg/L)和2-HBP(200mg/L)在UPLC色谱中分离的影响Fig.1 The influence of methanol/water volume ratio on UPLC separation of DBT(400 mg/L)and 2-HBP(200 mg/L)
2.2 2-HBP保留时间的确定
将经酸化及萃取处理后未接种的培养基,与200mg/L 2-HBP标准品混合进样,2-HBP的保留时间为0.73min(图2)。
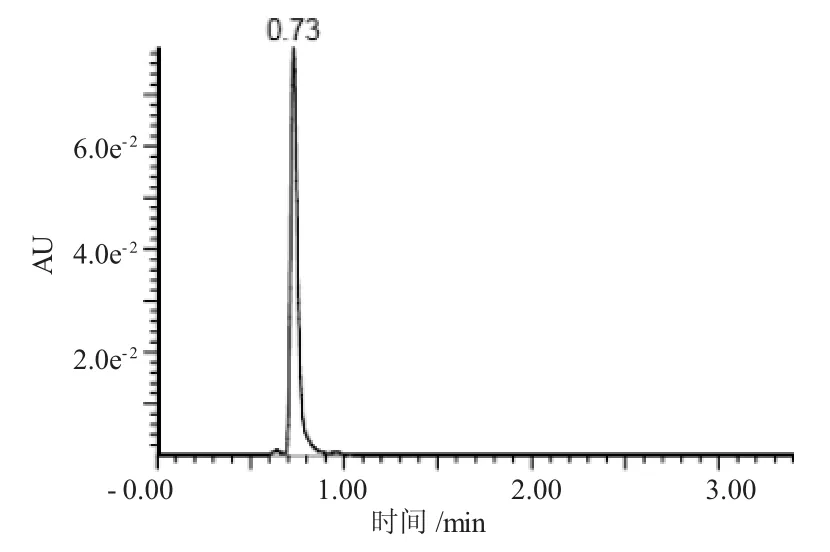
图2 2-HBP(200mg/L)标准品UPLC色谱图Fig.2 The 2-HBP(200 mg/L)standard UPLC chromatogram
2.3 2-HBP标准曲线
分别在超高效液相色谱条件下对质量浓度为10、15、20、40、60、80mg/L的2-HBP标准溶液进样测定,各质量浓度均测定3次并取其平均值,以2-HBP质量浓度(mg/L)为横坐标,峰面积为纵坐标,绘制标准曲线,结果表明质量浓度在0~80mg/L范围内曲线线性良好。2-HBP的质量浓度和峰面积之间的相关方程为y=5427.2X-8406.5,R2=0.9997。
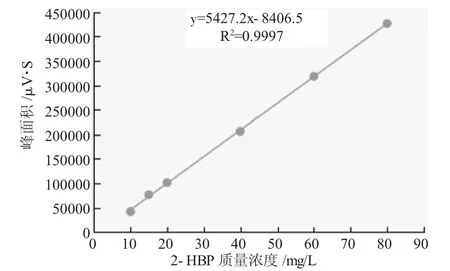
图3 2-HBP标准曲线Fig.3 The standard curve of 2-HBP
2.4 精密度和回收率
取3份50mg/L的2-HBP标准溶液用UPLC法进行测定,重复进样6次,峰面积相对标准偏差小于1.5%。分别加入一定量的2-HBP对照溶液到已知浓度的2-HBP发酵液中进行回收率实验,每个浓度设2个平行,具体加入量及结果见表1。2-HBP的平均回收率为97.73%,RSD为0.28%(n=6)。
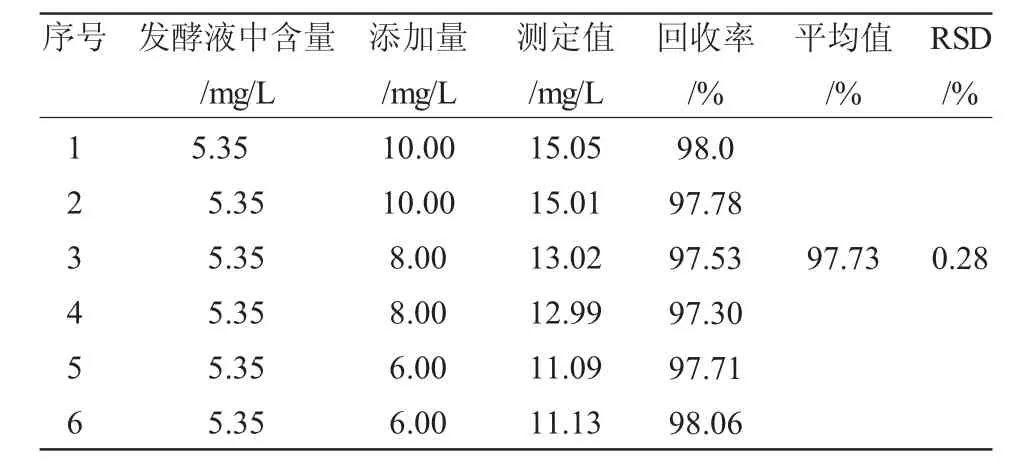
表1 检测的2-HBP回收率(n=6)Table 1 The recovery rates of 2-HBP with different addition amounts(n=6)
2.5 HNHHJ-1降解DBT生成2-HBP测定
将HNHHJ-1以1%的接种量接入培养基中培养3d,取经处理后的培养液进行UPLC检测分析,发现HNHHJ-1将DBT降解为2-HBP,超高效液相色谱显示DBT及2-HBP保留时间分别为1.07min和0.74min,得到良好的分离(图4),与标准品保留时间相符、且峰型好。根据标准曲线和超高效液相峰面积(图4)计算得出,此时培养液中2-HBP含量为5.35mg/L。
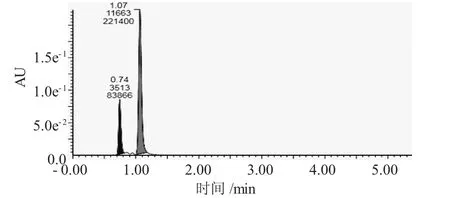
图4 HNHHJ-1最佳培养条件下培养液UPLC色谱图Fig.4 The UPLC chromatogram of HNHHJ-1 broth under optimal culture conditions
3 结论
本研究得到的UPLC法检测2-HBP的色谱条件为:以ACQVITYDPLC@BEH C18为色谱柱,流动相为甲醇∶水(90∶10,V/V),流速0.2mL/min,进样量 2μL,PDA检测器。2-HBP的保留时间为0.74min,检出线性范围为范围为0~80mg/L。利用该方法测定的HNHHJ-1菌株发酵液中的2-HBP的含量为5.35mg/L。
[1] 葛箐萍,王莉丽,平文祥.HPLC法测HDBRS-1菌株发酵液中2-羟基联苯含量[J].食品科学,2009,30(22):290~292.
[2] 宋静.二苯并噻吩脱硫菌的筛选及其代谢途径研究[D].武汉:华中科技大学,2011.
[3] 马挺,佟明友,张全,等.脱硫菌Fds-1的分离鉴定及其对柴油脱硫特性的研究[J].微生物学报,2006,46(1):104~110.
[4] 张建斌,于熙昌,魏雄辉,等.Mycobacterium.sp BY11脱硫代谢产物的色谱分析[J].内蒙古工业大学学报,2010,29(4):260~264.
[5] 李凌凌,吕早生,吴敏,等.二苯并噻吩降解菌的筛选鉴定及煤脱硫的研究[J].环境工程学报,2010,4(10):2391~2396.
[6] 詹晓,冯守帅,张玲,等.一株CX-DBT脱硫菌的筛选及发酵条件优化[J].微生物学通报,2016,43(6):1171~1180.
[6] 万涛.戈登氏菌Gordonia sp.WQ-01对石油中二苯并噻吩(DBT)生物脱硫的研究[D].天津:天津大学,2011.
[7] 明龙.二苯并噻吩脱硫菌的筛选、鉴定及其降解特性的研究[D].长春:吉林农业大学,2015.
[8] 高超,吴涓,李玉成,等.一株生物脱硫菌株的分离、鉴定及其脱硫活性的研究[J].生物学杂志,2010,27(4):39~41,34.
Determination of 2-Hydroxybiphenyl Content in Fermentation Broth of Desulfurization Strain HNHHJ-1 by UPLC Method
ZHANG Yu,ZHANG Yue,MA Ning and WANG Zhi-cheng
(Institute of Energy&Environmental Research Heilongjiang Academy of Science,Harbin 150090,China)
The concentration of 2-hydroxybiphenyl(2-HBP)in the fermentation broth of desulfurization strain was determined byultra performance liquid chromatography(UPLC).The 2-HBP was separated by a chromatographic column(2.1×50 mm,1.7μm,waters),eluted with methyl alcohol and water with a volume ratio of 90∶10 at a flow rate of 0.2mL/min and detected with PDA detector;the column temperature was 30℃,and the sample quantity was 2μL.The results showed that the retention time of 2-HBP was 0.74min with a detection limit of 0~200mg/L.The 2-HBP concentration in the fermentation broth of strain HNHHJ-1 was 5.35mg/L.
UPLC;2-HBP;detection
O657.72
A
1001-0017(2017)01-0040-03
2016-10-09
黑龙江省青年科学基金(编号:QC2014C028)
张宇(1983-),男,黑龙江肇州人,助理研究员,研究领域为环境与节能技术。
**通讯联系人:王志成(1973-),男,黑龙江哈尔滨人,研究员级高级工程师,从事生物质能源、替代能源和室内环境研究。

