姜黄素逆转HGF诱导PC9细胞对吉非替尼的耐药*
詹建伟, 王 剑, 王 弋, 焦德明, 陈 君, 李 优, 吴锦鸿, 陈清勇△
(1杭州市第一人民医院, 浙江 杭州 310006; 2解放军第一一七医院, 浙江 杭州 310013)
姜黄素逆转HGF诱导PC9细胞对吉非替尼的耐药*
詹建伟1, 王 剑2▲, 王 弋1, 焦德明2, 陈 君2, 李 优2, 吴锦鸿1, 陈清勇2△
(1杭州市第一人民医院, 浙江 杭州 310006;2解放军第一一七医院, 浙江 杭州 310013)
目的: 探索姜黄素逆转肝细胞生长因子(HGF)诱导的肺癌细胞吉非替尼耐药性的分子机制。方法: 利用MTT实验、划痕修复实验和Western blot观察HGF、吉非替尼和姜黄素对PC9细胞药物敏感性、迁移能力、上皮间质转化和相关信号通路的影响. 结果: HGF可显著降低PC9细胞对吉非替尼的敏感性,而姜黄素可显著逆转HGF诱导的PC9细胞对吉非替尼的耐药性。HGF还可诱导PC9细胞发生迁移及上皮间质转化,激活c-Met/AKT/mTOR通路,单独吉非替尼不能逆转HGF诱导的迁移、上皮间质转化及c-Met/AKT/mTOR通路活化,而吉非替尼联合姜黄素可抑制HGF诱导的c-Met/AKT/mTOR通路活化并逆转PC9细胞的迁移和上皮间质转化。结论: 姜黄素抑制HGF诱导的PC9细胞吉非替尼耐药性可能是通过逆转上皮间质转化和抑制c-Met/AKT/mTOR通路实现的。
姜黄素; 肝细胞生长因子; 吉非替尼; 耐药性; 上皮间质转化
肺癌已成为发病率和死亡率最高的恶性肿瘤之一。吉非替尼(gefitinib,Ge)已成为晚期非小细胞肺癌表皮生长因子受体(epidermal growth factor receptor,EGFR)突变阳性患者的一线用药,可显著延长患者生存期,改善生活质量。然而吉非替尼耐药是所有服用该靶向药物的肺癌患者不可避免的问题。已有研究表明,肿瘤细胞耐吉非替尼的机制主要有上皮间质转化[1]、T790M突变[2]、c-met突变或扩增[3]、非小细胞肺癌向小细胞肺癌转化[4]等。近来的研究报道显示,肝细胞生长因子(hepatocyte growth factor,HGF)可在体外诱导肺癌细胞耐吉非替尼,可能与激活旁路有关[5]。因此,抑制HGF诱导的旁路激活可能成为逆转吉非替尼耐药性的新的治疗手段。本实验将对姜黄素(curcumin,CUR)能否逆转HGF诱导的肺癌细胞对吉非替尼的耐药性及具体机制进行研究,为姜黄素逆转肺癌对靶向药物的耐药性提供更多的理论依据。
材 料 和 方 法
1 细胞系和主要试剂
人非小细胞肺癌细胞PC9购自上海中科院细胞库。
吉非替尼片(易瑞沙)购自Astra Zeneca,用DMSO配制成20 mmol/L储备液,-20 °C保存;姜黄素购自Sigma;HGF 购自PeproTech;c-Met抑制剂SU11274购自Selleck Chemicals;抗EGFR、p-EGFR、p-Met (Y1234/35)、c-Met、p-AKT (S473)、AKT、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR (S2448)、GAPDH等抗体购自Cell Signaling Technology;羊抗兔IgG II抗购自Jackson。
2 方法
2.1 细胞培养 细胞培养于含10%胎牛血清和青霉素、链霉素(终浓度为1×105U/L)的RPMI-1640(Gibco)培养液,常规置于37 °C、5% CO2培养箱中,取对数生长期细胞进行实验。
2.2 细胞分组 实验分为对照(control)组、HGF组、吉非替尼组、HGF+吉非替尼组和HGF+吉非替尼+姜黄素组。其中HGF使用浓度为40 μg/L,吉非替尼使用浓度为200 nmol/L,姜黄素使用浓度分别为20 μmol/L。
2.3 MTT实验检测细胞活力 接种3×103个PC9细胞于96孔板,培养12 h待细胞贴壁后,吸去培养基,按上述药物浓度加入全血清培养200 μL,每24 h换液1次,处理48 h后,各孔加20 μL MTT 溶液(5 g/L,无菌PBS配制),继续培养4 h,吸去培养基,各孔加入150 μL二甲基亚砜,摇床避光轻摇10 min,每孔吸100 μL置于另一96孔板内,酶标仪在490 nm处检测吸光度(A)值,绘制柱状图。每组设5个复孔,实验重复3次。
2.4 划痕修复实验 接种3×105个PC9细胞于6孔板,待细胞融合度为80%时,在板内用10 μL枪头进行划痕、拍照。吸去培养基,加入含有2.5%血清培养基,或含有上述药物的培养基,作用2 h后加入HGF,使终浓度为40 μg/L,继续培养24 h。划痕修复率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,计算平均数和标准差,绘制统计图。
2.5 Western blot实验 接种 3×105个PC9细胞于6孔板,培养12 h待细胞贴壁后,吸去培养基,按上述药物浓度加入全血清培养基2 mL,每24 h换液1次,处理48 h后用RAPI 裂解液提取各组细胞总蛋白并进行蛋白定量,每个泳道上蛋白样品10 μg,8% SDS-PAGE分离后,转印(300 mA、120 min)到PVDF上。5%脱脂牛奶或牛血清白蛋白室温封闭1 h。分别加入对应 I 抗,4 °C孵育过夜,TBST洗涤3次,加入 II 抗孵育2 h后洗膜,加入电化学发光法发光液,凝胶成像系统拍照,分析条带灰度值。
3 统计学处理
以上实验均至少重复3次,应用SPSS 13.0统计软件进行统计分析,数据以均数±标准差(mean±SD)表示,多组间的均数比较采用单因素方差分析(one-way ANOVA),多个样本均数两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 姜黄素逆转HGF诱导的PC9细胞对吉非替尼耐药
经HGF刺激后,细胞活力明显高于对照组。与对照组相比,吉非替尼可显著抑制PC9细胞的活力,而联合HGF可显著削弱吉非替尼对细胞活力的抑制作用。加入姜黄素处理后,可重新抑制PC9细胞的活力,见图1。
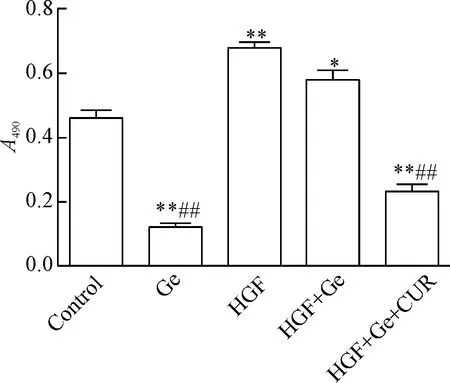
Figure 1.Curcumin (CUR) reversed HGF-induced resistance to gefitinib (Ge) in the PC9 lung cancer cells. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group;##P<0.01vsHGF+Ge group.
图1 姜黄素逆转HGF诱导的PC9细胞对吉非替尼的耐药性
2 姜黄素抑制HGF诱导的PC9细胞迁移
HGF可诱导PC9细胞迁移,在HGF存在的条件下,吉非替尼对PC9细胞迁移的抑制作用明显降低,在联合姜黄素处理后,HGF对PC9细胞迁移的促进作用减弱,见图2。
Figure 2.Curcumin (CUR) inhibitied HGF-induced PC9 cell migration (×100). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group,#P<0.05,##P<0.01vsHGF+Ge group.
图2 姜黄素抑制HGF诱导的PC9细胞迁移
3 姜黄素逆转HGF诱导的PC9细胞上皮间质转化
光镜观察发现,与对照组细胞形态比较,加入HGF刺激后,PC9细胞形态变得更为细长,特别是细胞两头的丝状伪足变得更为细长;在吉非替尼作用下,PC9细胞形态偏圆形;HGF和吉非替尼联合作用下,细胞形态偏长梭形;加入姜黄素后,细胞形态偏圆形,见图3。Western blot结果显示,HGF可诱导PC9细胞E-cadherin蛋白表达下调,vimentin蛋白表达上调;吉非替尼可上调PC9细胞E-cadherin蛋白表达,下调vimentin蛋白表达,但不能逆转HGF诱导的PC9细胞E-cadherin蛋白表达下调和vimentin蛋白表达上调;在姜黄素联合作用下,PC9细胞E-cadherin蛋白表达上调,vimentin蛋白表达无明显变化,见图4。

Figure 3.The effects of HGF, curcumin and gefitinib on the morphological changes of PC9 cells (×200).
图3 HGF、姜黄素和吉非替尼对PC9细胞形态的影响
4 姜黄素抑制c-Met/AKT/mTOR通路的活化
Western blot实验结果显示,HGF可诱导c-Met、AKT和mTOR磷酸化,但对EGFR磷酸化无影响;吉非替尼可抑制EGFR、AKT和mTOR磷酸化,但对HGF诱导的c-Met、AKT和mTOR磷酸化并无抑制作用;而在姜黄素联合作用下,可抑制HGF诱导的c-Met、AKT和mTOR磷酸化,同时抑制EGFR磷酸化,见图5。
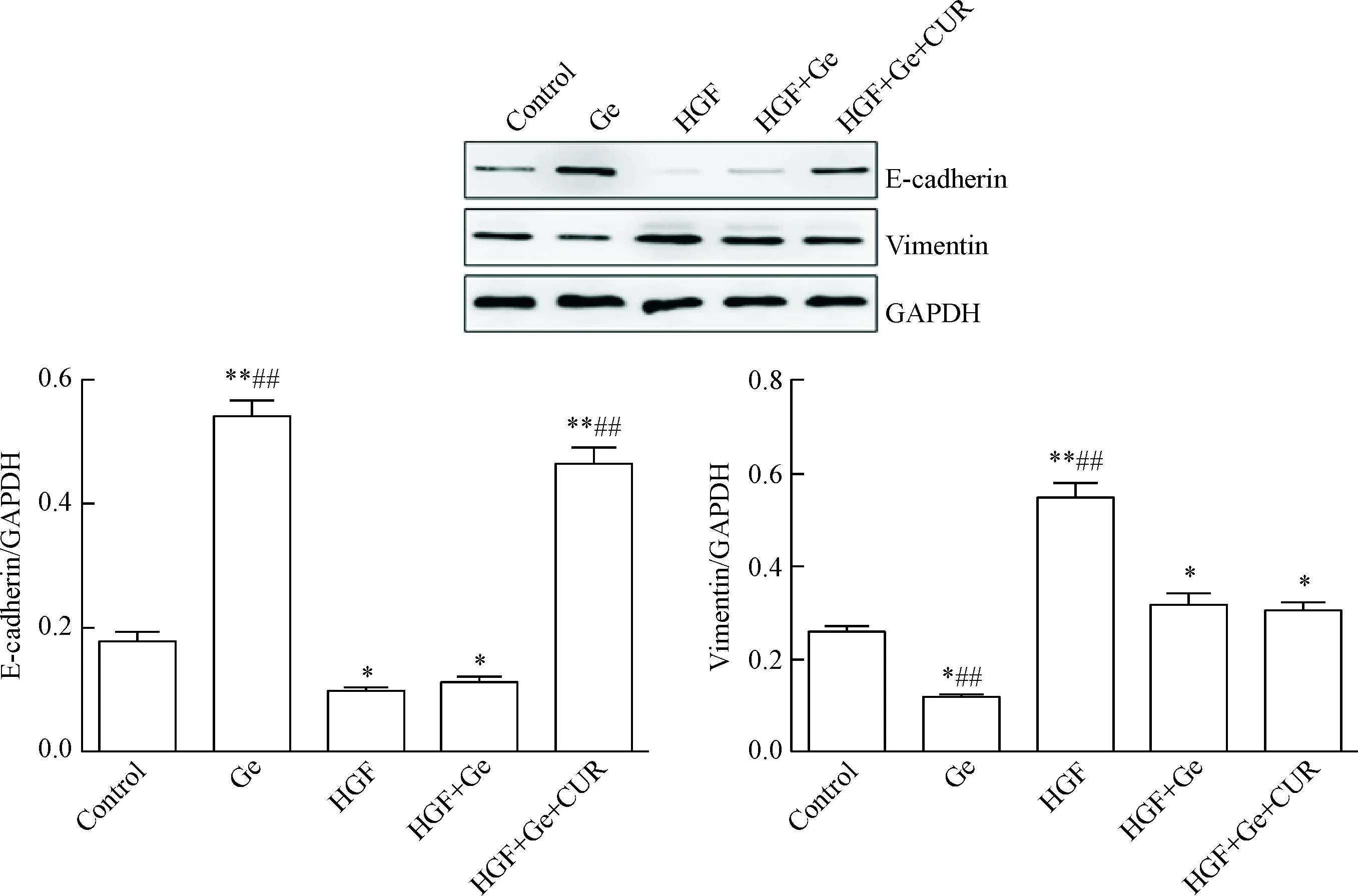
Figure 4.Curcumin (CUR) reversed HGF-induced epihelial-mesenchymal transition in the PC9 lung cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsHGF+Ge group.
图4 姜黄素逆转HGF诱导PC9细胞发生上皮间质转化
讨 论
非小细胞肺癌患者存在原发性或获得性对表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)的耐药性,但其耐药机理尚未完全明确。研究发现T790M突变与c-met基因的扩增被认为是吉非替尼获得性耐药的重要机制。HGF受体c-Met是由原癌基因c-met编码的蛋白产物,具有酪氨酸激酶活性,与肿瘤增殖、分化、侵袭、迁移、耐药等多种生物学行为密切相关[6]。一些研究发现,HGF可诱导EGFR突变耐药株对多种靶向药物耐药,机制可能是避开了EGFR介导的PI3K/AKT/mTOR通路,通过激活c-Met,从而维持PI3K/AKT/mTOR通路活化,保持细胞对靶向药物耐药[7-8]。
上皮间质转化是指肿瘤细胞由上皮表型向间充质表型转化的过程,从而获得侵袭、迁移及耐药的能力。其表现为细胞由卵圆形变为长梭形、多角形,上皮标志物如E-cadherin蛋白表达下降,间充质标志物如N-cadherin、vimentin蛋白表达上调[9]。有报道HGF也可诱导多种肿瘤细胞发生上皮间质转化,如Tsai 等[10]报道HGF可诱导乳腺癌MDA-MB-231细胞发生上皮间质转化。 Han等[11]报道HGF通过ERK/MAPK和Zeb-1通路诱导前列腺癌PC-3细胞发生上皮间质转化。但关于HGF诱导肺癌细胞发生上皮间质转化的研究尚无报道。
姜黄素是从姜科植物中提取的酚性色素,具有抗炎、抗肿瘤、抗血管生成等药理作用[12]。近期的研究显示,姜黄素可抑制阿霉素诱导的TGF-β/PI3K/AKT通路,抑制肺癌细胞上皮间质转化[13]。Huang 等[14]报道姜黄素可通过抑制NF-κB-Snail信号通路阻断LPS诱导乳腺癌细胞发生EMT。而近期Hu等[15]报道姜黄素可通过抑制c-Met/AKT和c-Met/ERK通路阻断HGF诱导前列腺癌细胞发生上皮间质转化。这些研究表明姜黄素可通过多条信号途径来阻断肿瘤细胞上皮间质转化。但关于姜黄素是否能靶向HGF/c-Met、阻断HGF诱导的肺癌上皮间质转化及相关信号通路激活,目前尚无研究报道。
针对上述假设,我们通过HGF刺激构建肺癌耐药模型,并用姜黄素进行处理。我们的研究结果显示,通过HGF刺激可诱导肺癌PC9细胞对吉非替尼耐药,同时细胞的迁移能力显著增加,细胞形态由软圆形变为长梭形,蛋白表达出现E-cadherin下调,vimentin下调,同时使c-Met/AKT/mTOR磷酸化水平增加;而使用吉非替尼处理,并不能逆转PC9细胞迁移及上皮间质转化,抑制c-Met/AKT/mTOR磷酸化;而在加用姜黄素处理后,细胞重新变为卵圆形,并可使HGF诱导的c-Met/AKT/mTOR磷酸化被阻断,同时阻断EMT发生。我们观察到吉非替尼可抑制EGFR/AKT/mTOR信号通路,但对HGF激活的c-Met/AKT/mTOR信号通路并无抑制作用,在HGF存在的情况下,尽管吉非替尼可抑制EGFR的磷酸化,但对下游AKT/mTOR活化并无抑制作用。表明EGFR和c-Met作为AKT/mTOR的共同上游,在HGF存在的情况下,c-Met介导AKT/mTOR通路保持活化可能是导致吉非替尼耐药性的重要机制。加入姜黄素后,可显著抑制c-Met/AKT/mTOR通路的磷酸化水平。
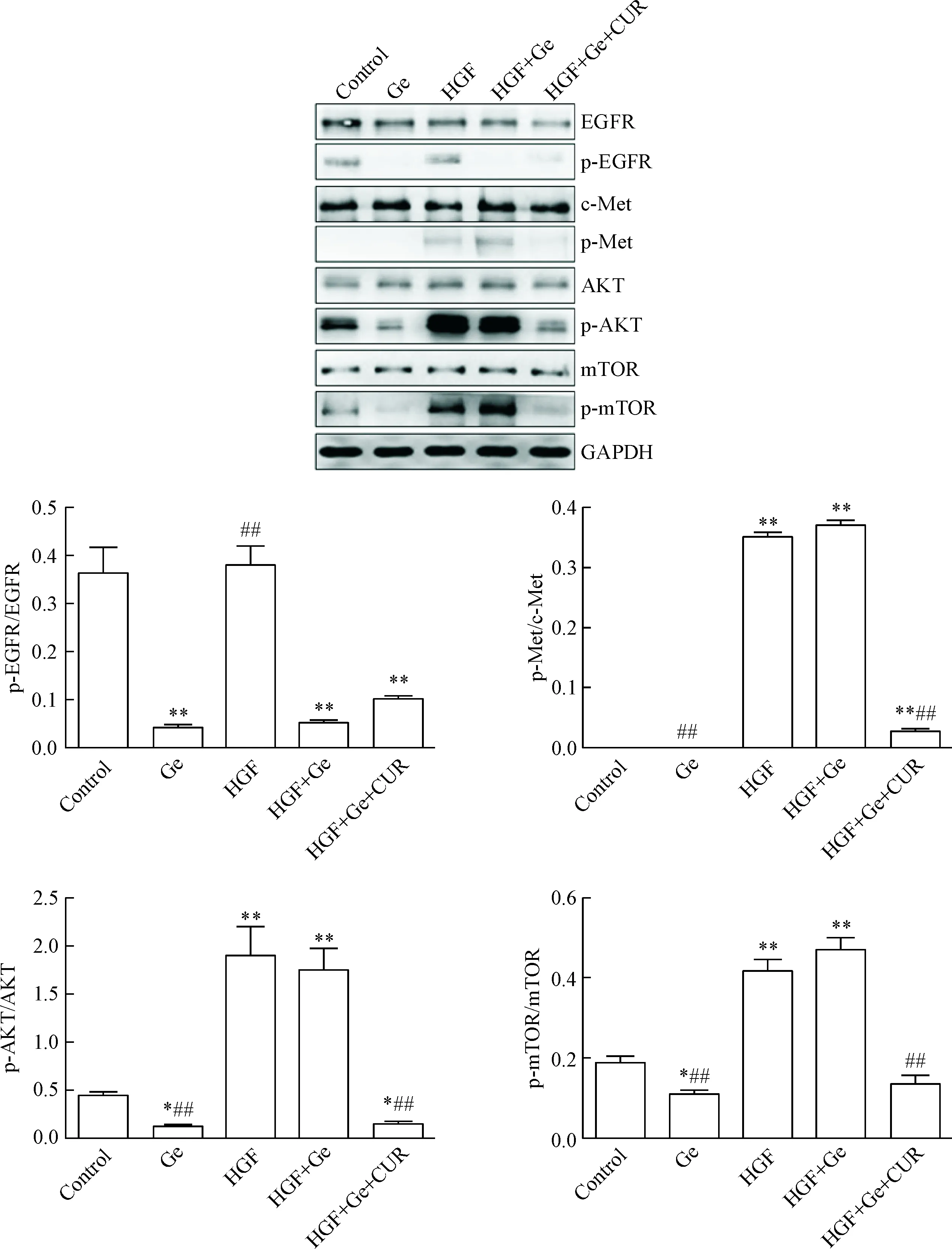
Figure 5.Curcumin (CUR) inhibited the HGF-induced the c-Met/AKT/mTOR signaling pathway activation in the PC9 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsHGF+Ge group.
图5 姜黄素抑制HGF诱导的c-Met/AKT/mTOR通路活化
综上所述,姜黄素可逆转HGF诱导的PC9肺癌细胞对吉非替尼的耐药性可能是通过逆转上皮间质转化和抑制c-Met/AKT/mTOR通路实现的。
[1] Yang J, Qin G, Luo M, et al. Reciprocal positive regulation between Cx26 and PI3K/Akt pathway confers acquired gefitinib resistance in NSCLC cells via GJIC-independent induction of EMT[J]. Cell Death Dis, 2015, 6:e1829.
[2] Jia Y, Yun CH, Park E,et al. Overcoming EGFR(T790M) and EGFR(C797S) resistance with mutant-selective allosteric inhibitors[J]. Nature, 2016, 534(7605):129-132.
[3] Jang WJ, Park B, Jeong GS, et al. SB365,Pulsatillasaponin D, suppresses the growth of gefitinib-resistant NSCLC cells with Met amplification[J]. Oncol Rep, 2014, 32(6):2612-2618.
[4] Kim WJ, Kim S, Choi H, et al. Histological transformation from non-small cell to small cell lung carcinoma after treatment with epidermal growth factor receptor-tyrosine kinase inhibitor[J]. Thorac Cancer, 2015, 6(6):800-804.
[5] Wu H, Fan F, Liu Z, et al. Norcantharidin combined with EGFR-TKIs overcomes HGF-induced resistance to EGFR-TKIs in EGFR mutant lung cancer cells via inhibition of Met/PI3k/Akt pathway[J]. Cancer Chemother Pharmacol, 2015, 76(2):307-315.
[6] Liu WT, Jing YY, Yu GF, et al. Hepatic stellate cell promoted hepatoma cell invasion via the HGF/c-Met signaling pathway regulated by p53[J]. Cell Cycle, 2016, 15(7):886-894.
[7] 玄香兰, 安昌善, 周彩存, 等. 肝细胞生长因子诱导敏感非小细胞肺癌细胞对吉非替尼耐药及机制的研究[J]. 中国肺癌杂志, 2013, 16(1):1-6.
[8] 玄香兰, 安昌善, 周彩存, 等. c-Met信号通道参与HGF诱导不同基因型非小细胞肺癌细胞株对吉非替尼耐药[J]. 中国肺癌杂志, 2013, 16(9):464-469.
[9] Liu S, Song L, Yao H, et al. MiR-375 is epigenetically downregulated by HPV-16 E6 mediated DNMT1 upregulation and modulates EMT of cervical cancer cells by suppressing lncRNA MALAT1[J]. PLoS One, 2016, 11(9):e0163460.
[10]Tsai PC, Fu YS, Chang LS, et al. Cardiotoxin III inhibits hepatocyte growth factor-induced epithelial-mesenchymal transition and suppresses invasion of MDA-MB-231 cells[J]. J Biochem Mol Toxicol, 2016, 30(1):12-21.
[11]Han Y, Luo Y, Wang Y,et al. Hepatocyte growth factor increases the invasive potential of PC-3 human prostate cancer cells via an ERK/MAPK and Zeb-1 signaling pathway[J]. Oncol Lett, 2016, 11(1):753-759.
[12]应丽丽, 倪瑾瑶, 李慧敏, 等. 姜黄素类似物L6H4对2型糖尿病大鼠心肌的保护作用[J].中国病理生理杂志, 2016, 32(1):27-32.
[13]Chen WC, Lai YA, Lin YC, et al. Curcumin suppresses doxorubicin-induced epithelial-mesenchymal transition via the inhibition of TGF-beta and PI3K/AKT signaling pathways in triple-negative breast cancer cells[J]. J Agric Food Chem, 2013, 61(48):11817-11824.
[14]Huang T, Chen Z, Fang L. Curcumin inhibits LPS-induced EMT through downregulation of NF-κB-Snail signaling in breast cancer cells[J]. Oncol Rep, 2013, 29(1):117-124.
[15]Hu HJ, Lin XL, Liu MH, et al. Curcumin mediates reversion of HGF-induced epithelial-mesenchymal transition via inhibition of c-Met expression in DU145 cells[J]. Oncol Lett, 2016, 11(2):1499-1505.
(责任编辑: 林白霜, 罗 森)
Curcumin reverses hepatocyte growth factor-induced resistance to gefitinib in PC9 lung cancer cells
ZHAN Jian-wei1, WANG Jian2, WANG Yi1, JIAO De-ming2, CHEN Jun2, LI You2, WU Jin-hong1, CHEN Qing-yong2
(1HangzhouFirstPeople’sHospital,Hangzhou310006,China;2The117thHospitalofPLA,Hangzhou310013,China.E-mail:CQYong117@163.com)
AIM: To explore the molecular mechanism through which curcumin reverses hepatocyte growth factor (HGF)-induced resistance to gefitinib in lung cancer cells. METHODS: The methods of MTT assay, wound healing assay and Western blot were used to observe the effects of HGF, curcumin and gefitinib on the migration, drug susceptibility, epithelial-mesenchymal transition, and related signaling pathways in the PC9 lung cancer cells. RESULTS: HGF reduced susceptibility of the PC9 cells to gefitinib, and curcumin significantly reversed HGF-induced resistance to gefitinib. HGF induced migration and epihelial-mesenchymal transition, and promoted c-Met/AKT/mTOR pathway activation in the PC9 cells. Gefitinib alone did not prevent the above activities. However, combined with curcumin, gefitinib prevented the above activities.CONCLUSION: Curcumin reverses HGF-induced resistance of the PC9 cells to gefitinib by preventing epithelial-mesenchymal transition and inhibiting c-Met/AKT/mTOR activation.
Curcumin; Hepatocyte growth factor; Gefitinib; Drug resistance; Epithelial-mesenchymal transition
1000- 4718(2017)05- 0805- 06
2016- 09- 30
2017- 03- 10
浙江省医药卫生科技计划项目(No. 2014KYB193);浙江省中医药科技计划项目(No. 2015ZB080);浙江省科技厅公益性技术应用研究计划(No. 2014C33277);杭州市科技发展计划项目(No. 20130633B29; No. 20140633B40);杭州市社会发展自主申报项目(No. 20160533B74)
R730.23; R965
A
10.3969/j.issn.1000- 4718.2017.05.007
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0571-28084876; E-mail: CQYong117@163.com
▲并列第1作者

