抑制miR-421表达增强宫颈癌细胞放疗敏感性*
潘雨露, 吴淑霞, 石翠格, 任兴业△
(1济南市第五人民医院妇产科, 山东 济南 250022; 2中国计划生育研究所细胞生物学实验室, 北京 100081)
抑制miR-421表达增强宫颈癌细胞放疗敏感性*
潘雨露1, 吴淑霞1, 石翠格2, 任兴业1△
(1济南市第五人民医院妇产科, 山东 济南 250022;2中国计划生育研究所细胞生物学实验室, 北京 100081)
目的: 研究抑制miR-421表达增强宫颈癌细胞放疗敏感性的分子机制。方法: 运用脂质体2000将miR-421 inhibitor转染4株宫颈癌细胞系HeLa、SiHa、C33A和CaSki,以转染阴性核苷酸为对照,real-time PCR检测子宫内膜上皮细胞ESC细胞和4株宫颈癌细胞中miR-421的表达水平;转染的细胞经不同剂量电离辐射(0、2、4、6和8 Gy)处理48 h后运用MTT法、ELISA和Annexin V-FITC/PI染色法联合流式细胞术分别测定细胞活力、乳酸脱氢酶(LDH)漏出率和细胞凋亡率;运用Western blot检测细胞中cleaved caspase-9、caspase-9、cleaved PARP、PARP、Bcl-2和Bax蛋白的水平。结果: miR421在ESC细胞中低表达,而在4株宫颈癌细胞中高表达,转染miR-421 inhibitor后miR-421显著低于阴性对照组(P<0.05)。相同条件下,辐照后低表达miR-421的宫颈癌细胞活力和LDH漏出率显著低于阴性对照组,72 h的细胞凋亡率明显增加(P<0.05)。Western blot结果显示,电离辐射后与阴性对照组比较,低表达miR-421的宫颈癌细胞中cleaved caspase-9、cleaved PARP和Bcl-2的蛋白水平明显增高,而Bax蛋白水平显著降低(P<0.05)。结论: miR-421在正常子宫内膜上皮ESC细胞中低表达,而在宫颈癌细胞系中高表达;下调miR-421表达能抑制宫颈癌细胞的活力,显著增强宫颈癌细胞的辐射敏感性,其机制至少部分通过激活caspase-9细胞凋亡通路进而促进抗凋亡蛋白Bcl-2表达和抑制促凋亡蛋白Bax表达而实现。
宫颈癌; miR-421; 电离辐射; 放疗敏感性; 细胞凋亡
宫颈癌是一种严重威胁妇女健康与生命的恶性肿瘤,其发病率和死亡率位居所有肿瘤的第2位。资料显示全球每年约有50万新增病例,其中我国每年有约13.1万宫颈癌患者[1-2],发病率和死亡率呈逐年增加及年轻化趋势[3]。目前手术和放疗是宫颈癌的主要治疗方案,但转移、放疗耐受的宫颈癌却很难彻底根治。因此,寻找和研发增强宫颈癌放疗敏感性的靶向药物迫在眉睫。
微小RNAs(microRNAs, miRNAs,miR)是一类长度约21~25 nt的非编码小RNA分子,在细胞增殖、分化、凋亡和肿瘤发生等生理或病理学进程中扮演着重要的角色[4]。大量的研究表明miRNAs的异常表达与多种肿瘤的发生发展密切相关[5-7]。已有研究证实,miR-210[8]、miR-193b[9]和miR-221/miR-222[10]异常表达与多种肿瘤细胞的放疗耐受有关。研究证实miR-421在神经母细胞瘤、胰腺癌、前列腺癌等恶性肿瘤中高表达[11-12],表明miR-421是一种肿瘤促进因子。Zhou等[13]发现下调miR-421表达显著抑制胃癌细胞异种移植肿瘤的生长。最新研究发现miR-421在MCF-7/ADR耐药细胞中的表达明显降低[14]。目前,miR-421在宫颈癌发生发展中的生物学功能以及下调miR-421的表达能否增强宫颈癌细胞的放疗敏感性尚无报道。本研究旨在观察下调miR-421表达对宫颈癌细胞放疗敏感性的影响,并探讨其分子机制,为以miR-421为靶点联合放疗的宫颈癌治疗方案提供科学依据。
材 料 和 方 法
1 细胞系与试剂
子宫内膜上皮细胞系ESC购自ATCC;宫颈癌细胞系HeLa、SiHa、C33A和CaSki购自中国科学院上海细胞生物研究所;DMEM培养基(Gibco)、胎牛血清(fetal bovine serum,FBS)和胰酶购自北京同立海源生物科技有限公司;双抗、MTT和DMSO购自Sigma;乳酸脱氢酶(lactate dehydrogenase,LDH) ELISA试剂盒和Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京博泰生物技术有限公司;miR-421 inhibitor和阴性对照核苷酸片段购自Sigma;microRNA提取试剂盒和TaqMan® miRNA试剂盒购自Applied Biosystems;脂质体2000购自Invitrogen;抗cleaved caspase-9、caspase-9、cleaved PARP和PARP抗体购自Cell Signaling Technology;抗Bcl-2和Bax抗体购自Abcam;抗β-actin抗体购自Santa Curz;BCA试剂盒购自Thermo。
2 方法
2.1 细胞培养 ESC、HeLa、SiHa、C33A和CaSki细胞培养于含10% FBS、1%青霉素和1%链霉素的DMEM培养基中,置于37 ℃、5% CO2及95%湿度的培养箱,细胞融合度达到80%~90%时进行细胞传代。
2.2 细胞转染 将生长良好的HeLa、C33A、SiHa和CaSki细胞消化计数后,以细胞密度为每孔2.5×104个接种到6孔板中,置于CO2培养箱中待细胞融合度达到60%时按照脂质体2000说明书进行miR-421 inhibitor细胞转染。转染的细胞培养4 h后换成完全培养基;以转染阴性对照核苷酸片段为阴性对照,细胞置于培养箱中培养用于后续实验。
2.3 Real-time PCR 转染的细胞培养48 h时刮下细胞、离心收集,按照mirVanaTMmiRNA分离试剂盒提取细胞miRNA;运用TaqMan® miRNA检测试剂盒检测miR-421的表达水平,采用SYBR GreenⅡ荧光染料法和IQ5TMReal-Time PCR Detection System(Bio-Rad)进行real-time PCR数据分析,内参照采用U6,miR-421的相对表达量用2-ΔΔCt表示。进行3次独立重复实验。
2.4 电离辐射 采用X射线照射,放射剂量率为2.0 Gy/min。运用0.5 mm铝过滤器对X射线进行过滤。实验分为3种细胞:未转染对照细胞、转染miR-421 inhibitor的细胞和阴性对照细胞。细胞经不同剂量(0、2、4、6和8 Gy)辐射处理,用于后续研究。
2.5 MTT实验检测细胞活性 放射处理的细胞经消化计数后,以细胞密度为每孔2.5×104个接种到96孔板中,置于 CO2培养箱中培养48 h后进行MTT实验,同时设空白对照组。每孔加入20 μL 5 g/L MTT,37 ℃继续培养4 h,弃掉培养液,每孔加入150 μL DMSO,置于摇床上室温振荡5 min,用酶标仪测定490 nm处的吸光度(A)值,按下式计算细胞活力抑制率:细胞增殖抑制率(%)=(对照组A值-实验组A值)/实验组A值×100%。
2.6 测定LDH漏出率 放射处理的细胞以每孔2.5×104个接种于96孔板中,同时设细胞自然释放对照组(DMEM培养基)和最大释放对照组(0.8% Triton X-100),每组各设5个复孔。37 ℃、5% CO2温箱中培养48 h,最大释放孔在结束培养前加入终浓度为0.8%的Triton X-100,作用45 min。分别从对应的培养板中取100 μL上清加入ELISA板中,37 ℃孵育10 min后, 加入新鲜配制的100 μL LDH底物溶液,室温避光反应15 min,每孔加入1 mol/L 柠檬酸终止液30 μL,用酶标仪在490 nm 处读取各孔A值, 并计算LDH漏出率:LDH漏出率(%)=(实验组A值-自然释放对照组A值)/(最大释放对照组A值-自然释放对照组A值)×100%。
2.7 细胞凋亡的检测 转染的细胞消化计数后接种到6孔板中,培养24 h后经5 Gy辐射处理;细胞培养72 h后弃掉培养基,PBS洗涤,细胞经无EDTA的胰酶消化收集细胞,加入PBS制成细胞悬液。按照Annexin V试剂盒说明书操作,先加入500 μL的binding buffer重悬细胞,再加入5 μL FITC标记的Annexin V和5 μL PI混匀,室温下避光孵育15 min,流式细胞仪检测细胞凋亡。
2.8 Western blot实验 照射处理的细胞经消化,离心收集细胞,加入RIPA(50 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,1% NP-40,0.5%脱氧胆酸钠,0.1% SDS)重悬细胞,超声破碎、12 000 r/min,4 ℃离心10 min,按照BCA试剂盒说明书测定蛋白浓度。取30 μg进行SDS-PAGE,将蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭,孵育 I 抗(cleaved caspase-9、caspase-9、cleaved PARP、PARP、Bcl-2和Bax抗体),以β-actin为内参照,4 ℃过夜。洗膜、孵育 II 抗,室温1 h。ECL显影后扫描,蛋白相对表达量经内参照校正后经ImageJ软件分析。
3 统计学处理
每个实验进行3次独立重复试验。应用SPSS 17.0统计软件进行相关数据分析,结果用平均值±标准差(mean±SD)表示,两组间的比较采用t检验,多组间的比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 miR-421在宫颈癌细胞中的表达
如图1所示,miR-421在HeLa、SiHa、C33A和CaSki细胞中高表达,而在ESC细胞中低表达,分别与4株宫颈癌细胞比较差异具有统计学意义(P<0.01);当宫颈癌细胞转染miR421 inhibitor后miR-421显著降低,与阴性对照组比较差异具有统计学意义(P<0.01)。
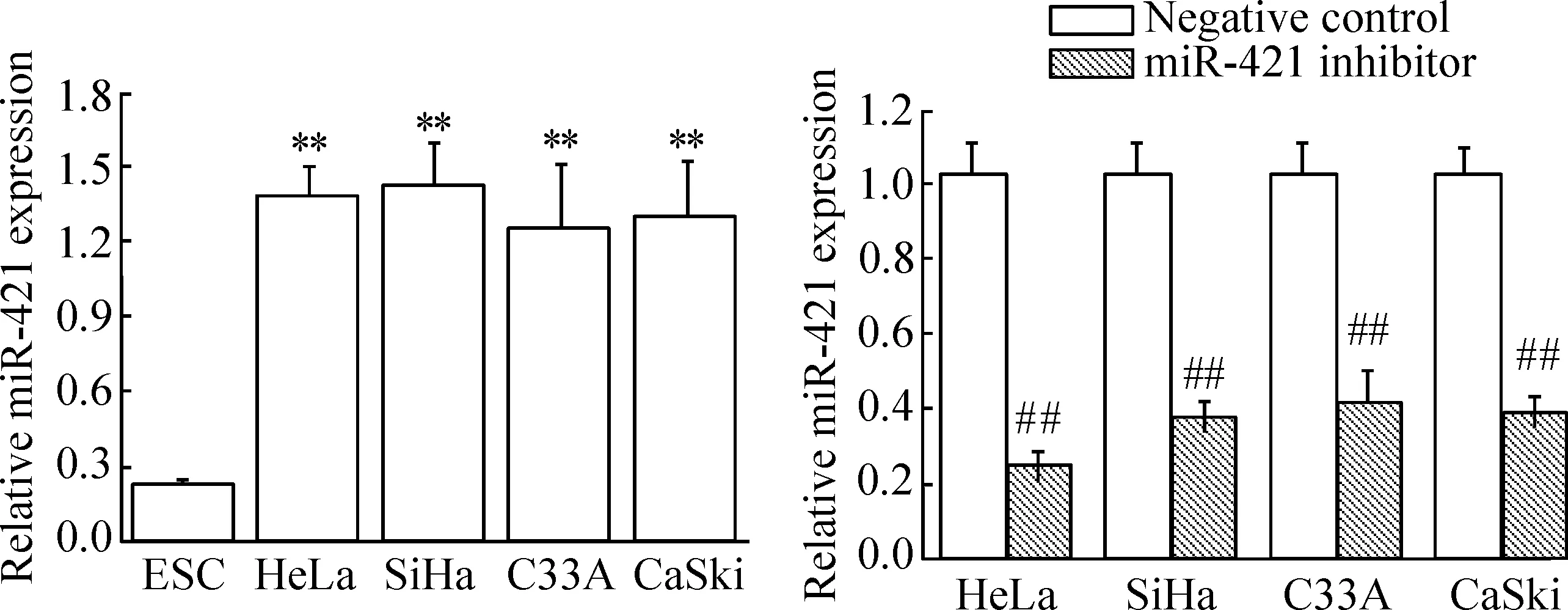
Figure 1.The level of miR-421 expression was detected by real-time PCR in the cervical cancer cells. Mean±SD.n=3.**P<0.01vsESC;##P<0.01vsnegative control.
图1 Real-time PCR检测宫颈癌细胞中miR-421的表达水平
2 电离辐射对低表达miR-421宫颈癌细胞活性的影响
如图2所示,随着辐射剂量的增加4株宫颈癌细胞活性逐渐降低;相同条件下,转染miR-421 inhibitor的宫颈癌细胞经不同剂量电离辐射后,细胞活性显著低于阴性对照组,其差异具有统计学意义(P<0.05)。这提示抑制miR-421的表达可提高宫颈癌细胞对电离辐射的敏感性。
3 电离辐射对低表达miR-421宫颈癌细胞LDH漏出率的影响
如图3所示,随着辐射剂量的增加,4株宫颈癌细胞中LDH漏出率逐渐降低;相同条件下,转染miR-421 inhibitor的宫颈癌细胞经不同剂量电离辐射后,LDH漏出率显著低于阴性对照组,其差异具有统计学意义(P<0.05)。结果提示抑制miR-421表达能抑制宫颈癌细胞增殖以及明显提高宫颈癌细胞对电离辐射敏感性。
4 电离辐射对低表达miR-421宫颈癌细胞凋亡的影响
如图4所示,5 Gy电离辐射能诱导4株宫颈癌细胞凋亡,HeLa、SiHa、C33A和CaSki细胞凋亡率分别为(24.7±3.3)%、(20.8±2.8)%、(19.9±3.0)%和(18.9±2.2)%;相同条件下,下调miR-421表达后HeLa、SiHa、C33A和CaSki细胞凋亡率分别为(46.1±5.5)%、(68.7±7.8)%、(56.1±6.5)%和(45.7±4.8)%,均显著低于阴性对照组,差异有统计学意义(P<0.05)。以上结果表明,抑制miR-421表达可促进电离辐射诱导的宫颈癌细胞凋亡。
Figure 2.The effect of various doses of ionizing radiation on the viability of cervical cancer cells with miR-421 low expression. Mean±SD.n=3.*P<0.05,**P<0.01vsnegative control.
图2 不同剂量电离辐射对低表达miR-421宫颈癌细胞活力的影响
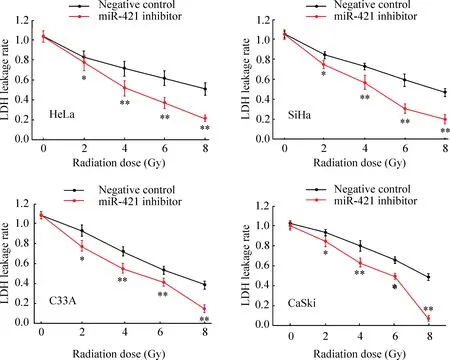
Figure 3.The effect of miR-421 down-regulation on the LDH leakage rate of cervical cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vsnegative control.
图3 下调miR-421表达对宫颈癌细胞LDH漏出率的影响
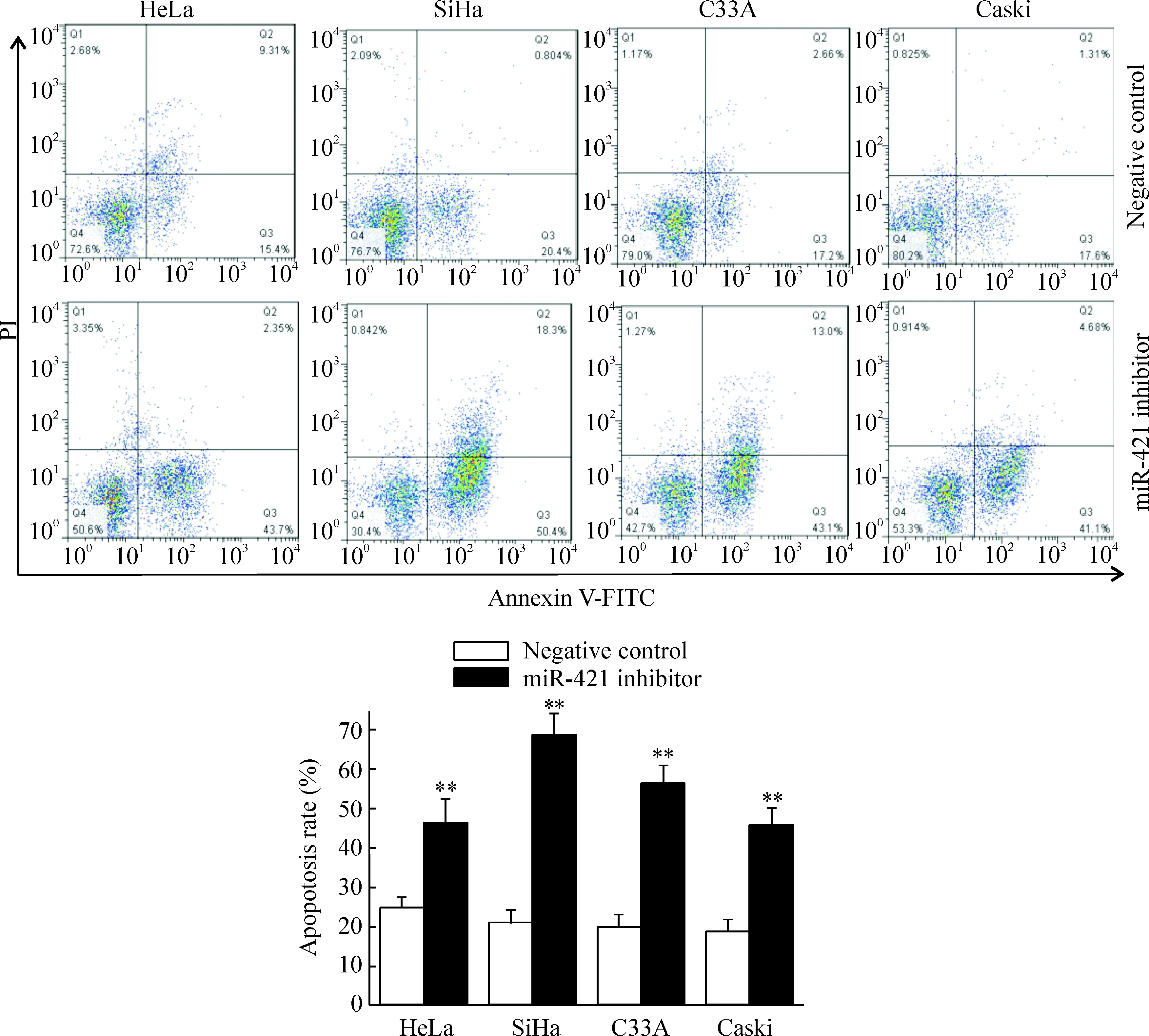
Figure 4.The effect of ionizing radiation on apoptosis of the cervical cancer cells with miR-421 low expression. Mean±SD.n=3.**P<0.01vsnegative control.
图4 电离辐射对低表达miR-421宫颈癌细胞凋亡的影响
5 电离辐射对miR-421低表达宫颈癌细胞凋亡通路的影响
Western blot结果显示,抑制miR-421表达促进caspase-9和PARP蛋白发生裂解,提示caspase-9通路被激活;促凋亡蛋白Bcl-2的表达水平显著增加,而抗凋亡蛋白Bax的表达水平显著降低,提示抑制miR-421表达激活细胞凋亡通路,电离辐射能增强miR-421下调介导的细胞凋亡通路活性,调控Bcl-2/Bax表达,从而促进细胞凋亡,见图5、表1。本研究结果提示,抑制miR-421表达可能通过激活细胞凋亡通路诱导细胞凋亡从而增强宫颈癌细胞对放疗的敏感性。
讨 论
宫颈癌细胞对放疗产生耐受严重影响患者预后和生存率,鳞状宫颈癌是宫颈癌的主要类型,80%的宫颈癌患者属于鳞状宫颈癌,这类肿瘤对放疗敏感,但是宫颈癌细胞群中的小部分恶性腺瘤或肿瘤干细胞对放疗耐受是导致肿瘤复发和预后不良的主要原因[15-16]。研究发现局部或远距离转移性宫颈癌患者对放疗产生抗性,导致预后不良[15]。因此,增强宫颈癌细胞的放疗敏感性是改善患者预后的重要手段,寻找和研发增强肿瘤细胞对放疗敏感性药物迫在眉睫。
大量研究表明microRNA异常表达与肿瘤细胞放疗耐受密切相关。研究发现let-7 miRNA过表达通过调控RAS和DNA损伤修复基因的表达增强肺癌细胞的放疗敏感性[17];miR-218低表达与宫颈癌恶性程度和预后不良相关[18]。因此,以micoRNA为靶点研发特异性增强宫颈癌细胞的放疗敏感性是宫颈癌治疗的热点研究领域。目前以miR-34为靶点的原发性肝癌靶向药物(NCT01829971)和以miR-122为靶点的慢性丙型肝炎靶向药物(NCT01872936)正在进行临床I期和II期试验[19-20]。研究发现miR-421在胃癌组织中的表达水平显著高于正常非癌旁组织,其在早期胃癌发生过程中扮演着重要作用[21]。本研究结果显示,miR-421在正常子宫内膜上皮细胞ESC中低表达,而在4株宫颈癌细胞系中高表达,提示miR-421在宫颈癌发生发展中具有重要作用。最新研究发现miR-421低表达与MCF-7/ADR细胞耐药密切相关[14]。本研究发现,低表达miR-421的宫颈癌细胞经电离辐射后细胞活性和LDH漏出率显著低于阴性对照组,提示抑制miR-421表达能增强宫颈癌细胞的放疗敏感性。

Figure 5.The effect of ionizing radiation on apoptosis pathway in the cervical cancer cells with miR-421 low expression.
图5 电离辐射对miR-421低表达宫颈癌细胞凋亡通路的影响
表1 电离辐射对miR-421低表达宫颈癌细胞中细胞凋亡相关蛋白表达的影响
Table 1.The effect of ionizing radiation on expression of apoptosis-associated proteins in the cervical cancer cells with miR-421 low expression (Mean±SD.n=3)
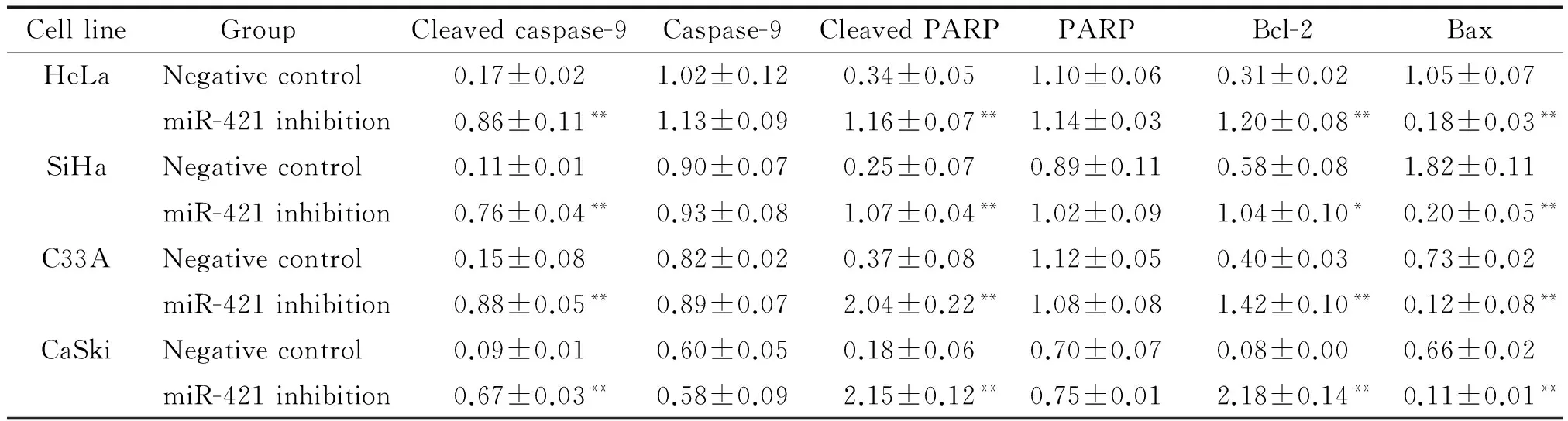
Cellline GroupCleavedcaspase-9Caspase-9CleavedPARPPARPBcl-2BaxHeLaNegativecontrol0.17±0.021.02±0.120.34±0.051.10±0.060.31±0.021.05±0.07miR-421inhibition0.86±0.11**1.13±0.091.16±0.07**1.14±0.031.20±0.08**0.18±0.03**SiHaNegativecontrol0.11±0.010.90±0.070.25±0.070.89±0.110.58±0.081.82±0.11miR-421inhibition0.76±0.04**0.93±0.081.07±0.04**1.02±0.091.04±0.10*0.20±0.05**C33ANegativecontrol0.15±0.080.82±0.020.37±0.081.12±0.050.40±0.030.73±0.02miR-421inhibition0.88±0.05**0.89±0.072.04±0.22**1.08±0.081.42±0.10**0.12±0.08**CaSkiNegativecontrol0.09±0.010.60±0.050.18±0.060.70±0.070.08±0.000.66±0.02miR-421inhibition0.67±0.03**0.58±0.092.15±0.12**0.75±0.012.18±0.14**0.11±0.01**
*P<0.05,**P<0.01vsnegative control.
电离辐射杀死肿瘤细胞可能的分子机制在于激活细胞凋亡通路诱导细胞凋亡[22]。凋亡相关基因表达异常或功能缺失导致细胞对外界刺激失敏,从而产生抗性。本研究发现miR-421低表达的宫颈癌细胞发生了细胞凋亡,经电离辐射后细胞凋亡率显著高于阴性对照组细胞,提示抑制miR-421表达能增强电离辐射介导的细胞凋亡,宫颈癌细胞对电离辐射的敏感性增加。死亡受体和线粒体介导的细胞凋亡是细胞凋亡主要的信号通路,caspase家族在细胞凋亡中具有重要作用,胞外死亡受体与相应配体结合、DNA损伤、缺氧及生长因子等激活caspase通路,导致细胞内重要蛋白质降解从而诱导细胞凋亡[23]。本研究发现miR-421低表达促进caspase-9和PARP蛋白降解,提示caspase通路被激活;经电离辐射后cleaved caspase-9和cleaved PARP蛋白表达水平显著升高,抗凋亡蛋白Blc-2表达升高,而促凋亡蛋白Bax表达降低,细胞凋亡率明显增高,提示抑制miR-421表达通过激活细胞凋亡通路诱导细胞凋亡,最终增强宫颈癌细胞对放疗敏感性。基于以上研究,以miR-421为靶向药物联合放疗有望成为miR-421高表达宫颈癌患者的新型治疗方案。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2011, 127(12):2893-2917.
[3] Ili CG, Brebi P, Lopez J, et al. Genotyping of human papillomavirus in cervical intraepithelial neoplasia in a high-risk population[J]. J Med Virol, 2011, 83(5):833-837.
[4] Esquela-Kerscher A, Slack FJ. Oncomirs: microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4):259-269.
[5] Li Z, Lei H, Luo M, et al. DNA methylation downregulated mir-10b acts as a tumor suppressor in gastric cancer[J]. Gastric Cancer, 2015, 18(1):43-54.
[6] Kajihara I, Jinnin M, Harada M, et al. miR-205 down-regulation promotes proliferation of dermatofibrosarcoma protuberans tumor cells by regulating LRP-1 and ERK phosphorylation[J]. Arch Dermatol Res, 2014, 306(4):367-374.
[7] Jiang K, Ren C, Nair VD. MicroRNA-137 represses Klf4 and Tbx3 during differentiation of mouse embryonic stem cells[J]. Stem Cell Res, 2013, 11(3):1299-1313.
[8] Yang W, Sun T, Cao J, et al. Downregulation of miR-210 expression inhibits proliferation, induces apoptosis and enhances radiosensitivity in hypoxic human hepatoma cellsinvitro[J]. Exp Cell Res, 2012, 318(8):944-954.
[9] 杜文霞, 姬 霞. miR-193b在宫颈癌中的表达与功能及其对化疗敏感性的影响[J]. 中国病理生理杂志, 2016, 32(7):1241-1245.
[10]Zhang CZ, Han L, Zhang AL, et al. MicroRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J]. BMC Cancer, 2010, 10:367.
[11]Hu H, Du L, Nagabayashi G, et al. ATM is down-regulated by N-Myc-regulated microRNA-421[J]. Proc Natl Acad Sci U S A, 2010, 107(4):1506-1511.
[12]Hao J, Zhang S, ZhouY, et al. MicroRNA 421 suppresses DPC4/Smad4 in pancreatic cancer[J]. Biochem Biophys Res Commun, 2011, 406(4):552-557.
[13]Zhou H, Xiao B, Zhou F, et al. MiR-421 is a functional marker of circulating tumor cells in gastric cancer patients[J].Biomarkers, 2012, 17(2): 104-110.
[14]Cui XY, Guo YJ, Yao HR. Analysis of microRNA in drug-resistant breast cancer cell line MCF-7/ADR[J]. J South Med Univ, 2008, 28(10):1813-1815.
[15]Powell ME. Modern radiotherapy and cervical cancer[J]. Int J Gynecol Cancer, 2010, 20(6):49-51.
[16]Gien LT, Beauchemin MC, Thomas G. Adenocarcinoma: a unique cervical cancer[J]. Gynecol Oncol, 2010, 116(7):140-146.
[17]Weidhaas JB, Babar I, Nallur SM, et al. MicroRNAs as potential agents to alter resistance to cytotoxic anticancer therapy[J]. Cancer Res, 2007, 67(23):11111-11116.
[18]邱 瑜, 黄建平, 周勤仙, 等. Hsa-miR-218靶向调控LASP1对宫颈癌HeLa细胞生长的影响[J]. 中国病理生理杂志, 2015, 31(9):1572-1577.
[19]Clinical Trials.gov. A multicenter phase I study of MRX34, microRNA miR-RX34 liposome injection[EB/OL]. (2016-09-26)[2016-11-01]. https://clinicaltrials.gov/ct2/show/NCT01829971.
[20]ClinicalTrials.gov. Miravirsen in combination with telaprevir and ribavirin in null responder to pegylated-interferon alpha plus ribavirin subjects with chronic hepatitis C virus infection[EB/OL].(2014-11-17)[2016-11-01]. https://clinicaltrials.gov/ct2/show/NCT01872936.
[21]Zhen J, Jun MG, Bing XX, et al. Increased expression of miR-421 in human gastric carcinoma and its clinical association[J]. Gastroenterol, 2010, 45(1):17-23.
[22]Shinomiya N. New concepts in radiation-induced apoptosis: premitotic apoptosis and post mitotic apoptosis[J]. J Cell Mol Med, 2001, 5(3):240-253.
[23]Creagh EM, Conroy H, Martin SJ. Caspase-activation pathways in apoptosis and immunity[J]. Immunol Rev, 2003, 193(2):10-21.
(责任编辑: 卢 萍, 罗 森)
Inhibition of miR-421 expression enhances radiosensitivity of cervical cancer cells
PAN Yu-lu1, WU Shu-xia1, SHI Cui-ge2, REN Xing-ye1
(1DepartmentofObstetrics&Gynecology,TheFifthPeople’sHospitalofJinan,Jinan250022,China;2LaboratoryofCellBiology,InstituteofFamilyPlanninginChina,Beijing100081,China.E-mail:wuyuanrenxingye@163.com)
AIM: To investigate the molecular mechanism of inhibition of miR-421 expression promoting radiosensitivity in the cervical cancer cells. METHODS: Cervical cancer lines HeLa, SiHa, C33A and CaSki were transfected with miR-421 inhibitor or negative control nucleotide using Lipofectamine 2000 kit, and the levels of miR-421 expression in the cervical cancer lines and endometrial epithelium cell line ESC were detected by real-time PCR. These cells with transfection were exposed to various doses of X-ray (0, 2, 4, 6 and 8 Gy). After 48 h, the cell viability, LDH leakage rate and apoptotic rate were measured respectively by MTT assay, ELISA and flow cytometry with Annexin V-FITC/PI staining. The protein levels of cleaved caspase-9, caspase-9, cleaved PARP, PARP, Bcl-2 and Bax were monitored by Western blot. RESULTS: Low miR-421 levels was found in the ESC cells, while high miR-421 levels were observed in the HeLa, SiHa, C33A and CaSki cells. The level of miR-421 in the cells transfected with miR-421 inhibitor was significantly lower than that in negative control group (P<0.05). The viability and LDH leakage rate of the cervical cancer cells with low miR-421 expression were notablely lower than those in negative control group, and the apoptotic rate at 72 h was remarkablely increased (P<0.05) under the same conditions. The results of Western blot indicated that, after exposure to ionizing radiation, the protein levels of cleaved caspase-9, cleaved PARP and Bcl-2 were significantly increased, while the protein level of Bax was significantly decreased in the cervical cancer cells with low miR-421 expression compared with negative control group (P<0.05). CONCLUSION: miR-421 is lowly expressed in the normal endometrial epithelial cells, but highly expressed in the cervical cancer cells. Down-regulation of miR-421 expression significantly inhibits the growth and enhances the radiosensitivity of cervical cancer cells at least partly via activating caspase-9 apoptosis pathway, thus promoting Bcl-2 and inhibiting Bax expression.
Cervical cancer; miR-421; Ionizing radiation; Radiosensitivity; Apoptosis
1000- 4718(2017)05- 0798- 07
2016- 11- 02
2017- 01- 16
山东省医药卫生资助项目(No. 2013WS0010)
R730.23
A
10.3969/j.issn.1000- 4718.2017.05.006
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0531-87197046; E-mail: wuyuanrenxingye@163.com

