阿帕替尼通过阻断VEGF通路增强胃癌放疗疗效*
李 彤, 翟二涛, 许丽霞, 黄霖琳, 彭 穗, 曾志荣
(中山大学附属第一医院消化内科, 广东 广州 510080)
阿帕替尼通过阻断VEGF通路增强胃癌放疗疗效*
李 彤, 翟二涛, 许丽霞, 黄霖琳, 彭 穗, 曾志荣△
(中山大学附属第一医院消化内科, 广东 广州 510080)
目的: 探讨血管内皮生长因子(VEGF)受体2酪氨酸激酶抑制剂阿帕替尼对胃癌细胞株SGC-7901放疗疗效的影响及其可能机制。方法: 试验设对照组、阿帕替尼组、单纯放疗组与联合组。CCK-8法检测细胞活力,流式细胞术分析细胞凋亡比例与细胞周期,免疫荧光染色观察细胞核内γ-H2AX的表达,Western blot法检测细胞增殖和凋亡相关蛋白。结果: 与阿帕替尼组或单纯放疗组相比,阿帕替尼联合X射线显著降低SGC-7901细胞的生长活力(P<0.01),增殖相关蛋白p-PLCγ1和p-ERK1/2的水平下降;细胞凋亡比例明显升高(P<0.01),凋亡相关蛋白PARP、cleaved caspase-9和cleaved caspase-3蛋白水平上调,Bcl-2表达下降;SGC-7901细胞核内γ-H2AX焦点淬灭延迟,表明阿帕替尼干扰放射线诱导的DNA双链断裂的修复;SGC-7901 G2期细胞比例显著增高(P<0.01)。结论: 阿帕替尼通过阻断VEGF通路增加胃癌细胞对X射线照射的敏感性。
胃癌; 放疗; 阿帕替尼; 血管内皮生长因子
胃癌是常见的恶性肿瘤之一[1],我国每年约有40万例新发胃癌,占全球的43%[2]。我国胃癌筛查没有韩国、日本等东亚国家普遍,多数患者确诊时属胃癌中晚期。胃癌的主要治疗方法包括外科手术、化疗、放疗。尽管化疗和手术治疗的方法在不断进步,但晚期胃癌患者的预后依然较差[3]。对于初期或手术后的病人,放疗是良好的局部区域控制治疗手段。研究表明,肿瘤组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)的高表达与放疗抵抗显著相关[4],靶向阻断VEGF信号通路有潜在放疗增敏的可能性。阿帕替尼(apatinib)是VEGF受体(VEGF receptor,VEGFR)2的酪氨酸激酶抑制剂,可靶向杀伤肿瘤细胞[5]。目前尚缺乏对阿帕替尼与胃癌放疗相关性的研究。本研究拟观察X线照射联合阿帕替尼干预对胃癌细胞的细胞周期、细胞活力及凋亡的影响,并初步探讨其分子信号通路,明确阿帕替尼是否可以增加胃癌对放疗的敏感性,为指导临床治疗提供新的理论依据。
材 料 和 方 法
1 细胞和主要试剂
人胃癌细胞株SGC-7901购自中科院上海细胞库。
RPMI-1640培养基、胎牛血清和胰蛋白酶(Gibco);PBS和RIPA细胞裂解液(Thermo Fisher Scientific);阿帕替尼(恒瑞);CCK-8试剂盒(Dojindo);抗磷脂酶C(phospholipase C,PLC)、p-PLCγ1、p-ERK1/2、ERK1/2、多聚(ADP-核糖)聚合酶[poly(ADP-ribose) polymerase,PARP]、caspase-3、caspase-9、Bcl-2、GAPDH抗体和相应 II 抗(Cell Signaling Technology);5% Triton、DAPI、山羊血清和多聚甲醛;兔抗人磷酸化组蛋白H2AX(γ-H2AX)抗体(Bioworld);羊抗兔IgG(Santa Cruz)。
2 主要方法
2.1 细胞培养及实验分组 SGC7901细胞置于含10% 胎牛血清的RPMI-1640培养基(含1×105U/L青霉素和100 mg/L链霉素)中,于37 ℃、5% CO2、饱和湿度条件下培养。实验设4个组别:对照(control)组不作处理;阿帕替尼组使用终浓度为5 mmol/L的阿帕替尼处理;单纯放疗组接受10 Gy X射线的电离辐射(ionizing radiation,IR);联合(combination)组使用5 mmol/L阿帕替尼处理24 h后接受10 Gy的X射线照射。
2.2 细胞活力的检测 对数生长期SGC7901细胞接种于96孔板,每孔含有1×104细胞悬液100 μL。使用含10% 胎牛血清的RPMI-1640培养基培养对照组和单纯放疗组细胞;在含10%胎牛血清的RPMI-1640培养基中加入终浓度为5 mmol/L的阿帕替尼培养阿帕替尼组和联合组细胞。培养板放在培养箱中培养过夜,单纯放疗组与联合组接受10 Gy的X线照射。向每孔加入10 μL CCK-8溶液(此后所有操作步骤均为避光进行),将培养板在培养箱内孵育3 h。用酶标仪测定在450 nm处的吸光度(A450)值,实验独立重复3次。
2.3 流式细胞术分析 对数生长期SGC7901细胞均匀接种于6孔板,每孔含5×105细胞。对照组和单纯放疗组常规培养,阿帕替尼组和联合组给予终浓度为5 mmol/L的阿帕替尼处理,24 h后单纯放疗组和联合组给予10 Gy X射线照射。各组细胞继续培养24 h。PBS轻柔冲洗各组SGC-7901细胞后,将各组样品一部分以PBS重悬为3×109/L单细胞悬液,每组取1 mL立即进行细胞凋亡检测;另一部分以70%冰乙醇重悬为3×109/L单细胞悬液,-20 ℃固定过夜,每组取1 mL进行细胞周期检测。实验独立重复3次。
2.4 Western blot法检测蛋白质 细胞处理同上。弃细胞培养液,用RIPA细胞裂解液∶PMSF(10∶1)的混合溶液提取细胞总蛋白,酶标仪测定蛋白浓度。配10%的SDS-PAGE胶,每组取总蛋白30 μg上样,恒压,浓缩胶 80 V、分离胶 100 V电泳100 min, 4 ℃、400 mA转膜120 min。裁膜,5% BSA室温封闭 1.5 h,加入I抗于4 ℃孵育过夜,1×TBST洗膜,加入相应 II 抗室温孵育2 h,1×TBST洗膜,曝光显影。实验独立重复3次。
2.5 免疫荧光技术 细胞处理同上。将单纯放疗组、联合组细胞分别在照射后1 h、6 h、12 h和24 h收集细胞,-20 ℃保存备用。全部细胞收集好后加3% H2O2室温孵育30 min,PBS振荡洗涤,多聚甲醛固定20 min,PBS振荡洗涤;0.5% Triton破膜,PBS振荡洗涤;滴加正常山羊血清封闭液,室温放置60 min;滴加适当稀释的兔抗人单克隆抗体,空白对照不加 I 抗,用PBS代替,室温放置2 h,PBS振荡洗涤;避光加入DAPI稀释的荧光 II 抗,37 ℃温箱、湿盒孵育60 min。PBS振荡洗涤,水溶性封片剂封片,激光共聚焦显微镜调至油镜下观察。
3 统计学处理
用SPSS 22.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用重复测量定量资料的方差分析,组间两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
结 果
1 阿帕替尼联合X线照射对SGC-7901细胞活力的影响
与阿帕替尼组或单纯放疗组相比,联合组显著降低SGC-7901细胞活力,差异具有统计学意义(P<0.01)。Western blot法检测进一步证实,与单纯放疗组或阿帕替尼组相比,联合组增殖相关蛋白p-PLCγ1和p-ERK1/2表达显著下降,见图1。
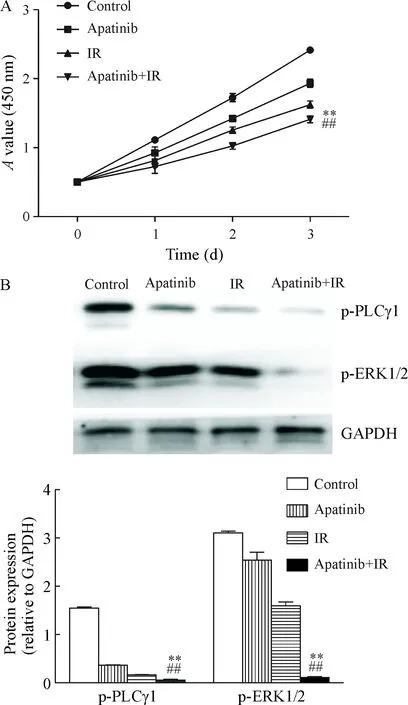
Figure 1.Apatinib and X-ray synergistically inhibited SGC-7901 cell viability. A:Avalues detected by CCK-8 assay; B: the protein levels of p-PLCγ1 and p-ERK1/2 determined by Western blot analysis. Mean±SD.n=3.**P<0.01vsIR group;##P<0.01vsapatinib group.
图1 阿帕替尼联合X线照射协同抑制SGC-7901细胞活力
2 阿帕替尼联合X线照射对SGC-7901细胞凋亡的影响
流式细胞术分析结果显示,对照组细胞的凋亡比例为4.081%,阿帕替尼组的细胞凋亡比例为10.42%,单纯放疗组的细胞凋亡比例为16.19%,联合组的细胞凋亡比例为27.49%。阿帕替尼组与单纯放疗组的细胞凋亡比例均高于对照组,而联合组的细胞凋亡比例明显高于阿帕替尼组与单纯放疗组,差异均有统计学意义(P<0.01)。联合组凋亡相关蛋白PARP、cleaved caspase-9和cleaved caspase-3表达水平上调,Bcl-2表达下降,见图2。
3 阿帕替尼联合X线照射对SGC-7901细胞中γ-H2AX表达的影响
我们前期研究发现,VEGF通路关键蛋白在SGC-7901胃癌细胞株中呈现高表达状态。应用10 Gy电离辐射剂量照射单纯放疗组与联合组SGC-7901细胞株,结果发现2组1 h时均可见γ-H2AX核内焦点出现。单纯放疗组随后核内焦点逐渐减少,12 h时接近照射前水平。而联合组核内焦点淬灭延迟,24 h未恢复照射前水平,见图3,表明联合组双链断裂(double-strand breaks,DSBs)修复过程被干扰。
4 阿帕替尼联合X线照射对SGC-7901细胞细胞周期影响
流式细胞术分析结果显示,对照组的G2期细胞比例为7.08%,阿帕替尼组的G2期细胞比例为12.13%,单纯放疗组的G2期细胞比例为23.49%,联合组的G2期SGC-7901细胞比例升高,为40.16%。与阿帕替尼组或单纯放疗组对比,联合组阻滞于G2期的细胞比例显著增高,差异均有统计学意义(P<0.01),见图4。
讨 论
胃癌根除术成功的患者因局部复发、远处转移风险高,5年生存率依然很低,放疗可明显减少淋巴引流区域复发,提高术后3年生存率和5年生存率[6-7]。对无远处转移(M0)的IV期胃癌患者实施放疗可以降低肿瘤分期、减小瘤体,从而降低手术难度、增加胃癌根除术的成功率。而伴有远处转移(M1)的IV期胃癌患者,放疗可缓解或治疗出血、狭窄、疼痛等症状[8]。对于初期或手术后的病人,放疗是一种良好的局部区域控制治疗。但一部分胃癌患者会发生放疗抵抗,导致放疗疗效不佳。胃周围重要器官对放射线的耐受性限制了射线剂量的提高,因此寻找可增强胃癌的放疗敏感性的药物或手段,对于胃癌的治疗有重要意义。
X射线用于肿瘤治疗的原理是其能够诱导细胞产生DNA双链断裂[9]。DSBs修复缺陷的细胞对放射线敏感性增加,DSBs修复蛋白高表达的细胞对射线耐受[10-11]。荧光标记的磷酸化组蛋白H2AX(γ-H2AX)是识别细胞内DSBs的有效标记物,细胞内残留γ-H2AX焦点数量代表了细胞对DSBs的修复能力,与细胞放射敏感性有密切关系[12]。研究显示,抑制VEGF信号通路可能减缓肿瘤细胞DSBs修复过程而增敏放疗[13]。在本研究中,与单纯放疗组相比,联合组细胞核内γ-H2AX荧光淬灭时间延迟,提示DSBs修复过程被干扰。其机制可能是放疗诱导DSBs形成,而阿帕替尼通过抑制VEGF信号通路来干扰DSBs修复,从而抑制肿瘤细胞增殖,实现增敏放疗。
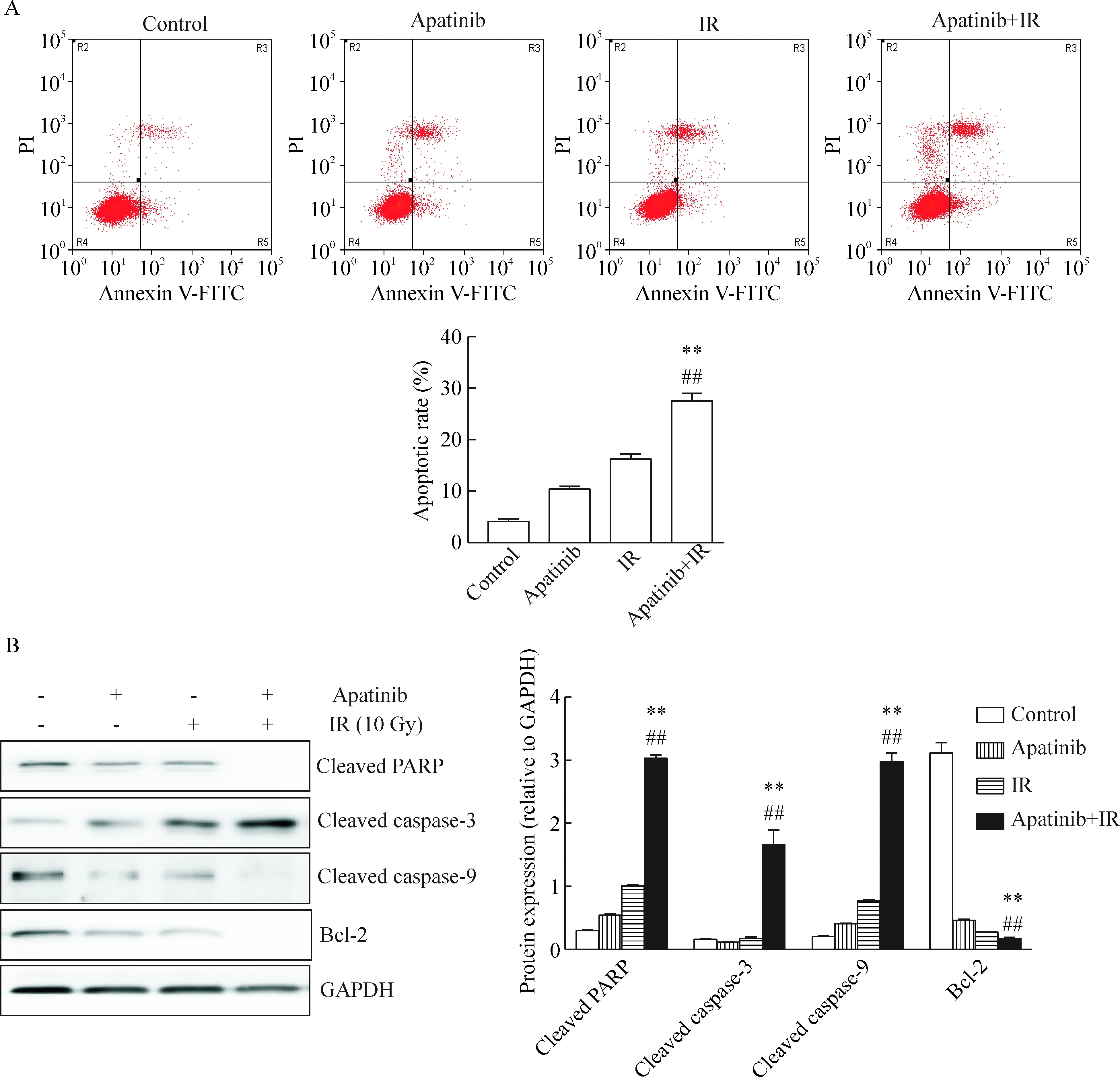
Figure 2.Combination of apatinib and X-ray induced SGC-7901 cell apoptosis. A: the apoptotic rate determined by flow cytometry; B: the protein levels of cell apoptosis biomarkers determined by Western blot analysis. Mean±SD.n=3.**P<0.01vsIR group;##P<0.01vsapatinib group.
图2 阿帕替尼联合X线照射通过线粒体途径诱导SGC-7901细胞凋亡
放疗会诱导VEGF、成纤维细胞生长因子2和血小板源性生长因子等促血管生长因子的表达[14],促进肿瘤血管生成,为肿瘤提供营养,抑制肿瘤血管生成可显著增敏放疗[15]。VEGF是很多实体肿瘤都分泌的调节血管形成最重要的信号分子,肿瘤组织中VEGF的高表达与放疗抵抗显著相关[4]。VEGFR包括VEGFR1、VEGFR2和VEGFR3[16]。VEGFR2与配体结合后,比其它受体更显著地增强激酶的活性,导致血管形成增强,微血管密度增大,血管内皮细胞增殖增强,与不良临床预后更相关[17]。阿帕替尼靶向抑制VEGFR2的酪氨酸激酶发挥杀伤肿瘤的作用[5],可显著延长一线或二线化疗失败的晚期胃癌患者的中位生存期与无进展生存期[18]。
目前认为细胞凋亡途径包括死亡受体通路介导的细胞凋亡和线粒体途径介导的细胞凋亡[19]。有研究显示,VEGF通路的激活可以抑制细胞凋亡,并通过PLC依赖的信号通路促进胃癌细胞增殖[20-21],而放疗过程中肿瘤细胞恢复增殖、凋亡信号传导途径中断,是肿瘤对放射不敏感又一重要机制[22]。阿帕替尼可通过阻滞VEGFR2-PLCγ1-ERK1/2信号通路抑制胃癌细胞增殖,并减少VEGF的分泌[21]。在整个细胞增殖周期中,G2/M期对放射损伤最为敏感。细胞周期阻滞于G2期的肿瘤细胞对放疗敏感性普遍高于阻滞在细胞周期其它阶段的肿瘤细胞[23]。有报道阿帕替尼可引起细胞周期抑制蛋白p21和p27的上调及cyclin B1和Cdc1的下调,阻滞细胞周期于G2/M期[24]。
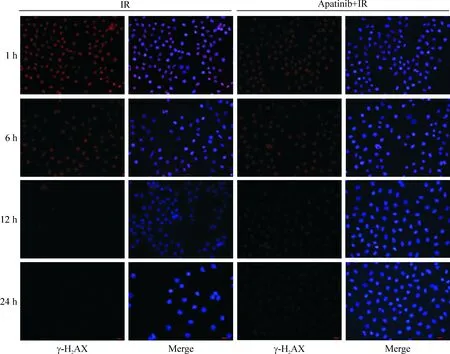
Figure 3.Detection of γ-H2AX expression by immunofluorescence cytochemistry. The combination group showed a delay of fluorescence quenching.
图3 免疫荧光观察阿帕替尼联合X射线组γ-H2AX核内焦点淬灭延迟
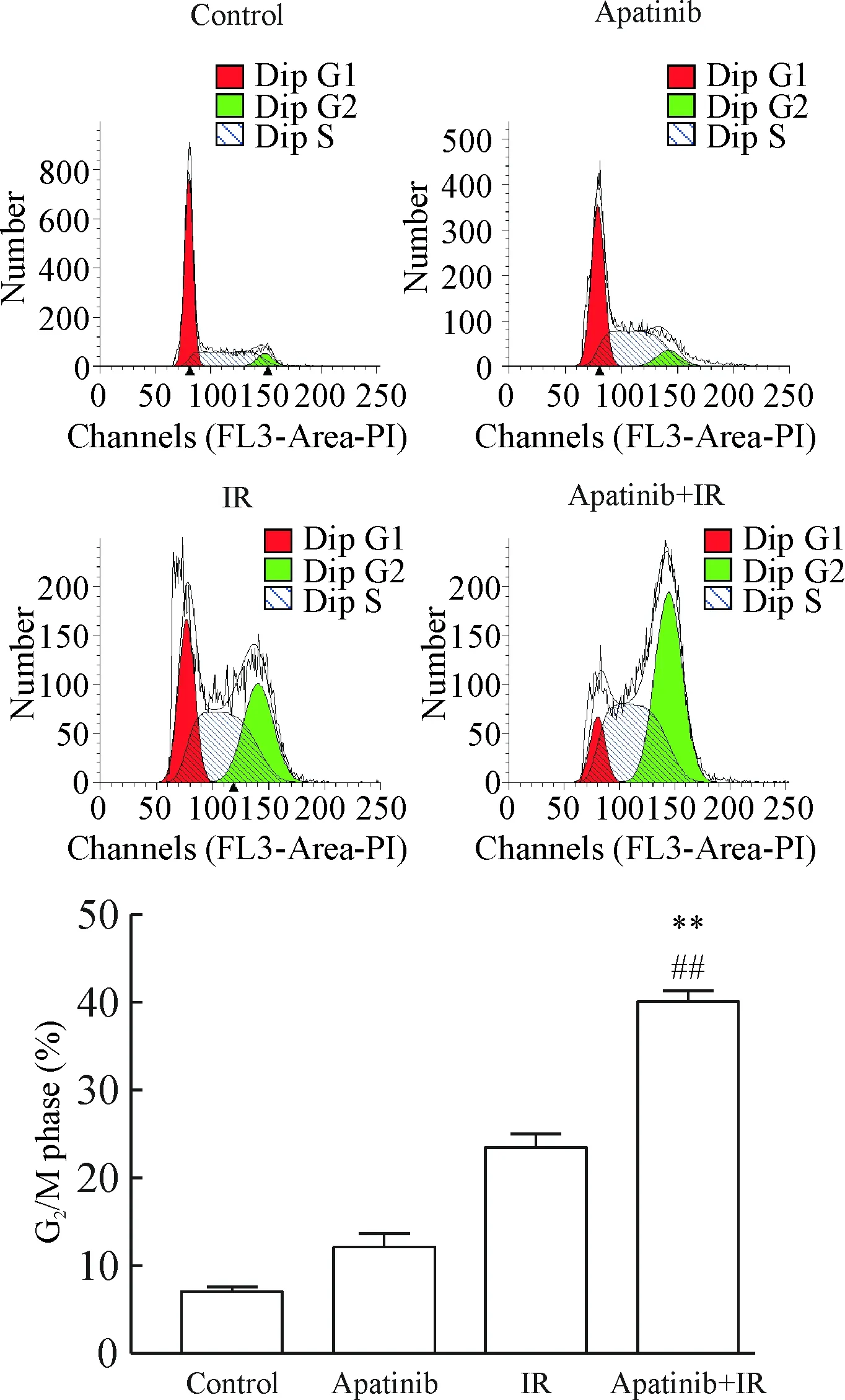
Figure 4.Apatinib combined with X-ray blocked cell cycle in the G2/M phase. Mean±SD.n=3.**P<0.01vsIR group;##P<0.01vsapatinib group.
图4 阿帕替尼联合X线照射使细胞周期阻滞于G2/M期
本研究发现,相对于阿帕替尼组或单纯放疗组,阿帕替尼联合X射线可显著提高SGC-7901细胞的凋亡比例,上调凋亡通路的标志物PARP、cleaved caspase-9和cleaved caspase-3蛋白水平,抑制抗凋亡蛋白Bcl-2表达,提示通过线粒体途径诱导细胞凋亡。此外,两者联合可协同增加对SGC-7901胃癌细胞的生长抑制作用,显著下调增殖相关蛋白p-PLC和p-ERK1/2的蛋白水平。阿帕替尼联合X线照射可使G2期细胞比例较明显增加,细胞周期阻滞于G2期,抑制肿瘤增殖,提高肿瘤细胞的放射敏感性。
基于本研究的初步探索,认为阿帕替尼可通过与VEGFR2结合,靶向阻断VEGF通路,从而抑制DSBs修复,降低放疗诱导的肿瘤血管形成效应,增加阻滞在G2期的胃癌细胞数目,抑制肿瘤增殖,诱导肿瘤凋亡,从而影响肿瘤组织对射线的敏感性,增强胃癌放疗的效应,可为临床胃癌实施放疗时用阿帕替尼增敏放疗提供理论依据。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12):2893-2917.
[3] Ueda T, Volinia S, Okumura H, et al. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis[J]. Lancet Oncol, 2010, 11(2):136-146.
[4] 刘阳云, 刘庚勋, 李正贤, 等. VEGF表达预测鼻咽癌放疗效应的价值[J]. 中国肿瘤,2014, 23(4):329-332.
[5] Scott AJ, Messersmith WA, Jimeno A. Apatinib: a promising oral antiangiogenic agent in the treatment of multiple solid tumors[J]. Drugs Today (Barc), 2015, 51(4):223-229.
[6] Yu JI, Lim do H, Ahn YC, et al. Effects of adjuvant radiotherapy on completely resected gastric cancer: a radiation oncologist’s view of the ARTIST randomized phase III trial[J]. Radiother Oncol, 2015, 117(1):171-177.
[7] Valentini V, Cellini F, Minsky BD, et al. Survival after radiotherapy in gastric cancer: systematic review and meta-analysis[J]. Radiother Oncol, 2009, 92(2):176-183.
[8] Izuishi K, Mori H. Recent strategies for treating stage IV gastric cancer: roles of palliative gastrectomy, chemotherapy, and radiotherapy[J]. J Gastrointestin Liver Dis, 2016, 25(1):87-94.
[9] Kuefner MA, Brand M, Engert C, et al. Radiation induced DNA double-strand breaks in radiology[J]. Rofo, 2015, 187(10):872-878.
[10]Kühne M, Riballo E, Rief N, et al. A double-strand break repair defect in ATM-deficient cells contributes to radiosensitivity[J]. Cancer Res, 2004, 64(2):500-508.
[11]Allal AS, Kahne T, Reverdin AK, et al. Radioresistance-related proteins in rectal cancer[J]. Proteomics, 2004, 4(8):2261-2269.
[12]Joist HE, Ahya SN, Giles K, et al. Differential effects of very high doses of doxercalciferol and paricalcitol on serum phosphorus in hemodialysis patients[J]. Clin Nephrol, 2006, 65(5):335-341.
[13]Shi L, Zhang S, Wu H, et al. MiR-200c increases the radiosensitivity of non-small-cell lung cancer cell line A549 by targeting VEGF-VEGFR2 pathway[J]. PLoS One, 2013, 8(10):e78344.
[14]Kleibeuker EA, Fokas E, Allen PD, et al. Low dose angiostatic treatment counteracts radiotherapy-induced tumor perfusion and enhances the anti-tumor effect[J]. Oncotarget, 2016, 7(47):76613-76627.
[15]Grifn RJ, Williams BW, Wild R, et al. Simultaneous inhibition of the receptor kinase activity of vascular endothelial, fibroblast, and platelet derived growth factors suppresses tumor growth and enhances tumor radiation response[J]. Cancer Res, 2002, 62(6):1702-1706.
[16]Glade-Bender J, Kandel JJ, Yamashiro DJ. VEGF blocking therapy in the treatment of cancer[J]. Expert Opin Biol Ther, 2003, 3(2):263-276.
[17]Roviello G, Ravelli A, Polom K, et al. Apatinib: A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J]. Cancer Lett,2016, 372(2):187-191.
[18]Li J, Qin S, Xu J, et al. Randomized, double-blind, placebo-controlled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016, 34(13):1448-1454.
[19] 邵 棋, 曹 斐, 李 梅, 等. Integrin β1对胃癌细胞 SGC7901 多药耐药性的影响[J]. 中国病理生理杂志, 2016, 32(12): 2233-2238.
[20]Peng H, Zhang Q, Li J, et al. Apatinib inhibits VEGF signaling and promotes apoptosis in intrahepatic cholangiocarcinoma[J]. Oncotarget, 2016, 7(13):17220-17229.
[21]Lin Y, Zhai E, Liao B, et al. Autocrine VEGF signaling promotes cell proliferation through a PLC-dependent pathway and modulates Apatinib treatment efficacy in gastric cancer[J]. Oncotarget, 2017, 8(7): 11990-12002.
[22]Kim JJ, Tannock IF. Repopulation of cancer cells during therapy: an important cause of treatment failure[J]. Nat Rev Cancer, 2005, 5(7):516-525.
[23]Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 59(4):928-942.
[24]Rahimi N. Vascular endothelial growth factor receptors: molecular mechanisms of activation and therapeutic potentials[J]. Exp Eye Res, 2006, 83(5):1005-1016.
(责任编辑: 林白霜, 罗 森)
Apatinib increases radiosensitivity of gastric cancer by inhibiting VEGF pathway
LI Tong, ZHAI Er-tao, XU Li-xia, HUANG Lin-lin, PENG Sui, ZENG Zhi-rong
(DepartmentofGastroenterology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:zengzhirong@vip.163.com)
AIM: To investigate radiosensitization effect of apatinib, a vascular endothelial growth factor (VEGF) receptor2 tyrosine kinase inhibitor, on human gastric carcinoma cell line SGC-7901 and its mechanism. METHODS: SGC-7901 cells were divided into control group, apatinib group, radiotherapy group and combination group. The cell viability was measured by CCK-8 assay. The changes of cell apoptosis and cell cycle were analyzed by flow cytometry. The protein levels of cell apoptosis biomarkers, such as PARP, cleaved caspase-9, cleaved caspase-3 and Bcl-2, and cell proliferation biomarkers, p-PLCγ1 and p-ERK1/2, were detected by Western blot. γ-H2AX expression was detected by immunofluorescence.RESULTS: Compared with apatinib group and radiation group, the cell viability was inhibited after treatment with both apatinib and X-ray (P<0.01). The protein levels of cell proliferation markers p-PLCγ1 and p-ERK1/2 were down-regulated. The cell apoptosis was enhanced (P<0.01). The protein levels of cell apoptosis makers such as PARP, cleaved caspase-9 and cleaved caspase-3 were up-regulated, while Bcl-2 was down-regulated. The disappearance of γ-H2AX foci in the nucleus was delayed, indicating that apatinib impaired the repair of radiation-induced DNA double-strand breaks. The proportion of G2phase was significantly increased (P<0.01). The combination treatment had more significant effect on SGC-7901 cells than treating with apatinib or radiotherapy alone. CONCLUSION: Apatinib increases the radiosensitivity of gastric cancer cells via blocking VEGF pathway.
Gastric carcinoma; Radiotherapy; Apatinib; Vascular endothelial growth factor
1000- 4718(2017)05- 0776- 06
2017- 01- 03
2017- 04- 06
国家自然科学基金资助项目(No. 81502079); 广州市科技计划项目(No. 201607010074)
R730.23; R735.2
A
10.3969/j.issn.1000- 4718.2017.05.002
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-87332200-8283; E-mail: zengzhirong@vip.163.com

