X线电离辐射通过上调c-Myc表达促进肺癌A549细胞上皮间质转化*
刘晓媛, 白丽红, 王冬辉, 林耿鹏, 杨惠玲, 郭禹标△
(中山大学 1附属第一医院呼吸内科, 2中山医学院病理生理教研室,广东 广州 510080)
X线电离辐射通过上调c-Myc表达促进肺癌A549细胞上皮间质转化*
刘晓媛1, 白丽红1, 王冬辉2, 林耿鹏1, 杨惠玲2, 郭禹标1△
(中山大学1附属第一医院呼吸内科,2中山医学院病理生理教研室,广东 广州 510080)
目的: 探讨电离辐射对肺癌A549细胞上皮间质转化(EMT)的影响及其可能机制。方法: 采用不同剂量(0 Gy、1 Gy、2 Gy、4 Gy和8 Gy)的X射线分别照射肺癌A549细胞不同时间,通过倒置显微镜观察X射线照射12 h、24 h和48 h时肺癌A549细胞形态的改变;Western blot检测X射线照射12 h与24 h时EMT相关蛋白vimentin、N-cadherin及E-cadherin和转录因子c-Myc的表达。结果: 照射后肺癌A549细胞轮廓不清,突起增多,边缘不规则且呈煎蛋样塌陷,以8 Gy X射线照射48 h时肺癌A549细胞上皮间质化形态最明显。与0 Gy照射剂量对照组相比,vimentin虽然于4 Gy剂量照射12 h时下调,但是处理24 h时各剂量照射组vimentin均表现为上调,其中2 Gy剂量照射组其上调最明显(P<0.01);与0 Gy照射剂量对照组相比,1 Gy、2 Gy及4 Gy照射组照射肺癌A549细胞24 h后其N-cadherin表达上调(P<0.05);各照射剂量对肺癌A549细胞E-cadherin表达没有显著影响。照射24 h后肺癌A549细胞c-Myc表达上调,以4 Gy剂量照射组表达差异最明显(P<0.01)。结论: X线电离辐射可能通过上调c-Myc表达促进肺癌A549细胞发生上皮间质转化。
电离辐射; 肺癌; 上皮间质转化
肺癌居癌症发病率之首,且据最新统计资料显示,全球2012年因肺癌死亡病例数为160万,中国肺癌患者死亡率为610.2/100 000,提示肺癌是癌症患者死亡的最主要原因[1-2]。肺癌通常起病隐匿确诊时患者多处晚期,因失去手术机会多被迫接受以放化疗为主的综合治疗方案,尤其是放射治疗,据报道超过50%肿瘤患者接受了放射治疗。虽然放射治疗是治疗晚期肿瘤的主要手段,但临床研究发现放疗可能增加口咽部肿瘤、膀胱癌及宫颈癌的远处转移[3-4],有体内外实验结果显示电离辐射(ionizing radiation,IR)包括X射线和γ射线等可促进肿瘤转移及介导自身放疗耐受[4],由此严重影响放疗的疗效,然而其确切的作用及其机制尚未完全阐明。近期研究表明上皮间质转化(epithelial-mesenchymal transition,EMT)参与肿瘤转移或介导IR耐受[5]。IR是否可诱导肿瘤细胞EMT,促进转移或介导IR耐受却不清楚。本研究拟采用倒置显微镜观察不同X线照射剂量及不同照射时间对肺癌A549细胞形态的改变,同时采用Western blot方法检测不同剂量X线照射不同时间对肺癌A549细胞EMT相关蛋白vimentin、N-cadherin及E-cadherin和转录因子c-myc的影响,旨在探讨X线照射对肺癌A549细胞EMT的影响及机制。
材 料 和 方 法
1 材料、试剂和仪器
肺癌A549细胞株由中山大学实验中心提供。
试剂DMEM细胞培养基、胎牛血清、胰酶及青霉素/链霉素溶液均购自Gibco;抗β-actin单克隆抗体(Sigma);抗E-cadherin多克隆抗体和抗vimentin多克隆抗体(ABclonal);抗N-cadherin单克隆抗体、抗c-Myc单克隆抗体和HRP标记的Ⅱ抗(CST);蛋白Marker(Thermo)。
X光生物学辐射仪(RAD SOURCE);全自动倒置显微镜(Zeiss);化学发光成像系统(Bio-Rad)。
2 方法
2.1 细胞培养 培养液为含10%胎牛血清、1%青霉素/链霉素双抗溶液的DMEM培养混合溶液,培养于5% CO2、37 ℃培养箱中。
2.2 X线电离辐射 取对数生长期A549细胞均匀接种在细胞培养皿中,使细胞分别接受X光生物学辐射仪0 Gy、1 Gy、2 Gy、4 Gy和8 Gy剂量的照射,照射12 h及24 h分别收取细胞蛋白进行Western blot分析。
2.3 显微镜观察形态学变化 将照射后细胞及对照细胞放置于全自动倒置显微镜上,相差显微镜观察照射后细胞及对照细胞形态学变化情况。
2.4 制备蛋白样品 贴壁细胞弃去培养液,PBS清洗2遍后加全细胞裂解液及蛋白酶抑制剂cocktail放置冰上15 min,使用细胞刮刮取细胞蛋白,收集至离心管后4 ℃、12 000 r/min离心,提取上清液;BCA试剂盒(Thermo)测定蛋白浓度,以PBS配平细胞蛋白浓度,添加SDS上样缓冲液后沸水加热10 min,冷却后备用。
2.5 Western blot实验 常规配置5%浓缩胶及10%分离胶,进行SDS-PAGE(恒压90 mV 30 min后更改为恒压130 mV 60 min);电泳后将凝胶转移至滤纸上,覆盖PVDF膜(Millipore)后装入转膜夹,湿法转膜(恒流200 mV 110 min),丽春红预染后剪切目标条带,用TBST(含吐温0.5%)洗膜5 min、3次,5%脱脂奶粉封闭后加 I 抗(β-actin,稀释度1∶10 000;E-cadherin稀释度1∶2 000;vimentin稀释度1∶2 000;N-cadherin稀释度1∶1 000;c-Myc稀释度1∶1 000)4 ℃孵育过夜,TBST(含0.5%吐温)漂洗后孵育HRP标记的Ⅱ抗,滴加ECL显色,化学发光成像系统采集结果,用ImageLab 3.0软件分析条带。
3 统计学处理
所有数据采用SPSS 13.0分析软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,多组间分析采用单因素方差分析,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
结 果
1 电离辐射对肺癌A549细胞形态的影响
为探讨IR是否可诱导A549发生EMT形态改变,本实验采用倒置显微镜观察0 Gy、2 Gy、4 Gy及8 Gy剂量X线照射12 h、24 h和48 h时肺癌A549细胞形态的改变。结果表明未经照射的肺癌A549细胞透亮、边缘整齐,呈椭圆多边形;经2 Gy、4 Gy及8 Gy X线照射后12 h时细胞体积变大、折光度下降,24 h时细胞突起增多,48 h时细胞轮廓不清、边缘呈煎蛋样塌陷,8 Gy照射48 h时细胞上皮间质转化的形态改变最明显,见图1。这提示电离辐射促使肺癌A549细胞由上皮型向间质型形态转化。
2 电离辐射对肺癌A549细胞间质蛋白及上皮蛋白表达的影响
为进一步从分子层面探讨IR是否可诱导肺癌A549细胞EMT,我们采用Western blot检测方法观察不同X线照射剂量对12 h和24 h时EMT相关蛋白vimentin表达的影响。结果表明,与0 Gy对照组相比,vimentin虽然于4 Gy照射12 h时下调,但是处理24 h时各剂量照射组vimentin表达均出现上调,其中2 Gy照射的上调作用最明显(P<0.01),见图2。

Figure 1.The effects of different doses of X-ray irradiation for different time on the morphology of lung cancer A549 cells (×400).
图1 不同剂量X线照射不同时间对肺癌A549细胞形态的影响
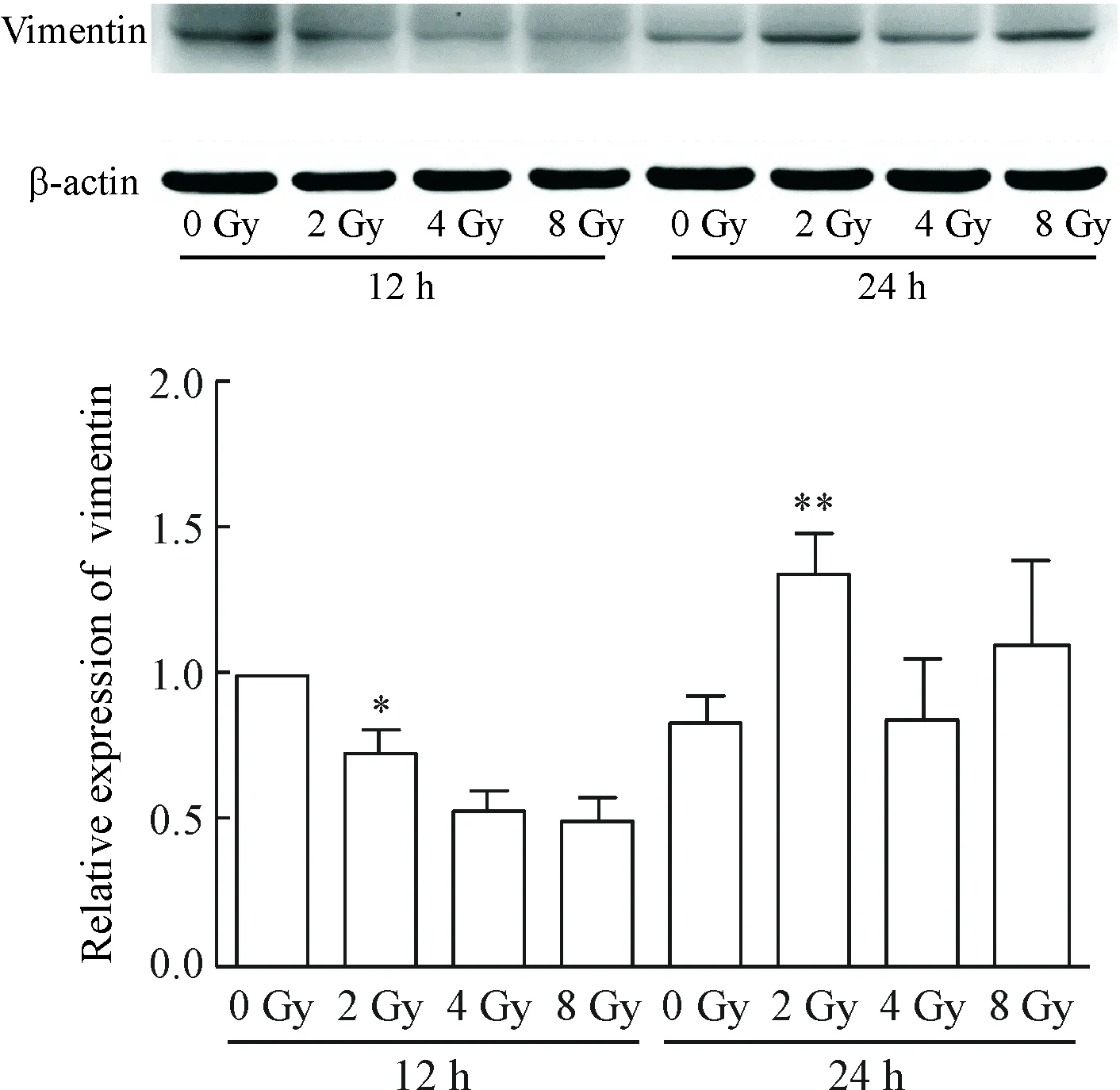
Figure 2.The effects of different doses of X-ray irradiation for different time on the expression of vimentin in the lung cancer A549 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 Gy.
图2 不同剂量X线照射不同时间对肺癌A549细胞vimentin表达的影响
进一步观察IR对肺癌A549细胞另一间质蛋白N-cadherin表达的影响,Western blot结果表明,与0 Gy照射组相比,1 Gy、2 Gy及4 Gy照射均上调N-cadherin表达(P<0.05),但各组别之间没有显著差异,见图3。
为观察IR是否能下调肺癌A549细胞上皮蛋白E-cadherin表达,我们同样采用Western blot方法检测0 Gy、1 Gy、2 Gy及4 Gy X线照射A549细胞24 h后E-cadherin的表达,结果表明,与0 Gy对照组相比,IR并不下调E-cadherin表达,见图4。

Figure 3.The effects of different doses of X-ray irradiation for 24 h on the expression of N-cadherin in the lung cancer A549 cells. Mean±SD.n=3.*P<0.05vs0 Gy.
图3 不同剂量X线照射肺癌A549细胞24 h对N-cadherin表达的影响

Figure 4.The effects of different doses of X-ray irradiation for 24 h on the expression of E-Cadherin in the lung cancer A549 cells. Mean±SD.n=3.
图4 不同剂量X线照射肺癌A549细胞24 h对E-cadherin表达的影响
3 电离辐射对肺癌A549细胞转录因子c-myc蛋白表达的影响
为进一步了解IR诱导肺癌A549细胞 EMT的可能机制,本实验通过Western blot检测方法观察不同剂量X线照射A549细胞12 h和24 h时对转录因子c-Myc表达的影响。结果显示,经2 Gy、4 Gy及8 Gy X线照射12 h和24 h后c-Myc表达均有不同程度的上调;其中,与0 Gy对照组相比,4 Gy照射24 h时c-Myc表达上调有统计学意义(P<0.01),见图5。这提示电离辐射可能通过上调c-Myc表达促进肺癌A549细胞上皮间质转化。
Figure 5.The effects of different doses of X-ray irradiation for different time on the expression of c-Myc in the lung cancer A549 cells. Mean±SD.n=3.**P<0.01vs0 Gy.
图5 不同剂量X线照射不同时间对肺癌A549细胞c-Myc表达的影响
讨 论
已有研究表明IR通过多种机制促进多种肿瘤的转移[4, 6-7]:如募集循环肿瘤细胞向其它脏器播散、增强肿瘤细胞变形能力使其易于转移、直接破坏肿瘤血管壁为肿瘤细胞提供转移窗口,和上调肿瘤转移相关分子表达。近期EMT与肺癌转移的相关性备受关注。Reka 等[8]研究显示EMT与肺癌淋巴结转移率呈正相关;Soltermann 等[9]研究显示EMT间质表型标记是进展期肺癌预后不良的预测因子;Yang 等[10]则通过动物实验证实EMT参与肺癌的转移,提示EMT与肺癌的转移及预后相关。同时已有研究结果显示IR通过诱导结肠癌、乳腺癌、鼻咽癌细胞EMT参与肿瘤转移[11-13],但IR是否诱导肺癌细胞EMT促进肺癌转移值得探讨。
本研究采用倒置显微镜及Western blot实验方法观察不同X线照射剂量照射不同时点对肺癌A549细胞EMT的影响,结果表明IR可诱导肺癌A549细胞由上皮型向间质型形态过渡,并与X线照射剂量及时间相关,照射剂量越大、时间越长则细胞形态学变化越明显;同时证实IR上调肺癌A549细胞vimentin和N-cadherin蛋白表达,结果提示IR可诱导肺癌A549细胞EMT,与其它学者的研究结果相似。Yang 等[14]采用γ射线照射A549及H460进行RNAseq组学分析,结果发现IR上调367个基因表达,其中包含参与细胞变形、介导EMT(如TGF-β/BMP、细丝蛋白及激活素等)等相关基因;同时结果提示IR影响肺癌A549细胞 EMT相关分子表达的影响,经照射后细胞不表达E-cadherin,而vimentin表达上调[15],但该实验采用的射线和辐射方式与本实验不同,且未探讨γ射线与EMT的时间、剂量效应之间的关系。Kang 等[16]为观察鼠李黄素及条叶蓟素逆转IR耐受效应,采用γ射线照射肺癌细胞株H1299及H460后成功构建IR耐受模型,构建模型时发现γ射线可诱导2株细胞发生EMT。另外,Gomez-Casal 等[17]证实γ射线通过诱导肺癌A549及H460干细胞生成介导IR耐受,仅通过荧光定量方法分析干细胞表型发现γ射线诱导其EMT。既往研究过于简化EMT为上皮标志物E-cadherin表达缺失而间质标志物vimentin及N-cadherin表达上调;但Nieto等[5]根据近期研究总结指出细胞可在表达上皮标志物的同时表达间质标志物,此中间状态称之为部分EMT。本研究结果发现电离辐射并不下调E-cadherin表达,支持Nieto 等的部分EMT理论。由此可见,本研究从形态及分子层次揭示X线电离辐射可诱导肺癌A549细胞上皮间质转化,并呈一定的时间及剂量依赖性。
本研究结果提示IR可诱导肺癌A549细胞EMT,但具体机制仍未明确。Chen 等[18]的动物研究表明c-Myc可通过介导EMT促进局部肿瘤病变,IR是否可上调c-Myc表达促进肺癌A549细胞EMT未有研究报道。本研究通过Western blot方法证实IR可上调肺癌A549细胞c-Myc表达,且与X线照射剂量及时间相关,这些结果与Popa 等[19]报道相似。Popa 等[19]观察胸腺干细胞对胸腺破坏的修复效应时发现γ射线上调c-Myc表达;Chang 等[20]报道c-Myc是干细胞标志物之一。这些表明X线电离辐射通过上调c-Myc促进肺癌A549细胞EMT,另外提示其可能与放疗耐受相关。
X线电离辐射诱导肺癌A549细胞发生上皮间质转化可能与肿瘤转移相关。波士顿大学医学院通过对比联合术前放疗与单纯手术治疗口咽部肿瘤患者预后的随机临床试验,结果提示放疗并不改善患者预后,同时还增加了远处转移[3];临床研究发现接受放疗的早期肺癌患者其远处及原位复发率分别为19%及10%,远处复发高于原位[21];Yang 等[10]研究表明EMT是肿瘤转移的重要机制,至于IR是否通过诱导肺癌EMT介导放疗耐受并促进转移,增加远处转移风险值得深入探讨。
[1] Chen W, Zheng R, Baade PD, et al.Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[2] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[3] Strong MS, Vaughan CW, Kayne HL, et al. A randomized trial of preoperative radiotherapy in cancer of the oropharynx and hypopharynx[J]. Am J Surg, 1978, 136(4):494-500.
[4] Vilalta M, Rafat M, Graves EE. Effects of radiation on metastasis and tumor cell migration[J]. Cell Mol Life Sci, 2016, 73(16):2999-3007.
[5] Nieto MA, Huang RY, Jackson RA, et al. EMT: 2016[J]. Cell, 2016, 166(1):21-45.
[6] Moncharmont C, Levy A, Guy JB, et al.Radiation-enhanced cell migration/invasion process: a review[J]. Cri Rev Oncology/Hematology, 2014, 92(2):133-142.
[7] von Essen CF. Radiation enhancement of metastasis: a review[J]. Clin Exp Metastasis, 1991, 9(2):77-104.
[8] Reka AK, Chen G, Jones RC, et al.Epithelial-mesenchymal transition-associated secretory phenotype predicts survival in lung cancer patients[J]. Carcinogenesis, 2014, 35(6):1292-1300.
[9] Soltermann A, Tischler V, Arbogast S, et al. Prognostic significance of epithelial-mesenchymal and mesenchymal-epithelial transition protein expression in non-small cell lung cancer[J]. Clin Cancer Res, 2008, 14(22):7430-7437.
[10]Yang YA, Ahn YH, Chen YL, et al. ZEB1 sensitizes lung adenocarcinoma to metastasis suppression by PI3K antagonism[J]. J Clin Invest, 2014, 124(6):2696-2708.
[11]Yuan WW, Yuan Y, Zhang T, et al.Role of Bmi-1 in re-gulation of ionizing irradiation-induced epithelial-mesenchymal transition and migration of breast cancer cells[J]. PLoS One, 2015, 10(3):e0118799.
[12]Diao WL, Luo L, Luo Q. Effect of X-ray irradiation on epithelial-mesenchymal transition of colorectal cancer SW480 cells[J]. J Biol Regul Homeost Agents, 2016, 30(2):553-558.
[13]He EH, Pan F, Li GC, et al. Fractionated ionizing radiation promotes epithelial-mesenchymal transition in human esophageal cancer cells through PTEN deficiency-mediated Akt activation[J]. PLoS One, 2015, 10(5):e0126149.
[14]Yang HJ, Kim N, Seong KM, et al.Investigation of radiation-induced transcriptome profile of radioresistant non-small cell lung cancer A549 cells using RNA-seq[J]. PLoS One, 2013, 8(3):e59319.
[15]Youn H, Son B, Kim W, et al.Dissociation of MIF-rpS3 complex and sequential NF-κB activation is involved in IR-induced metastatic conversion of NSCLC[J]. J Cell Biochem, 2015, 116(11):2504-2516.
[16]Kang J, Kim E, Kim W, et al.Rhamnetin and cirsiliol induce radiosensitization and inhibition of epithelial-mesenchymal transition (EMT) by miR-34a-mediated suppression of Notch-1 expression in non-small cell lung cancer cell lines[J]. J Biol Chem, 2013, 288(38):27343-27357.
[17]Gomez-Casal R, Bhattacharya C, Ganesh N, et al. Non-small cell lung cancer cells survived ionizing radiation treatment display cancer stem cell and epithelial-mesenchymal transition phenotypes[J]. Mol Cancer, 2013, 12:13.
[18]Chen CH, Lin DS, Cheng CW, et al.Cdc6 cooperates with c-Myc to promote genome instability and epithelial to mesenchymal transition EMT in zebrafish[J]. Oncotarget, 2014, 5(15):6300-6311.
[19]Popa I, Zubkova I, Medvedovic M, et al. Regeneration of the adult thymus is preceded by the expansion of K5+K8+epithelial cell progenitors and by increased expression of Trp63, cMyc and Tcf3 transcription factors in the thymic stroma[J]. Int Immunol, 2007, 19(11):1249-1260.
[20]Chang QS, Chen BL, Thakur C, et al. Arsenic-induced sub-lethal stress reprograms human bronchial epithelial cells to CD61 cancer stem cells[J]. Oncotarget, 2014, 5(5):1290-1303.
[21]Senthi S, Lagerwaard FJ, Haasbeek C, et al.Patterns of disease recurrence after stereotactic ablative radiotherapy for early stage non-small-cell lung cancer: a retrospective analysis[J]. Lancet Oncol, 2012, 13(8):802-809.
(责任编辑: 陈妙玲, 罗 森)
X-ray ionizing radiation up-regulates c-Myc expression and promotes epithelial-mesenchymal transition in lung cancer cell line A549
LIU Xiao-yuan1, BAI Li-hong1, WANG Dong-hui2, LIN Geng-peng1, YANG Hui-ling2, GUO Yu-biao1
(1DepartmentofRespiratoryMedicine,TheFirstAffiliatedHospital,2DepartmentofPathophysiology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:guoyubiao@hotmail.com)
AIM: To investigate the effect of ionizing radiation on epithelial-mesenchymal transition in lung cancer cell line A549 and its possible mechanism.METHODS: The lung cancer A549 cells were irradiated with different doses (0 Gy, 1 Gy, 2 Gy, 4 Gy and 8 Gy) of X-ray for different time. The morphological changes of the cells were observed under inverted microscope at time points of 12 h, 24 h and 48 h. The expression of vimentin, N-cadherin, E-cadherin and transcription factor c-Myc was detected by Western blot at the time points of 12 h and 24 h.RESULTS: After ionizing radiation, the contours of the A549 cells were unclear, the protrusions increased, and the edges were irregular, with fried egg-like collapses. The mesenchymal morphology of the A549 cells was most obvious after irradiation at 8 Gy for 48 h. Compared with 0 Gy irradiation group, the expression of vimentin was down-regulated seemingly 12 h after irradiation, but up-regulated in 2 Gy, 4 Gy and 8 Gy irradiation groups for 24 h, and the most obvious effect was observed in 2 Gy irradiation group (P<0.01). Compared with 0 Gy irradiation group, the expression of N-cadherin was up-regulated in 1 Gy, 2 Gy and 4 Gy irradiation groups for 24 h (P<0.05), while the expression of E-cadherin was not influenced. The up-regulation of vimentin expression in lung cancer cell line A549 was positively correlated with c-Myc expression. CONCLUSION: Ionizing radiation may promotes epithelial-mesenchymal transition in the lung cancer cell line A549 by up-regulating the c-Myc expression.
Ionizing radiation; Lung neoplasms; Epithelial-mesenchymal transition
1000- 4718(2017)05- 0788- 05
2017- 01- 06
2017- 04- 10
国家自然科学基金资助项目(No. 81502492); 广东省自然科学基金资助项目(No. 2016A030313839)
R363.1+2; R730.23
A
10.3969/j.issn.1000- 4718.2017.05.004
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-87333133; E-mail: guoyubiao@hotmail.com

