IL-19及其受体与慢性鼻-鼻窦炎组织重塑的相关性研究*
李 霞, 常利红, 黄子真, 王志远, 陈贤珍, 王 君, 张革化
(中山大学附属第三医院耳鼻咽喉头颈外科, 广东 广州 510630)
IL-19及其受体与慢性鼻-鼻窦炎组织重塑的相关性研究*
李 霞, 常利红, 黄子真, 王志远, 陈贤珍, 王 君, 张革化△
(中山大学附属第三医院耳鼻咽喉头颈外科, 广东 广州 510630)
目的: 探讨白细胞介素19(interleukin-19,IL-19)及其受体 (IL-20R1/IL-20R2)在不同类型慢性鼻-鼻窦炎[慢性鼻-鼻窦炎伴鼻息肉 (chronic rhinosinusitis with nasal polyps,CRSwNP)和慢性鼻-鼻窦炎不伴鼻息肉(chronic rhinosinusitis without nasal polyps,CRSsNP)]患者中表达的差异,并分析其与慢性鼻-鼻窦炎组织重塑的相关性。方法: 研究共分3组:CRSwNP组(30例)、CRSsNP组(15例)和对照组(鼻中隔偏曲患者15例)。实时荧光定量PCR检测IL-19及其受体(IL-20R1/IL-20R2)和组织重塑因子基质金属蛋白酶(MMP)-2、MMP-9、金属蛋白酶组织抑制物(TIMP)-1的 mRNA相对表达量;免疫组化检测IL-19及其受体的蛋白表达量;ELISA检测MMP-9、TIMP-1的蛋白表达量。结果: CRSwNP组IL-19、IL-20R1、IL-20R2和MMP-9的mRNA和蛋白表达量高于CRSsNP组和对照组(P<0.05),CRSsNP组TIMP-1的mRNA和蛋白的表达量均高于CRSwNP组和对照组 (P<0.05); MMP-2的mRNA和蛋白的表达量在各组无显著差异。CRSwNP组IL-19、IL-20R1和IL-20R2均与MMP-9的mRNA相对表达量呈正相关(P<0.05);IL-19及其受体与TIMP-1的mRNA相对表达量无明显相关。结论: IL-19及其受体的mRNA在CRSwNP中高表达,且与MMP-9 mRNA表达呈正相关,提示二者可能存在交互作用,可能参与慢性鼻-鼻窦炎的组织重塑。
慢性鼻-鼻窦炎; 组织重塑; 白细胞介素19; 基质金属蛋白酶9; 金属蛋白酶组织抑制物1
慢性鼻-鼻窦炎(chronic rhinosinusitis,CRS)是鼻腔及鼻窦的慢性炎性疾病,其发病与多种因素相关,机制复杂。目前临床上将CRS分为慢性鼻-鼻窦炎伴鼻息肉(chronic rhinosinusitis with nasal polyps,CRSwNP)和慢性鼻-鼻窦炎不伴鼻息肉(chronic rhinosinusitis without nasal polyps,CRSsNP) 2种类型[1]。研究认为不同类型CRS的炎症反应类型及组织重塑特性不同:CRSwNP以假性囊肿形成、炎症细胞浸润和细胞外基质(extracellular matrix,ECM)合成降低为特征;CRSsNP则以间质纤维化、胶原沉积和ECM合成增加为特征[2]。ECM的合成和降解失衡是决定CRS病变性质和预后的重要因素。基质金属蛋白酶(matrix metalloproteinases,MMPs)和金属蛋白酶组织抑制物(tissue inhibitor of metalloproteinases,TIMPs)是调节ECM平衡的主要因子,MMPs/TIMPs失衡可能是导致组织重塑的机制之一[3]。新近研究发现,IL-19在多种慢性炎症性及自身免疫性疾病中表达,发挥调节炎症和免疫的作用,并最终影响组织重塑[4-6]。然而目前国内外关于IL-19及其受体在CRS中的研究较少,其与组织重塑及MMPs、TIMPs间的关系亦不明确。因此,本研究旨在观察IL-19及其受体与CRS组织重塑的关系,为进一步探讨CRS发病机制提供实验资料。
材 料 和 方 法
1 标本采集和处理
标本采自于2013年7月~2015年1月在我科住院的患者,研究组45例CRS,其中CRSwNP 30例(男21例,女9例;年龄17~75岁),CRSsNP 15例(男9例,女6例;年龄26~71岁);对照组15例,为同期住院行鼻中隔手术的患者(男11例,女4例;年龄19~57岁);各组患者年龄及性别构成比差异无统计学意义。术中采集CRSwNP组的息肉组织,CRSsNP组的窦口鼻道复合体黏膜,对照组下鼻甲黏膜。排除标准:(1)有下列疾病患者:自身免疫性疾病、阿司匹林不耐受三联征,原发性纤毛运动功能障碍和囊性纤维化;(2)有下列药物近期用药史患者:术前1个月内使用抗菌药物、糖皮质激素类药物治疗。所有患者均签署知情同意书。
新鲜标本离体后用生理盐水清洗表面的黏液和血渍,分为3份,2份置于-80℃冻存;另一份用10%甲醛溶液固定。
2 主要仪器和试剂
荧光定量PCR仪(ABI7500);生物显微镜(Leica);酶标仪(Thermo);TRIzol(Invitrogen);逆转录试剂盒、SYBR定量 PCR 试剂盒(TaKaRa);羊抗人IL-19(Santa Cruz);鼠抗人IL-20R1(R&D);兔抗人IL-20R2(Abcam); HRPⅡ抗(Bioworld);山羊血清(北京博奥森公司);兔血清(NQBB);二氨基联苯胺(diaminobenzidine,DAB)显色剂(北京中杉金桥公司);MMP-9和TIMP-1 ELISA试剂盒(武汉华美公司);蛋白酶抑制剂(MCE);所用引物由英潍捷基公司合成,具体序列见表1。
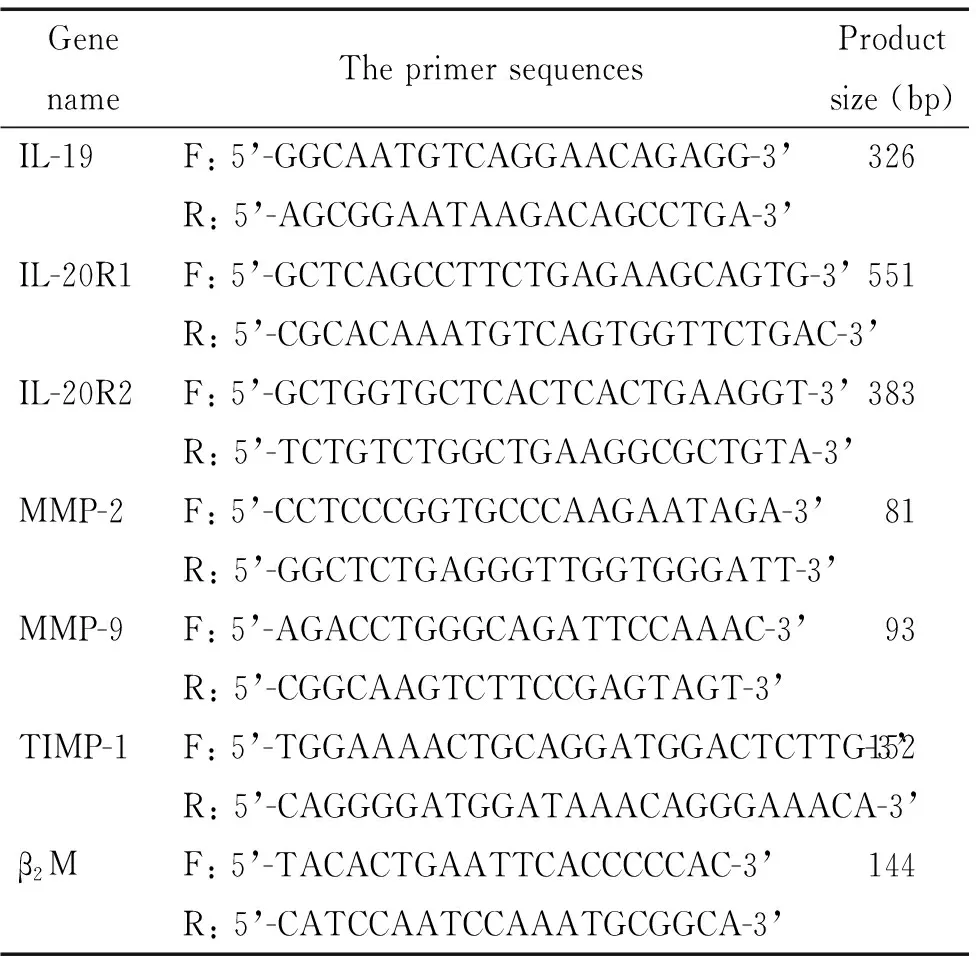
表1 引物序列表
F: forward; R: reverse.
3 主要方法
3.1 RT-qPCR检测组织中IL-19、IL-20R1、IL-20R2、MMP-9、MMP-2和TIMP-1的mRNA相对表达量 TRIzol法提取总RNA,反转录为cDNA。10 μL PCR反应体系:cDNA 1μL,引物0.2 μmol/L,ROX DyeⅡ,SYBR Premix Ex Taq。IL-19、IL-20R1和IL-20R2反应条件:95 ℃ 30 s; 95 ℃ 15 s, 55 ℃ 30 s, 72 ℃ 1 min,45个循环;MMP-2、MMP-9和TIMP-1反应条件:95 ℃ 30 s; 95 ℃ 15 s, 60 ℃ 1 min, 72 ℃ 1 min, 45个循环。以2-ΔΔCt法计算相对表达量。
3.2 免疫组织化学染色 S-P二步法进行染色。新鲜组织经10%甲醛溶液固定、石蜡包埋后连续4 μm切片。60 ℃烤片1 h,常规二甲苯、乙醇脱蜡复水、枸橼酸盐溶液高压热修复5 min,3% H202阻断内源性过氧化物酶活性。Ⅰ抗4 ℃孵育过夜(羊抗人IL-19抗体1∶100,鼠抗人IL-20R1抗体1∶20,兔抗人IL-20R2抗体1∶50),Ⅱ抗37 ℃孵育1 h, DAB显色,显微镜下观察染色至适度终止。苏木素复染,梯度乙醇溶液脱水,二甲苯溶液透明,封片。
免疫组织化学染色结果判定标准: 2位病理学专家双盲独立评分。100倍显微镜下按切片染色强度评分:无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分。400倍显微镜下随机选取5个上皮细胞富集的视野,每个视野计数100个细胞,计算阳性染色细胞百分比,按5个视野阳性细胞百分比的平均值计分:0为0分, 1%~25%为1分, 26%~50%为2分, 51%~75%为3分, 76%~100%为4分。将以上2项得分相加(总分0~7分),<3分为(-),3分为(+),4~5分为(++),6~7分为(+++)。
3.3 ELISA 液氮中研磨组织成粉状,每100 mg组织干粉加1 mL蛋白提取缓冲液(含蛋白酶抑制剂的PBS),4 ℃ 10 000 r/min 离心组织匀浆液10 min后取上清,置于-80℃冰箱保存待用。ELISA检测组织匀浆上清中MMP-9和TIMP-1的蛋白含量,绘制标准曲线,计算被测蛋白的浓度。
4 统计学处理
采用SPSS 20.0进行分析。多组比较采用Kruskal-WallisH检验,置信区间采用Bonferroni校正;两两比较采用Mann-WhitneyU检验。相关性分析采用Spearman检验。以P<0.05为差异有统计学意义。
结 果
1 IL-19及其受体(IL-20R1/IL-20R2)的mRNA及蛋白表达水平
CRSwNP组IL-19、 IL-20R1和IL-20R2的mRNA表达水平高于CRSsNP组和对照组(P<0.05),见图1。
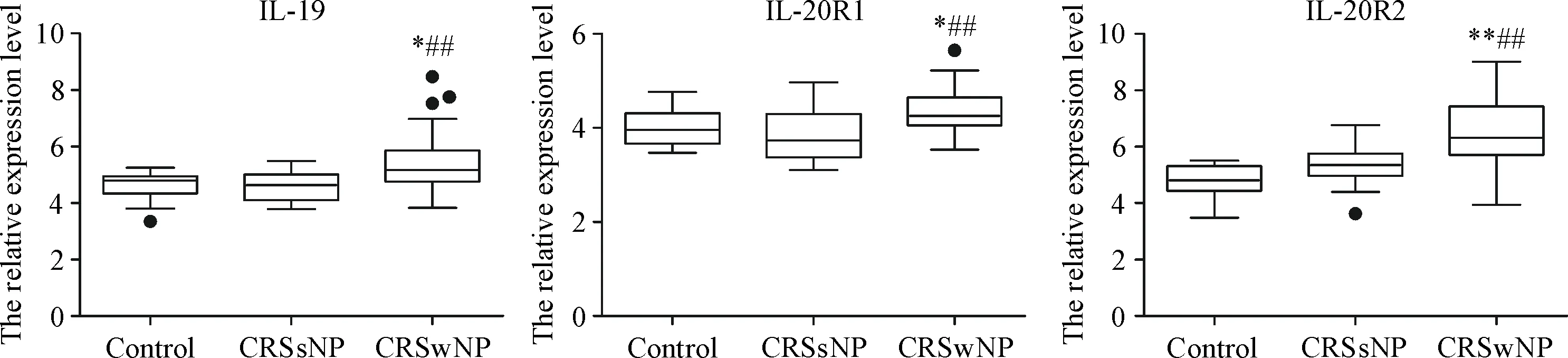
Figure 1.The mRNA expression of IL-19, IL-20R1 and IL-20R2 in human CRS and control tissues. CRSwNP: chronic rhinosinusitis with nasal polyps (n=30); CRSsNP: chronic rhinosinusitis without nasal polyps (n=15); control:n=15.*P<0.05,**P<0.01vscontrol;##P<0.01vsCRSsNP.
图1 CRS和对照组IL-19及其受体(IL-20R1/IL-20R2)的mRNA表达水平
IL-19、IL-20R1和IL-20R2蛋白均主要表达在鼻黏膜上皮细胞和黏膜下炎症细胞中,表达位置具有一致性。IL-19、IL-20R1和IL-20R2阳性染色主要定位于细胞质和细胞膜,且CRSwNP组阳性率高于CRSsNP组和对照组,见图2。
2 组织重塑因子(MMP-2、MMP-9和TIMP-1)mRNA及蛋白的表达水平
CRSwNP组MMP-9的mRNA表达水平高于CRSsNP组和对照组(P<0.05);CRSsNP组TIMP-1的mRNA表达水平高于CRSwNP组和对照组(P<0.05);MMP-2 mRNA在3组间的表达无显著差异,见图3。
CRSwNP组MMP-9蛋白水平高于CRSsNP组和对照组(P<0.05), CRSsNP组TIMP-1蛋白水平高于CRSwNP组和对照组(P<0.05),见图4。
3 IL-19及其受体(IL-20R1/IL-20R2)与组织重塑因子的相关性分析
在CRSwNP中,IL-19及其受体(IL-20R1/IL-20R2) mRNA表达水平与MMP-9 mRNA表达水平呈正相关(P<0.05);CRSsNP和对照组中,IL-19及其受体与MMP-9 mRNA无明显相关。IL-19及其受体(IL-20R1/IL-20R2)mRNA表达水平与TIMP-1 mRNA表达水平无明显相关,见图5。
讨 论
CRS是鼻腔及鼻窦的异质性慢性炎性疾病,发病机制至今尚不明确,以往研究认为该类疾病的发生可能是多种致病因素参与、多种信号通路调节的结果[7]。组织重塑是气道慢性炎症的主要病理特征,是决定 CRS 病变性质和预后的重要因素。MMPs是以细胞外基质蛋白为主要底物的一组钙离子活化锌离子依赖的肽链内切酶总称。TIMPs是MMPs的天然组织抑制物,TIMP-1可以抑制所有MMPs的活性。MMPs和TIMPs之间的平衡在细胞外基质和基底膜成分更新和稳态维持的过程中发挥重要作用,是调节组织重塑的关键因素之一[3]。与以往对CRS组织上清的研究[8]一致,本研究发现在mRNA和蛋白水平,CRSwNP组中MMP-9表达明显高于CRSsNP和对照组,TIMP-1在CRSsNP组中表达明显高于CRSwNP和对照组,提示MMP-9/TIMP-1参与了CRS的组织重塑过程。
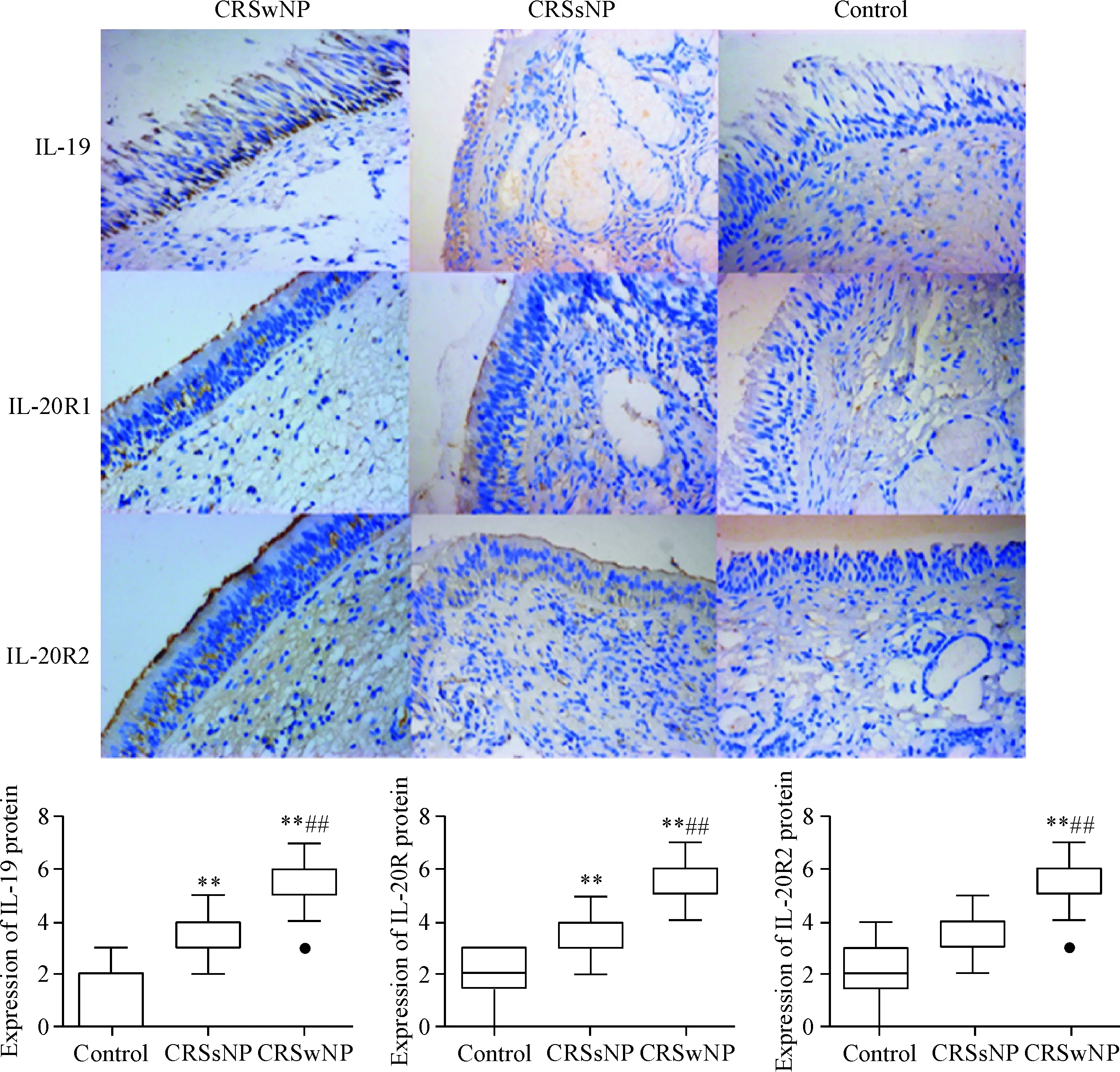
Figure 2.The expression of IL-19, IL-20R1 and IL-20R2 in human CRS and control tissues (immunohistochemical staining,×400). CRSwNP: chronic rhinosinusitis with nasal polyps (n=15); CRSsNP: chronic rhinosinusitis without nasal polyps (n=15); control:n=10.**P<0.01vscontrol;##P<0.01vsCRSsNP.
图2 CRS和对照组IL-19及其受体的蛋白表达水平
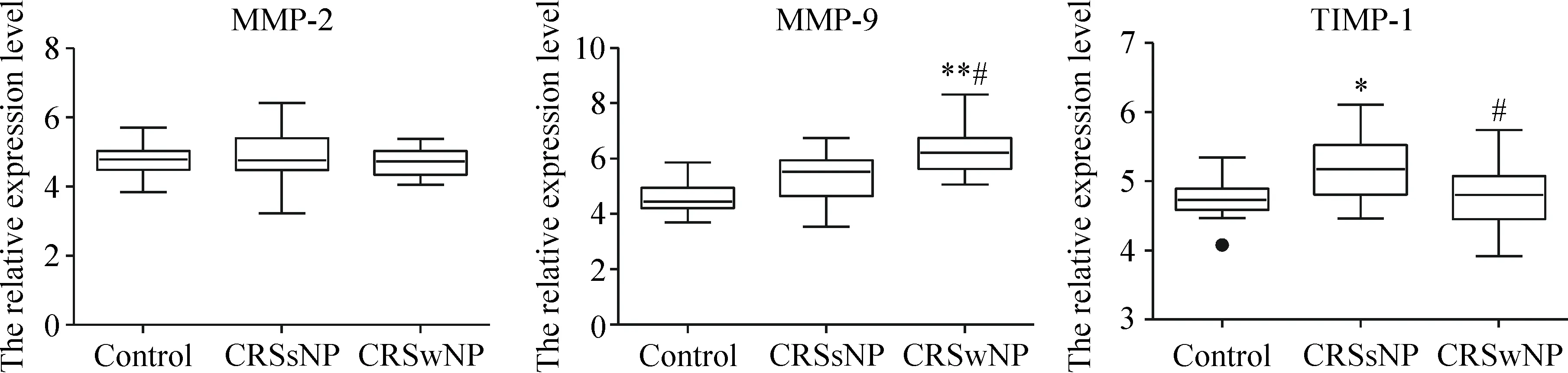
Figure 3.The mRNA expression of MMP-2, MMP-9 and TIMP-1 in human CRS and control tissues. CRSwNP: chronic rhinosinusitis with nasal polyps (n=30); CRSsNP: chronic rhinosinusitis without nasal polyps (n=15); control:n=15.*P<0.05,**P<0.01vscontrol;#P<0.05vsCRSsNP.
图3 CRS和对照组组织重塑因子MMP-2、MMP-9和TIMP-1的mRNA表达水平
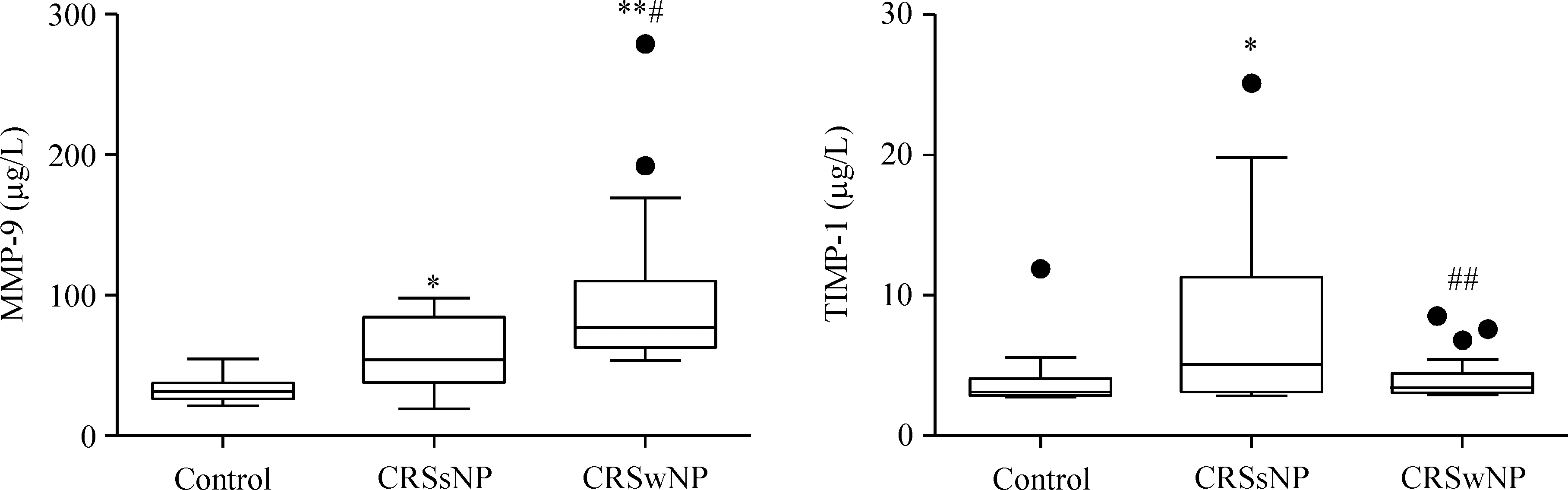
Figure 4.The protein expression of MMP-9 and TIMP-1 in human CRS and control tissues detected by ELISA. CRSwNP: chronic rhinosinusitis with nasal polyps (n=15); CRSsNP: chronic rhinosinusitis without nasal polyps (n=15); control:n=10.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsCRSsNP.
图4 CRS和对照组组织重塑因子MMP-9和TIMP-1的蛋白表达水平
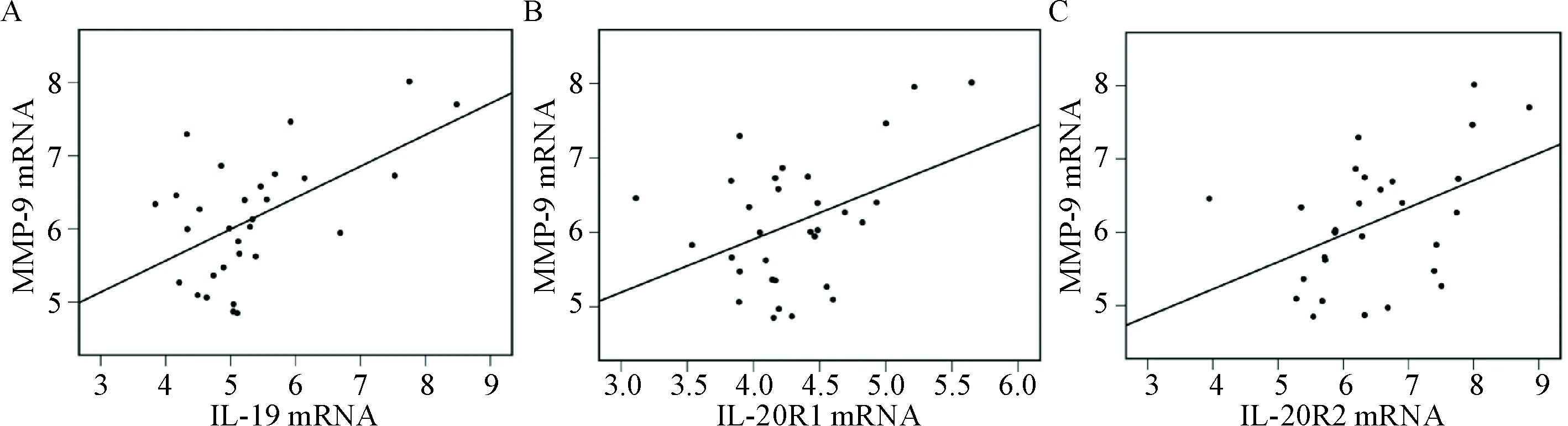
Figure 5.Correlations between the expression of IL-19, IL-20R1 or IL-20R2 and tissue remodeling factor MMP-9 in CRSwNP (chronic rhinosinusitis with nasal polyps). A: IL-19 was positively correlated with MMP-9 (rs=0.421,P=0.020); B: IL-20R1 was positively correlated with MMP-9 (rs=0.385,P=0.039); C: IL-20R2 was positively correlated with MMP-9 (rs=0.435,P=0.018).
图5 CRSwNP组IL-19及其受体与组织重塑因子MMP-9的相关性分析
IL-20亚家族成员(IL-19、IL-20、IL-22、IL-24和IL-26)通过与细胞表面特异性受体的结合,在多种慢性炎症性疾病的组织重塑中发挥重要作用[4]。本研究结果显示:IL-19及其受体(IL-20R1/IL-20R2)主要在鼻黏膜上皮中表达;在CRS中表达高于对照组,尤其是CRSwNP组的鼻黏膜上皮中。有研究也发现IL-19在欧洲人群CRSwNP中高表达,但并未对IL-19受体表达进行研究[9]。本研究还发现CRSwNP鼻黏膜组织中IL-19和MMP-9在mRNA水平呈正相关,提示IL-19在CRSwNP鼻黏膜组织中的作用可能为与其受体结合后促进MMP-9的表达,进而导致ECM降解组织水肿。然而目前对MMP-2在CRS的表达尚存在争议,有研究认为MMP-2在以水肿为特征的CRSwNP组增高[10],也有研究[11]与本研究结果一致,MMP-2在各组表达无显著差异,可能与MMP-2表达量低而样本量有限,因此,不能真实体现其表达水平,或与标本的取材位置有关。
鼻黏膜与下气道黏膜具有延续性,IL-19在CRS组织重塑中的调控机制可能与其诱导下气道慢性炎症具有相似的途径。研究发现在哮喘患者气道上皮细胞、在肺黏膜上皮细胞及浸润的免疫细胞中高表达的IL-19及其受体IL-20R1、IL-20R2,可通过激活T细胞促进Th2型细胞因子产生,还可通过结合其特异性受体激活STAT1、STAT3通路提高气道高反应性并促进哮喘的炎症反应,而Th2细胞因子IL-4、IL-13联合IL-17A可通过NF-κB及STAT6通路正向反馈上调IL-19的表达[12-13]。IL-20亚家族参与其它慢性炎症性疾病的组织重塑研究中发现:IL-20可促进椎间盘突出患者椎间盘细胞中MMP-3的表达[14];也有研究发现IL-20可以促进肝纤维化,抗IL-20、抗IL-20R1治疗后小鼠肝脏TGF-β1、 TIMP-3和TIMP-4减少,同时MMP-2、MMP-3和MMP-13合成增加,进而抑制细胞外基质的募集,促进I型胶原沉积,导致肝纤维化减轻[15]。
本研究证实在国人CRSwNP中存在IL-19及其受体(IL-20R1/IL-20R2)和MMP-9的高表达及TIMP-1的低表达,且IL-19及其受体与MMP-9在mRNA水平呈正相关关系,提示IL-19及其受体可能参与了CRS组织重塑的发生发展, 其具体的分子机制还有待进一步研究。
[1] Fokkens WJ, Lund VJ, Mullol J, et al. EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012. A summary for otorhinolaryngologists[J]. Rhinology, 2012, 50(1):1-12.
[2] Couto LG, Fernades AM, Brandão DF, et al. Histological aspects of rhinosinusal polyps[J]. Braz J Otorhinolaryngol, 2008, 74(2):207-212.
[3] Lechapt-Zalcman E, Escudier E. Implication of extracellular matrix metalloproteinases in the course of chronic inflammatory airway diseases[J]. Morphologie, 2000, 84(265):45-49.
[4] Rutz S, Wang X, Ouyang W. The IL-20 subfamily of cytokines: from host defence to tissue homeostasis[J]. Nat Rev Immunol, 2014, 14(12):783-795.
[5] 刘 梦, 刘 岩, 杨梦如, 等. IL-22对类风湿关节炎成纤维样滑膜细胞的作用[J]. 中国病理生理杂志,2016, 32(7):1273-1278.
[6] 常 贺, 赵法允, 王 焱, 等. 静脉注射IL-19重组质粒对大鼠实验性自身免疫性心肌炎的治疗作用[J]. 中国病理生理杂志, 2015, 31(4):744-749.
[7] Van Crombruggen K, Zhang N, Gevaert P, et al. Pathogenesis of chronic rhinosinusitis: inflammation[J]. J Allergy Clin Immunol, 2011, 128(4):728-732.
[8] 陆 翔, 刘 争, 崔永华. 转化生长因子β1和基质金属蛋白酶及其组织抑制物在慢性鼻窦炎和鼻息肉组织中的差异性表达[J]. 临床耳鼻咽喉科杂志, 2005, 19(14):633-635.
[9] Pace E, Scafidi V, Di Bona D, et al. Increased expression of IL-19 in the epithelium of patients with chronic rhinosinusitis and nasal polyps[J]. Allergy, 2012, 67(7):878-886.
[10]Can IH, Ceylan K, Caydere M, et al. The expression of MMP-2, MMP-7, MMP-9, and TIMP-1 in chronic rhinosinusitis and nasal polyposis[J]. Otolaryngol Head Neck Surg, 2008, 139(2):211-215.
[11]Li X, Meng J, Qiao X, et al. Expression of TGF, matrix metalloproteinases, and tissue inhibitors in Chinese chro-nic rhinosinusitis[J]. J Allergy Clin Immunol, 2010, 125(5):1061-1068.
[12]Liao SC, Cheng YC, Wang YC, et al. IL-19 induced Th2 cytokines and was up-regulated in asthma patients[J]. J Immunol, 2004, 173(11):6712-6718.
[13]Huang F, Wachi S, Thai P, et al. Potentiation of IL-19 expression in airway epithelia by IL-17A and IL-4/IL-13: important implications in asthma[J]. J Allergy Clin Immunol, 2008, 121(6):1415-1421, 1421.
[14]Huang KY, Lin RM, Chen WY, et al. IL-20 may contribute to the pathogenesis of human intervertebral disc herniation[J]. Spine (Phila Pa 1976), 2008, 33(19):2034-2040.
[15]Chiu YS, Wei CC, Lin YJ, et al. IL-20 and IL-20R1 antibodies protect against liver fibrosis[J]. Hepatology,2014, 60(3):1003-1014.
(责任编辑: 卢 萍, 罗 森)
Correlation of IL-19 and its receptors with tissue remodeling in chronic rhinosinusitis
LI Xia, CHANG Li-hong, HUANG Zi-zhen, WANG Zhi-yuan, CHEN Xian-zhen, WANG Jun, ZHANG Ge-hua
(DepartmentofOtorhinolaryngology,Head&NeckSurgery,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:gehuazh@hotmail.com.cn)
AIM: To explore the differential expression of interleukin-19 (IL-19) and its receptors (IL-20R1/IL-20R2) in the samples of chronic rhinosinusitis (CRS) with or without nasal polyps (CRSwNP and CRSsNP), and to investigate the correlation of IL-19 and its receptors with tissue remodeling factors, including matrix metalloproteinase (MMP)-2, MMP-9 and tissue inhibitor of metalloproteinase (TIMP)-1 in CRS. METHODS: The polyps from CRSwNP patients (n=30), the sinus mucosa from CRSsNP patients (n=15) and the inferior turbinal mucosa of nasal septum de-viation patients (n=15) were collected. The expression of IL-19 and its receptors (IL-20R1/IL-20R2) in each group was detected by real-time RT-PCR and immunohistochemistry. The expression of tissue remodeling factors MMP-2, MMP-9 and TIMP-1 in different groups was detected by real-time RT-PCR and ELISA. RESULTS: Increased mRNA and protein expression levels of IL-19, IL-20R1, IL-20R2 and MMP-9 were observed in CRSwNP group compared with CRSsNP and control group (P<0.05), while elevated expression level of TIMP-1 was observed in CRSsNP group compared with CRSwNP and control group (P<0.05). The relative expression of MMP-2 among the 3 groups showed no obvious difference. The expression of IL-19 and its receptors showed significantly positive correlations with MMP-9 in CRSwNP (P<0.05). No significant correlation between IL-19 and/or its receptors with TIMP-1 in CRSwNP group was observed. CONCLUSION: The high expression levels of IL-19, IL-20R1 and IL-20R2 and their positive correlations with MMP-9 in CRSwNP indica-te that IL-19 and its receptors may be involved in the tissue remodeling of chronic rhinosinusitis.
Chronic rhinosinusitis; Tissue remodeling; Interleukin-19; Matrix metalloproteinase-9; Tissue inhibitor of metalloproteinase-1
1000- 4718(2017)05- 0919- 06
2017- 01- 09
2017- 03- 20
国家自然科学基金资助项目(No.81371073; No.81670913); 广东省自然科学研究计划项目(No. 2013B021800081)
R765
A
10.3969/j.issn.1000- 4718.2017.05.025
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-85252252; E-mail: gehuazh@hotmail.com.cn

