CCR5第一、二胞外环特异性结合的拮抗短肽对TNBS诱导SD大鼠结肠炎的治疗作用*
胡 梅, 宋杨达▲, 刘思雪, 宋铱航, 沈溪明, 黄花荣, 钟英强△
(中山大学孙逸仙纪念医院 1消化内科, 2病理科, 3儿科, 广东 广州 510120)
CCR5第一、二胞外环特异性结合的拮抗短肽对TNBS诱导SD大鼠结肠炎的治疗作用*
胡 梅1, 宋杨达1▲, 刘思雪1, 宋铱航1, 沈溪明2, 黄花荣3△, 钟英强1△
(中山大学孙逸仙纪念医院1消化内科,2病理科,3儿科, 广东 广州 510120)
目的: 研究C-C趋化因子受体5(CCR5)膜外第一、二胞外环(ECL1和ECL2)特异性结合的拮抗短肽对三硝基苯磺酸(TNBS)诱导的结肠炎模型大鼠的治疗作用与机制。方法: 采用100 mg/kg TNBS诱导结肠炎SD大鼠模型;用不同剂量的2条拮抗短肽(ECL1: 25、35和45 mg/kg; ECL2:15、25和35 mg/kg)分别作用于模型大鼠,观察其对大鼠疾病活动指数(DAI)、结肠大体损伤指数(CMDI)和组织病理学改变的影响,采用real-time PCR和Western blot法分别检测结肠组织TNF-α和COX-2的mRNA与蛋白表达水平。结果: 与模型组相比,有效剂量的ECL2拮抗短肽HY治疗组大鼠疾病活动程度、肠道溃疡及病理组织学损伤均有明显减轻,各评分指数差异具有统计学意义(P<0.05);TNF-α和COX-2的蛋白和mRNA表达水平均明显下降(P<0.05)。ECL1拮抗短肽GH作用的大鼠结肠炎症状评分及TNF-α和COX-2炎症因子表达无明显改变。结论: ECL2拮抗短肽可能通过下调结肠黏膜TNF-α 和COX-2的表达来缓解TNBS诱导的SD大鼠结肠炎,而ECL1拮抗短肽的作用不明显。
C-C趋化因子受体5; 拮抗肽; 炎症性肠病
近年来,我国炎症性肠病(inflammatory bowel disease,IBD)发病率有逐年上升的趋势。C-C趋化因子受体5(C-C chemokine receptor 5,CCR5)是一种G蛋白偶联受体(G protein-coupled receptors,GPCRs),与配体结合后通过调节多种炎症细胞在体内的迁移与定位,参与多种免疫性疾病的发病机制。我们先前的研究发现,IBD与CCR5关系密切[1-2];CCR5主要表达在肠黏膜固有层炎性细胞、固有腺体上皮细胞和血管内皮细胞的胞浆或胞膜上[3]。我们还通过噬菌体展示肽库技术淘选与大鼠CCR5特异性结合的活性短肽并进行了体外功能的初步鉴定[4]。在此基础上,本实验进一步研究CCR5膜外第一、二胞外环特异性结合的活性短肽(GH和HY)对三硝基苯磺酸(trinitrobenzenesulfonic acid,TNBS)诱导的SD大鼠结肠炎的治疗作用与机制。
材 料 和 方 法
1 动物
健康成年雌性Sprague-Dawley (SD)大鼠,体重(200±10) g,6~7周龄,购买并饲养于中山大学实验动物中心。饲养条件为SPF级。本项目经中山大学实验动物管理与使用委员会以及实验动物伦理委员会的批准。
2 主要试剂与仪器
CCR5的2条模拟短肽[5]由吉尔生化有限公司合成,纯度为95%; 5% (W/V) TNBS购自Sigma,与无水乙醇按1∶1体积配成灌肠液;粪便隐血试剂盒(双联法)购自珠海贝索生物技术有限公司;TRIzol® RNA 提取试剂、Premix Taq PCR试剂盒及real-time PCR试剂盒均购自TaKaRa;BCA-100法蛋白质定量测定试剂盒和SDS-PAGE凝胶配制试剂盒均购自上海碧云天生物医学研究所;兔抗鼠TNF-α抗体购自Novus;兔抗鼠COX-2抗体购自CST;HRP标记羊抗鼠 II 抗购自武汉谷歌生物科技有限公司;LightCycler 480 Real-Time PCR System为Roche产品。
3 主要方法
3.1 TNBS诱导SD大鼠结肠炎模型的构建 SD大鼠适应性饲养1周,正常自由饮食。大鼠结肠炎模型的诱导方法参照文献[5]稍加改动,具体方法为:大鼠禁食不禁水24 h,称质量后10%水合氯醛(0.03 mL/kg)腹腔麻醉,用16号大鼠灌胃针将灌肠液缓慢灌入大鼠结肠末端(距肛门端约8 cm),继续保持大鼠倒立姿势30 min,仰卧归笼,自然苏醒,自由饮食。
3.2 TNBS造模剂量的筛选 选取27只SD大鼠,分4组,正常组3只,造模组每组8只,依照文献[5]的TNBS造模剂量,选取80 mg/kg、100 mg/kg和120 mg/kg的灌肠液剂量造模,根据大鼠疾病活动指数评分及死亡率筛选TNBS建立炎症性肠病的最佳造模剂量,再利用最适剂量建模并进行后续研究。
3.3 CCR5两条模拟短肽干预实验的分组给药 选取40只SD大鼠,每组5只,分为正常对照组(normal组)、TNBS/乙醇造模组(model组)、TNBS/乙醇造模+GH短肽治疗组(GH组)和TNBS/乙醇造模+HY短肽治疗组(HY组)。在造模后第3天治疗组大鼠分别予以GH短肽和HY短肽尾静脉注射治疗,模型组大鼠尾静脉给予等体积的无菌PBS溶液注射,每天1次,连续7 d(至造模后第9天)。其中,2个短肽给药组分别设立3个浓度梯度,GH短肽治疗组为25 mg/kg、35 mg/kg和45 mg/kg,HY短肽治疗组为15 mg/kg、25 mg/kg和35 mg/kg。经疾病活动指数(disease activity index,DAI)、结肠大体损伤指数(colon macroscopic damage index, CMDI)及组织学分级结果选择最适有效给药浓度。随后,对最适给药浓度组大鼠结肠组织行TNF-α和COX-2的mRNA及蛋白表达水平测定。
3.4 大鼠DAI评分 每天记录大鼠的体重下降程度、大便性状(正常、稀便或腹泻)以及粪便潜血或便血进行DAI评分,DAI为体重下降分数、粪便性状分数和隐血分数三者之和的平均数,具体方法参照文献[6](表1)进行。粪便潜血通过匹拉米洞化学法检测。
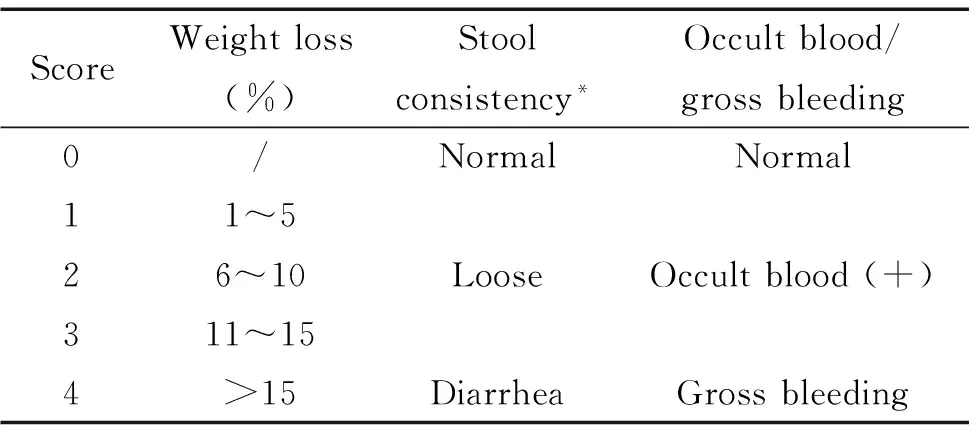
表1 疾病活动指数
DAI = (combined score of weight loss, stool consistency and bleeding)/3.*Normal stools: well-formed pellets; loose: pasty stools which do not stick to the anus; diarrhea: liquid stools that stick to the anus.
3.5 大鼠CMDI评分 造模后第21天,用10%水合氯醛(0.06 mL/kg)腹腔过量麻醉处死大鼠。取大鼠结肠沿肠系膜打开,用预冷生理盐水冲洗掉粪便,清理粘连组织。对各组结肠进行CMDI评分,该评分包括结肠和周围组织的粘连程度、溃疡及炎症的严重程度,具体方法参照文献[7](表2)进行。
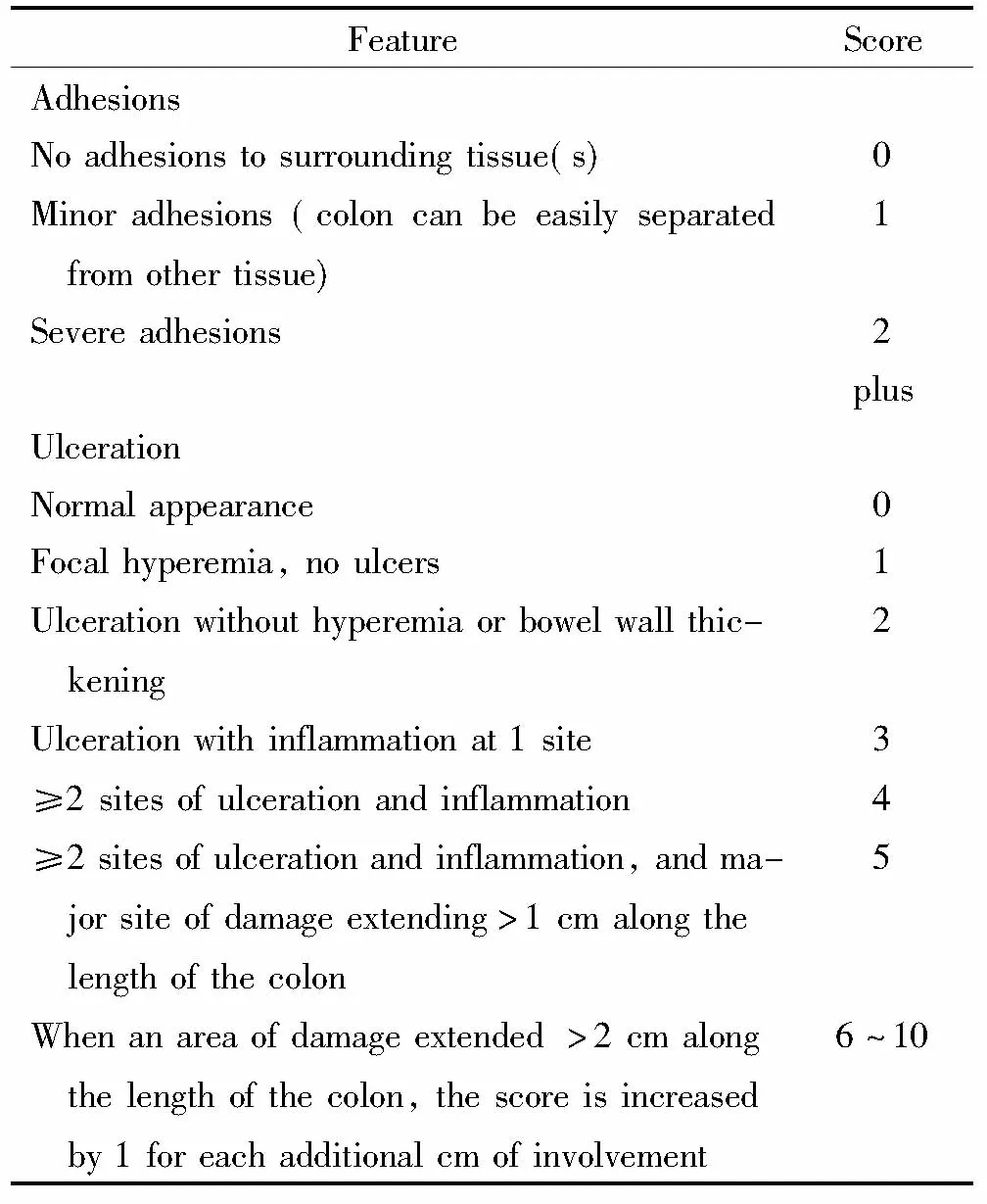
表2 结肠大体形态损伤指数
3.6 大鼠结肠炎的组织学分级评分 大体损伤评分后,迅速取炎症最严重的结肠组织,用4%的多聚甲醛固定,5 mm切片后HE染色。每张结肠切片随机选取10个100倍的镜下视野,按照文献[8](表3)组织学损伤评分标准进行评分。其中,每个视野的“炎症、深度、隐窝损伤或再生”程度评分后,乘以各自的累及范围,得出各项评分(即炎症和深度评分范围是0~12分,再生或隐窝损伤评分范围是0~16分),最终组织学评分为各部分之和。
3.7 Real-time PCR法检测结肠组织TNF-α 和COX-2的mRNA表达水平 采用TRIzol法提取结肠组织总RNA。参照逆转录试剂盒说明书进行逆转录,合成cDNA,用cDNA模板1 μL对大鼠内参照β-actin、COX-2及TNF-α(具体引物序列见表4)分别进行PCR扩增。反应体系含1 μL cDNA、5 μL 2×Premix Type试剂、0.4 μL上游引物和0.4 μL下游引物,无菌双蒸水补足至10 μL。PCR仪扩增参数为: 95 ℃ 30 s, 95 ℃5 s, 60 ℃ 20 s, 40个循环。实时荧光定量PCR 反应结束后,电脑自动分析荧光信号并将其转换为COX-2和TNF-α的起始拷贝数及循环阈值(Ct)。最后,用2-ΔΔCt方法计算各个基因表达的相对变化[9]。
3.8 Western blot法检测结肠组织TNF-α和COX-2的蛋白表达水平 将结肠组织称重,按1∶4的比例加入细胞裂解液,冰上匀浆,裂解30 min后,4 ℃下14 000×g离心5 min取上清,用BCA比色法按说明书操作检测样品蛋白浓度,并计算60 μg所需的上样体积。样品加入SDS上样缓冲液混匀后加热5 min使蛋白变性,进行SDS-PAGE(恒压60 V~110 V,约2.5 h),用PDVF膜进行电转膜(恒流250 mA,90 min),用50 g/L脱脂奶粉封闭液封闭1 h,后分别加入抗COX-2(1∶1 000)、β-actin(1∶1 500)和TNF-α(1∶1 000)的单抗4 ℃孵育过夜,用TBST洗膜10 min×3次后,加入 II 抗(1∶3 000)孵育1 h,用TBST洗膜10 min×3次,使用电脑凝胶成像系统曝光。采用ImageJ软件,对每组COX-2和TNF-α与β-actin积分吸光度的比值进行半定量分析。
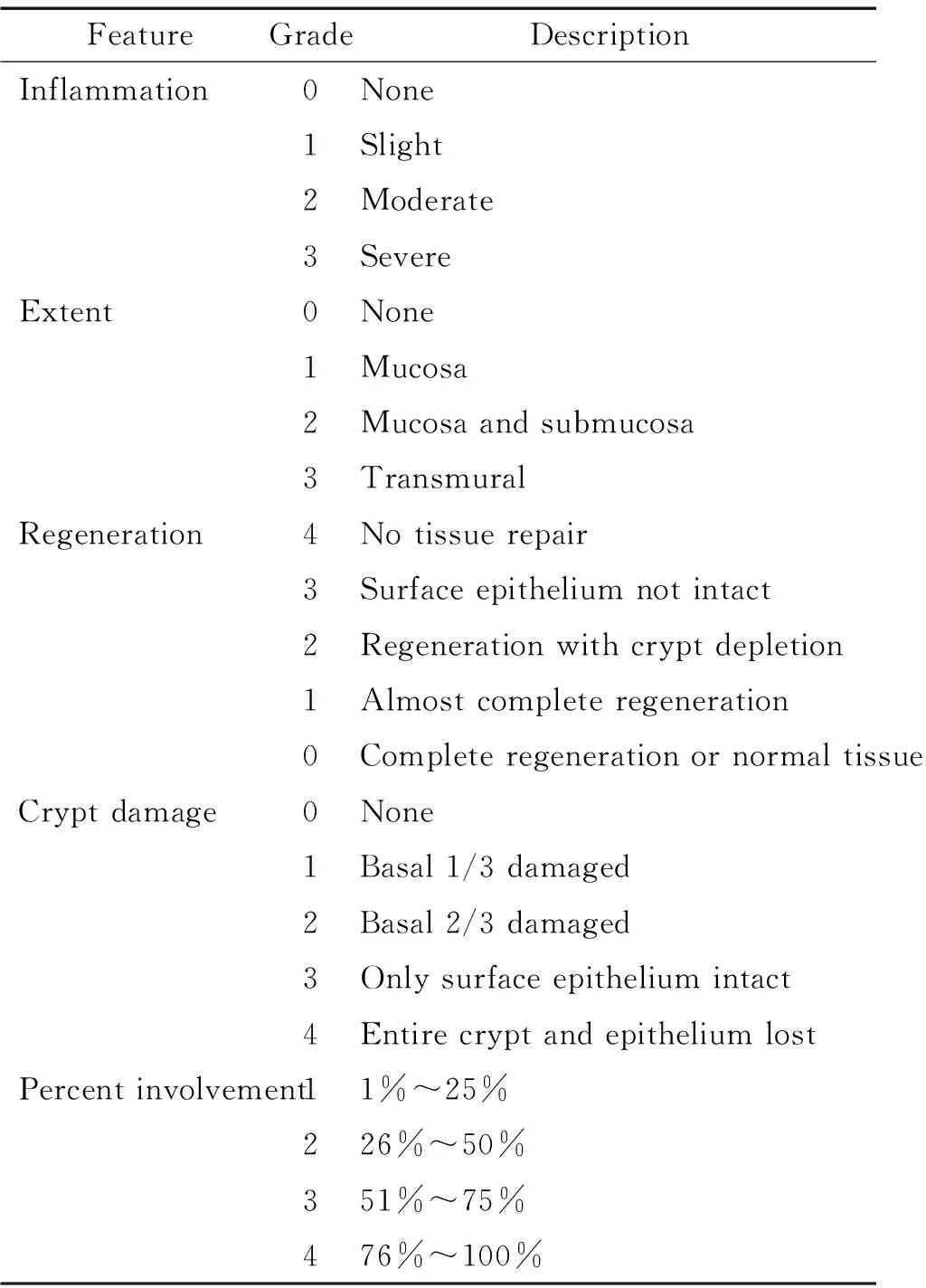
表3 结肠炎的组织学分级
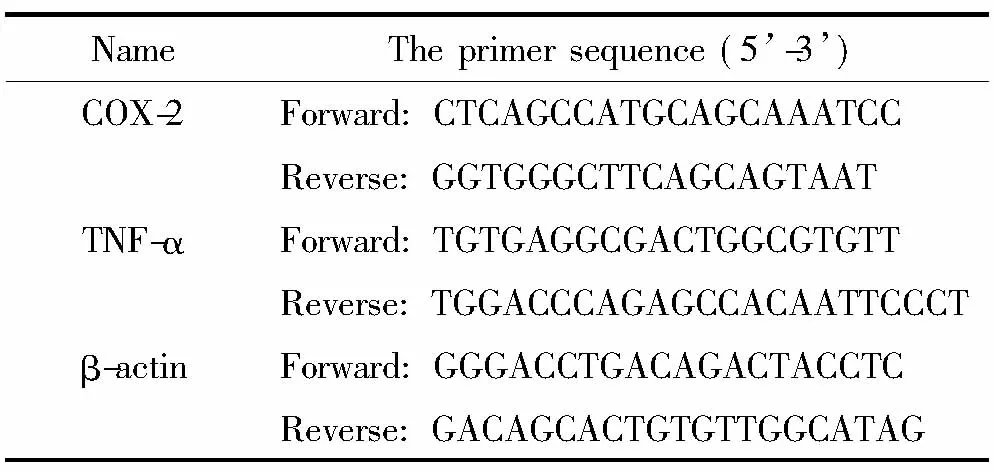
表4 引物序列
4 统计学处理
用SPSS 12.0数据分析软件进行统计。计量数据用均数±标准误(mean±SEM)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 TNBS建立结肠炎大鼠的最适造模剂量
120 mg/kg TNBS造模组在第5、6天各死亡1只,在第10天死亡2只,死亡率达50%,造模后大鼠少动,精神萎靡、无进食等,体质量显著下降,持续6~10 d,血样黏液便可持续7~9 d,实验结束见大便潜血,平均DAI评分约为2,该剂量组模型鼠症状过重且死亡率过高。100 mg/kg TNBS造模组在第14天死亡1只,造模后大鼠抱团、少动、进食少等,体重持续下降5~7 d,血样黏液便可持续3~6 d,大便潜血可持续9~14 d。80 mg/kg TNBS造模组,在第10天死亡1只,造模后大鼠精神稍差,懒动,部分大鼠于造模后第6天恢复到造模前体重,部分大鼠造模后无明显血便,部分造模后第6天大便潜血即为阴性,实验结束时平均DAI评分约为0.33,该剂量组模型鼠结肠炎症状偏轻且持续时间过短。因此,100 mg/kg为TNBS建立结肠炎大鼠的最适造模剂量,见图1。
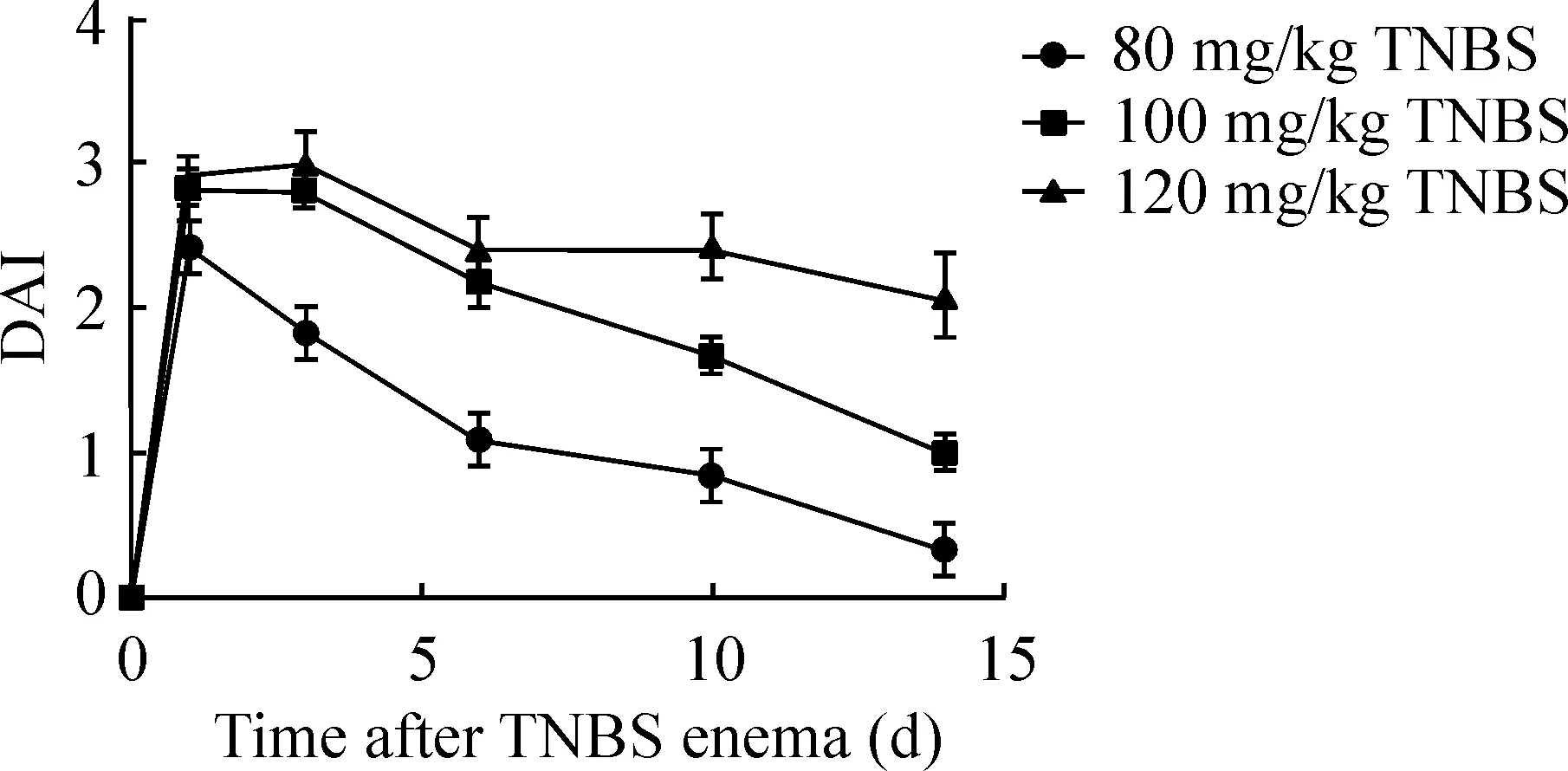
Figure 1.The DAI in groups with different doses of TNBS. Mean±SEM.n=8.
图1 不同TNBS剂量组的疾病活动指数评分
2 CCR5拮抗短肽对疾病活动指数的影响
结肠炎大鼠经2条短肽治疗后,HY拮抗短肽组的DAI评分在造模后第6天均较model组明显降低,差异有统计学意义(P<0.05)。治疗后大鼠粪便恢复正常的时间比model组提前。而GH拮抗短肽组与模型组在第6、10、21天DAI评分比较,差异均无统计学显著性,见表5。
3 CCR5拮抗短肽对大体形态损伤指数的影响
与model组相比,HY2组的CMDI显著下降,差异有统计学意义(P<0.05),该组大鼠结肠肉眼可见炎症损伤明显减轻,溃疡面积缩小,并可见愈合瘢痕。GH短肽组的溃疡病变则均无明显改善,与model组比较,CMDI差异均无统计学显著性,见图2、表6。
表5 GH短肽和HY短肽对结肠炎大鼠疾病活动指数评分的影响
Table 5.The effects of GH peptide and HY peptide on the DAI in the colitis rats (Mean±SEM.n=5)
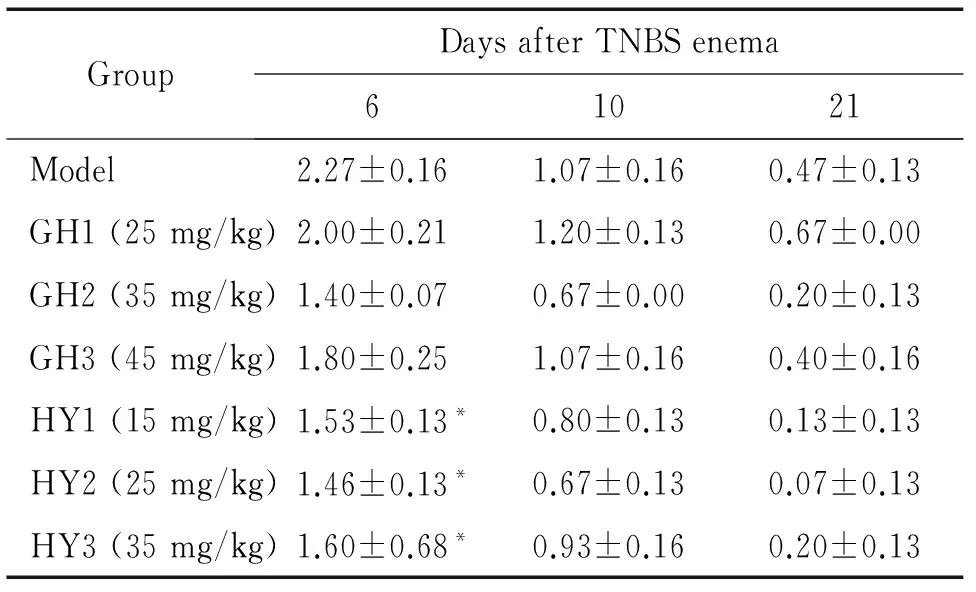
GroupDaysafterTNBSenema61021Model2.27±0.161.07±0.160.47±0.13GH1(25mg/kg)2.00±0.211.20±0.130.67±0.00GH2(35mg/kg)1.40±0.070.67±0.000.20±0.13GH3(45mg/kg)1.80±0.251.07±0.160.40±0.16HY1(15mg/kg)1.53±0.13*0.80±0.130.13±0.13HY2(25mg/kg)1.46±0.13*0.67±0.130.07±0.13HY3(35mg/kg)1.60±0.68*0.93±0.160.20±0.13
*P<0.05νsmodel group.

Figure 2.The pathological changes of the colons in each group.
图2 各组结肠肉眼变化
4 CCR5拮抗短肽对组织学损伤评分的影响
与模型组相比,HY2组的病理学评分差异有统计学意义(P<0.05);余下各剂量组及GH组的病理学评分差异则无统计学显著性。病理见模型组结肠组织内大量炎症细胞浸润, 甚至累及全层,上皮部分坏死脱落,黏膜腺体减少,黏膜下层结构疏松水肿明显,HY2短肽结肠组织炎症细胞浸润明显减少,黏膜下层结缔组织稍疏松,结肠组织处于完全自身修复状态,GH2短肽结肠组织仍可见明显炎症细胞浸润,腺体紊乱数量减少,见图3、表6。
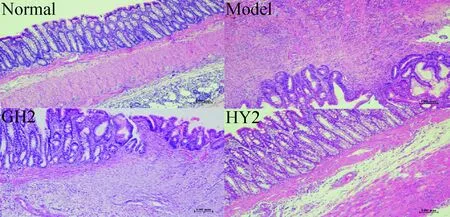
Figure 3.Histological changes of colonic mucosa in each group (×100).
图3 各组结肠黏膜组织学改变
表6 GH短肽和HY短肽对结肠大体损伤指数和组织学评分的影响
Table 6.The effects of GH peptide and HY peptide on CMDI and histological scores in different groups (Mean±SEM.n=5)
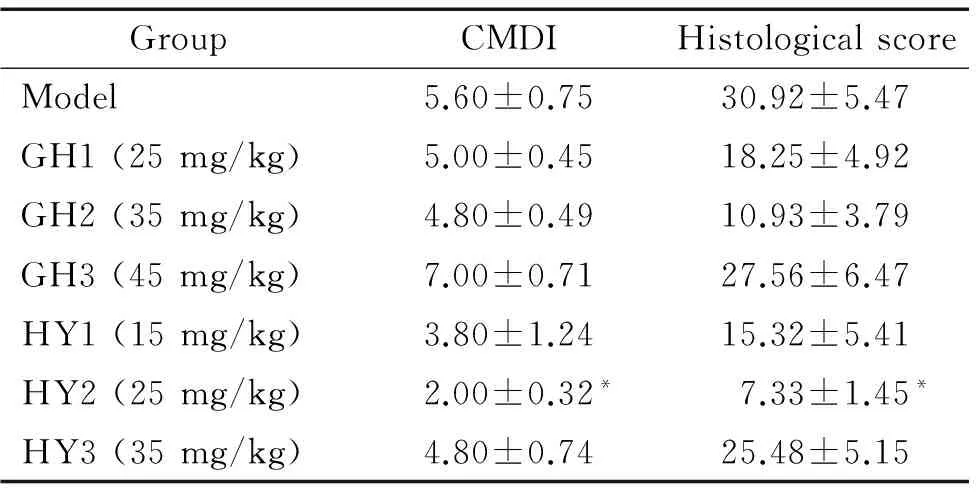
GroupCMDIHistologicalscoreModel5.60±0.7530.92±5.47GH1(25mg/kg)5.00±0.4518.25±4.92GH2(35mg/kg)4.80±0.4910.93±3.79GH3(45mg/kg)7.00±0.7127.56±6.47HY1(15mg/kg)3.80±1.2415.32±5.41HY2(25mg/kg)2.00±0.32*7.33±1.45*HY3(35mg/kg)4.80±0.7425.48±5.15
*P<0.05vsmodel group.
5 CCR5拮抗短肽对结肠黏膜COX-2和TNF-α mRNA和蛋白表达的影响
由表7可见,模型组COX-2和TNF-α的mRNA表达水平较正常组明显升高;HY2短肽干预组中COX-2和TNF-α的mRNA表达水平与模型对照组相比明显下调,两组间差异具有统计学意义(P<0.05);且HY2拮抗肽组和正常组比较差异无统计学显著性,GH2短肽干预组与模型组比较差异也无统计学显著性。
模型组COX-2和TNF-α蛋白表达水平和正常对照组比较明显升高;HY短肽干预组中的COX-2和TNF-α蛋白表达水平与模型组相比明显下调,两组间差异有统计学意义(P<0.05),且与正常组比较差异无统计学显著性。而GH短肽干预组与模型组比较差异无统计学显著性,见图4、表7。
表7 COX-2 和TNF-α mRNA和蛋白表达量的比较
Table 7.The expression of COX-2 and TNF-α at mRNA and protein levels determined by RT-qPCR and Western blot (Mean±SEM.n=5)

GroupmRNAProteinCOX-2TNF-αCOX-2TNF-αNormal110.40±0.060.39±0.06Model4.90±0.12#2.19±0.21#0.77±0.06#0.86±0.06#GH2(35mg/kg)4.59±0.101.73±0.220.52±0.030.62±0.13HY2(25mg/kg)3.57±0.39*1.39±0.18*0.36±0.04*0.39±0.12*
#P<0.05vsnormal group;*P<0.05vsmodel group.
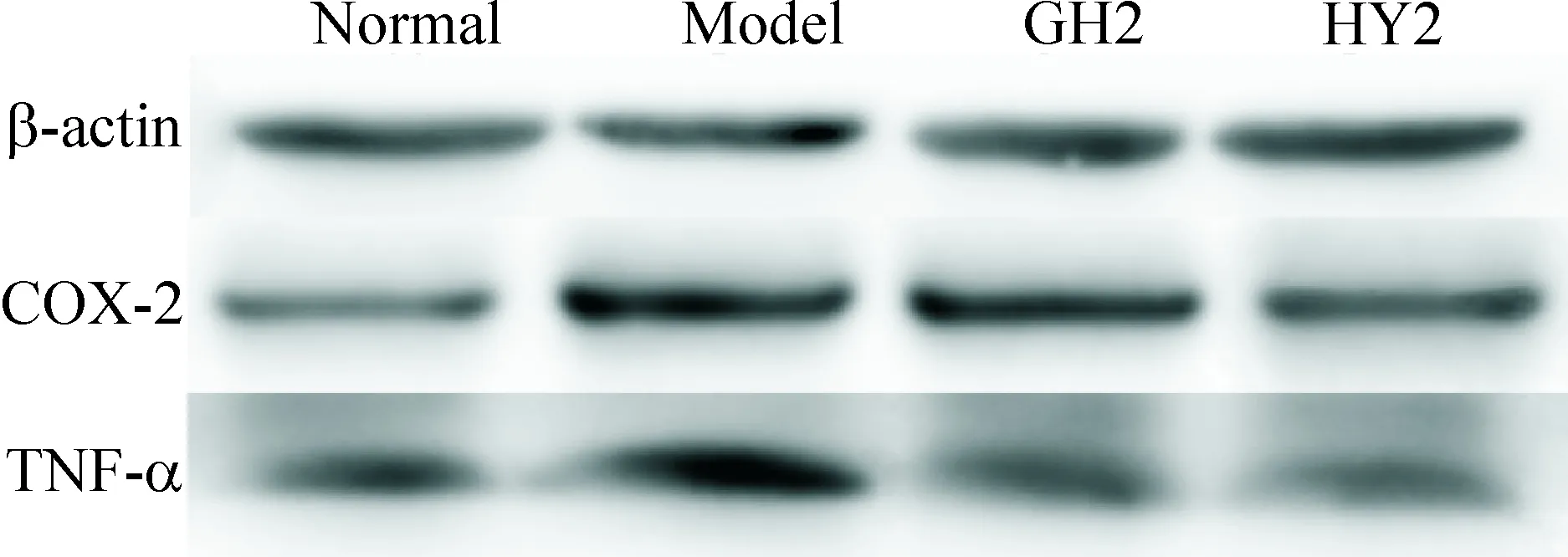
Figure 4.The images of Western blot for determining the protein expression of COX-2 and TNF-α.
图4 Western blot检测COX-2和TNF-α的蛋白表达
讨 论
CCR5是一种由7次跨膜螺旋区、胞外长N末端、3个胞外环(ECL1-3)、3个胞内环(ICL1-3)和胞内C末端几个部分构成的蛋白,其与配体调解活化正常T细胞表达和分泌因子(regulated upon activation normal T cell expression and secrete, RANTES)、巨噬细胞炎症蛋白(macrophage inflammatory protein, MIP)-1α、MIP-1β等结合后通过调节炎症细胞的活化和定向迁移来控制免疫和炎症反应,从而参与IBD的发生与发展。在各免疫性疾病的发病机制中CCR5主要通过PKC、NF-κB、JAK-STAT等多条信号通路,促进T细胞增殖,上调多种细胞因子受体表达,促进炎症反应。另外,CCR5是HIV-1感染靶细胞的辅助受体,CCR5拮抗剂也因此成为抗艾滋病药物研发热点,目前以CCR5为靶点的拮抗剂主要分趋化因子衍生物、非肽类小分子化合物、单克隆抗体及肽类化合物等4类,本实验使用的亲和短肽即属于肽类拮抗剂一类,具有高活性、高稳定性、高亲和力和特异性结合的特点。因此说明CCR5拮抗短肽作为受体蛋白拮抗剂,可以干预CCR5介导的多种炎症通路反应,发挥治疗作用。已有研究者使用CCR5拮抗剂Met-RANTES、MIP-3α单克隆抗体以及TAK-779等分别治疗实验动物结肠炎,发现其可有效地抑制肠道炎症反应、减轻肠道损伤[10-13]。
TNF-α是炎症性肠病中公认存在的一种促炎因子,在结肠炎活动期,血液及炎症性肠组织中TNF-α的水平明显升高,介导肠黏膜损伤,临床上抗TNF-α药物在IBD的治疗中也起到重要作用[14]。同样COX-2/NF-κB也是炎症性肠病发病机制中重要的炎症通路,参与IBD的发展[15]。COX-2和TNF-α表达水平是许多研究治疗IBD药物的观察指标[16],它们在IBD中通过抑制NF-κB介导的促炎介质(COX-2、TNF-α等)发挥肠道抗炎作用[17]。
本实验中,CCR5膜外第二环特异结合的拮抗短肽能明显降低结肠炎大鼠疾病活动指数、大体损伤指数及组织学分级的评分,且发现模型组大鼠结肠组织COX-2和TNF-α表达水平异常增高,经过CCR5拮抗短肽治疗,COX-2和TNF-α的表达明显下降。说明HY拮抗短肽可通过下调COX-2和TNF-α的表达,减轻其与炎症细胞相互作用,缓解肠道黏膜的炎症损伤,促进肠黏膜修复与溃疡愈合。推测CCR5膜外第二环特异结合的拮抗短肽,可能通过模拟CCR5配体的结合表位,结合在由跨膜区一些关键氨基酸残基组成的疏水口袋中,诱发CCR5的ECL2区域的构象发生改变,阻止CCR5特异性配体与CCR5的结合,进而影响下游信号通路的级联反应,减少炎症细胞趋化和炎症因子的释放,从而抑制炎症反应[18]。但同时发现CCR5胞外第一环的模拟肽对实验大鼠结肠炎无明显缓解作用,因而推断可能由于CCR5与配体结合而发挥生理功能的主要位点是N末端和ECL2[19]的缘故。
因此,CCR5在结肠炎的炎症反应机制中起重要作用,其胞外第二环的活性拮抗短肽对TNBS诱导的结肠炎模型大鼠具有治疗作用。对于CCR5胞外第一环拮抗剂对结肠炎的作用机制和效果有待进一步的探索和评价。因此,合成性CCR5胞外第二环拮抗肽可能成为研究IBD治疗一种候选药物,为IBD的临床治疗方面的研究提供一种新的方法。
[1] 叶小研, 钟英强. CCR与炎症性肠病[J]. 胃肠病学, 2014, 19(1):50-53.
[2] 胡 梅, 钟英强. CC趋化因子受体5与炎症性肠病的研究进展[J].胃肠病学,2015, 20(12):753-756.
[3] 叶小研, 刘思雪, 胡 梅, 等. CCR5在炎症性肠病患者肠黏膜的表达及其与β-arrestin2表达的关系[J]. 中国病理生理杂志, 2016, 32(4):713-718.
[4] 刘思雪, 胡 梅, 叶小研, 等. 应用噬菌体展示肽库技术淘选大鼠CCR5膜外第一、二胞外环特异性结合的活性拮抗肽与初步鉴定[J]. 中国病理生理杂志, 2015, 31(7):1225-1230.
[5] Brenna O, Furnes MW, Drozdov I, et al. Relevance of TNBS-colitis in rats: a methodological study with endoscopic, histologic and transcriptomic characterization and correlation to IBD[J]. PLoS One, 2013, 8(1):e54543.
[6] Murano M, Maemura K, Hirata I, et al. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis[J]. Clin Exp Immunol, 2000, 120(1):51-58.
[7] Paiotti APR, Miszputen SJ, Oshima CTF, et al. Etanercept attenuates TNBS- induced experimental colitis: role of TNF-α expression[J]. J Mol Histol, 2011, 42(5):443-450.
[8] Dieleman LA, Palmen MJ, Akol H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J]. Clin Exp Immunol,1998, 114(3):385-391.
[9] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods, 2001, 25 (4): 402-408.
[10]Ajuebor MN, Hogaboam CM, Kunkel SL, et al. The chemokine RANTES is a crucial mediator of the progression from acute to chronic colitis in the rat[J]. J Immunol, 2001, 166(1):552-558.
[11]Kucuk C, Sozuer E, Gursoy S, et al. Treatment with Met-RANTES decreases bacterial translocation in experimental colitis[J]. Am J Surg, 2006, 191(1): 77-83.
[12]Katchar K, Kelly CP, Keates S, et al. MIP-3 neutralizing monoclonal antibody protects against TNBS-induced colonic injury and inflammation in mice[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 292(5):G1263-G1271.
[13]Tokuyama H. The simultaneous blockade of chemokine receptors CCR2, CCR5 and CXCR3 by a non-peptide chemokine receptor antagonist protects mice from dextran sodium sulfate-mediated colitis[J]. Int Immunol, 2005, 17(8): 1023-1034.
[14]宋杨达, 刘思雪, 钟英强. 生物制剂治疗炎症性肠病的进展与风险[J]. 世界华人消化杂志, 2016, 24(19):2964-2973.
[15]Sakthivel KM, Guruvayoorappan C. Amentoflavone inhibits iNOS, COX-2 expression and modulates cytokine profile, NF-κB signal transduction pathways in rats with ulcerative colitis[J]. Int Immunopharmacol, 2013, 17(3): 907-916.
[16]Serra D, Paixão J, Nunes C, et al. Cyanidin-3-glucoside suppresses cytokine- induced inflammatory response in human intestinal cells: comparison with 5-aminosalicylic acid[J]. PLoS One, 2013, 8(9):e73001.
[17]Mcdaniel DK, Eden K, Ringel VM, et al. Emerging roles for noncanonical NF-κB signaling in the modulation of inflammatory bowel disease pathobiology [J]. Inflamm Bowel Dis, 2016, 22(9):2265-2279.
[18]Kondru R, Zhang J, Ji C, et al. Molecular interactions of CCR5 with major classes of small-molecule anti-HIV CCR5 antagonists[J]. Mol Pharmacol, 2008, 73(3):789-800.
[19]Schnur E, Kessler N, Zherdev Y, et al. NMR mapping of RANTES surfaces interacting with CCR5 using linked extracellular domains[J]. FEBS J, 2013, 280(9):2068-2084.
(责任编辑: 林白霜, 罗 森)
Effects of antagonistic peptides binding specifically with first and second extracellular loops of CCR5 on colitis rats induced by TNB
SHU Mei1, SONG Yang-da1, LIU Si-xue1, SONG Yi-hang1, SHEN Xi-ming2, HUANG Hua-rong3, ZHONG Ying-qiang1
(1DepartmentofGastroenterology,2DepartmentofPathology,3DepartmentofPediatrics,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:zhongyingqiang@126.com;hhrvivi@126.com)
AIM: To study the effects of antagonistic peptides binding specifically with the first and second extracellular loops (ECL1 and ECL2) of C-C chemokine receptor 5 (CCR5) on the colitis rats induced by trinitrobenzenesulfonic acid (TNBS) and the mechanisms. METHODS: The colitis model of SD rats was induced by TNBS (100 mg/kg). The effects of 2 antagonistic peptides at different doses (ECL1: 25, 35 and 45 mg/kg; ECL2: 15, 25 and 35 mg/kg) on the model rats including the changes of disease activity index (DAI), colon macroscopic damage index (CMDI) and histological grading were observed. The mRNA and protein expression levels of TNF-α and COX-2 in the colonic mucosa were detected by real-time PCR and Western blot, respectively. RESULTS: Compared with model group, the changes of DAI, CMDI and histopathological injury of the rats treated with ECL2 antagonistic peptide HY at an appropriate dose were significantly reduced (P<0.05), and the protein and mRNA expression levels of TNF-α and COX-2 were significantly decreased (P<0.05). However, the effects of ECL1 antagonistic peptide GH on all scores and the expression levels of TNF-α and COX-2 were not obvious. CONCLUSION: ECL2 antagonistic peptide HY relieves TNBS-induced colitis in SD rats via down-regulating the expressions of TNF-α and COX-2 in the colonic mucosa, while the effect of ECL1 antagonist peptide GH was not obvious.
C-C chemokine receptor 5; Antagonistic peptide; Inflammatory bowel disease
1000- 4718(2017)05- 0902- 06
2016- 12- 13
2017- 02- 13
国家自然科学基金资助项目(No. 81370499);广东省自然科学基金资助项目(No. 2014A030313020; No. 2016A03031343)
R363; R965.2
A
10.3969/j.issn.1000- 4718.2017.05.022
杂志网址: http://www.cjpp.net
△通讯作者 钟英强 Tel: 020-81332598; E-mail: zhongyingqiang@126.com; 黄花荣 Tel: 020-81332446; E-mail: hhrvivi@126.com
▲并列第1作者

