ELMO1在胃癌细胞侵袭和迁移中的作用*
郭称明, 彭会云, 高 典, 胡 雁, 余琼芳△, 罗 文
(南昌大学 1第二附属医院消化内科, 2基础医学院病原生物学与免疫学系, 江西 南昌 330006)
ELMO1在胃癌细胞侵袭和迁移中的作用*
郭称明1, 彭会云2, 高 典2, 胡 雁2, 余琼芳1△, 罗 文1
(南昌大学1第二附属医院消化内科,2基础医学院病原生物学与免疫学系, 江西 南昌 330006)
目的: 探讨吞噬和细胞运动蛋白1(ELMO1)的表达在胃癌细胞侵袭和迁移中的作用和功能。方法: 用Western blot和实时荧光定量PCR实验检测5种胃癌细胞和1种人正常胃黏膜上皮细胞ELMO1的蛋白和mRNA表达水平,并筛选出ELMO1表达量高的胃癌细胞株;用细胞转染实验沉默胃癌细胞株的ELMO1;用细胞划痕实验以及Trenswell小室迁移和侵袭实验检测抑制该基因的表达对胃癌细胞侵袭和迁移能力的影响。结果: 胃癌细胞中ELMO1的表达量明显高于人正常胃黏膜上皮细胞(P<0.01),其中SGC7901细胞的ELMO1表达量最高;在SGC7901细胞中ELMO1-siRNA可显著沉默ELMO1的表达(P<0.05);沉默ELMO1可显著降低胃癌细胞侵袭和转移的能力(P<0.01)。结论: ELMO1在胃癌细胞中高表达,并可促进胃癌细胞的侵袭和迁移。
吞噬和细胞运动蛋白1; 胃癌; 细胞侵袭; 细胞迁移
胃癌是我国最常见的恶性肿瘤之一,最近几年每年约有40万新发病例,死亡人数高达30多万[1-2]。胃癌的侵袭和转移是胃癌患者死亡的主要原因,因此揭示胃癌转移发生发展的分子机制、确立防治靶点并积极探索抗复发、转移的有效治疗手段,对进一步提高胃癌患者的治愈率和生存率具有重要意义。
吞噬和细胞运动蛋白(engulfment and cell mobi-lity,ELMO)家族最初在秀丽隐杆线虫(Caenorhabditiselegans,C.elegans)的研究中被发现,其与C.elegans的CED-12蛋白同源,在哺乳动物细胞中包括3种不同的转录剪接体:ELMO1、ELMO2和ELMO3[3],且在进化过程中高度保守[4]。研究表明人Crk下游180 kDa蛋白(downstream of Crk with molecular weight of 180 kDa,Dock180)须与ELMO1相互结合成ELMO1/Dock180复合物才能激活下游的依赖Ras相关的C3肉毒杆菌毒素底物(Ras-related C3 botulinum toxin substrate,Rac)的肌动蛋白在细胞吞噬作用和细胞趋化作用中结构重组,从而促进细胞的运动和迁移[5-8]。目前研究发现ELMO1对于维持机体的生态平衡具有重要意义,其异常表达与多种恶性肿瘤的发生、发展及预后关系密切,但尚未有文献报道ELMO1与胃癌相关[9]。本研究主要探讨ELMO1的异常表达在胃癌细胞侵袭和迁移中的作用和功能。
材 料 和 方 法
1 材料与试剂
人正常胃黏膜上皮细胞GES-1以及胃癌细胞株AGS、BGC823、MGC803、MKN28和SGC7901由本实验室冻存;RPMI-1640培养液和胎牛血清购于北京全式金生物技术公司;胰蛋白酶购自Gibco;BCA试剂盒购自碧云天生物技术研究所;β-actin购自ComWin;抗ELMO1抗体购自Sigma;辣根酶标记山羊抗小鼠IgG和山羊抗兔IgG购自北京中杉金桥生物技术有限公司;TRIzol 购自上海拜力生物科技有限公司;逆转录试剂盒购于普洛麦格生物技术有限公司;qPCR试剂盒购自TaKaRa;qPCR引物购自南京金斯瑞生物科技有限公司;ELMO1-siRNA购自GenePharma;Lipofectamine 2000脂质体购自Invitrogen;Transwell小室购自Coring;基质胶/基质膜购自BD Biosciences。
2 方法
2.1 细胞培养 人胃癌细胞AGS、BGC823、MGC803、MKN28和SGC7901及作为对照组的人正常胃黏膜上皮细胞GES-1培养于含10%FBS、1×105U/L青霉素、1×105U/L链霉素的 RPMI-1640培养液中,放入37 ℃、5%CO2孵化箱中培养,待细胞生长处于对数期时用于实验。
2.2 Western blot实验 裂解处于对数生长期的细胞提取总蛋白,BCA法测蛋白浓度,每个样本上30 μg总蛋白进行SDS-PAGE凝胶电泳,湿转2 h至硝酸纤维素膜上,室温下5%脱脂奶粉封闭0.5 h,加Ⅰ抗置于4 ℃冰箱孵育过夜,TBST洗3次,每次10 min,加Ⅱ抗室温下孵育2 h,再用TBST洗3次,每次10 min,凝胶成像仪成像后用Image-Pro Plus 6.0图像分析软件计算各组蛋白条带的灰度值,再计算目的蛋白条带的灰度值与β-actin灰度值的比值,得出目的蛋白的相对表达水平,每个实验均重复3次,取平均值。选出表达量最高的胃癌细胞株用于做进一步实验。
2.3 实时荧光定量PCR实验 用TRIzol裂解处于对数生长期的细胞提取总RNA,每个样本上1 μg 总RNA进行逆转录成cDNA,严格按照实时定量PCR试剂盒操作说明书进行实验,20 μL总反应体系,GAPDH作为内参照。ELMO1的上游引物为5′-GGAGCAGGTTATGAGAGCACT-3′,下游引物为5′-GGGCCGGACTGGAAATCTTC-3′;GAPDH的上游引物为5′-TGACTTCAACAGCGACACCCA-3′,下游引物为5′-CACCCTGTTGCTGTAGCCAAA-3′。分别用ELMO1和GAPDH的Ct值计算ΔCt,再计算2-ΔΔCt代表ELMO1的相对表达量,每个实验均重复3次,取平均值,筛选出表达量最高的胃癌细胞株用于后续实验。
2.4 转染实验 转染前24 h将ELMO1表达量最高且处于对数生长期的胃癌细胞株均匀接种于6孔板,置于37 ℃、5%CO2孵化箱中培养,待细胞密度达70%~80%时,按Lipofectamine 2000说明书转染细胞。实验选用的3条ELMO1-siRNA分别为siRNA_001(正义链5′-GCA CUU ACA ACC AAG CCU ATT-3′,反义链5′-UAG GCU UGG UUG UAA GUG CTT-3′)、siRNA_002(正义链5′-GGA UGA ACC AGG AAG AUU UTT-3′,反义链5′-AAA UCU UCC UGG UCC AUC CTT-3′)和siRNA_003(正义链5′-GGC UUU CGC CAA AUC ACA ATT-3′,反义链5′-UUG UGA UUU GGC GAA AGC CTT-3′),另用1条无任何靶基因的siRNA作为阴性对照(negative control;正义链5′-UUC UCC GAA CGU GUC ACG UTT-3′,反义链5′-ACG UGA CAC GUU CGG AGA ATT-3′),实验共分为4组。转染24 h后,用实时荧定量PCR实验检测基因沉默效率,每个实验均重复3次。筛选出沉默效率最高的ELMO1-siRNA用于后续细胞划痕、Trenswell小室迁移和侵袭实验。
2.5 细胞划痕实验 实验分ELMO1-siRNA组、negative control组和空白对照(blank control)组(只加Lipofectamine 2000,而未加任何siRNA的细胞组)。将细胞以每孔2×105的密度均匀地铺在24孔板中,24 h后细胞融合率可达90%,吸出培养基,用10 μL的枪头用力均匀地在孔中划痕,PBS洗3次,加1 mL的RPMI-1640培养基。分别在划痕后的0 h、18 h和36 h用显微镜检测细胞的划痕距离。细胞的迁移率(%)=(0 h划痕距离-不同时点划痕距离)/0 h划痕距离×100%。每个实验均重复3次,取平均值作为实验结果进行统计分析。
2.6 Transwell小室侵袭和迁移实验 细胞侵袭实验分ELMO1-siRNA组、negative control组和blank control组。Transwell小室的上室铺一层人工基质胶,置于24孔板上,将消化后用不含胎牛血清的RPMI-1640培养液重悬的各组细胞悬液分别取100 μL加入小室上室中(1.0×109/L),下室各加入600 μL含10%胎牛血清的RPMI-1640培养液,置于37 ℃、5% CO2的细胞培养箱中连续培养48 h,吸去培养基,用棉签擦尽上室面的人工基质胶和细胞,下室面固定染色。每孔随机取5个高倍镜(×200)视野,取平均值,计数下室的细胞数即为穿透人工基底膜的细胞数,每个实验重复3次,取平均值作为实验结果进行统计分析。对于细胞迁移实验,只是在Transwell小室的上室不铺人工基质胶,其余步骤均相同。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,组间均数比较选用单因素方差分析。数据用SPSS 20.0软件进行处理,以P<0.05为差异有统计学意义。
结 果
1 Western blot检测胃癌细胞系和人正常胃黏膜上皮细胞ELMO1蛋白表达量的结果
如图1所示,胃癌细胞系中ELMO1蛋白表达水平显著高于人正常胃黏膜上皮细胞,差异显著(P<0.01)。其中SGC7901细胞的ELMO1蛋白表达水平相对最高。
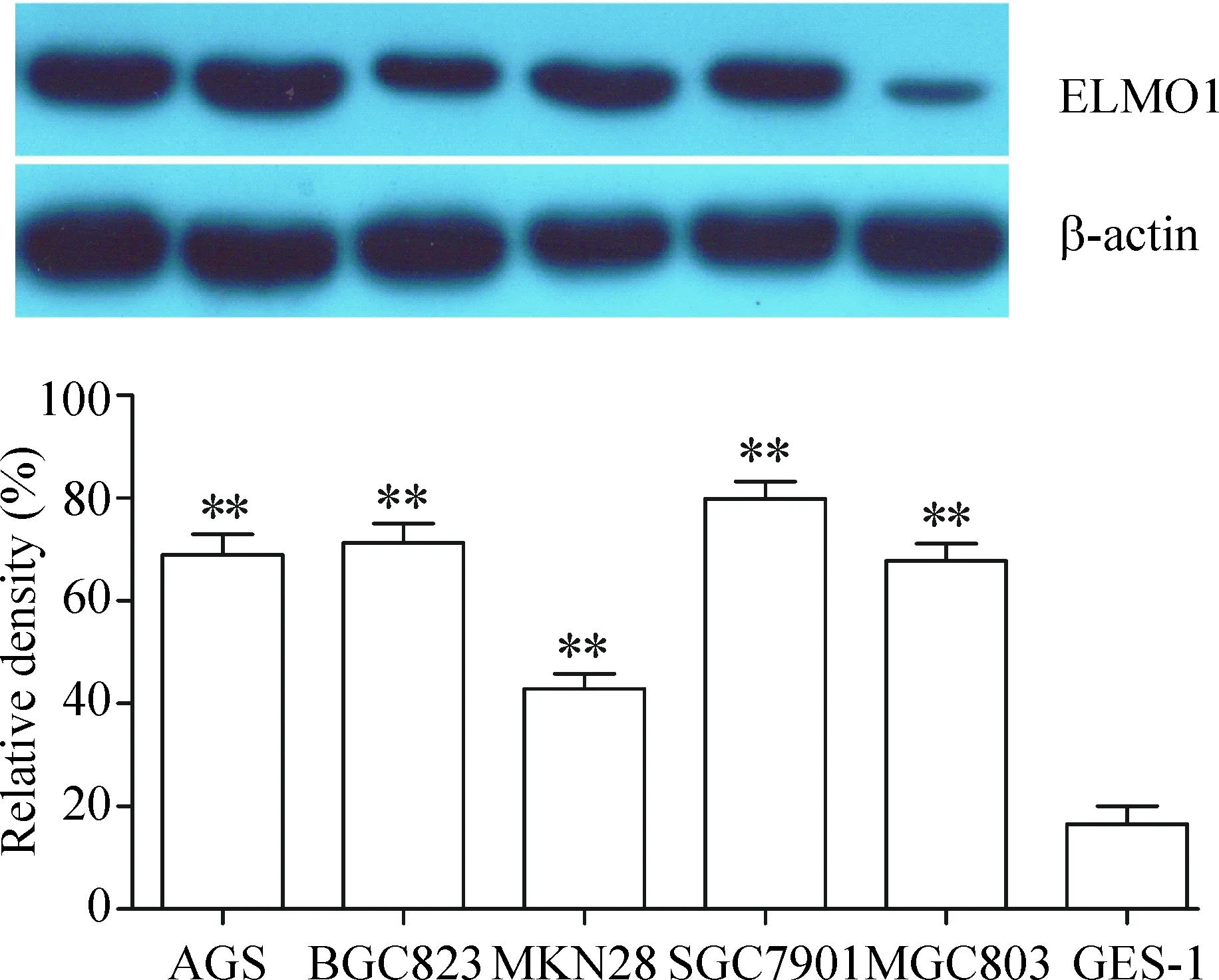
Figure 1.The protein expression of ELMO1 in normal gastric epithelial cells and different gastric cancer cell lines. Mean±SD.n=3.**P<0.01vsGES-1.
图1 不同胃癌细胞株和人正常胃黏膜上皮细胞ELMO1蛋白的表达水平
2 实时荧光定量PCR检测胃癌细胞系和人正常胃黏膜上皮细胞ELMO1 mRNA表达量的结果
胃癌细胞系中ELMO1 mRNA的表达水平同样显著高于人正常胃黏膜上皮细胞(P<0.01),其中SGC7901的 ELMO1 mRNA表达量相对最高,与Western blot的结果基本一致,因此选用SGC7901细胞株作为后续的实验研究,见图2。
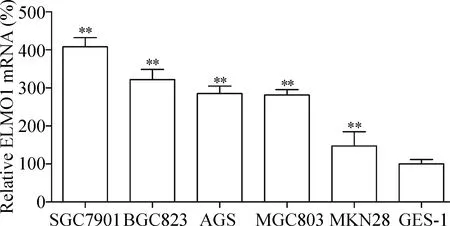
Figure 2.The mRNA expression of ELMO1 in normal gastric epithelial cells and different gastric cancer cell lines. Mean±SD.n=3.**P<0.01vsGES-1.
图2 不同胃癌细胞株和人正常胃黏膜上皮细胞ELMO1 mRNA的表达水平
3 ELMO1-siRNA在SGC7901细胞中的沉默效果
选用的3条ELMO1-siRNA(siRNA_001、siRNA_002和siRNA_003)对SGC7901细胞ELMO1 mRNA的沉默效果均较显著,如图3所示,其相对ELMO1 mRNA表达抑制率分别达88.3%(siRNA_001)、90.3%(siRNA_002)和88.7%(siRNA_003),差异显著(P<0.05),其中以siRNA_002对SGC7901细胞ELMO1 mRNA表达的抑制效率最高,因此选取siRNA_002用于后续的实验。
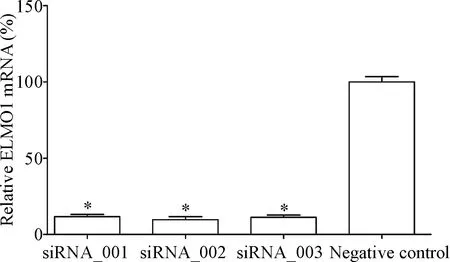
Figure 3.The result ofELMO1 silencing in SGC7901 cells. Mean±SD.n=3.*P<0.05vsnegative control.
图3 3种不同siRNA在SGC7901细胞中对ELMO1的沉默效果
4 细胞划痕实验检测ELMO1对SGC7901细胞迁移能力影响的结果
用沉默后的SGC7901细胞株做细胞划痕实验,如图4所示,划痕后18 h,阴性对照组和空白对照组的细胞迁移率分别为(38.4±1.9)%和(38.2±3.3)%,而ELMO1-siRNA组的细胞迁移率为(6.3±1.6)%,差异有统计学意义(P<0.01)。划痕36 h后,阴性对照组和空白对照组的细胞迁移率分别为(56.1±4.3)%和(53.5±4.4)%,而ELMO1 siRNA组的细胞迁移率为(35.4±5.5)%,其差异有统计学意义(P<0.01)。这说明沉默ELMO1可显著降低胃癌细胞的迁移能力。
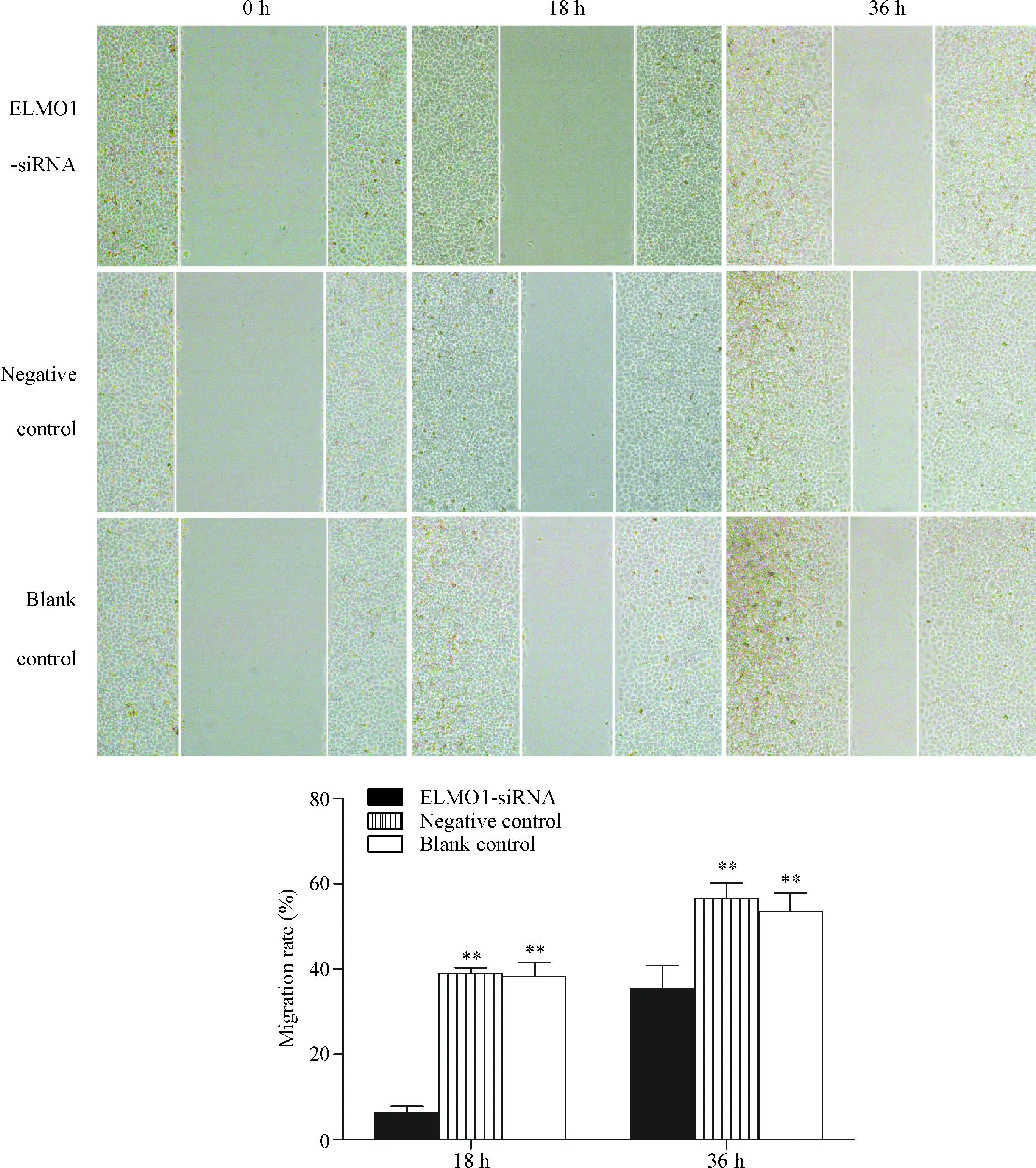
Figure 4.The effect of ELMO1-siRNA on the migration of SGC7901 cells (×40). Mean±SD.n=3.**P<0.01vsELMO1-siRNA.
图4 沉默ELMO1对SGC7901细胞迁移能力的影响
5 Trenswell检测ELMO1对SGC7901细胞迁移和侵袭能力影响的结果
如图5所示,在迁移实验中,培养48 h后,阴性对照组和空白对照组的SGC7901细胞迁移数分别为(140.0±15.7)个和(144.3±19.1)个,而ELMO1-siRNA组SGC7901细胞迁移数显著减少为(84.0±8.5)个,差异有统计学意义(P<0.01)。同样,在侵袭实验中,培养48 h后,阴性对照组和空白对照组的SGC7901细胞侵袭数分别为(95.7±7.5)个和(100.0±16.8)个,而ELMO1-siRNA组SGC7901细胞侵袭数显著减少为(36.3±7.0)个,差异有统计学意义(P<0.01)。以上实验说明沉默ELMO1可显著降低胃癌细胞的迁移和侵袭能力。
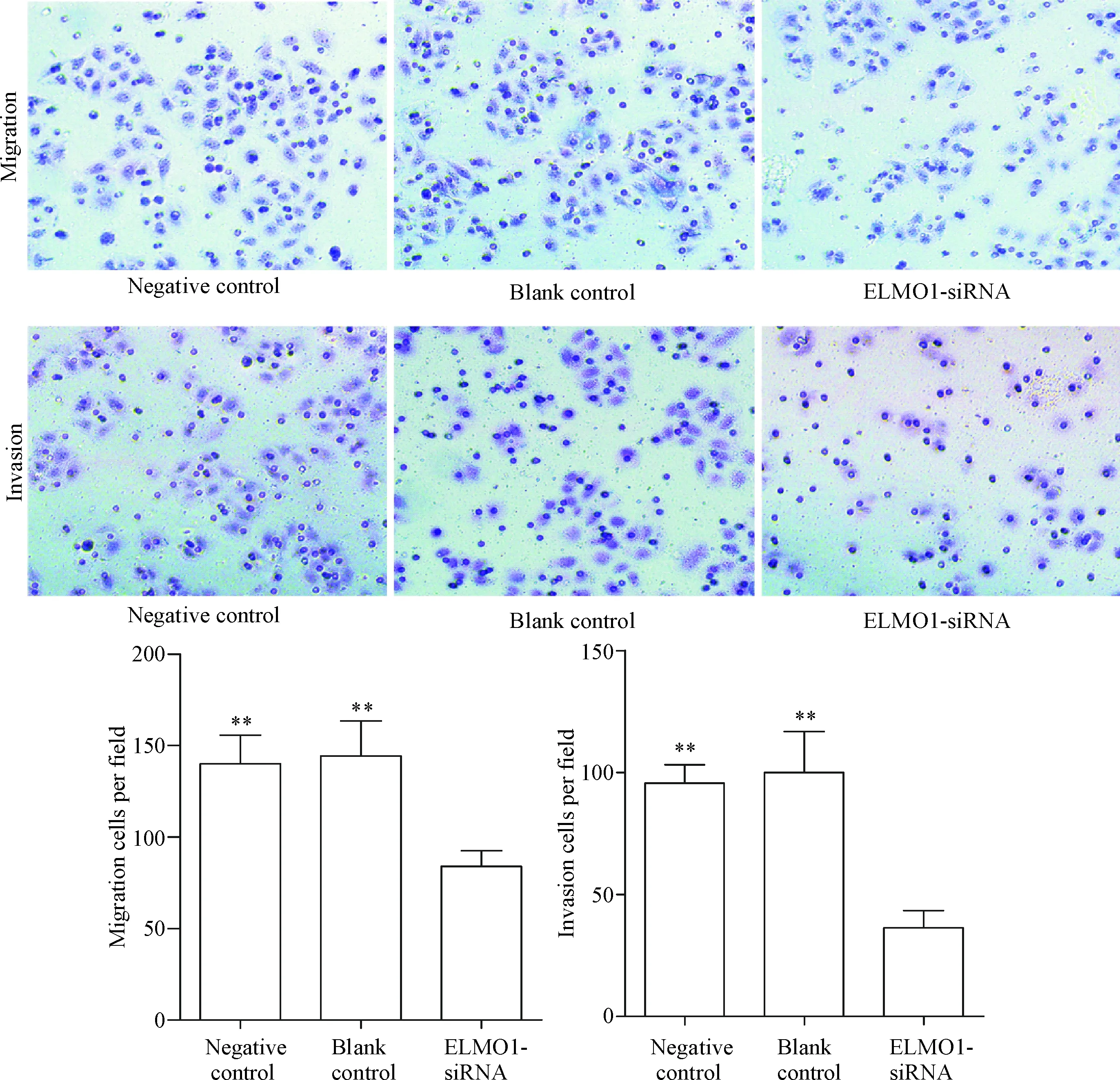
Figure 5.The effect of ELMO1-siRNA on the migration and invasion of SGC7901 cells (×200). Mean±SD.n=3.**P<0.01vsELMO1-siRNA.
图5 沉默ELMO1对SGC7901细胞迁移和侵袭能力的影响
讨 论
侵袭转移是恶性肿瘤最具特征性的生物行为之一,它是一个多因素参与的复杂生物学过程,肿瘤微环境的改变、基质降解、新血管形成、肿瘤细胞的脱黏附、迁移及免疫逃逸等多因素参与其中[10-11]。研究表明正常情况下Dock180 N端的SH3区域与C端的CZH2区域相互结合在一起,阻碍了Rac与Dock180 C端CZH2区域的结合,从而抑制Rac的激活,ELMO1与Dock180 N端的SH3区域结合成复合体后,降低了SH3区域与CZH2区域结合的稳定性,而促进Rac与CZH2区域结合,从而激活Crk/Dock180/Rac1信号通路,进而促进肿瘤细胞的趋化和转移[8,12]。众多研究发现ELMO1在原发性神经胶质瘤[13]、乳腺癌[14]、肝细胞癌[15]、卵巢癌[16-17]等多种恶性肿瘤中均有不同程度的异常表达,ELMO1/Dock180复合体在肿瘤细胞的趋化和转移过程中发挥重要作用。本研究利用Western blot和实时定量PCR实验分别检测了胃癌细胞株和人正常胃黏膜上皮细胞ELMO1的表达情况,结果发现胃癌细胞株ELMO1蛋白和mRNA的表达水平显著高于人正常胃黏膜上皮细胞,沉默ELMO1后,胃癌细胞株SGC7901细胞迁移和侵袭能力显著降低。通过以上研究结果的分析,我们推测ELMO1也可能是通过与Dock180结合成ELMO1/Dock180复合体而激活Crk/Dock180/Rac1信号通路,进而促进胃癌细胞的趋化、转移和侵袭。因此,ELMO1是促进胃癌细胞侵袭和转移的重要因素,有望成为胃癌侵袭转移治疗的有效靶点,但ELMO1促进胃癌细胞侵袭和转移的具体作用机制还不清楚,后续我们将利用人体胃癌组织和动物模型检测ELMO1与Dock180和Rac1之间的相互关系,进一步探讨ELMO1对胃癌侵袭、转移、增殖和凋亡能力的影响及其作用机制。
[1] Chen W, Zheng R, Zhang S, et al. The incidences and mortalities of major cancers in China, 2009[J]. Chin J Cancer, 2013, 32(3):106-112.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[3] Gumienny TL, Brugnera E, Tosello-Trampont AC, et al. CED-12/ELMO, a novel member of the CrkII/Dock180/Rac pathway, is required for phagocytosis and cell migration[J]. Cell, 2001, 107(1):27-41.
[4] Brzostowski JA, Fey P, Yan J, et al. The ELMO family forms an ancient group of actin-regulating proteins[J]. Commun Integr Biol, 2009, 2(4):337-340.
[5] Reddien PW, Horvitz HR. The engulfment process of programmed cell death inCaenorhabditiselegans[J]. Annu Rev Cell Dev Biol, 2004, 20:193-221.
[7] Brugnera E, Haney L, Grimsley C, et al. Unconventional Rac-GEF activity is mediated through the Dock180-ELMO complex[J]. Nat Cell Biol, 2002, 4(8):574-582.
[8] Lu M, Kinchen JM, Rossman KL, et al. PH domain of ELMO functions in trans to regulate Rac activation via Dock180[J]. Nat Struct Mol Biol, 2004, 11(8):756-762.
[9] 郭称明, 彭会云, 罗 文, 等. ELMO蛋白家族与恶性肿瘤侵袭转移关系的研究进展[J]. 中国病理生理杂志, 2015, 31(12):2296-2300.
[10]Zhou H, Huang S. Role of mTOR signaling in tumor cell motility, invasion and metastasis[J]. Curr Protein Pept Sci, 2011, 12(1(l):30-42.
[11]Watanabe H. Extracellular matrix-regulation of cancer invasion and metastasis[J]. Gan To Kagaku Ryoho, 2010, 37(11):2058-2061.
[12]Lu M, Ravichandran KS. Dock180-ELMO cooperation in Rac activation[J]. Methods Enzymol, 2006, 406:388-402.
[13]Jarzynka MJ, Hu B, Hui KM, et al. ELMO1 and Dock180, a bipartite Rac1 guanine nucleotide exchange factor, promote human glioma cell invasion [J]. Cancer Res, 2007, 67(15):7203-7211.
[14]Li H, Yang L, Fu H, et al. Association between Gαi2 and ELMO1/Dock180 connects chemokine signalling with Rac activation and metastasis [J]. Nat Commun, 2013, 4:1706.
[15]Jiang J, Liu G, Miao X, et al. Overexpression of engulfment and cell motility 1 promotes cell invasion and migration of hepatocellular carcinoma [J]. Exp Ther Med, 2011, 2(3):505-511.
[16]Wang J, Dai JM, Che YL, et al. Elmo1 helps Dock180 to regulate Rac1 activity and cell migration of ovarian cancer [J]. Int J Gynecol Cancer, 2014, 24(5):844-850.
[17]Wang H, Linghu H, Wang J, et al. The role of Crk/Dock180/Rac1 pathway in the malignant behavior of human ovarian cancer cell SKOV3[J]. Tumour Biol, 2010, 31(1):59-67.
(责任编辑: 陈妙玲, 罗 森)
Role of ELMO1 in invasion and migration of gastric cancer cells
GUO Cheng-ming1, PENG Hui-yun2, GAO Dian2, HU Yan2, YU Qiong-fang1, LUO Wen1
(1DepartmentofGastroenterology,TheSecondAffiliatedHospital,2DepartmentofPathogenBiologyandImmunology,SchoolofBasicMedicalSciences,NanchangUniversity,Nanchang330006,China.E-mail:qiongfangyu@yeah.net)
AIM: To reveal the role and function of engulfment and cell mobility 1 (ELMO1) in the invasion and migration of gastric cancer cells. METHODS: The expression of ELMO1 at protein and mRNA levels was detected in 5 kinds of gastric cancer cells and 1 normal human gastric epithelial cells by Western blot and real-time PCR, and the gastric cancer cells with the highest expression of ELMO1 were screened out. The cell transfection experiment was used to silenceELMO1 expression in the gastric cancer cells, and the effect ofELMO1 silencing on the invasion and migration of the gastric cancer cells was detected by Transwell assay. RESULTS: The expression level of ELMO1 in the gastric cancer cells was significantly higher than that in human normal gastric epithelial cells (P<0.01), and the SGC7901 cells had the highest expression level of ELMO1. ELMO1-siRNA significantly silenced the expression ofELMO1 in the SGC7901 cells (P<0.01). Silencing ofELMO1 expression significantly reduced the invasion and migration abilities of the human gastric can-cer cells (P<0.01). CONCLUSION: ELMO1 is highly expressed in the gastric cancer cells, and promotes the invasion and migration abilities of the gastric cancer cells. ELMO1 may become an effective target for the treatment of invasion and metastasis of gastric cancer.
Engulfment and cell mobility 1; Gastric cancer; Cell invasion; Cell migration
1000- 4718(2017)05- 0782- 06
2016- 11- 08
2017- 01- 06
国家自然科学基金资助项目(No. 81460462);南昌大学研究生创新基金资助项目(No.cx2015170)
R730.23
A
10.3969/j.issn.1000- 4718.2017.05.003
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0791-86259017; E-mail: qiongfangyu@yeah.net

