PXD101 诱导人前列腺癌细胞PC3凋亡的线粒体信号通路*
胡明珠, 李 磊, 曹 蕾, 张一梅, 罗海华, 胡水旺, 刘爱华, 姜 勇△
(1 南方医科大学病理生理学教研室, 广东省蛋白质组学重点实验室, 2南方医院呼吸科, 广东 广州 510515)
PXD101 诱导人前列腺癌细胞PC3凋亡的线粒体信号通路*
胡明珠1, 李 磊1, 曹 蕾1, 张一梅1, 罗海华1, 胡水旺1, 刘爱华2, 姜 勇1△
(1南方医科大学病理生理学教研室, 广东省蛋白质组学重点实验室,2南方医院呼吸科, 广东 广州 510515)
目的: 探讨PXD101(又称belinostat)诱导人前列腺癌PC3细胞凋亡的线粒体通路。方法: PXD101以不同刺激时间和剂量处理PC3细胞,CCK-8法检测细胞的活力;流式细胞术检测细胞的凋亡率和线粒体膜电位;Western blot检测线粒体凋亡相关蛋白Bcl-2、细胞色素C(Cyt C)和Bax; caspase-3活性检测试剂盒检测caspase-3活性。结果: PXD101能以时间和剂量依赖的方式抑制PC3细胞的存活(P<0.05),流式细胞术检测结果表明PXD101处理后PC3细胞的凋亡率明显增加(P<0.01)。PXD101能时间依赖性致线粒体膜电位降低和Bcl-2 蛋白含量明显下降,Bax蛋白含量上升,促进线粒体释放Cyt C 蛋白,caspase-3活性明显增强。结论: PXD101通过线粒体途径诱导人前列腺癌细胞系PC3细胞凋亡。
前列腺癌; PXD101; 细胞凋亡; 线粒体; PC3细胞
前列腺癌在欧洲等国家居男性恶性肿瘤发病率的首位,致死率一直位居前3名,而在中国,近几年前列腺癌发病率也呈上升趋势[1-3]。
癌细胞凋亡在抑制前列腺癌疾病进展过程中起着关键性作用[4-5]。PXD101(又称belinostat)是一种有效的异羟肟酸类组蛋白脱乙酰酶(histome deacetylase, HDAC)抑制剂,在体外是有细胞毒性的,这种毒性增强了化疗作用[6-7],且可以延迟卵巢癌和结肠癌中肿瘤的生长[8-9]。然而,PXD101在前列腺癌进展过程中的作用及其机制研究甚少,弄清PXD101诱导前列腺癌细胞凋亡的机制是突破点。现以PC3细胞为模型,探究PXD101诱导前列腺癌细胞凋亡的线粒体信号通路,为临床治疗前列腺癌提供参考。
材 料 和 方 法
1 细胞培养
人前列腺癌细胞系PC3由本实验室保存,采用含10%胎牛血清的1640培养液,于37 ℃、5% CO2条件下培养,待细胞生长至80%~90%融合度时进行传代。
2 主要试剂
PXD101(Denmark);RPMI-1640培养液和血清(Gibco);CCK-8活力检测试剂盒(南京恩晶生物科技有限公司);Annexin V-FITC/PI 细胞凋亡双染试剂盒(凯基公司);JC-1染液(Molecular Probes);抗Bcl-2和Bax抗体(Cell Signaling Technology);caspase-3活性检测试剂盒(Sigma);兔抗caspase-3抗体(Sigma);抗β-actin mouse mAb(HRP Conjugate)及HPR标记的抗鼠IgG购自CST; HPR标记的羊抗兔IgG购自Proteintech;其它试剂均为进口分装或国产分析纯。
3 主要方法
3.1 CCK-8法检测细胞活力 将PC3细胞以每孔5 000个接种于96孔板中,每孔100 μL培养基,于37 ℃、5%CO2条件下培养48 h后,向培养板中加入100 μL培养基,给予不同浓度PXD101(0、1、10和100 μmol/L)刺激48 h或10 μmol/L PXD101刺激不同时间(0、12、24和48 h),空白组为不含细胞的培养基,每组设3个复孔。37 ℃、5% CO2条件下培养到达相应时点后,除去原有培养基,并用新的培养基洗涤细胞2次,然后加入新的培养基和10 μL CCK-8,培养箱中继续培养2 h,酶标仪下测定450 nm波长处的吸光度(A)。
3.2 流式细胞术检测PC3细胞凋亡 PC3细胞以每孔1×105个接种于6孔板,37 ℃、5% CO2条件下培养24 h后更换培养基,给予10 μmol/L的PXD101刺激不同时间(0、24和28 h)。收集细胞及上清,根据试剂盒操作说明进行流式细胞定量分析。
3.3 线粒体膜电位(mitochondrial membrane potential, MMP)的测定 取对数生长期的PC3细胞,以每孔1×105接种于6孔板内。37 ℃、5% CO2条件下培养48 h后更换培养基,给予10 μmol/L的PXD101刺激不同时间(0、24、28 h)。以终浓度为5 μmol/L JC-1,充分混匀后37 ℃孵育15 min,DPBS清洗去除残余的JC-1后,流式细胞仪测定样本。其中激发波长488 nm,应用侧向散射光(SSC)和前向散射光(FSC)圈定要分析的细胞后,每个样本获取10 000个细胞。应用流式细胞仪软件分析数据。
3.4 Western blot检测蛋白表达 取对数生长期PC3细胞, 以每孔2×105接种于6孔板中。37 ℃、5% CO2条件下培养48 h后更换培养基,给予10 μmol/L的PXD101刺激不同时间(0、12、24和48 h), 收集各组细胞,用DPBS 洗2次,加入150 μL RIPA裂解液,置于冰上30 min。13 000×g离心10~15 min, 取上清,BCA蛋白定量后,加5×上样缓冲液,98 ℃变性5 min,采用12%的SDS-聚丙烯酰胺凝胶进行电泳,之后电转移至PVDF 膜上。5%脱脂奶粉封闭2 h,加入I 抗4 ℃孵育过夜。用TBST漂洗膜3次后,加入辣根过氧化酶标记的 II抗,室温孵育1 h。用TBST 漂洗3次,经SuperSignal West Pico化学发光底物显色,利用Kodak IS4 000R图像工作站进行化学发光检测。图片扫描后使用Gelpro软件测量蛋白条带的灰度值。
3.5 Caspase-3蛋白活性的检测 取对数生长期PC3细胞, 以每孔2×105接种于6孔板中。37 ℃、5% CO2条件下培养24 h后更换培养基,给予10 μmol/L的PXD101刺激不同时间(0、8、12和24 h), 收集各组细胞,按照caspase-3活性检测试剂盒说明书进行操作。以488 nm激发光,525 nm发射光的M5酶标仪进行检测。
4 统计学处理
用SPSS 13.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,组间均数的比较采用单因素方差分析(one-way ANOVA),两两比较行SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 PXD101对细胞活力的影响
CCK-8法检测结果显示,PXD101能够引起PC3细胞的活力下降,抑制细胞的生长,并且呈现剂量和时间依赖性,10 μmol/L PXD101刺激24 h能够引起PC3细胞的活力下降36.3%(P<0.01),见图1。
2 PXD101诱导PC3细胞凋亡
流式细胞术结果表明,PXD101刺激24 h组的凋亡率为18.01%±2.37%,刺激48 h组的凋亡率为48.27%±5.10%,与对照组(3.85%±1.22%)相比,差异有统计学显著性(P<0.01),见图2。
3 PXD101引起PC3细胞线粒体膜电位的变化
本研究中采用荧光探针JC-1的单体JC-1/聚合率比率这一指标反映线粒体膜电位。结果表明PXD101刺激后,单体JC-1/聚合率比例有所增加,PXD101刺激24 h组比例增加至对照组的(5.65±0.41)倍,刺激48 h组比例增加至对照组的(30.14±2.00)倍,差异有统计学显著性(P<0.01),见图3。
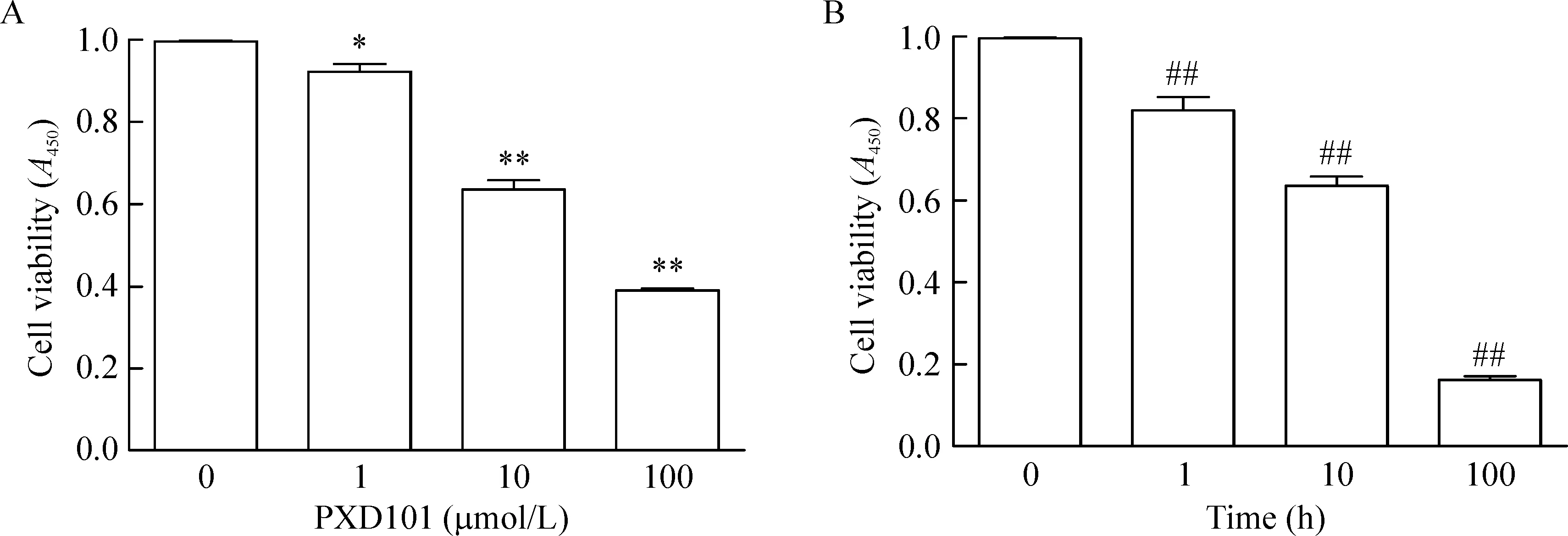
Figure 1.The effect of PXD101 on PC3 cell viability detected by CCK-8 assay. A: the viability of the PC3 cells treated with PXD101 at different doses; B: the dynamic change of PC3 cell viability induced by 10 μmol/L PXD101 treatment for different time. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group;##P<0.01vs0 h group.
图1 PXD101对PC3细胞活性的影响
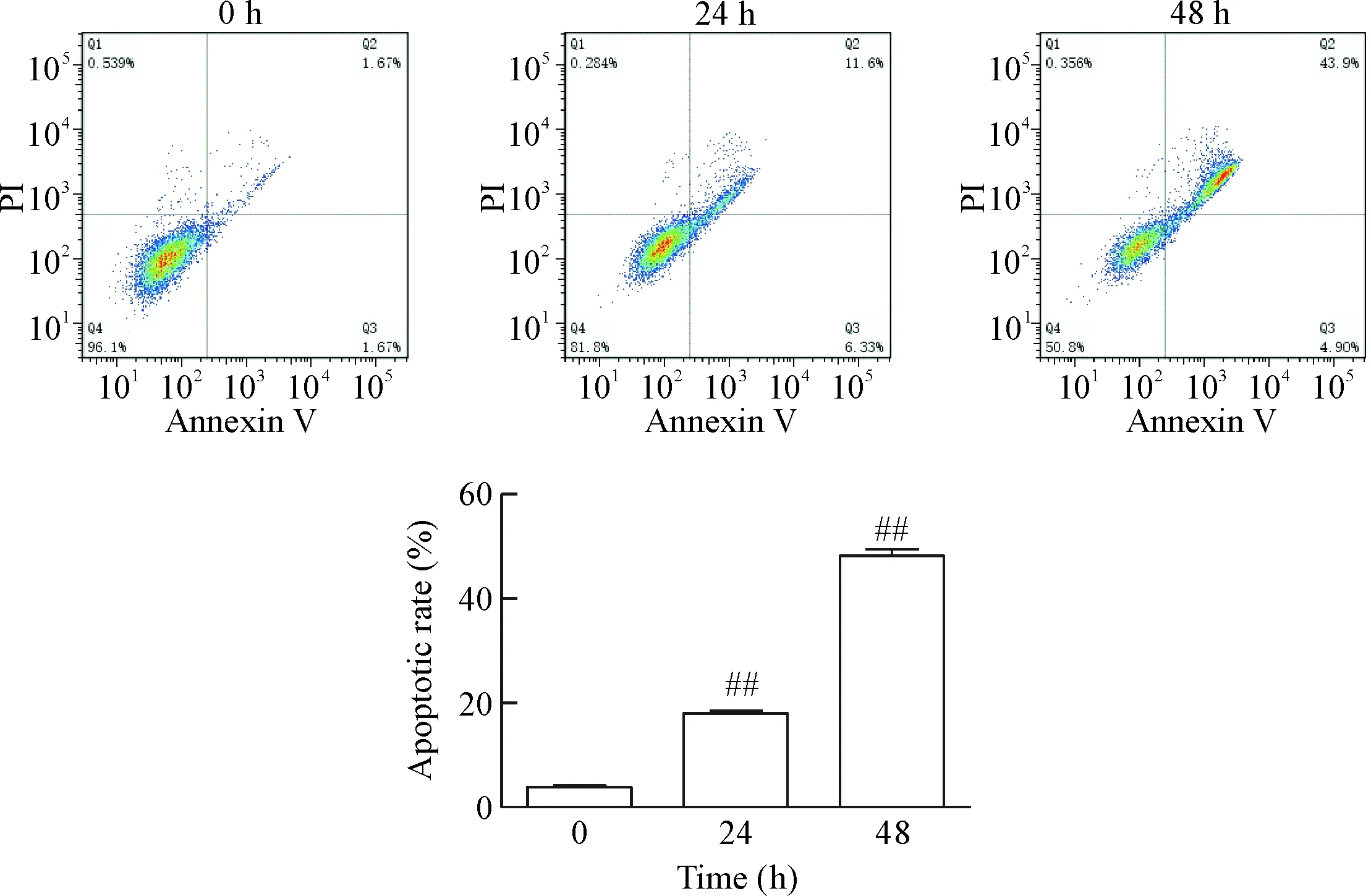
Figure 2.The effect of PXD101 on the apoptotic rate of PC3 cells detected by flow cytometry. Mean±SD.n=3.##P<0.01vs0 h group.
图2 PXD101对PC3细胞凋亡的影响
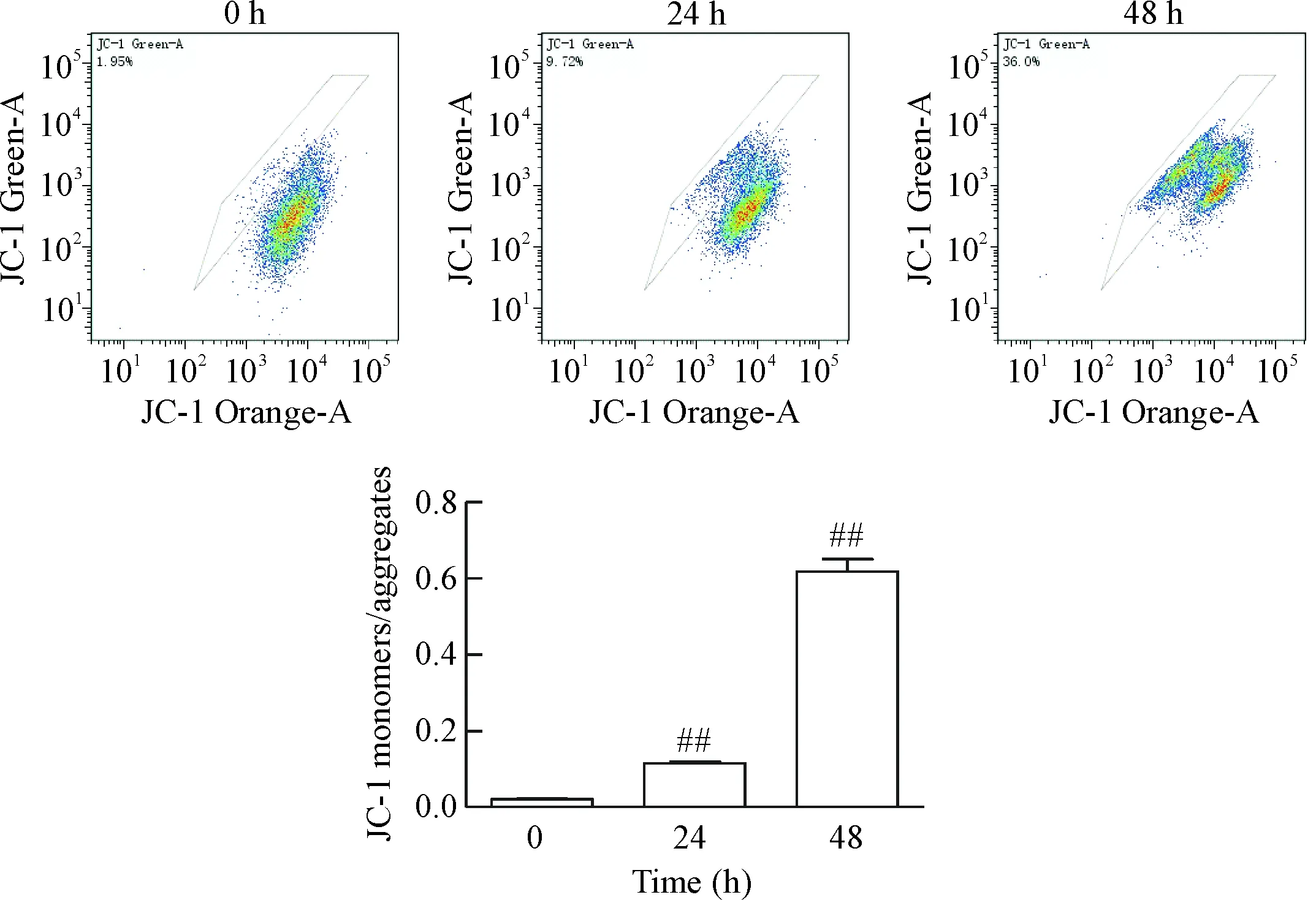
Figure 3.The effect of PXD101 on the mitochondrial membrane potential of PC3 cells. Mean±SD.n=3.##P<0.01vs0 h group.
图3 PXD101对PC3细胞线粒体膜电位的影响
4 PXD101通过线粒体通路介导PC3细胞发生凋亡
为更进一步研究PXD101诱导PC3细胞发生凋亡的分子机制,采用Western blot对线粒体介导的凋亡通路所涉及的一系列信号分子进行检测,并提取了PC3细胞的胞质和线粒体蛋白测定细胞色素C(cytochrome C, Cyt C)的表达,结果表明,PXD101刺激后,随着时间的延长,Bcl-2 蛋白含量明显下降,Bax蛋白含量上升,线粒体Cyt C 蛋白从线粒体释放入胞浆,差异有统计学意义(P<0.01),见图4。
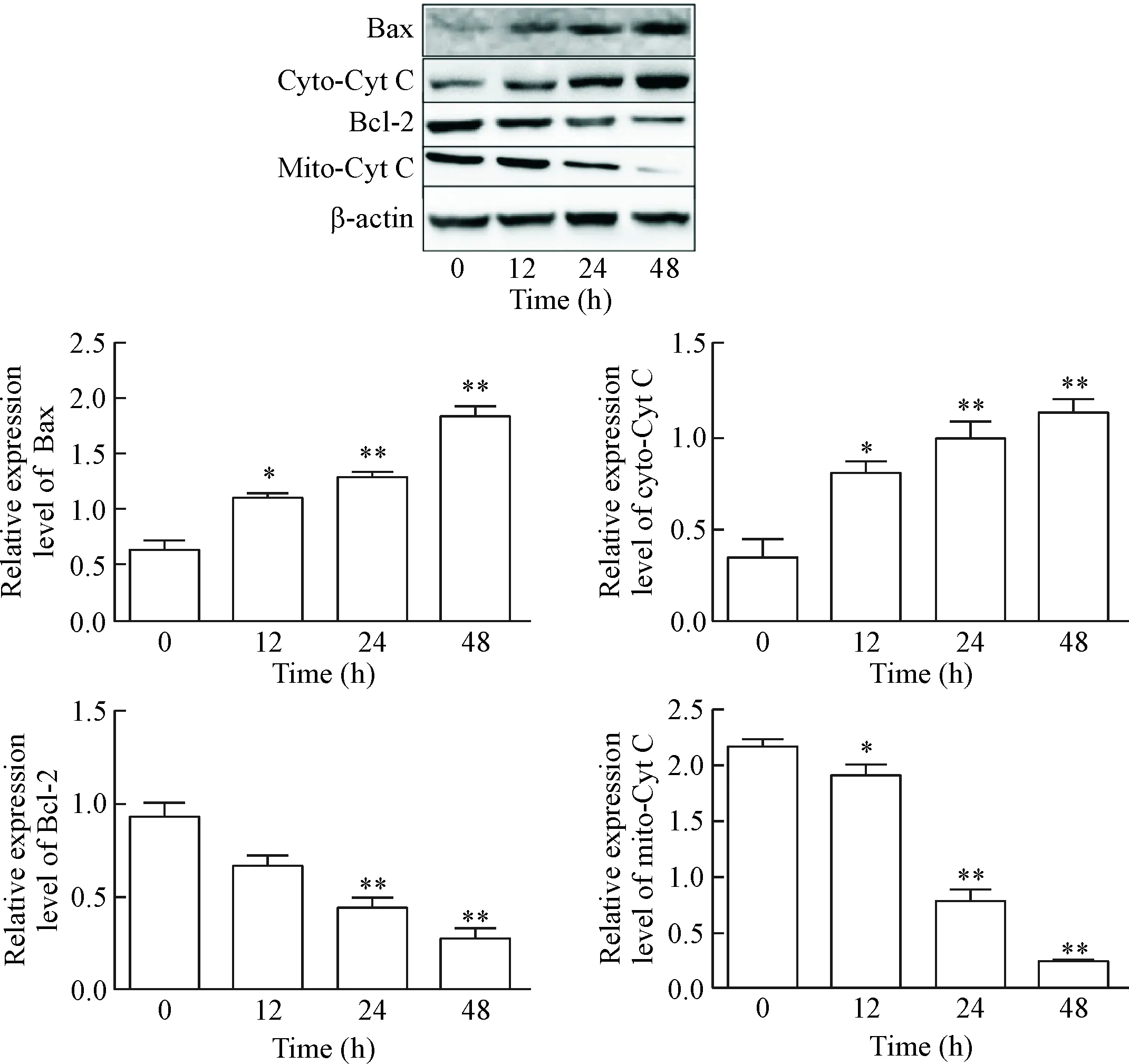
Figure 4.The expression of mitochondrial apoptosis pathway-related proteins Bcl-2, Bax, cytoplasmic cytochrome C (cyto-Cyt C) and mitochondrial cytochrome C (mito-Cyt C) determined by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vs0 h group.
图4 PXD101对PC3细胞线粒体通路相关蛋白表达的影响
5 PXD101引起PC3细胞caspase-3活性改变
Caspase-3活性检测表明,PXD101刺激PC3细胞后,随着时间的延长,caspase-3活性逐渐增强,刺激24 h时检测A值增加至0 h的(6.66±0.94)倍,差异有统计学显著性(P<0.01),见图5。
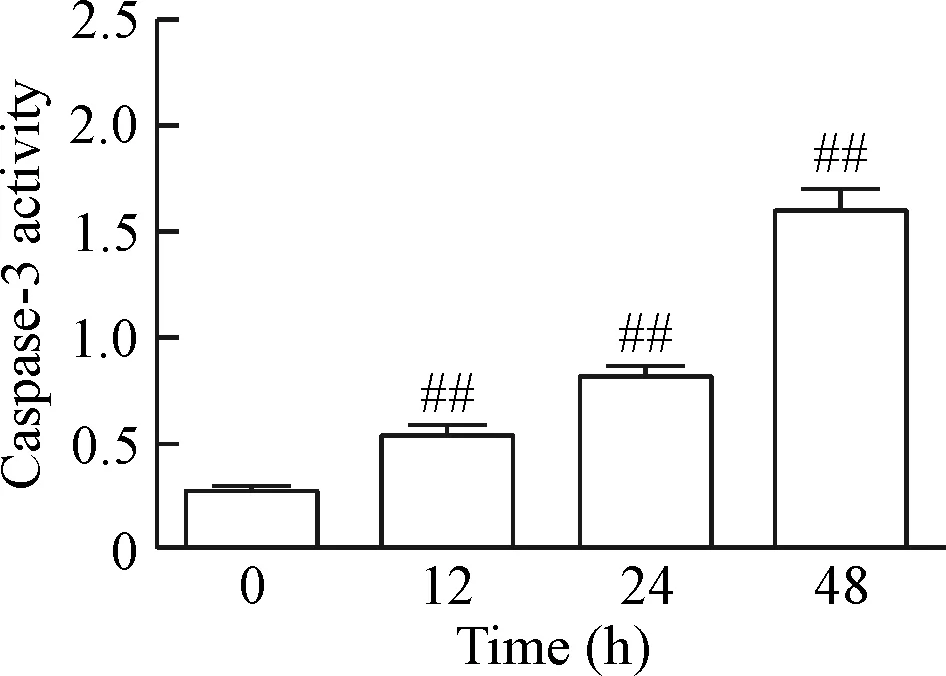
Figure 5.Effects of treatment with PXD101 for different time on the changes of caspase-3 activity in the PC3 cells. Mean±SD.n=3.##P<0.01vs0 h group.
图5 PXD101对PC3细胞caspase-3酶活性的影响
讨 论
前列腺癌是常见的非皮肤癌,近几年随着研究的深入与技术的发展,越来越多的研究表明表观遗传学的改变在癌细胞中起着重要作用[10],所以通过乙酰化、甲基化、磷酸化、泛素化或三磷酸腺苷核糖基化来修饰组蛋白是一个重要的治疗途径,而在这些修饰中,组蛋白N末端尾部赖氨酸残基的乙酰化能够显著降低组蛋白对DNA的亲和力,导致与肿瘤抑制和(或)分化相关基因的表达[11]。这就提示我们HDAC抑制剂对于治疗癌症具有非常重要的意义和前景。有研究表明,HDAC在前列腺癌中的活性升高,这也促进了HDAC抑制剂作为抗肿瘤药物的研发[12-13],但是目前用于临床的HDAC抑制剂只有辛二酰苯胺异羟肟酸(SAHA),而且仅用于皮肤T细胞淋巴瘤。而近几年关于新型羟肟酸类 HDAC 抑制剂PXD101研究越来越多,而对于它促进癌细胞凋亡的机制尚不完善。为了探讨PXD101对前列腺癌细胞凋亡的影响,本课题选取人前列腺癌细胞系PC3,采用CCK-8法检测了不同浓度及不同处理时间下,PXD101对PC3细胞活性的影响,结果表明,PXD101能够明显降低PC3细胞活性,并且呈现剂量与时间依赖性。进一步研究PXD101所导致的PC3细胞活性下降是否与细胞凋亡相关,流式细胞技术分析结果显示,PXD101能够显著地引起PC3细胞发生凋亡。
研究表明,PXD101促进癌细胞凋亡与Bcl-2蛋白家族有关[14-15],而Bcl-2蛋白家族在细胞凋亡的线粒体途径中起着重要作用,因此我们进一步研究PXD101促进前列腺癌细胞凋亡是否是通过线粒体途径。流式细胞术结果表明,PXD101呈时间依赖性地致MMP降低,Western blot检测发现Bcl-2 蛋白含量明显下降,Bax蛋白含量上升,线粒体Cyt C从线粒体释放到胞浆。Caspase-3活性检测试剂盒检测caspase-3 活性增强。这提示PXD101诱导PC3细胞凋亡是通过线粒体凋亡通路的。
综上所述,PXD101通过线粒体途径诱导人前列腺癌细胞系PC3细胞凋亡,从而阻止前列腺癌的发生发展。本研究针对临床治疗前列腺癌提供了新的思路。
[1] Lavery H, Cooperberg M. Clinically localized prostate cancer in 2017: A review of comparative effectiveness[J]. Urologic oncology, 2016, 35(2):40-41.
[2] Sathianathen NJ, Lamb A, Nair R, et al. Updates of prostate cancer staging: Prostate-specific membrane antigen[J]. Invest Clin Urol, 2016, 57(Suppl 2):S147-S154.
[3] 周 磊, 李 扬, 苏 静, 等. 维生素K3对雄激素非依赖性前列腺癌PC-3M细胞的凋亡诱导作用[J]. 中国病理生理杂志,2007, 23(7):1339-1342.
[4] 刘艳波, 沈维高, 芦丽莉, 等. Survivin-siRNA对前列腺癌DU145细胞的促凋亡作用[J]. 中国病理生理杂志, 2010, 26(8):1474-1478.
[5] Chen M, Zhou B, Zhong P, et al. Increased intracellular reactive oxygen species mediates the anti-cancer effects of WZ35 via activating mitochondrial apoptosis pathway in prostate cancer cells[J]. The Prostate, 2016, 77(5):489-504.
[6] 彭晓丹, 诸梦露, 高绿芬, 等. FK228和雷帕霉素协同促进人乳腺癌细胞凋亡和细胞周期阻滞[J]. 中国病理生理杂志,2015, 31(4):577-584.
[7] Damaskos C, Valsami S, Spartalis E, et al. Histone deacetylase inhibitors: a novel therapeutic weapon against medullary thyroid cancer?[J]. Anticancer Res, 2016, 36(10):5019-5024.
[8] Qian X, Larochelle WJ, Ara G, et al. Activity of PXD101, a histone deacetylase inhibitor, in preclinical ovarian cancer studies[J]. Mol Cancer Ther, 2006, 5(8): 2086-2095.
[9] Plumb JA, Finn PW, Williams RJ, et al. Pharmacodynamic response and inhibition of growth of human tumor xenografts by the novel histone deacetylase inhibitor PXD101[J]. Mol Cancer Ther, 2003, 2(8):721-728.
[10] Peprah E, Xu H, Tekola-Ayele F, et al. Genome-wide association studies in Africans and African Americans: expanding the framework of the genomics of human traits and disease[J]. Public Health Genomics, 2014, 18(1):40-51.
[11] 张水莲, 沈 静. 表观遗传修饰参与细胞恶性转化过程中FHIT基因的表达调控[J]. 中国病理生理杂志,2015, 31(10):1846-1850.
[12] Ellis L, Hammers H, Pili R. Targeting tumor angiogenesis with histone deacetylase inhibitors[J]. Cancer Lett, 2009, 280(2):145-153.
[13] Abbas A, Gupta S. The role of histone deacetylases in prostate cancer[J]. Epigenetics, 2008, 3(6):300-309.
[14] Ieranò C, Chakraborty A, Nicolae A, et al. Loss of the proteins Bak and Bax prevents apoptosis mediated by histone deacetylase inhibitors[J]. Cell Cycle, 2013, 12(17):2829-2838.
[15] Hwang JJ, Kim YS, Kim MJ, et al. Histone deacetylase inhibitor potentiates anticancer effect of docetaxel via modulation of Bcl-2 family proteins and tubulin in hormone refractory prostate cancer cells[J]. J Urol, 2010, 184(6): 2557-2564.
(责任编辑: 陈妙玲, 罗 森)
PXD101 induces apoptosis of human prostate cancer cell line PC3 by mitochondrial signal pathway
HU Ming-zhu1, LI Lei1, CAO Lei1, ZHANG Yi-mei1, LUO Hai-hua1, HU Shui-wang1, LIU Ai-hua2, JIANG Yong1
(1DepartmentofPathophysiology,KeyLaboratoryofProteomicsofGuangdongProvince,SouthernMedicalUniversity,2DepartmentofRespiratoryDisease,NanfangHospital,Guangzhou510515,China.E-mail:jiang48231@163.com)
AIM: To explore the mitochondrial pathway in the apoptosis of PC3 cells induced by PXD101 (also named as belinostat). METHODS: PC3 cells were treated with PXD101 at different doses or stimulated with PXD101 for different time. The effect of PXD101 on the viability of PC3 cells was measured by CCK-8 assay. The apoptotic rates and the mitochondrial membrane potential (MMP) were analyzed by flow cytometry. The protein levels of Bcl-2, Bax and cytochrome C (Cyt C) were determined by Western blot. The caspase-3 activity were tested by caspase-3 activity assay kit.RESULTS: The viability of the PC3 cells was inhibited by PXD101 in a dose- and time-dependent manner. Flow cytometric analysis showed that the apoptotic rates were increased in the cells treated with PXD101 (P<0.01). At the same time, PXD101 induced the decreases in MMP and Bcl-2, the release of Cyt C, and the increase in caspase-3 activity. CONCLUSION: PXD101 induces the apoptosis of human prostate cancer cell line PC3 by mitochondrial signal pathway.
Prostate cancer; PXD101; Apoptosis; Mitochondria; PC3 cells
1000- 4718(2017)05- 0793- 05
2017- 01- 05
2017- 03- 15
国家自然科学基金资助项目(No. 81372030); 南方医科大学南方医院院长基金(No. 2015Z005)
R363.21; R730.23; R737.25
A
10.3969/j.issn.1000-4718.2017.05.005
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-61648231; E-mail: jiang48231@163.com

