反向高效液相色谱法分离检测乳粉中的酪蛋白
刘梦云,申雨珂,靳羽晓,袁海娜,2,鲍文娜,2,尤玉如,刘士旺
(1.浙江科技学院生化学院/轻工学院,杭州310023;2.浙江省农产品化学与生物加工技术重点实验室,杭州310023;3.浙江省农业生物资源生化制造协同创新中心,杭州310023)
反向高效液相色谱法分离检测乳粉中的酪蛋白
刘梦云1,2,3,申雨珂1,靳羽晓1,袁海娜1,2,鲍文娜1,2,尤玉如1,刘士旺1,2,3
(1.浙江科技学院生化学院/轻工学院,杭州310023;2.浙江省农产品化学与生物加工技术重点实验室,杭州310023;3.浙江省农业生物资源生化制造协同创新中心,杭州310023)
以C8色谱柱为分离柱,利用反相高效液相色谱法,在流速1.0 mL/min,检测波长220 nm,柱温25℃,0.1%TFA水溶液为A流动相;100%乙腈溶液为B流动相的梯度洗脱条件下对乳粉中酪蛋白的4种组分(αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白和κ-酪蛋白)分离检测。结果表明,该法具有良好的线性关系,重复性好,加标回收率高,对全脂牛乳粉、羊乳粉等乳粉中酪蛋白组分的分离测定有很好的效果。
反相高效液相色谱;酪蛋白;牛乳粉;羊乳粉
0 引言
酪蛋白(Casein,CN)是乳品中重要的蛋白组分,主要包括αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白和κ-酪蛋白[1,2,3],具有促进磷、钙等离子的吸收[4]和调节人体免疫等功能[5]。酪蛋白分子链中包含许多生物活性序列[6]且功能不同[7],如α-CN是乳源生物活性肽的重要来源,但它会使酪蛋白胶束颗粒增大,易在婴儿胃中结块,不易消化[8];β-CN适于配制婴儿配方奶粉,提高配方乳粉的消化性[9];κ-CN可刺激新生儿胃肠内有益菌落的生长。检测技术的发展,使得乳蛋白的检测变得快速、准确[10-11],由于液相色谱法具有较好的重现性,因此应用较广[12]。本研究通过改进实验条件对全脂牛奶粉和羊奶粉中的酪蛋白进行了分析和检测,并对酪蛋白含量进行了测定与比较,以期为乳制品的安全检测提供参考。
1 实验
1.1 材料与试剂
市售全脂牛乳粉,羊乳粉。
α-酪蛋白(α-CN),β-酪蛋白(β-CN),κ-酪蛋白(κ-CN)标准品,三氟乙酸(TFA)和甲醇为色谱纯;其他试剂均为分析纯。
样品缓冲液:含有浓度为8 mol/L尿素,浓度为165 mmol/L的Tris碱,浓度为44 mmol/L柠檬酸钠和质量分数0.5%的DTT(pH=8.0)。
1.2 仪器设备与工作条件
1.2.1 仪器设备
高效液相色谱仪(Waters e2695,2489紫外可见光检测器,Empower色谱工作站);Sepax Bio-C8(4.6 nm×250 nm,300Å,5 μm i.d.);Satorius普及型PB-10 pH计;电子天平SCA-210。
1.2.2 工作条件
参考Ivan Bonizzi[13]的方法并稍作改动,以C8色谱柱作为分离柱,并将柱子的再平衡时间延长至15 min,流速由0.8 mL/min提高到1 mL/min,而流动相B则由质量分数为100%甲醇溶液替代原方法中的含有0.1%的乙腈溶液。
流动相A:质量分数0.1%的TFA水溶液;流动相B:质量分数100%甲醇溶液;梯度条件:0~40 min流动相B从30%线性渐变到50%,40~42 min流动相B从50%上升到100%,42~43 min流动相B维持100%,43~46 min流动相B则线性下降至30%,46~61 min为柱子的再平衡时间此时流动相B为30%。
流速1 mL/min;检测波长220 nm;柱温25℃;进样体积10 μL。
2 方法
2.1 酪蛋白的提取
取20 g奶粉,用40℃去离子水搅拌均匀,使奶粉充分溶解。转速为8 000 r/min(4℃)离心10 min,弃去上层脂肪,保留上清液。上清液用浓度为1 mol/L的HCl调节pH值至4.6,转速为8 000 r/min(4℃)离心10 min,弃上层液。沉淀分别用去离子水、体积分数为95%酒精、乙醇-乙醚(体积比1∶1)、乙醚各洗涤两遍,真空抽滤,于55℃干燥箱烘干至恒重,-20℃保存备用。
2.2 标准溶液的配制
分别称取5 mgα-CN,β-CN,κ-CN蛋白标准品于同一离心管中,加入5 mL样品缓冲液,振荡混匀后,即得标准储备液,放入4℃冰箱备用。上机前用0.45 μm滤膜过滤后直接进样。
2.3 酪蛋白样品的制备
准确称量1.0 mg样品于1.5 mL离心管中,加入1 mL样品缓冲液,混匀后室温下静置1 h,使样品充分溶解。0.45 μm滤膜过滤后直接进样分析。
3 结果与讨论
3.1 检测波长的选择
含有酪氨酸、苯丙氨酸和色氨酸的蛋白质在280 nm处有较强的紫外吸收,而肽键在200~220 nm处的紫外吸收则强于其280 nm处的吸收[14]。214 nm和220 nm被广泛应用于蛋白的检测中,但因220 nm多用于液相中乳蛋白的检测,因此本研究选择220 nm作为检测波长。
3.2 流速的选择
流速的大小影响着蛋白质的出峰时间以及分离效果,若流速较大会使色谱柱的负荷过大,造成柱子的损伤;若流速过小可能会在流动过程中不能提供足够的动力,不利于蛋白质的分离检测,因此选择1.0 mL/min作为实验流速。
3.3 纯品酪蛋白组分的分离
含有α-CN,β-CN,κ-CN的混合标准溶液在色谱柱梯度洗脱程序中运行61 min,4种酪蛋白组分在25 min内即可实现有效分离,且各组分酪蛋白的保留时间相比于Bonizzi等人[13]检测方法(运行时间51 min)显著减少。图1为混合标准液的色谱图,由于κ-CN的遗传变异体A和B型中糖基化的不同程度,使κ-CN在色谱图上的峰有3个[15],并且因其分子量最小而率先被洗脱。αs1-CN和αs2-CN构成了α-CN,因此在色谱图上能明显的看到αs1-CN和αs2-CN的两个洗脱峰,这说明α-CN实现了较好的分离[16]。为了能够实现酪蛋白组分的较好的分离,本实验将标准溶液放入4℃冰箱保存,这在一定程度上可以减少或避免蛋白质的降解,减少实验误差[13]。
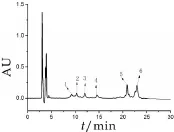
图1 混合标准溶液的色谱
3.4 标准曲线的建立
本研究采用外标法,准确移取0.4,0.6,0.8,1.0 mL质量浓度为5.0 g/L的标准混合溶液于1.5 mL离心管中,再分别加入0.6,0.4,0.2,0 mL样品缓冲液,震荡摇匀后即可得到质量浓度分别为0.4,0.6,0.8,1.0 g/L的标准混合溶液。根据蛋白浓度和相应峰面积得到αs1-CN,αs2-CN,β-CN,κ-CN的标准曲线(表1)。结果表明,酪蛋白的质量浓度和对应的峰面积之间的线性相关系数R2有着远高于0.99的精度,可以满足检测要求。

表1 4种标准蛋白的线性回归方程及相关系数
3.5 方法的重复性实验
取适量的自提酪蛋白,按照2.3的方法处理样品。重复进样6次,计算各蛋白组分的保留时间和峰面积,并以此为基础计算出相应的相对标准偏差(RSD),结果显示(表2),峰面积的RSD在1.06%~4.60%范围内,保留时间的RSD在0.57%~1.93%范围内,该方法具有很好的重复性。
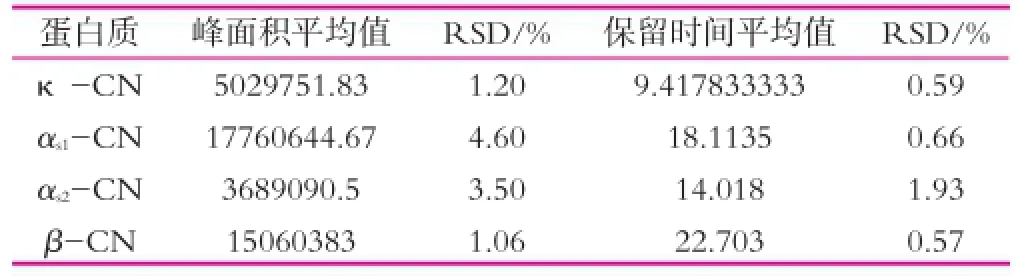
表2 分析方法的重复性
3.6 加标回收率分析
准确称取一定质量的自提酪蛋白样品,分别加入一定质量浓度的α-CN,β-CN,κ-CN标准酪蛋白,按2.3方法处理后进行检测分析,结果如表3所示。由表3可以看出,4种酪蛋白的加标回收率在95.2%~100.6%范围之内,RSD在0.58%~1.8%范围之内,说明该方法有较高的回收率,并且在实验条件下的稳定性良好。

表3 4种主要酪蛋白的回收率
3.7 样品的差异性分析
在上述实验条件下,对自提的不同的酪蛋白组分进行分离检测,实验结果如图2所示。两种乳粉中的酪蛋白组分的色谱图与酪蛋白标准混合液的色谱图相比,分离行为以及出峰顺序较为一致[13],即都含有4种主要的单体成分。羊乳酪蛋白与牛乳酪蛋白色谱结果相比,两种奶中的K-CN的质量浓度都比较低,但牛乳酪蛋白中αs1-CN和αs2-CN质量浓度比较高,羊乳酪蛋白中β-CN质量浓度则明显的高于牛乳酪蛋白,并且两种酪蛋白的组分质量浓度也不相同[17]。由此可见,αs1-CN和αs2-CN,β-CN,κ-CN是构成酪蛋白的主要成分[18],并且不同的乳源中所含酪蛋白的质量和比例也是不相同的,这种不相同在色谱图上可以清晰地得到,差异性可能是因为物种基因的不同造成的,并且乳蛋白的各种成分含量受季节、温度、奶源的种类和健康状况、挤乳时间及次数等诸多条件影响,会在一定范围内波动,从而影响蛋白质结构和组成的不同。两种奶粉中酪蛋白的质量如表4所示。
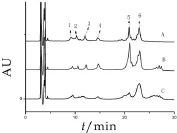
图2 牛乳酪蛋白和羊乳酪蛋白的色谱
4 结论
反相高效液相色谱法是分离蛋白质的有效且快速的方法,其高效稳定的分离能力可很好的用于蛋白质的定量检测。本研究以C8为分离柱,流速1.0 mL/min,检测波长220 nm,质量分数为0.1%TFA水溶液为A流动相、100%乙腈溶液为B流动相的梯度洗脱条件下,对经过样品缓冲液处理的乳粉中酪蛋白的组分进行分析和检测,获得了很好的分离效果和定量结果。结果表明,该法具有良好的线性关系(R2>0.99),重复性好(RSD<1.93%)加标回收率高(95.2%~100.6%),对全脂牛乳粉、羊乳粉等乳粉中酪蛋白组分的分离测定有很好的效果。两种乳粉中具有相同的酪蛋白成分,但是各种成分在含量上具有一定的差异。随着对液相色谱方法研究的不断深入、前处理方法以及分离体系的不断完善和其他联用检测手段的快速发展,液相色谱方法必将能够发挥其优势,在食品、蛋白质分析检测领域得到更加广泛和实际的应用。

表4 牛乳和羊乳粉中酪蛋白的含量测定
[1]余飞,陈云霞.凝固型酸奶的发酵制作与工艺研究[J].粮油食品,2013,21(1):71-75.
[2]FRAAELL H M,JIMENEZ F.Nomenclature of the proteins of cow’s milk-sixth revision[J].Journal of Dairy Science,2004,87(6):1641-1674.
[3]MOITZI C,PORTNAYA I,GLATTER O,et al.Effect of tempera⁃ture on self-assembly of bovineβ-casein above and below isoelectric pH:Structural analysis by cryogenictransmission electron microscopy and small-angle X-ray scattering[J].Langmuir,2008,24(7):3020-3029.
[4]KITTS D D,YUAN Y V.Caseinophosphopeptides and calcium bio⁃availability[J].Trends in Food Science and Technology,1992,3(2):31-35.
[5]MCCANN K B,SHIELL B J,MICHALSKI W P,et al.Isolation and characterisation of a novel antibacterial peptide from bovine αS1-casein [J].International Dairy Journal,2006,16(4):316-323.
[6]豆剑伟,袁永俊,刘纳,等.高效液相色谱法测定酪蛋白组分[J].食品与发酵科技,2016,52(4):90-101.
[7]VISSER S.Proteolytic enzymes and their relation to cheese ripening and flavour:an overview[J].Journal of Dairy Science,1993,76:329–350.
[8]李武祎,郭顺堂,俞树孝,等.酪蛋白组分分离技术及消化性测定[J].食品科学,2005,26(7):70-73.
[9]张艳,胡志和,赖宜萍.牛乳中αs-、β-酪蛋白组分的分离[J].食品科学,2009,30(14):31-36.
[10]KRALY J,ABUL FAZAL M,SCHOENHERR R M.Metabolic fin⁃gerprinting with capillary electrophoresis[J].Anal Chem,2006,78:4097-4110.
[11]LEE M C G,WU K S Y,NGUYEN T N T,et al.Sodium dodecyl sulfate polyacrylamide gel electrophoresis for direct quantitation of protein adsorption[J].AnalyticalBiochemistry,2014,465(15):102-104.
[12]王浩,张志国,常彦忠,等.RP-HPLC法对乳制品中主要牛奶蛋白的分离及定量测定[J].食品科学,2009,30(24):376-380.
[13]BONIZZI I,BUFFONI J N,FELIGINI M.Quantification of bo⁃vine casein fractions by direct chromatograph⁃ic analysis of milk.Approaching the application to a real production context[J].Journal of Chromatography A,2009,1216:165-168.
[14]LIN S J,SUN J,CAO D D.Distinction of different hert-treated bo⁃vine milk by native-page fingerprinting of their whey proteins[J]. Food chemistry,2010,121(3):803-808.
[15]BORDIN G,CORDEIRO RAPOSO F,CALLE B,et al.Identifica⁃tion and quantification of major bovine milk proteins by liquid chro⁃ matography[J].J.Chromatogr A,2001,928:63-76.
[16]田兰,陈春丽,马晓丽,等.毛细管电泳法对乳及乳制品中乳源蛋白的测定[J].食品研究与开发,2013,34(4):81-84.
[17]王丽娜,李子超,李昀锴,等.基于毛细管区带电泳系统的南方水牛奶酪蛋白分析技术研究[J].分析测试学报,2011,30(3):264-268.
[18]董爱军,杨鑫,张春英,等.高效液相色谱法分离测定牦牛乳中的8种蛋白质[J].分析测试学报,2012,31(8):972-976.
Separation and quantification of casein in the milk powder by reversed-phase High Performance Liquid Chromatography
LIU Mengyun1,2,3,SHEN Yuke1,JIN Yuxiao1,YUAN Haina1,2,BAO Wenna1,2,YOU Yuru1,LIU Shiwang1,2,3
(1.School of Biological and Chemical Engineering/School of Light Industry,Zhejiang University of Science and Tech⁃nology,Hangzhou 310023,China;2.Zhejiang Provincial key Lab for Chem&Bio Processing Technology of Farm Prod⁃uct,Hangzhou 310023,China;3.Zhejiang Provincial Collaborative Innovation Center of Agricultural Biological Re⁃sources Biochemical Manufacturing,Hangzhou 310023,China)
The testing condition is the flow rate of 1.0 mL/min,detection wavelength of 220 nm,column temperature 25℃,0.1%TFA aqueous solution as A mobile phase,100%acetonitrile solution as mobile phase B.In this study,four components of casein(αS1-casein,αS2-casein,β-casein,andκ-casein)in milk powder were determined by reversed-phase high performance liquid chromatography with C8 column(4.6 nm×250 nm,300Å,5μm i.d.).The results showed that the method had a good linearity,good reproducibility and high re⁃covery.For whole milk powder and goat milk powder,Separation and determination of casein components have a good effect.
Reversed-Phase High Performance Liquid Chromatography;casein;milk powder;sheep milk powder
TS252.7
:A
:1001-2230(2017)03-0052-03
2016-09-17
浙江省自然科学基金资助(Y14C200036)。
刘梦云(1990-),女,硕士研究生,研究方向为生物化工。
刘士旺

