基于SPME-GC-MS法分析发酵乳中挥发性风味物质
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,呼和浩特010018)
基于SPME-GC-MS法分析发酵乳中挥发性风味物质
周亭亭,王丹,陈永福,孙天松,张和平,丹彤
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,呼和浩特010018)
利用固相微萃取-气质联用技术(SPME-GC-MS)检测嗜热链球菌(Streptococcus thermophilus)IMAU20537和德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus)IMAU20240的单菌发酵乳和二者复配发酵乳贮藏期间的挥发性风味物质。结果表明:三种发酵乳的风味物质包括酸类、醇类、醛类、酮类、酯类、含氮化合物和芳香族及其衍生物。其中,酮类化合物在S.ther⁃mophilusIMAU20537发酵乳风味物质中种类最多,占种类总量的27.27%;醛类化合物在L.delbrueckiisubsp.bulgaricusIMAU20240发酵乳中种类最多,为20.83%;复配发酵乳中酮类和醛类化合物的种类相同,均占22.73%;而且三种发酵乳在贮藏不同时间内相对峰面积最高的物质均是酮类化合物。分析发现,复配发酵乳在贮藏期间的风味物质种类较两株单菌的发酵乳增多,其中,一些主要的风味化合物如乙醛、乙酸、双乙酰、乙偶姻等对于构成其特征风味具有重要作用。
SPME-GC-MS;复配发酵乳;挥发性风味物质
0 引言
一般来说,用于酸奶生产的基础发酵剂主要有嗜热链球菌(Streptococcus thermophiles)和德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus),这些菌株可以生产具有优良风味和适宜质构的发酵乳[1]。气相色谱-质谱联用(Gas chromatography-mass spec⁃trometry,GC-MS)技术始于20世纪50年代,目前已广泛应用在食品风味研究中[2,3]。一些研究学者采用这项技术检测发酵乳乳制品中的风味物质,截止目前为止,从发酵乳中确定的挥发性风味物质已超过90种,包括醇、醛、酮、酸、酯、含硫化合物、呋喃衍生物等[4-5]。
本文以实验室筛选具有较好发酵特性的S.ther⁃mophilusIMAU20537和L.delbrueckiisubsp.bulgaricus IMAU20240作为发酵剂,采用固相微萃取与气相色谱-质谱(SPME-GC-MS)联用技术对S.thermophilus IMAU20537和L.delbrueckiisubsp.bulgaricusIMAU20240单菌发酵乳和复配发酵乳中的风味物质进行检测和分析,研究其在贮藏期间风味物质的动态变化。
1 实验
1.1 材料与设备
1.1.1 菌种来源
本研究所用的发酵菌株由内蒙古农业大学“乳品生物技术与工程”教育部重点实验室提供,菌株编号IMAU20537(Genbank号:HM058256),IMAU20240(Genbank号:HM057974)。
1.1.2 主要仪器设备
气相色谱-质谱联用仪(Agilent 7890B GC sys⁃tem-5977A MSD);色谱柱为HP-5ms毛细管柱(30 m× 0.25 mm,0.25 μm);手动固相微萃取(SPME)进样手柄(USA,SUP-ELCO),萃取头(50/30 μm)聚二乙烯苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/ pol-ydimethylsiloxane,DVB/CAR/PDMS)。
1.2 方法
1.2.1 乳样的制备
冻干保藏的S.thermophilusIMAU20537和L.del⁃brueckiisubsp.bulgaricusIMAU20240用脱脂乳培养基(10%脱脂乳,0.1%酵母粉和90%蒸馏水,121℃灭菌7 min)活化一代(37℃,24 h),S.thermophilusIMAU20537和L.delbrueckiisubsp.bulgaricusIMAU20240分别接种到M17(CM0817)和MRS液体培养基(CM0359,英国OXOID公司)中活化两代。活化三代的菌株制备菌悬液并进行活菌计数。将S.thermophilusIMAU 20537和L.delbrueckiisubsp.bulgaricusIMAU20240按照活菌数为5×107mL-1的量以单菌和复配的形式接种于均质后的全脂乳(质量分数11.5%全脂乳,6.5%蔗糖,95℃灭菌5 min;非脂乳固体质量分数为13.87%,脂肪质量分数为3.08%)中,分装5 mL到样品瓶中,42℃恒温培养pH值达到4.5后于4℃冰箱贮藏(此时为贮藏期0 d),在贮藏0,1,3,7和14 d时取样测定其风味物质。
1.2.2 挥发性成分的测定条件
萃取头老化条件:进样口温度250℃,老化20 min。
固相微萃取条件:将已老化好的萃取头插入样品瓶,50℃300 rmp吸附60 min后,在进样口250℃解吸附3 min。
气相色谱条件:升温程序是起始温度35℃,保持5 min,以5℃/min升温至140℃,保持2 min,以10℃/min上升至250℃,保持3 min;汽化室温度为250℃;载气为氦气(≥99.999%),流速1.0 mL/min;不分流进样。
质谱条件:电离方式为EI源,电子能量70 eV;发射电流100 μA;离子源温度230℃;质量扫描范围m/ z33~450。
1.2.3 挥发性成分的定性与定量
利用GC/MS工作站软件Masshunter自带NIST 1.1标准库自动检索各组分质谱数据,结合质谱裂解规律确定化学成分,相对定量检测是利用面积归一化法计算各组分相对峰面积百分比。
2 结果与分析
2.1 发酵乳的挥发性风味物质鉴定
采用固相微萃取和气质联用技术检测S.ther⁃mophilusIMAU20537和L.delbrueckiisubsp.bulgaricus IMAU20240的单菌发酵乳与复配发酵乳中的挥发性风味物质,其挥发性成分GC-MS总离子流色谱如图1所示,分析鉴定结果如表1所示。
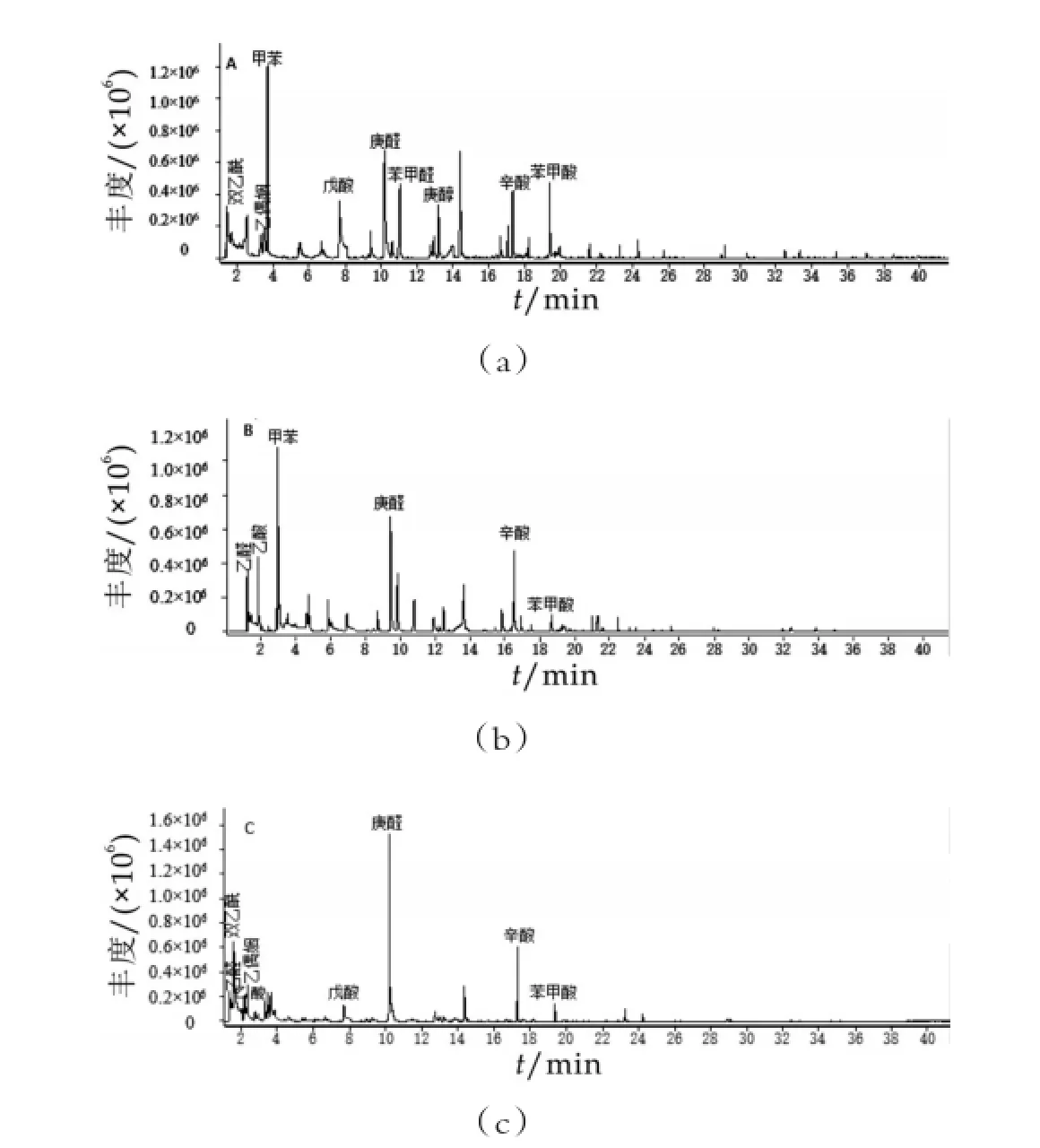
图1 在贮藏0d时挥发性风味组分的总离子流
S.thermophilusIMAU20537和L.delbrueckiisubsp. bulgaricusIMAU20240的单菌发酵乳与二者复配发酵乳经气相色谱分离后检测出挥发性风味物质的总数分别为22,24,22种,主要包括酸类、醇类、醛类、酮类、酯类、芳香族及其衍生物和含氮化合物等。S.ther⁃mophilusIMAU20537发酵乳中主要的风味物质有双乙酰、乙偶姻、甲苯、戊酸、庚醛、苯甲醛、庚醇、辛酸、苯甲酸;L.delbrueckiisubsp.bulgaricusIMAU20240发酵乳中主要的风味物质有乙醛、乙酸、甲苯、戊酸、庚醇、辛酸、苯甲酸;复配发酵乳中的主要风味物质有乙醛、乙酸、双乙酰、乙偶姻等。随着贮藏期的延长,三种发酵乳的挥发性酸种类增加,以复配发酵乳为例,在贮藏后期产生了丁酸和戊酸,但是烃类物质减少,比如壬炔和十一炔烃在后期消失。这些结果表明发酵乳在贮藏期间的风味物质的组成随着贮藏时间的延长而发生改变,这和Settachaimongkon等的研究结果是一致的[6]。
2.2 贮藏期间发酵乳风味物质相对峰面积的变化
发酵乳中挥发性风味物质及相对峰面积变化如表1所示。在贮藏1 d时,单菌发酵乳风味物质种类最多,S.thermophilus IMAU20537和L.delbrueckii sub⁃sp.bulgaricus IMAU20240单菌发酵乳分别有21种和17种;14 d时复配发酵乳中风味物质种类最多,检测到的风味物质为22种;而在贮藏3和7 d时,风味物质种类变化相对稳定,在贮藏3 d时三种发酵乳分别检测到20,18,18种风味物质,7 d时分别检测到19,18,16种。贮藏期发酵乳风味物质相对峰面积也有不同程度变化。

表1 挥发性成分的鉴定结果
2.2.1 酸类化合物
S.thermophilusIMAU20537单菌发酵乳、L.del⁃brueckiisubsp.bulgaricusIMAU20240单菌发酵乳和复配发酵乳中检测到的酸类化合物如表1所示。其中,相对峰面积较高的酸类化合物有乙酸。乙酸是发酵乳中重要的风味化合物,能赋予发酵乳独特的风味[7]。S. thermophilusIMAU20537单菌发酵乳在贮藏(7和14 d)期间,其相对峰面积分别为2.21%和1.05%。L.del⁃brueckiisubsp.bulgaricusIMAU20240发酵乳在贮藏(0、1、3、7、14 d)期间,其相对峰面积分别为6.06%,6.35%,7.07%,8.67%和13.47%;而复配发酵乳在贮藏(0,1,3,7,14 d)期间,其相对峰面积分别为29.4%,27.57%,32.11%,28.01%和25.44%。根据这些结果,可以看出复配发酵乳中乙酸的相对峰面积明显高于S.ther⁃mophilusIMAU20537和L.delbrueckiisubsp.bulgaricus IMAU20240单菌发酵乳中乙酸的相对峰面积,这与Herve-Jimenez[8]和Pinto[9]的研究结果是一致的。
此外,复配发酵乳中酸类相对峰面积普遍高于单菌发酵,如贮藏0 d时,复配发酵乳中酸类化合物的相对峰面积为35.01%,而S.thermophilusIMAU20537和L.delbrueckiisubsp.bulgaricusIMAU20240发酵乳中酸类化合物分别占2.01%和11.67%。说明嗜热链球菌和德氏乳杆菌保加利亚亚种混合培养后产酸速度加快,能促进S.thermophilusIMAU20537和L.delbrueckiisubsp. bulgaricusIMAU20240维持更好的生长,这与Veringa等的研究结果是一致的[10]。
2.3.2 醛类化合物
发酵乳的风味物质中,醛类属于微量香气成分,对发酵乳风味构成有重要影响[11]。S.thermophilus IMAU20537单菌发酵乳、L.delbrueckiisubsp.bulgaricus IMAU20240单菌发酵乳和复配发酵乳中检测到的醛类化合物如表1所示。在醛类化合物中乙醛是发酵乳中重要的特征风味物质,L.delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳和复配发酵乳中检测到的乙醛的相对峰面积较高,且L.delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳和复配发酵乳中乙醛的峰面积远高于S.thermophilus IMAU20537单菌发酵乳中乙醛的峰面积,如L.delbrueckiisubsp.bulgaricus IMAU20240单菌发酵乳在贮藏期间(0,1,3 d)检测到乙醛的相对峰面积分别为8.75%,4.61%,6.17%;复配发酵乳在贮藏(0,1,3,7,14 d)期间检测到乙醛的相对峰面积分别为3.91%,9.03%,7.8%,5.96%和3.02%;而S.thermophilus IMAU20537单菌发酵乳在贮藏(3和7 d)期间检测到乙醛的相对峰面积分别为1.15%和1.63%。一般认为,发酵乳中的乙醛主要由保加利亚乳杆菌产生的,这和我们的实验结果是一致的。
除上述的醛类化合物乙醛外,在本实验中检测到的重要的醛类化合物还有庚醛。庚醛具有强烈的油脂味,对发酵乳的整体风味有较大的影响。在S.ther⁃mophilus IMAU20537单菌发酵乳和L.delbrueckii subsp. bulgaricus IMAU20240单菌发酵乳中检测到庚醛的相对峰面积较高,如S.thermophilus IMAU20537单菌发酵乳在贮藏(0,1,3。7,14 d)期间检测到庚醛的相对峰面积分别为5.81%,3.95%,4.9%,5.68%和6.51%;L. delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳在贮藏(0,1,3,7,14 d)期间检测到庚醛的相对峰面积分别为1.56%,4.4%,2.69%,5.34%和2.63%;而在复配发酵乳中几乎没有检测到庚醛。
2.3.3 酮类化合物
S.thermophilus IMAU20537单菌发酵乳、L.del⁃brueckii subsp.bulgaricus IMAU20240单菌发酵乳和复配发酵乳中检测到的酮类化合物如表1所示。表1中,双乙酰、2-庚酮和乙偶姻的相对峰面积较高,是发酵乳中的主要风味物质。S.thermophilus IMAU20537单菌发酵乳在贮藏(0,1,3,7 d)期间检测到双乙酰的相对峰面积分别为5.28%,9.62%,9.85%和10.27%;复配发酵乳在贮藏(0,1,3,7,14 d)期间检测到双乙酰的相对峰面积分别为2.06%,3.89%,6.72%,7.31%和9.41%;而在L.delbrueckii subsp.bulgaricus IMAU20240发酵乳中没有检测到双乙酰,说明双乙酰的生产和S. thermophilus菌株密切相关。类似的结果还有乙偶姻,乙偶姻是和双乙酰类似的酮类化合物,具有浓郁的奶油香味,是发酵乳中重要的风味物质。
2-庚酮具有轻微的药香气味,其在发酵乳中的相对峰面积远高于其他类酮类化合物。如S.thermophi⁃lus IMAU20537单菌发酵乳在贮藏(0,1,3,7,14 d)期间检测到2-庚酮的相对峰面积分别为11.09%,7.67%,8.54%,8.49%和8.5%;L.delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳在贮藏(0,1,3,7,14 d)期间检测到2-庚酮的相对峰面积分别为12.71%,22.92%,9.81%,27.55%和9.97%;复配发酵乳在贮藏(0,1,3,7,14 d)期间检测到2-庚酮的相对峰面积分别为31.39%,18.35%,20.29%,13.76%和13.9%。此外,相对峰面积较高的酮类化合物还有2-壬酮等。
2.3.4 醇类化合物
醇类物质一般来源于糖类,氨基酸和醛类物质的还原反应[12]。从表1可以看出,S.thermophilus IMAU20537单菌发酵乳、L.delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳和复配发酵乳中检测到的醇类化合物中1-庚醇的相对峰面积较高。如S.ther⁃mophilus IMAU20537单菌发酵乳在贮藏(0,1,3,7,14 d)期间检测到1-庚醇的相对峰面积分别为2.13%,1.29%,1.39%,1.25%和1.54%;L.delbrueckii subsp.bul⁃garicus IMAU20240单菌发酵乳在贮藏期间检测到1-庚醇的相对峰面积分别为4.67%,6.35%,4.83%,5.98%和5.06%;复配发酵乳在贮藏期间检测到1-庚醇的相对峰面积分别为1.38%,1.61%,1.58%,1.63%和1.84%。根据这些结果,可以看出L.delbrueckii subsp. bulgaricus IMAU20240单菌发酵乳中检测到的1-庚醇的相对峰面积明显高于S.thermophilus IMAU20537,说明1-庚醇的相对峰面积可能和菌株密切相关。此外,相对峰面积较高还有1-己醇。尽管发酵乳中检测到的1-庚醇和1-己醇具有较高的相对峰面积,但因为醇类化合物的风味阈值较高,所以我们认为这些醇类化合物对发酵乳中的风味没有较大贡献[13]。
2.3.5 芳香族及其衍生物
S.thermophilus IMAU20537单菌发酵乳、L.del⁃brueckii subsp.bulgaricus IMAU20240单菌发酵乳和复配发酵乳中检测到的芳香族及其衍生物有苯甲醛、苯甲酸和甲苯(表1)。其中相对峰面积较高的芳香族及其衍生物有苯甲醛,如S.thermophilus IMAU20537单菌发酵乳在贮藏(0,1,3,7,14 d)期间检测到苯甲醛的相对峰面积分别为2.48%,1.9%,1.62%,2.05%和2.95%;L.delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳在贮藏期间检测到苯甲醛的相对峰面积分别为2.07%,2.5%,2.16%,2.68%和2.45%;复配发酵乳在贮藏期间检测到苯甲醛的相对峰面积分别为1.83%,1.78%,1.41%和2.02%。苯甲醛能赋予发酵乳坚果味、杏仁味及苦涩味[14],对发酵乳中的风味有较大的贡献。
2.3.6 含氮化合物
氨基酸的分解代谢对发酵乳的风味具有重要影响,如小分子多肽可以促进乳酸菌生长及其风味化合物的生成[15]。在本实验中,检测到的含氮化合物种类较多。如S.thermophilus IMAU20537发酵乳在贮藏期间期检测到苯甲醛缩氨基脲、2-氨基-1-丙醇、己内酰胺;L.delbrueckii subsp.bulgaricus IMAU20240发酵乳中检测到1-甲氧基-2-丙胺、甲氧基苯肟;而在复配发酵乳中检测到两种新含氮化合物,N,N-庚肼基苯甲酸和甲酰胺。
3 结论
本研究主要采用固相微萃取和气相色谱联用技术检测S.thermophilus IMAU20537和L.delbrueckii sub⁃sp.bulgaricus IMAU20240的单菌发酵乳与复配发酵乳中风味化合物。结果表明,这些发酵乳中挥发性风味成分复杂,在发酵和贮藏期间共鉴定出35种挥发性成分。其中,S.thermophilus IMAU20537单菌发酵乳中酮类化合物种类最多,占风味物质种类总量的27.27%;L.delbrueckii subsp.bulgaricus IMAU20240单菌发酵乳中醛类化合物最多,占总风味物质种类总量的20.83%;复配发酵乳中酮类和醛类化合物种类较多,均占种类总量的22.73%。在贮藏不同时间段单菌和复配发酵乳的挥发性风味化合物在种类、数量及相对峰面积存在差异,而复配发酵中风味化合物种类相对更加丰富,如乙醛、乙酸、双乙酰、乙偶姻等对于构成其特征风味具有重要作用。
[1]SERRA M,TRUJILLO A J,GUAMIS B,et al.Flavour Profiles and Survival of Starter Cultures of Yoghurt Produced from High-pressure Homogenized Milk[J].International Dairy Journal,2009,19(2): 100-106.
[2]CHENG H,QIN Z H,GUO X F,et al.Geographical Origin Identifi⁃cation of Propolis Using GC–MS and Electronic Nose Combined with Principal Component Analysis[J].Food Research International, 2013,51(2):813-822.
[3]BALASUBRAMANIAN S,PANIGRAHI S.Solid-Phase Microex⁃traction(SPME)Techniques for Quality Characterization of Food Products:A Review[J].Food&Bioprocess Technology,2011,4(1): 1-26.
[4]MARSHALL V M E,DAVIES F L,LAW B A.Flavour Development in Fermented Milks[J].Advances in the Microbiology&Biochemistry of Cheese&Fermented Milk,1984.
[5]OTT A,FAY L B,CHAINTREAU A.Determination and Origin of the Aroma Impact Compounds of Yogurt Flavor[J].Journal of Agri⁃cultural&Food Chemistry,1997,45(3):850-858.
[6]SETTACHAIMONGKON S,NOUT M J R,FERNANDES E C A, et al.Influence of Different Proteolytic strains of Streptococcus thermophi⁃lus in Co-culture with Lactobacillus Delbrueckii subsp.Bulgaricus on the Metabolite Profile of Set-yoghurt[J].International Journal of Food Microbiology,2014,177(5):29-36.
[7]PANAGIOTIDIS P,TZIA C,SPANIER A M,et al.Effect of Milk Composition and Heating on Flavor and Aroma of Yogurt[C]// Food Flavors and Chemistry:Advances of the New Millennium.Pro⁃ceedings of the 10th International Flavor Conference,Paros,Greece, 4-7 July 2000.2001.
[8]HERVE-JIMENEZ L,GUILLOUARD I,GUEDON E,et al.Post⁃genomic Analysis of Streptococcus Thermophilus Cocultivated in Milk with Lactobacillus delbrueckii subsp.bulgaricus:Involvement of Nitrogen, Purine,and Iron metabolism[J].Applied&Environmental Microbiol⁃ogy,2009,75(7):2062-73.
[9]PINTO S M,CLEMENTE M D G,ABREU L R D.Behaviour of Volatile Compounds during the Shelf Life of Yoghurt[J].Internation⁃al Journal of Dairy Technology,2009,62(2):215–223.
[10]VERINGA H,GALESLOOT T E,DAVELAAR H.Symbiosis in Yogurt Isolation and Identification of a Growth Factor for Lactobacil⁃lus Bulgaricus Produced by Streptococcus Thermophiles[J].Netherlands Milk and Dairy Journal.1968,22:114-120
[11]HEFA C.Volatile Flavor Compounds in Yogurt:a Review[J].Criti⁃cal Reviews in Food Science&Nutrition,2010,50(10):938-50.
[12]GAAFAR A M.Volatile Flavour Compounds of Yoghurt[J].Interna⁃tional Journal of Food Science&Technology,2007,27(1):87-91.
[13]SUDUN,WULIJIDELIGEN,Arakawa K,et al.Interaction between Lactic Acid Bacteria and Yeasts in Airag,an Alcoholic Fermented Milk[J].Animal Science Journal Nihon Chikusan Gakkaihō,2013,84 (1):66–74.
[14]OTT A,GERMOND J E,MARCEL BAUMGARTNER A,et al. Aroma Comparisons of Traditional and Mild Yogurts:?Headspace Gas Chromatography Quantification of Volatiles and Origin of α-Diketones[J].Journal of Agricultural&Food Chemistry,1999, 47(6):2379-85.
[15]LEKSRISOMPONG P P,MIRACLE R E,DRAKE M A.Charac⁃terization of Flavor of Whey Pprotein Hydrolysates[J].Journal of Ag⁃ricultural&Food Chemistry,2010,58(10):6318-6327.
Volatile compounds analysis in fermented milk by GCMS and SPME
ZHOU Tingting,WANG Dan,CHEN Yongfu,SUN Tiansong,ZHANG Heping,DAN Tong
(Key Laboratory of Dairy Biotechnology and Engineering,Inner Mongolia Agricultural University,Hohhot 010018,China)
This study utilized SPME-GC-MS to analyze the flavor substances in three kinks of milk samples that were fermented withStrep⁃tococcus thermophilusIMAU20537,Lactobacillus delbrueckiisubsp.bulgaricus IMAU20240 and their mixed fermentation,respectively.The flavour compouds of the three kinds of fermented milk were made up of acids,alcohols,esters,aldehydes,ketones,nitrogen compounds,aro⁃matic and its derivatives.The ketones constituted the largest proportion(27.27%)among all these volatile flavor substances in the milk fer⁃mented with S.thermophilus IMAU20537;in the yorgurt ofL.delbrueckiisubsp.bulgaricusIMAU20240,the aldehydes accounted for the greatest percentage of the flavor substances,which was 20.83%;both the ketones and aldehydes were 22.7%of flavor substances in the mixed fermentation.And the ketone compounds was the highest relative content during storage in these kinds of fermented milk.Comparing with monoxenie fermentation,the mixed fermented milk had more categories of flavor.Some of the major flavor compounds such as acetalde⁃hyde,acetic acid,diacetyl,acetoin played an important role in constituting the characteristics of flavor.
SPME-GC-MS;mixed fermented milk;volatile flavor compound
TS252.1
:A
:1001-2230(2017)03-0004-05
2016-07-15
国家自然科学基金项目(31471711;31460446);公益性行业(农业)科研专项(201203009)。
周亭亭(1992-),女,硕士研究生,研究方向为乳品生物技术与工程。
丹彤

