内源乳化法制备干酪乳杆菌微胶囊
(东北农业大学食品学院乳品科学教育部重点实验室,哈尔滨150030)
内源乳化法制备干酪乳杆菌微胶囊
张国芳,王婷婷,刘丽波,赵丽双,吕秋月,张硕,王婧莹,李春
(东北农业大学食品学院乳品科学教育部重点实验室,哈尔滨150030)
为提高益生菌干酪乳杆菌KLDS 1.0301对不利环境的抗性,采用内源乳化法,将菌株包埋在海藻酸钠和浓缩乳清蛋白中制成微胶囊制剂。通过响应面实验对微胶囊包埋工艺参数进行优化,并通过人工胃肠液对微胶囊的耐受性进行分析。结果表明,微胶囊的最佳制备工艺:海藻酸钠1.93%,海藻酸钠与浓缩乳清蛋白80的质量比1∶1,水油体积比1∶2.7,碳酸钙与海藻酸钠质量比1∶2.18,包埋率为93.51%。干酪乳杆菌微胶囊在模拟人工胃液中处理3 h后活菌数下降2个对数值,而未经包埋的干酪乳杆菌在相同条件下活菌数下降4个对数值。干酪乳杆菌微胶囊在人工肠液中处理60 min后,活菌数基本保持不变,表明了干酪乳杆菌微胶囊具有较好的肠溶性。将包埋的微胶囊与嗜热链球菌KLDS 3.0501和保加利亚亚种ATCC 11842在乳清粉底料中进行混合发酵,发现包埋的干酪乳杆菌在发酵期间同样能够良好产酸,并对产酸量几乎没有影响。
干酪乳杆菌;内源乳化法;微胶囊;胃肠道;应用
0 引言
益生菌作为食品领域的重要微生物,其高效的价值是不容小觑的。但在实际应用中,无论是在加工储藏,还是在人体胃肠道的过程中都会对益生菌的活性和数量有一定不良影响。因此,有效的保护益生菌以抵抗外界的不利环境因素是非常重要的[1-3]。利用微胶囊包埋技术可以增强菌体对消化道内环境的耐受性和抵抗力,能够显著地提高菌体的生存能力。微胶囊化的方法有很多种,但能够高效包埋益生菌的方法还在探索中[4]。目前,内源乳化法应用比较广泛,该法具有工艺流程简单,便于工业化生产,微胶囊粒径大小可控,安全可食用等优点[5-7]。
本研究利用内源乳化法制备干酪乳杆菌微胶囊,运用响应面法探究其最佳的包埋工艺,并对微胶囊的保护作用进行评价。
1 实验
1.1 材料与仪器
1.1.1 试验菌种
干酪乳杆菌KLDS 1.0301,嗜热链球菌KLDS 3.0501,来源于乳品科学教育部重点实验室(KLDS);德氏乳杆菌保加利亚亚种ATCC 11842,来源于美国模式菌种收集中心。
1.1.2 试剂
胃蛋白酶(活力453U/mg),胰蛋白酶(活力11800U/mg),磷酸氢二钠,冰醋酸,磷酸氢二钾,氯化钠,海藻酸钠,柠檬酸钠,丙三醇,碳酸钙,大豆油,Span-80,乙醇,浓缩乳清蛋白80,MRS培养基,M17肉汤培养基。
1.1.3 仪器与设备
PL2002型电子天平,PL203型电子分析天平,Del⁃ta320型pH计,HJ-3磁力恒温搅拌器,SPX-150B生化培养箱,上海一恒有限公司;QT-1型旋涡混合器,TGL-16G型高速离心机离心机,HIRAYAMA HVE-50型高压灭菌器,手动移液器。
1.2 方法
1.2.1 菌悬液的制备
将干酪乳杆菌菌粉按体积分数为2%的接种量接种于MRS液体培养基中,于恒温培养箱中37℃培养20 h,活化2~3次后,离心(4 000 r/min,4℃,离心15 min),收集菌体并用质量分数为0.9%无菌生理盐水洗涤2遍,同样条件离心得到菌体,然后用无菌生理盐水将菌体配置成一定浓度的菌悬液。
1.2.2 主要溶液的配置
解囊液:分别配制浓度为0.1 mol/L的磷酸氢二钠和浓度为0.05 mol/L的柠檬酸,调节pH=7.25,121℃灭菌15 min待用。
模拟人工胃液[8]:取浓度为0.1 mol/L稀盐酸溶液16.4 mL,胃蛋白酶10 g,加无菌水搅拌均匀后,定容至1 L,调节pH=1.2,过0.22 μm微孔滤膜除菌备用。
模拟人工肠液[8]:称取磷酸二氢钾6.8 g,胰蛋白酶10 g,加适量无菌水使之溶解,定容至1 L,调节pH= 7.4,过0.22 μm微孔滤膜除菌备用。
1.2.3 内源乳化法制备干酪乳杆菌微胶囊工艺流程
内源乳化法制备微胶囊的过程参照Chandramouli[9]等人报道的方法,并在此基础上进行修改。将10 mL菌悬液与20 mL一定浓度的海藻酸钠和浓缩乳清蛋白溶液混合均匀后,加入碳酸钙粉末,均匀地分散到该混合溶液中,然后再将此混合液乳化到含有体积分数1.0%的Span80大豆油中(转速为300 r/min),15 min后,加入冰醋酸继续搅拌,以促进冰醋酸和碳酸钙的接触反应,30 min后,向该体系加入pH=5.5的醋酸盐溶液并缓慢搅拌,待凝胶成型的微胶囊都沉降到醋酸盐溶液底部后,吸去油相,收集微胶囊,洗涤2次,去除剩余油相和表面菌体。最后将收集到的微胶囊存放于质量浓度为0.2 g/100 mL的氯化钠中,放在4℃冰箱保存。
1.2.4 微胶囊包埋工艺单因素实验
以微胶囊的包埋率为指标,通过单因素试验测定不同海藻酸钠质量分数(1%,2%,3%,4%,5%);大豆油的体积(30,90,150,210,240 mL);浓缩乳清蛋白(海藻酸钠与浓缩乳清蛋白的质量比分别为5∶1,3∶1,1∶1,1∶3,1∶5);碳酸钙(碳酸钙与海藻酸钠的质量比分别为1∶1,1∶1.5,1∶3,1∶6,1∶15)对微胶囊包埋效果的影响。
1.2.5 响应面法优化干酪乳杆菌微胶囊包埋工艺
选取海藻酸钠(A)、浓缩乳清蛋白(B)、水油体积比(C)和碳酸钙(D)四个因素,以微胶囊的包埋率为响应值,设计四因素三水平的响应面优化试验,确定干酪乳杆菌微胶囊的最佳包埋工艺(表1)。
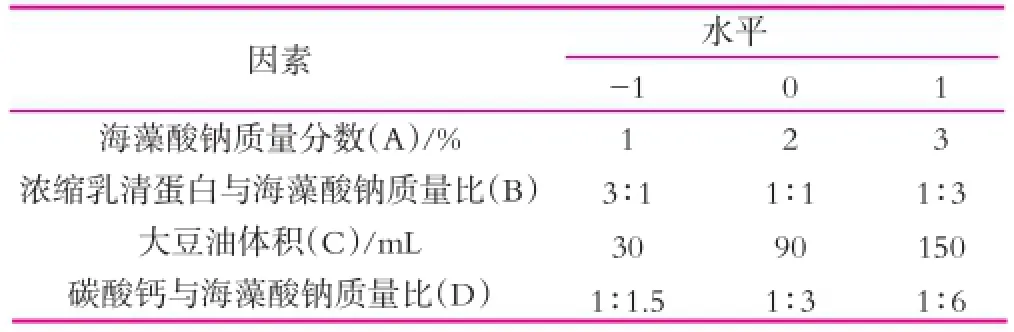
表1 干酪乳杆菌微胶囊制备工艺响应面实验因素水平
1.2.6 干酪乳杆菌微胶囊耐受性[10]
1.2.6.1 干酪乳杆菌微胶囊在人工胃液中的耐受性测试
实验组:取1 g干酪乳杆菌微胶囊加入装有99 mL人工胃液的三角瓶中,于37℃摇床中震荡处理0.5,1,1.5,2,2.5 h;分别取样,活菌计数。另取1mL菌悬液作对照。
1.2.6.2 干酪乳杆菌微胶囊在人工肠液中的耐受性测试
取1 g干酪乳杆菌微胶囊加入装有99 mL人工肠液的三角瓶中,于37℃摇床中震荡处理0,0.5,1,1.5,2 h;分别取样,进行活菌计数,测定其溶出情况。
1.2.7 干酪乳杆菌微胶囊的应用
(1)干酪乳杆菌微胶囊产品储藏稳定性。实验组:将最佳工艺条件下包埋的干酪乳杆菌微胶囊置于4℃条件下进行保藏,每隔7 d取样计活菌数,检测微胶囊的稳定性。对照组:相同条件下取未被包埋的干酪乳杆菌置于4℃条件下进行保藏,每隔7 d取样计活菌数。
(2)干酪乳杆菌微胶囊在乳清粉中的发酵产酸分析。实验组:以干酪乳杆菌微胶囊、嗜热链球菌、保加利亚乳杆菌为试验菌株,将活化后的三种菌株按体积比为1∶1∶1接种于乳清粉培养基中,于37℃恒温培养箱中培养24 h。每隔3 h取样,测定试样的PH值和每种菌株的活菌数。对照组:相同条件下,以干酪乳杆菌、嗜热链球菌、保加利亚乳杆菌为试验菌株,测定试样的pH值和每种菌株的活菌数。
1.3 分析方法
菌落计数采用国标GB 4789.35-2010中MRS固体培养基平板倾注法[11]。
pH值采用S-25型酸度计测定,每试样重复3次。
包埋率[12]:称取0.1 g微胶囊产品,加入到20 mL解囊液中,在恒温摇床培养箱中以37℃,180 rpm的条件进行崩解。取1 mL样品稀释后釆用倾注法倒平板,置于37℃培养箱培养48 h,菌落计数,得微胶囊中包埋的活菌数。

1.4 统计学处理
利用SPSS 17.0统计分析软件进行分析处理,每个实验重复3次,结果用3次独立试验均值±标准差形式表示表示,采用one-way ANOVA检验比较不同组间差别,P<0.05为差异有统计学意义。
2 结果与讨论
2.1 海藻酸钠质量分数对微胶囊包埋率的影响
图1为海藻酸钠质量分数对微胶囊包埋率的影响。由图1可以看出,微胶囊的包埋率随海藻酸钠质量分数的增大而升高,当海藻酸钠质量分数为2%时,微胶囊的包埋率最大,当海藻酸钠的浓度继续变大时,微胶囊的包埋率反而降低了。其原因可能是:海藻酸钠浓度较高时,黏度变大,不利于菌体均匀的分散,形成的囊壁过厚。海藻酸钠的质量分数较低时,形成的膜过薄,机械强度不好,影响包埋效果。
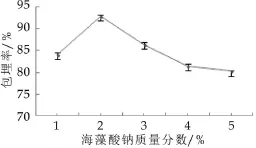
图1 海藻酸钠质量分数对微胶囊包埋率的影响
2.2 浓缩乳清蛋白质量分数对微胶囊包埋率的影响
图2为浓缩乳清蛋白质量分数对微胶囊包埋率的影响。由图2可以看出,微胶囊的包埋率随海藻酸钠与乳清蛋白的质量比的降低而升高,当海藻酸钠与浓缩乳清蛋白的质量比为1∶1时,微胶囊的包埋率最高。
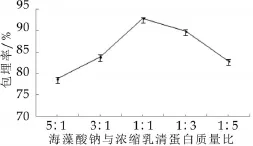
图2 浓缩乳清蛋白质量分数对微胶囊包埋率的影响
2.3 水油体积比对微胶囊包埋率的影响
图3为大豆油的添加量比对微胶囊包埋率的影响。由图3可以看出,油相不足时,可能导致微球粘连,包埋率较低。水油体积比变大时,分散空间比较宽松,有利于大液滴的形成,但微胶囊的粒径要求不要过大。当水油体积比为1∶3时,微胶囊的包埋率最高。
2.4 碳酸钙浓度对微胶囊包埋率的影响
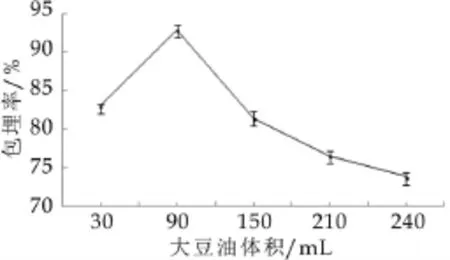
图3 大豆油的添加量比对微胶囊包埋率的影响
图4为碳酸钙的添加量对微胶囊包埋率的影响。由图4可以看出,当碳酸钙与海藻酸钠的质量比为1∶3时,微胶囊的包埋率最高,为92.86%。当溶液中的Ca2+浓度比较低的时候,外层的海藻酸钙沉淀不容易形成。但当碳酸钙的加入量变大时,会使溶液的表面张力面大,密度增加,导致微胶囊的包埋率降低。
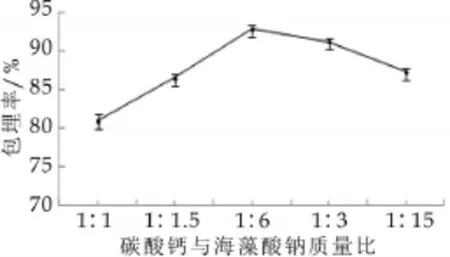
图4 碳酸钙的添加量对微胶囊包埋率的影响
2.5 干酪乳杆菌微胶囊工艺优化
响应面实验结果如表2所示。
2.5.1 回归模型的确定和显著性分析
利用Design-expert软件对响应值进行处理,表为回归模型方差分析结果。
利用软件建立二次多元回归方程:Y=92.86000+ 0.39083A+0.26167B-0.488833C-2.26417D+0.26000AB-0.82750AC+3.05500AD-1.57500BC+0.4500BD+1.58750 CD-8.87875A2-9.80750B2-4.82250C2-2.42125D2
从回归分析以及方差分析表可以看出该模型的拟合效果比较好,说明试验的可信度和精确度较高。
2.5.2 模型验证
通过软件分析,微胶囊的最佳制备工艺如图5所示:海藻酸钠1.93%,海藻酸钠与乳清蛋白质量比1∶1,水油体积比1∶2.7,碳酸钙与海藻酸钠质量比1∶2.18。以此条件进行验证实验。三次试验的平均包埋率为92.5%,基本与模型的预测值93.51%是相符的,说明响应面优化试验得到的数学模型与试验的具体数据的拟合效果很好,可以用于干酪乳杆菌微胶囊的包埋。图6为各因素两两交互作用对包埋率的影响。
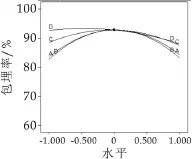
图5 干酪乳杆菌微胶囊包埋工艺最优参数
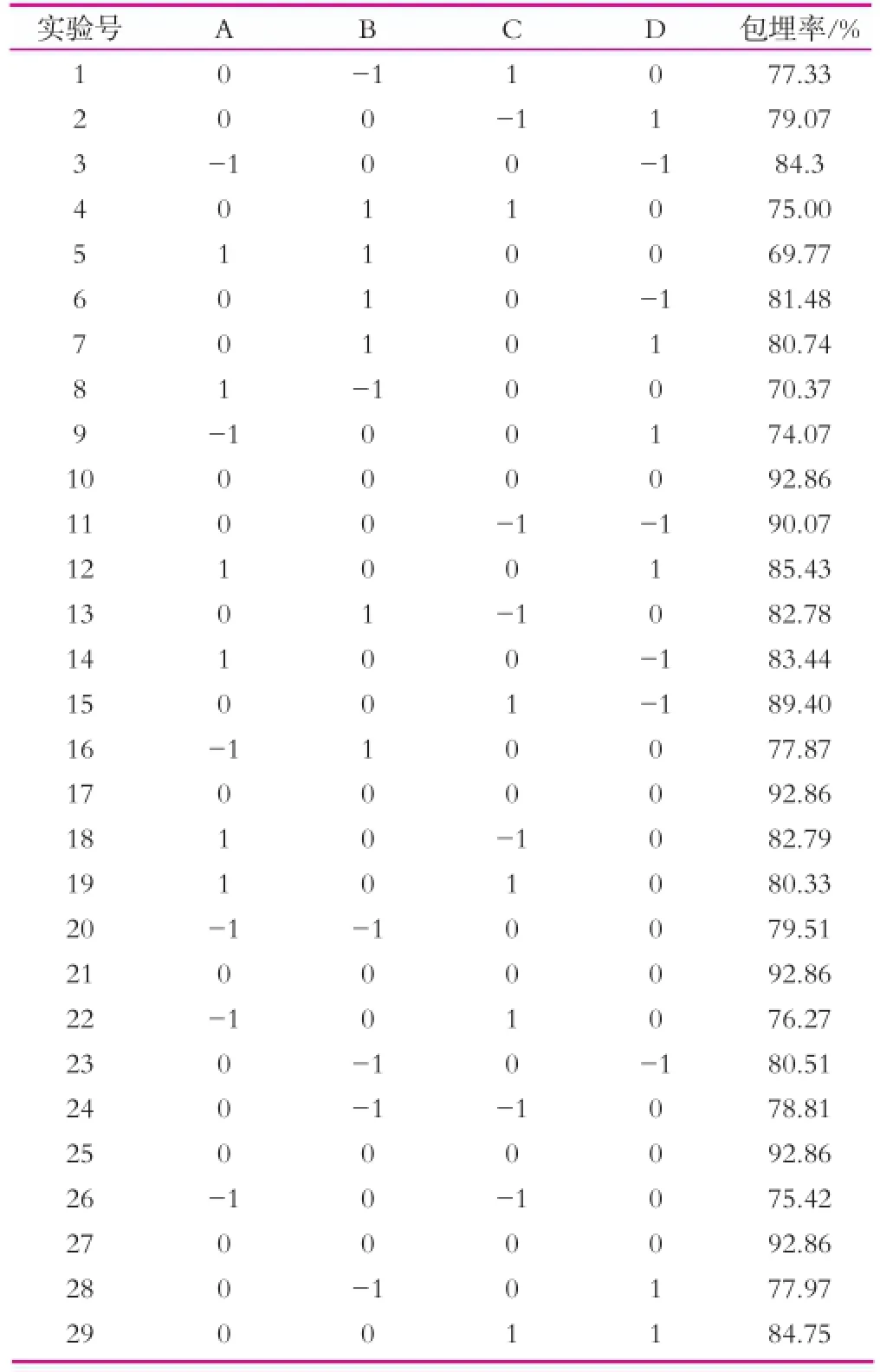
表2 响应面优化实验结果
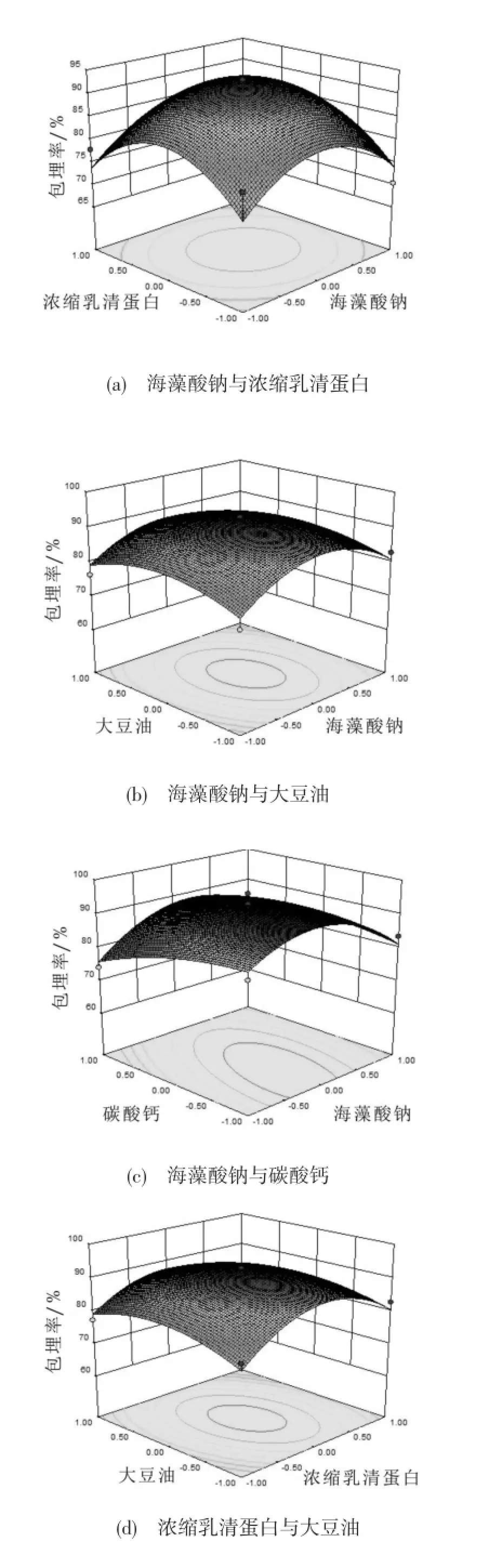
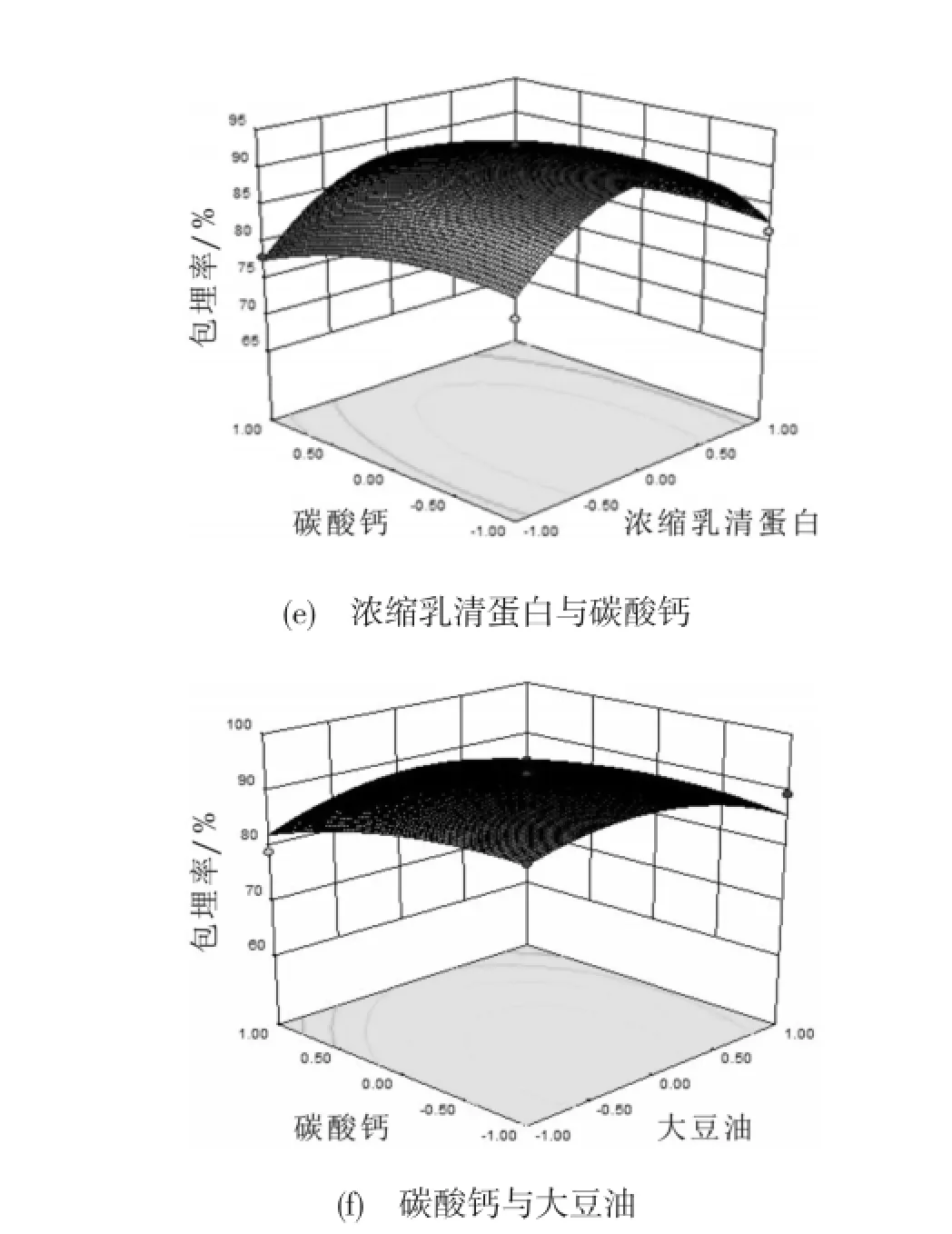
图6 因素间交互作用
2.6 干酪乳杆菌微胶囊在模拟人工胃液中的耐受性
图7为干酪乳杆菌微胶囊在模拟胃液中的活菌数变化结果。由图7可以看出,干酪乳杆菌经模拟胃液处理90 min后,活菌数从8.81 mL-1(对数值)下降到4.30 mL-1(对数值),下降4个对数值,150 min后几乎剩余较少了,这是由于干酪乳杆菌的耐胃酸能力很差,胃酸的低PH值会导致存活率的降低。干酪乳杆菌微胶囊在模拟胃液中处理90 min后,活菌数从8.78 mL-1(对数值)下降到6.64 mL-1(对数值),下降2个对数值,120 min后,仍有5.20 mL-1(对数值)的菌体存活,相比于未经包埋的干酪乳杆菌,微胶囊化显著的提高了菌株在模拟胃液中的存活量。实验结果表明:采用内源乳化法制备的干酪乳杆菌微胶囊能够抵抗较低pH值的影响,保证经胃酸的作用后仍有足够数量的活菌到达肠道内定制并发挥益生所用。
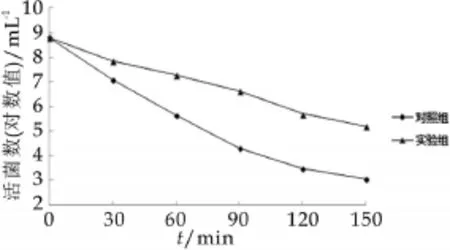
图7 干酪乳杆菌微胶囊在模拟胃液中的活菌数变化
2.7 干酪乳杆菌微胶囊在模拟人工肠液中的耐受性
图8为干酪乳杆菌微胶囊在模拟肠液中的活菌数变化。由图8可以看出,干酪乳杆菌微胶囊经模拟肠液处理60 min后,干酪乳杆菌的活菌数保持不变,维持在8.0 mL-1(对数值),说明本研究所制备的微胶囊具有很好的肠溶性,60 min后,能将包埋在微胶囊内部的活菌都释放出来。
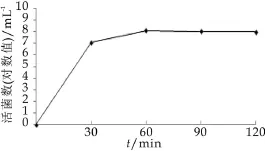
图8 干酪乳杆菌微胶囊在模拟肠液中的活菌数变化
2.8 干酪乳杆菌微胶囊产品储藏稳定性
图9为未包埋与包埋的干酪乳杆菌微胶囊在4℃的储藏稳定性。由图9可以看出,两种样品中的活菌数都随着储藏时间的增加而处于下降的趋势。未经过微胶囊化包埋的干酪乳杆菌的活菌数从8.9 mL-1(对数值)下降到3.0 mL-1(对数值),下降了6个数量级。利用微胶囊技术保护的干酪乳杆菌,活菌数从8.87 mL-1(对数值)下降到了4.78 mL-1(对数值),下降了4个数量级,说明微胶囊能够显著提高干酪乳杆菌的储藏稳定性。
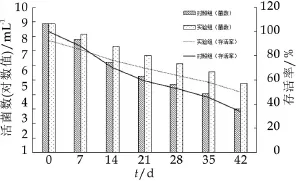
图9 干酪乳杆菌微胶囊在4℃的储藏稳定性
2.9 干酪乳杆菌微胶囊在乳清粉中的发酵分析
2.9.1 复合菌种发酵过程活菌数的变化
图10为复合菌种在乳清粉中混合发酵活菌数变化结果。由图10可以看出,干酪乳杆菌在包埋之后,虽然发酵过程中产酸比较慢,开始时的活菌数变化不明显,但15 h左右可以被完全释放出来,能保持较高的活菌数。
2.9.2 复合菌种发酵过程pH值变化
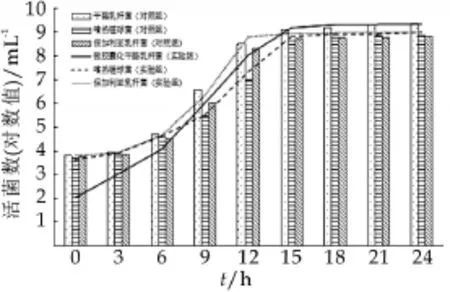
图10 复合菌种在乳清粉中混合发酵活菌数变化
图11为复合菌种发酵的pH值随时间变化的曲线。由图11可以看出,复合菌种在发酵的过程中,pH值呈降低趋势,pH值由6.5降至4.3。两种样品在发酵12 h前未包埋的菌株pH值变化的更明显,包埋的菌株pH值变化比较慢,但发酵终点的pH值相差不大。结果表明,微胶囊化的干酪乳杆菌在发酵过程中虽然释放的比较缓慢,但是并不影响发酵终点时发酵乳的酸度。进而表明微胶囊化的干酪乳杆菌不仅得到了保护,在应用时也能被完全的释放出来。
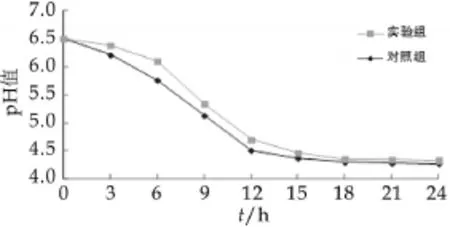
图11 复合菌种发酵的pH值随时间变化的曲线
3 结论
采用内源乳化法制备的干酪乳杆菌1.0301微胶囊的最佳包埋工艺条件为海藻酸钠1.93%,海藻酸钠与乳清蛋白质量比1∶1,水油体积比1∶2.7,碳酸钙与海藻酸钠质量比1∶2.18,此条件下所形成的微胶囊的包埋率为93.51%。所制备的干酪乳杆菌微胶囊在人工胃液中处理3 h活菌数下降2个对数值,在模拟人工肠液中60 min后可以被完全释放,放在4℃下45 d仍有较高的存活率。
由此可以证明,试验所制备的微胶囊在模拟胃肠液中具有较好的耐受性和较高的储藏稳定性,且微胶囊在复合菌株发酵过程表现较好的产酸性。为该菌种在功能性食品方面的应用提供理论基础。
[1]SHIN H S,LEE J H,PESTKA J J,et al.Viability of bifidobacteria in commercial dairy products during refrigerated storage[J].Journal of Food Protection,2000,63(3):327-331.
[2]ZOU QIANG,LIU XIAOMING,ZHAO JIANXIN,et al.Microen⁃capsulation of Bifidobacterium bifidum F-35 in whey protein-based microcapsules by transglutaminase-induced gelation[J].Journal of Food Science,2012,77(5):270-277.
[3]PIMENTEL-GONZ?LEZ D J,CAMPOS-MONTIEL R G,LOBA⁃TOCALLEROS C,et al.Encapsulation of Lactobacillus rhamnosus in double emulsion formulated with sweet whey as emulsifier and surviv⁃al in simulated gastrointestinal conditions[J].Food Research Interna⁃tional,2013,42(2):292-297.
[4]BURGAIN J,GAIANI C,LINDER M,et al.Encapsulation of probi⁃otic living cells:from laboratory scale to industrial applications[J].Jour⁃nal of Food Engineering,2011,104(4):467-483.
[5]ZHAO M,CAI S,QU F N,et al.Research progress of emulsification/ internal gelation technology for the preparation of alginate microcap⁃sules[J].Science and Technology of Food Industry,2013,22: 392-396.
[6]陈金子,侯红漫,陈莉,等.降胆固醇乳酸菌WB的微胶囊化研究[J].中国乳品工业,2010,38(5):16-25.
[7]HANSEN L T,ALLAN-WOJTAS P M,JIN Y L.Survival of Ca-al⁃ginate microencapsulated Bidobacterium spp.in milk and simulated gastrointestinal conditions[J].Food Microbiology,2002,19(1):35-45.
[8]李宁.双歧杆菌微胶囊制备工艺及功能特性的研究[D].保定:河北农业大学,2007:14.
[9]CHANDRAMOULI V,KALASAPATHY K,PEIRIS P,et al.An im⁃proved method of microencapsulation and its evaluation to protect Lactobacillus spp.in simulated gastric conditions[J].J Microbiol Meth,2004,56(1):27-35.
[10]XIAO YAN LI,XI GUANG CHEN,ZHONG WU SUN,et al. Preparation of alginate/chitosan/carboxymethyl chitosan complex mi⁃crocapsules and application in Lactobacillus casei ATCC 393[J].Carbo⁃hydrate Polymers,2011,83(4):1479-1485.
[11]GB4789.35-2010.食品安全国家标准:食品微生物学检验[S].北京:中国标准出版社,2010.
[12]CARLISE B,FRITZEN-FREIRE,ELANE S,et al.Effect of micro⁃encapsulation on survival of Bifidobacterium BB-12 exposed to simu⁃lated gastrointestinal conditions and heat treatments[J].LWT-Food Science and Technology,2012,50(1):39-44.
Internal emulsification microcapsule preparation of Lactobacillus casei
ZHANG Guofang,WANG Tingting,LIU Libo,ZHAO Lishuang,LYU Qiuyue,ZHANG Shuo, WANG Jingying,LI Chun
(Key Laboratotry of Dairy Science,Ministry of Education,College of Food Science,Northeast Agricultural University, Harbin 150030,China)
To improve the probioticLactobacillus caseiKLDS 1.0301 resistance to adverse environment,the internal emulsification method is adopted,the strain of the embedding in the sodium alginate and whey protein in composite wall made of microcapsule preparation.Through the response surface optimization experiment optimize the microcapsule embedding process parameters,and through the artificial stomach in⁃testinal juice tolerance analysis of microcapsules.Experimental results show that the best preparation technology of microcapsule are as fol⁃lows:sodium alginate 1.93%,sodium alginate and whey protein concentrate 80 ratio 1∶1,the quality of water and oil volume ratio 1∶2.7,cal⁃cium carbonate and sodium alginate mass ratio of 1∶2.18,the embedding rate was 93.51%.Lactobacillus casei microcapsules in simulated in artificial gastric juice processing 3 h after the number of living bacterium down two of value,and without the embedding ofLactobacillus casei under the condition of same number of living bacterium fell four to numerical values.Lactobacillus caseimicrocapsules in the artificial intestinal juice processing,after 60 min basic remains the same number of living bacterium,showed that lactobacillus casei microcapsule has good intes⁃tinal soluble.The embedding of the microcapsules withThermophilic streptococcusKLDS 3.0501 andBulgaria SubspeciesATCC 11842 in the base of whey powder mixed fermentation,found that the embedding ofLactobacillus caseigood can also produce acid during fermentation,and have little impact on produce acid.
lactobacillus casei;internal emulsification method;microcapsules;the gastrointestinal tract;application;
TS201.3
:A
:1001-2230(2017)03-0015-06
2016-09-20
国家自然科学基金(31671874)。
张国芳(1990-),女,硕士研究生,从事乳品科学方面的研究。
刘丽波

