低温诱导羊乳中β-酪蛋白从胶束中解离的研究
邵言蹊,刘大松,徐 姝,李志宾,周 鹏
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
羊乳易消化[1]、不易产生乳糖不耐症和过敏反应,其诸多营养价值和功能特性均优于牛乳[2]。近年来,基于羊乳的液态奶、奶酪、酸奶、婴幼儿配方奶粉等乳制品的消费者接受度和市场份额正逐步扩大[3]。羊乳中乳清蛋白和酪蛋白的质量比为30∶70,其中酪蛋白部分主要包括β、αs1、αs2和κ型,其占比为55%、6%、19%、20%;牛乳中乳清蛋白和酪蛋白的质量比例为20∶80,酪蛋白部分主要含β、αs1、αs2和κ型,其占比为36%、40%、10%、14%;人乳中乳清蛋白与酪蛋白的质量比为60∶40,酪蛋白部分主要含β、αs1、κ型,占比为68%、12%、20%[4]。相较于牛乳,羊乳在蛋白质组成和配比方面与人乳更接近。α-酪蛋白为乳中主要的过敏原,羊乳中的α-酪蛋白含量较少,且β-酪蛋白含量较牛乳多[5]。因此,羊乳更适用于婴幼儿配方乳粉的生产。
目前,婴幼儿配方乳粉的母乳化研制主要集中在增加乳清蛋白含量方面,较少考虑酪蛋白配比的差异[6]。提高婴幼儿配方乳粉中β-酪蛋白与乳清蛋白的含量,可使其与人乳蛋白组成更为接近,更有利于婴幼儿消化吸收。乳中的酪蛋白主要以胶束形式存在,而乳清蛋白游离在胶束外面的乳清中。在胶束中,部分β-酪蛋白和α-酪蛋白通过它们所带的磷酸基团和胶体磷酸钙相互作用,从而形成胶束骨架结构,还有部分β-酪蛋白是通过疏水作用在胶束骨架上结合[7]。β-酪蛋白是疏水性较强的酪蛋白,在低温作用下,会减弱蛋白的疏水作用,使部分β-酪蛋白从胶束中解离到乳清中,并以分子单体或者低相对分子质量聚集体形式存在[8]。Liu等在4℃条件下采用30 nm孔径陶瓷膜微滤处理脱脂牛乳,使游离的β-酪蛋白和乳清蛋白同时富集到透过液中,进而通过超滤脱糖脱盐,再经喷雾干燥脱水,制备了富含β-酪蛋白和乳清蛋白的乳蛋白配料[9]。
作者以山羊脱脂乳为原料,采用聚丙烯酰胺凝胶电泳(SDS-PAGE)、反相高效液相色谱(RPHPLC)、电感耦合等离子体质谱(ICP-MS)等分析方法,研究温度、平衡时间、pH、NaCl浓度、柠檬酸钠浓度、CaCl2浓度对β-酪蛋白从胶束中解离的影响,旨在为羊乳β-酪蛋白的低温微滤分离提供参考。
1 材料与方法
1.1 材料与试剂
生鲜羊乳:杭州云泉约牧业有限公司产品;二硫苏糖醇、三氟乙酸:美国Sigma公司产品;乙腈、甲醇:赛默飞世尔科技(中国)有限公司产品;丙烯酰胺、β-巯基乙醇、三羟甲基氨基甲烷、十二烷基硫酸钠、四甲基乙二胺、甲叉丙烯酰胺、过硫酸铵、尿素:上海生工生物工程股份有限公司产品。
1.2 主要仪器
CLARA 20LFCO乳脂分离器:瑞典Alfa Laval公司产品;GCM-C-30陶瓷膜分离系统:厦门国初科技有限公司产品;Optima L-100XP超速离心机:美国Beckman Coulter公司产品;E2695高效液相色谱分析仪:美国Waters公司产品;PROTEAN II XL电泳系统、ChemiDoc XRS+化学发光成像系统:美国Bio-Rad公司产品;ICAP TQ电感耦合等离子体质谱仪:德国Thermo公司产品;LRH-250CA低温培养箱:上海一恒科学仪器有限公司产品。
1.3 实验方法
1.3.1 诱导解离及其分离羊乳经乳脂分离器去除奶油,收集生鲜脱脂羊乳,使用1.4μm孔径陶瓷膜进行除菌处理。取除菌脱脂羊乳,进行不同的β-酪蛋白诱导解离处理,而后在100 000 g下离心60 min,取上清液进行后续组分分析。不同温度诱导处理:25、20、15、10、4℃,120 min;不同平衡时间处理:0、15、30、60、120、180、240 min,4℃;不同pH值处理:6.7、6.4、6.2、6.0、5.8、5.6、5.4,4℃,120 min; 不 同NaCl浓 度 处 理:0、25、50、100、150、250 mmol/L,4℃,120 min;不同柠檬酸钠浓度处理:0、0.5、1.0、2.0、3.0、5.0 mmol/L,4℃,120 min;不同CaCl2浓度 处 理:0、2.5、5.0、10.0、15.0、25.0 mmol/L,4℃,120 min。
1.3.2 电泳分析取1.3.1中脱脂羊乳及超速离心上清液,采用超纯水稀释8倍,与样品缓冲液等体积混合,其中样品缓冲液中含有体积分数5%的β-巯基乙醇,沸水条件下水浴3 min,而后立即冷却,每个样品上样量均为20μL。浓缩胶和分离胶质量浓度分别为4、13 g/dL,所采用的电流强度分别为20、45 mA。
1.3.3 高效液相色谱分析取1.3.1中脱脂羊乳及超速离心上清液,与缓冲液1(0.1 mol/L Bis-Tris丙烷,pH 7,质量分数1.3%柠檬酸钠、8 mom/L尿素、20 mmol/L DTT)以体积比1∶1进行混合,室温条件下,在旋转振荡器上振荡1 h,然后在10 000 g条件下离心5 min,将上清液与缓冲液2(V(乙腈)∶V(水)∶V(三氟乙酸)=100∶900∶1)以体积比1∶3进行混合,然后过0.45μm的有机膜。采用C8色谱柱,上样量40μL,梯度洗脱所采用的流动相A、B中乙腈、水、三氟乙酸的体积比分别为100∶900∶1和900∶100∶0.7,流量0.8 mL/min,检测波长为220 nm[10]。采用Empower软件对各个色谱峰的面积进行积分。
1.3.4 电感耦合等离子体质谱分析取1.3.1中脱脂羊乳及超速离心上清液1 mL于消解管内,加入3.2 mL硝酸,进行微波消解,采用超纯水定容到50 mL,采用ICP-MS进行钙含量的测定。脱脂乳钙含量减去超速离心上清液钙含量,所得到的差值,即是胶束钙含量。
1.4 数据分析
采用SPSS 20.0进行数据统计及分析,用Ducan’stest比较均值之间的差异,P<0.05时表明存在显著差异。
2 结果与分析
不同温度下平衡120 min后脱脂羊乳中游离蛋白的组成如图1所示。游离蛋白部分主要含有β-酪蛋白、β-乳球蛋白和α-乳白蛋白,还含少量κ-酪蛋白、α-酪蛋白以及一些高相对分子质量的蛋白质。随处理温度的降低,3种游离酪蛋白所对应的条带强度均逐渐增加,两种主要游离乳清蛋白的条带强度无显著变化,都与脱脂羊乳中对应蛋白的条带强度相接近。
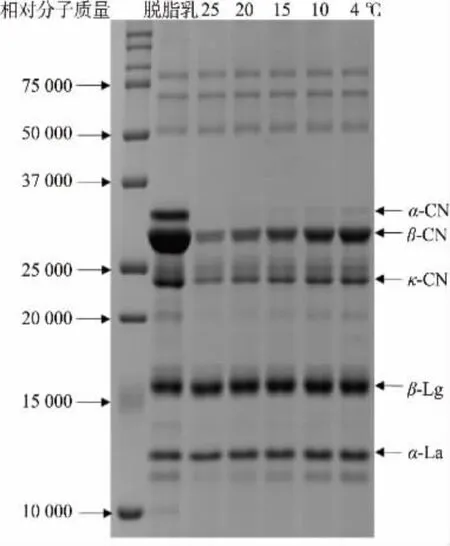
图1 不同温度处理脱脂羊乳中游离蛋白质的电泳图Fig.1 SDS-PAGE patterns of free proteins in goat skim milk incubated at different temperature
2.1 不同温度对胶束态β-酪蛋白解离的影响
不同温度下平衡120 min后脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白的质量分数及各游离酪蛋白质量分数如图2所示。随处理温度从25℃降低到4℃,3种游离酪蛋白的质量分数均逐渐增加,其中β-酪蛋白的质量分数由6.9%增加至36.5%,κ-酪蛋白的质量分数由12.1%增加至25.5%,α-酪蛋白的质量分数由4.7%增加至10.1%,3种游离酪蛋白质量分数的增幅均在15~4℃达最大。随处理温度的降低,3种游离酪蛋白中,β-酪蛋白的质量分数逐渐增加,κ-酪蛋白和α-酪蛋白的质量分数都逐渐降低。在25℃时,各游离酪蛋白的占比以κ-酪蛋白为主,β-酪蛋白略低,α-酪蛋白相对微少,其中游离κ-酪蛋白的质量分数高于脱脂乳中κ-酪蛋白所对应的质量分数,游离β-酪蛋白和α-酪蛋白的质量分数都低于脱脂乳中各蛋白所对应的质量分数;在20℃及以下时,游离β-酪蛋白的质量分数最大,且高于脱脂乳中β-酪蛋白所对应的质量分数。
不同温度下平衡120 min后脱脂羊乳中胶束钙的质量分数如图3所示。处理温度从25℃降低到4℃,胶束钙质量分数由71.1%降低至63.2%,降幅在20~4℃较大。磷酸钙在脱脂羊乳的乳清中一直处于饱和的溶解状态,且和胶束态酪蛋白中的胶体磷酸钙分布平衡[11]。乳清液中磷酸钙的饱和溶解度随温度降低而增加,进而促使胶体磷酸钙的解离,重新建立磷酸钙的饱和溶解状态。β-酪蛋白是疏水性最强的酪蛋白,在胶束结构中,一部分β-酪蛋白通过其所带的磷酸基团与胶体磷酸钙相互作用,参与胶束骨架结构形成,另一部分β-酪蛋白则通过疏水作用结合到胶束骨架上[12]。在低温作用下,会减弱蛋白之间的疏水作用,通过疏水作用结合的部分β-酪蛋白质将逐渐从胶束解离到乳清中。此外,低温条件下胶束钙含量的降低,使得胶束中通过疏水作用结合的β-酪蛋白的含量增加,进一步促使低温条件下β-酪蛋白从胶束中的解离[13]。
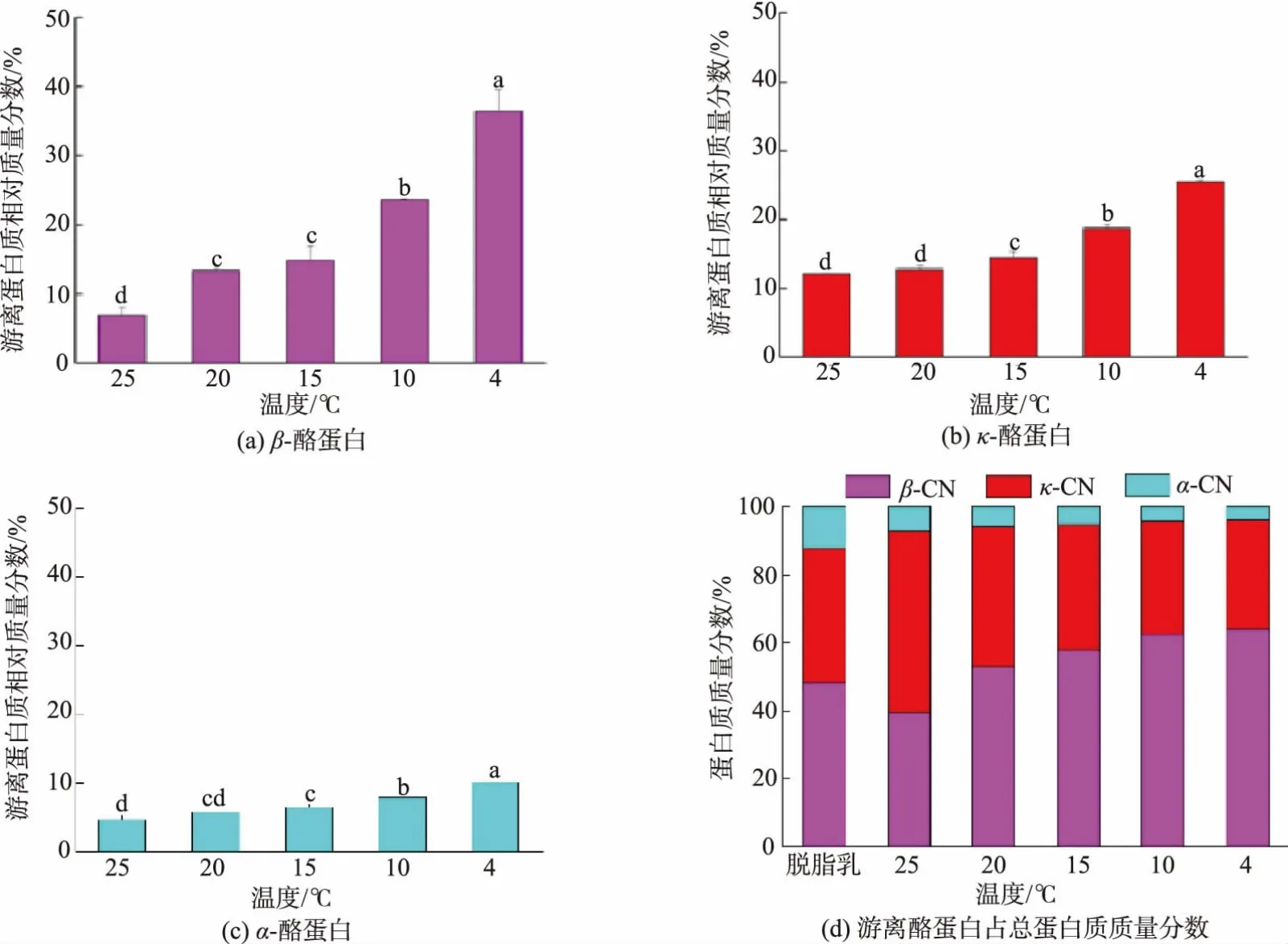
图2 不同温度处理脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白及各游离酪蛋白质量分数Fig.2 Contents of freeβ-casein,κ-casein,α-casein and ratios of each free caseins in goat skim milk incubated at different temperature
2.2 不同平衡时间对胶束态β-酪蛋白解离的影响
4℃下平衡不同时间后脱脂羊乳中各游离酪蛋白的质量分数及占比如图4所示。在平衡时间0~120 min,3种游离酪蛋白的质量分数均逐渐增加,在随后的120~240 min趋于平稳不变,其中β-酪蛋白的质量分数由17.1%增加至44.4%,κ-酪蛋白的质量分数由8.1%增加至33.7%,α-酪蛋白的质量分数由6.7%增加至14.8%,3种游离酪蛋白质量分数的增幅均在0~15 min达最大。随平衡时间的增加,3种游离酪蛋白中,β-酪蛋白的质量分数逐渐增加,κ-酪蛋白和α-酪蛋白的质量分数逐渐降低。上述结果表明,低温诱导的羊乳酪蛋白胶束内部结构重排及胶束态β-酪蛋白的解离在120 min后达到平衡状态。
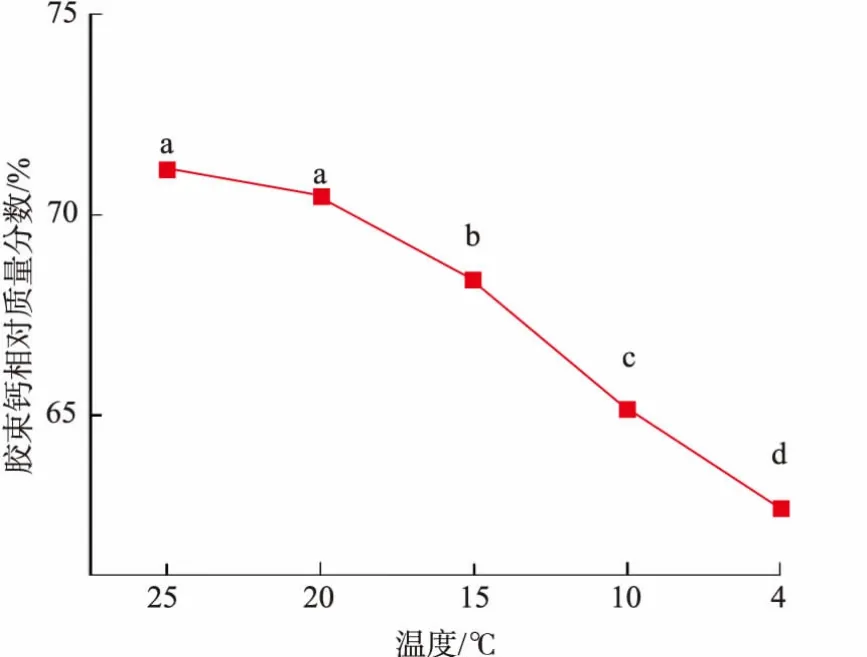
图3 不同温度处理脱脂羊乳中胶束钙的质量分数Fig.3 Contents of colloidal calcium in goat skim milk incubated at different temperature

图4 4℃下不同平衡时间处理脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白及各游离酪蛋白质量分数Fig.4 Contents of freeβ-casein,κ-casein,α-casein and ratios of each free caseins in goat skim milk incubated for different time at 4℃
2.3 不同pH对胶束态β-酪蛋白解离的影响
4℃下不同pH脱脂羊乳中各游离酪蛋白的质量分数如图5所示。在pH 6.7~5.8,3种游离酪蛋白的质量分数均逐渐增加,在随后的pH 5.8~5.4趋于平稳不变,其中β-酪蛋白的质量分数由31.4%增加至47.2%,κ-酪蛋白的质量分数由16.9%增加至25.3%,α-酪蛋白的质量分数由7.7%增加至23.0%,β-酪蛋白质量分数的增幅在pH 6.2~5.8达最大,κ-酪蛋白和α-酪蛋白质量分数的增幅均在pH 6.0~5.8达最大。在pH 6.7~6.0,3种游离酪蛋白中,β-酪蛋白的质量分数略有增加;在pH 6.0~5.8,β-酪蛋白的质量分数显著降低;在pH 5.8~5.4,β-酪蛋白的质量分数趋于稳定不变。游离α-酪蛋白的质量分数在pH 6.7~5.8逐渐增加,在pH 5.8~5.4则趋于稳定不变。游离κ-酪蛋白的质量分数在pH 6.7~6.0逐渐降低,在pH 6.0~5.8显著增加,在pH 5.8~5.4则趋于稳定不变。
4℃下不同pH脱脂羊乳中胶束钙的质量分数如图6所示。随pH从6.7降低到5.4,胶束钙质量分数由65.2%降低至37.1%。磷酸根离子的质子化程度随pH降低而增加,从而导致磷酸钙饱和溶解度增加,使胶体磷酸钙解离,重新建立磷酸钙饱和溶解平衡。胶束态酪蛋白分子上,负电荷基团逐渐暴露(如磷酸基和羧酸基),然后发生质子化,且乳清离子强度的增加会增加负电荷基团所受的静电屏蔽作用,进而降低脱钙胶束内部邻近酪蛋白分子之间的静电排斥力,脱钙胶束主要在疏水作用的维持下保持一种相对稳定的状态[14]。这也使得胶束中通过疏水作用结合的β-酪蛋白的含量增加,促使低温条件下β-酪蛋白从胶束中的解离。

图5 4℃下不同pH处理脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白及各游离酪蛋白质量分数Fig.5 Contents of freeβ-casein,κ-casein,α-casein and ratios of each free caseins in goat skim milk incubated at different pH at 4℃
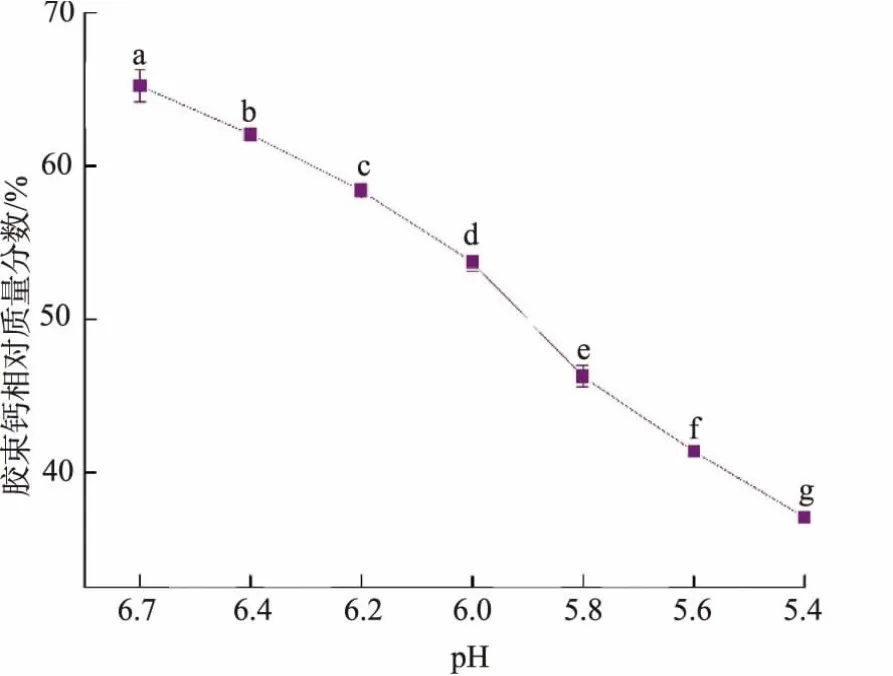
图6 4℃下不同pH处理脱脂羊乳中胶束钙的质量分数Fig.6 Contents of colloidal calcium in goat skim milk incubated at different pH at 4℃
2.4 不同NaCl浓度对胶束态β-酪蛋白解离的影响
4℃下不同NaCl浓度的脱脂羊乳中各游离酪蛋白的质量分数及占比如图7所示。随NaCl浓度从0 mmol/L增加到250 mmol/L,3种游离酪蛋白的质量分数均呈增加趋势,其中β-酪蛋白的质量分数由30.5%增加至37.25%,κ-酪蛋白的质量分数由19.7%增加至26.4%,α-酪蛋白的质量分数由7.3%增加至19.3%。随NaCl浓度的增加,3种游离酪蛋白中,β-酪蛋白的占比逐渐降低,κ-酪蛋白和α-酪蛋白的占比逐渐增加。添加NaCl使脱脂羊乳乳清的离子强度增加[15],促使胶束钙的解离,胶束中通过疏水作用结合的β-酪蛋白的质量分数增加,进而促使低温条件下β-酪蛋白从胶束中的解离。
2.5 不同柠檬酸钠浓度对胶束态β-酪蛋白解离的影响
不同柠檬酸钠浓度的脱脂羊乳中各游离酪蛋白的质量分数如图8所示,3种游离酪蛋白的质量分数在柠檬酸钠浓度0~3 mmol/L时均呈增加趋势,在3~5 mmol/L时趋于平稳。β-酪蛋白的质量分数由30.5%增加至38.1%,κ-酪蛋白的质量分数由19.7%增加至26.0,α-酪蛋白的质量分数由7.3%增加至13.8%。随柠檬酸钠添加浓度的增加,3种游离酪蛋白中,β-酪蛋白和α-酪蛋白的质量分数都略有增加,κ-酪蛋白的质量分数逐渐降低。
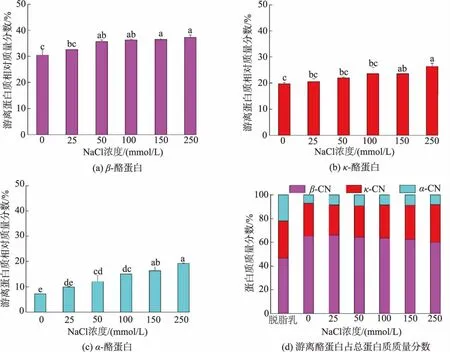
图7 4℃下不同NaCl浓度处理脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白及各游离酪蛋白质量分数Fig.7 Contents of freeβ-casein,κ-casein,α-casein and ratios of each free caseins in goat skim milk incubated with different added concentration of NaCl at 4℃
4℃下不同柠檬酸钠浓度处理脱脂羊乳中胶束钙的质量分数如图9所示。柠檬酸钠浓度从0 mmol/L增加到5 mmol/L,胶束钙质量分数由65.4%降低至53.2%。添加的螯合剂与脱脂羊乳乳清中游离的钙离子相结合,从而使胶束钙解离到乳清中,磷酸钙的饱和溶解状态重新建立。胶束态酪蛋白分子上的负电荷基团随之暴露,增加了脱钙胶束内部邻近酪蛋白分子之间的静电排斥力,使胶束态酪蛋白解离到乳清中。胶束中通过疏水作用结合的β-酪蛋白的含量增加,进一步促使低温条件下β-酪蛋白从胶束中解离[16-17]。
2.6 不同CaCl2浓度对胶束态β-酪蛋白解离的影响
4℃下不同CaCl2浓度处理脱脂羊乳中各游离酪蛋白的质量分数如图10所示。CaCl2浓度从0 mmol/L增加到25 mmol/L,3种游离酪蛋白的质量分数均呈降低趋势,其中β-酪蛋白的质量分数由30.5%减少至15.9%,κ-酪蛋白的质量分数由19.7%减少至6.8%;α-酪蛋白的质量分数由7.3%减少至4.8%,3种游离酪蛋白中,β-酪蛋白和κ-酪蛋白的质量分数呈逐渐减少趋势,α-酪蛋白的质量分数呈逐渐增加趋势。添加CaCl2使脱脂羊乳乳清中磷酸钙处于过饱和状态,促使游离钙离子结合到胶束中,增加胶束钙含量,胶束中通过疏水作用结合的β-酪蛋白的质量分数降低,从而减少低温条件下β-酪蛋白从胶束中的解离[18-19]。
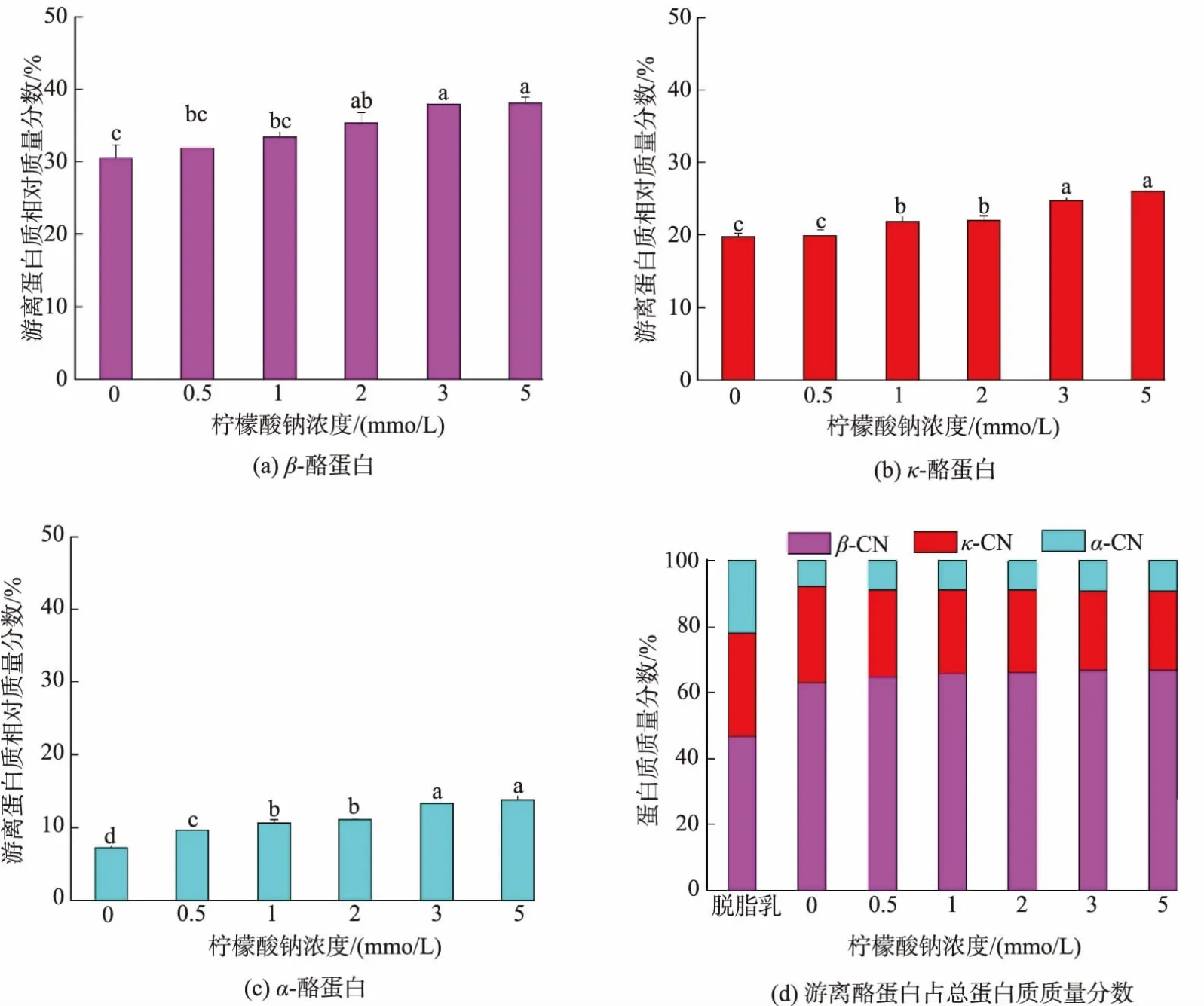
图8 4℃下不同柠檬酸钠浓度处理脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白及各游离酪蛋白质量分数Fig.8 Contents of freeβ-casein,κ-casein,α-casein and ratios of each free caseins in goat skim milk incubated with different added concentration of sodium citrate at 4℃
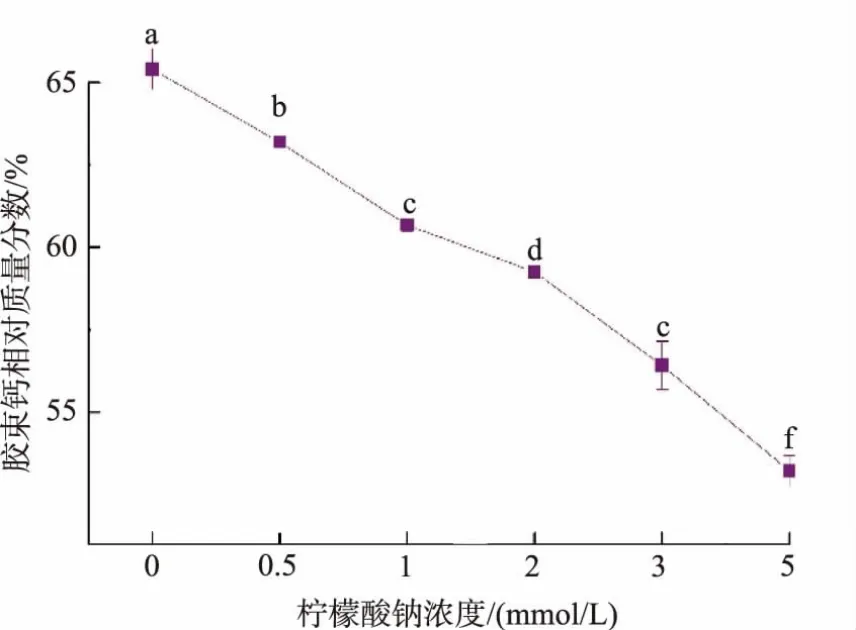
图9 4℃下不同柠檬酸钠浓度处理脱脂羊乳中胶束钙的质量分数Fig.9 Contents of colloidal calcium in goat skim milk incubated with different added concentration of sodium citrate at 4℃
3 结语
温度、平衡时间、pH、NaCl浓度、柠檬酸钠浓度、CaCl2浓度对羊乳中β-酪蛋白从胶束中的解离有显著影响。在羊乳酪蛋白胶束结构中,部分β-酪蛋白通过疏水作用与胶束骨架相结合,在低温作用下,会减弱蛋白质之间的疏水作用,通过疏水作用结合的部分β-酪蛋白从胶束中解离。低温诱导胶束钙的解离,使得胶束中通过疏水作用结合的β-酪蛋白的含量增加,促进低温条件下β-酪蛋白从胶束中的解离。低温诱导胶束态β-酪蛋白的解离在120 min后达到平衡状态。降低pH及添加柠檬酸钠和NaCl促进胶束钙的解离,增加胶束中通过疏水作用结合的β-酪蛋白的含量,进一步促使低温条件下β-酪蛋白从胶束中的解离。上述结果将为羊乳中β-酪蛋白的低温微滤分离提供参考。

图10 4℃下不同CaCl2浓度处理脱脂羊乳中游离β-酪蛋白、κ-酪蛋白、α-酪蛋白及各游离酪蛋白质量分数Fig.10 Contents of freeβ-casein,κ-casein,α-casein and ratios of each free caseins in goat skim milk incubated with different concentration of CaCl2 at 4℃

