基于微流控芯片的茶多酚电化学检测方法研究
谢耀聪,俞建峰*,石 赛
(1.江南大学 机械工程学院,江苏 无锡 214122;2.江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
茶多酚是茶叶中多酚类化合物的总称,是一种安全无毒、无副作用的纯天然提取物[1]。茶多酚中含有较多羟基,能够有效抑制氧化酶活性,阻止氧化过程中的链式反应,表现出较强的抗氧化能力[2],具有清除自由基[3]、抗衰老[4]、抗癌[5]、降血脂[6]等生物活性,广泛应用于食品、医药、化妆品等领域[7-9]。因此,茶多酚的检测分析对茶多酚制品的品质控制具有重要意义。
目前茶多酚的检测方法主要有福林酚法、气相色谱法、高效液相色谱法等[10],虽然这些方法检测精度高,但也存在操作复杂、分析时间长、仪器成本高等缺点。循环伏安法和安培滴定法等电化学技术,具有检测速度快、灵敏度高和仪器成本低等优点[11],已成为一种茶多酚检测的新方法,但现有的茶多酚电化学检测过程仍存在自动化程度低,试剂样品用量大等[12]缺陷。
微流控是一种在微米尺度的通道中实现微液滴操纵、沉淀反应、分离及检测等功能的技术[13]。微流控芯片中可集成生物酶、微电极等结构,并借助检测仪器实现物质的定量分析,减少了试剂用量,实现样品预处理到检测分析的整体微型化、集成化与便携化[14-15]。开展微流控和电化学技术相结合的茶多酚检测方法的研究尚未见相关文献报道。
作者提出了一种基于微流控芯片的茶多酚电化学检测方法,将茶多酚检测过程中的进料、混合和循环伏安检测功能集成在微流控芯片上,采用3D打印技术制造微流控芯片,以微流控芯片为检测通道,丝网印刷电极为电化学传感器,建立了微流控检测平台,通过实验对检测过程中的缓冲液种类、缓冲液pH、扫描速度和进料流量等4个参数进行了优化,最后运用该方法测定普洱茶样品的茶多酚含量,并与标准福林酚法的检测结果进行对比。
1 材料与方法
1.1 材料与仪器
1.1.1 材料没食子酸标准品:购于合肥博美生物公司;普洱茶样品:购于云南普洱茶(集团)有限公司;福林酚、碳酸钠、氯化钾、浓硫酸,配置PBS缓冲液的磷酸、磷酸氢二钠、磷酸二氢钾,配置CBS缓冲液的柠檬酸、磷酸氢二钠、配置B-R缓冲液的硼酸、乙酸、氢氧化钠:购于国药集团试剂有限公司;其他试剂均为分析纯,使用前未进行纯化;实验用水均为去离子水。
1.1.2 仪器CHI660E电化学工作站:上海辰华仪器公司产品;注射泵:苏州汶颢微流控技术有限公司产品;微流控芯片:江南大学食品加工技术与装备研究中心自制;丝网印刷碳电极:市售;精密电子分析天平:奥豪斯国际贸易(上海)有限公司产品;722可见分光光度计:上海欣茂仪器有限公司产品;高速离心机:上海安亭科学仪器厂产品。
1.2 微流控芯片研制
为了满足微流控检测平台对茶多酚的检测需求,设计了具有自动进料、混合和循环伏安检测功能的微流控芯片,模型如图1所示。A为芯片的进料通道,通过PTFE导管分别与注射泵的两个微量进样器连接,实现缓冲液和待测样品的自动进料功能;B为混合通道,将缓冲液和待测样品进行充分混合,为循环伏安法提供稳定的检测环境,混合是茶多酚检测过程中的关键环节,如果混合不均匀将产生较大的检测误差,因此将混合通道设计成内肋形微混合结构,文献报道并验证了此结构混合效率高,混合均匀性好[16]。C为电化学检测区,D为废液出口,E为电极插口。可集成商品化丝网印刷电极,降低了微电极高昂的制作成本,丝网印刷电极为三电极结构,工作电极和辅助电极为碳墨电极,参比电极为Ag/AgCl电极。

图1 微流控芯片结构模型Fig.1 Structure model of microfluidic chip
微流控芯片由Micro Plus Advantage 3D打印机(EnvieionTEC,德国)采用DLP技术打印成型,芯片材料为Formlabs耐高温光敏树脂。
1.3 检测平台搭建
图2为微流控检测平台示意图,主要由注射泵(行程分辨率:0.078μm)、微流控芯片(自制)、丝网印刷电极、电化学工作站和计算机组成。微流控芯片的接口处均采用热熔胶密封,防止溶液泄漏。注射泵通过微量进样器以一定的进料流量将缓冲液和待测样品分别注入微流控芯片的进料通道,两种溶液混合均匀后到达电化学检测区,丝网印刷电极通过适配器与电化学工作站连接,电化学工作站采用循环伏安法测得氧化峰电流与没食子酸浓度的定量关系,进而应用于茶多酚的检测分析。
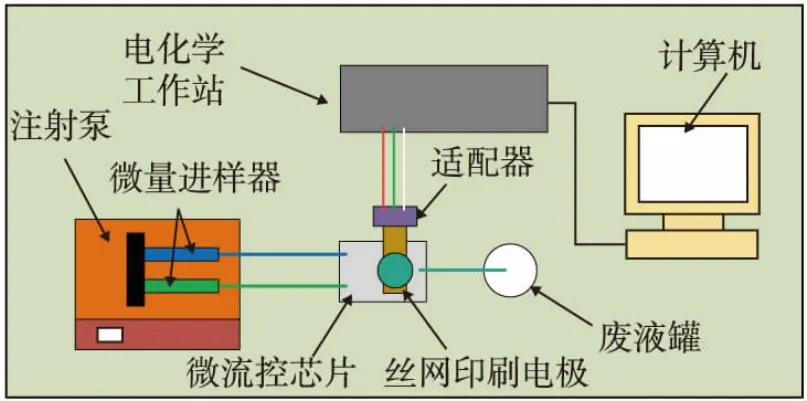
图2 微流控检测平台示意图Fig.2 Schematic diagram of microfluidic detection platform
1.4 实验方法
1.4.1 标准溶液制备没食子酸母液制备:称取0.171 g的没食子酸(gallic acid,GA)标准品加入烧杯中,用去离子水充分溶解后,移至100 mL容量瓶中定容。将母液稀释成5~1 250μmol/L共13个不同浓度的没食子酸溶液,4℃冰箱中保存备用。
1.4.2 样品制备普洱茶样品母液制备:将15 mL体积分数10%的甲醇溶液置于70℃水浴锅中预热,普洱茶样品置于碾磨钵中碾磨,称取0.2 g碾磨后的样品于8 mL离心试管中,加入5 mL预热后的甲醇溶液,充分搅拌,立即转至70℃水浴锅中保温10 min,取出后降到室温,在3 500 r/min的离心机中离心10 min,上层清液移至10 mL容量瓶中,残渣再提取一次,另用滤纸过滤两次,合并两次清液加去离子水定容到10 mL,摇匀,4℃冰箱中保存备用。
1.4.3 电极活化丝网印刷碳电极的活化方法1:将电极插入饱和碳酸钠溶液中,采用计时电流法,恒电位为1.2 V,扫描5 min;方法2:将电极置于0.5 mol/L稀硫酸溶液中,采用循环伏安法扫描至稳定。电极活化后集成至微流控检测平台上,采用循环伏安法,进料流量为40μL/min,以100 mV/s进行扫描,电解质为B-R缓冲液(pH 3.0)。在此条件下,研究没食子酸的电化学行为,选择最佳的电极活化方法。
1.4.4 实验条件优化
1)研究缓冲液种类和pH的影响 制备0.1 mol/L的B-R,PBS,CBS 3种缓冲液(pH 3.0)。注射泵的检测样品进样器吸取500μmol/L的没食子酸溶液2 mL,缓冲液进样器每次吸取与没食子酸等量的缓冲液,设定注射泵的进料流量为40μL/min,以100 mV/s进行扫描,同一条件下连续检测5次,取氧化峰电流的平均值。更换缓冲液进样器中的缓冲液,重复检测步骤。选定最佳缓冲液后,配置其不同pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0),重复检测步骤。
2)研究扫描速度的影响 注射泵的两个进样器分别吸取B-R缓冲液(pH 3.0)和500μmol/L的没食子酸溶液2 mL,设定其进料流量为40μL/min,改变循环伏安扫描方式,同一条件下连续检测5次,取氧化峰电流的平均值。
3)研究进料速度的影响 注射泵的两个进样器分别吸取B-R缓冲液(pH 3.0)和500μmol/L的没食子酸溶液2 mL,设定循环伏安扫描速度为100 mV/s,改 变 进 料 流 量(0,20,40,60,80,100,120,140,160,180,200μL/min),同一条件下连续检测5次,取氧化峰电流的平均值。
1.4.5 标准曲线的测定在最优实验条件下,分别测定5~1 250μmol/L共13组不同浓度没食子酸的氧化峰电流值,同一浓度下连续检测5次,取氧化峰电流的平均值,每次检测所消耗的没食子酸溶液为10μL。以没食子酸浓度x为横坐标,氧化峰电流值y为纵坐标,计算得到标准曲线。
1.4.6 普洱茶样品中的茶多酚质量分数测定取普洱茶样品母液0.25 mL加至100 mL容量瓶中,加水定容,取4份5 mL样品溶液,分别加入一定量的没食子酸标准品,得到样品待测液,在最优实验条件下,分别测定其氧化峰电流,平行检测3次,计算得到回收率与样品中茶多酚的质量分数。
1.4.7 统计分析方法采用Excel 2013记录和整理实验数据,运用OriginPro 2017软件对数据进行统计分析及作图。
2 结果与讨论
2.1 没食子酸在微流控检测平台上的电化学行为
图3为空白底液和没食子酸溶液在集成不同活化电极的微流控检测平台上的循环伏安图(电压0~0.9 V)。两种活化电极在空白底液中,未出现电流响应;在没食子酸溶液中,电压在0.41 V(相对于Ag/AgCl)左右均出现一个不可逆的氧化峰,与文献[17]中报道的一致。对比图3中(a)和(b)两条曲线可知,饱和碳酸钠活化电极的氧化峰电流响应更大,峰形明显,主要原因是经过饱和碳酸钠溶液处理后,电极表面的碳墨变得蓬松多孔,增加了其与没食子酸的接触面积;同时,电极表面生成的含氧基团有利于减弱羟基键能[18]。这些性质有效提高了电极表面的电荷迁移速度,使得电极反应速度加快,故选择在微流控检测平台上集成饱和碳酸钠活化电极。
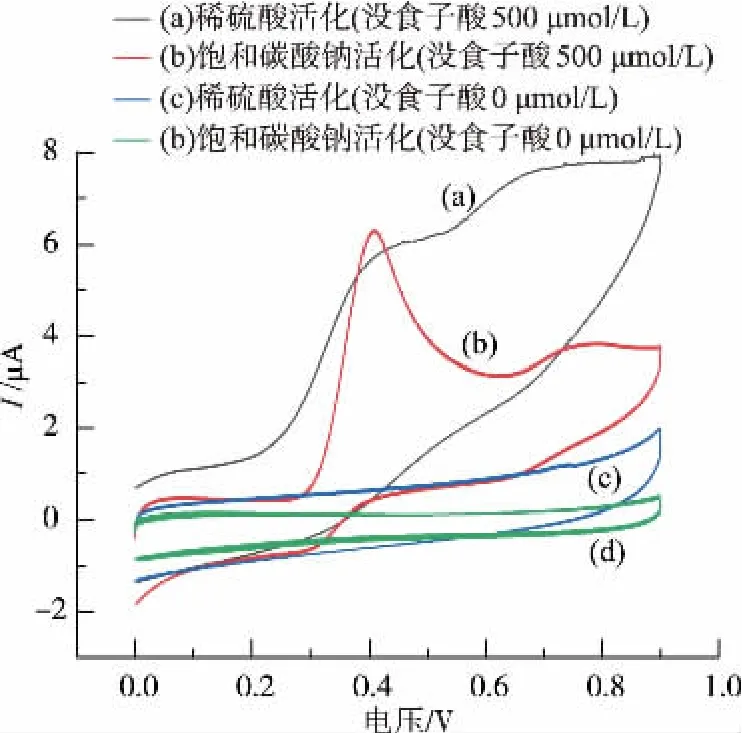
图3 饱和碳酸钠活化电极和稀硫酸活化电极的循环伏安图Fig.3 CVs of saturated sodium carbonate solution activated carbon electrodes and dilute sulfuric acid solution activated carbon electrodes
2.2 缓冲液种类和pH的影响
没食子酸的电化学行为与缓冲液种类和pH等多种因素有关。在微流控检测平台上,采用循环伏安法对B-R,PBS和CBS 3种缓冲液中没食子酸的氧化行为进行研究。由图4(a)可知,B-R缓冲液的氧化峰与阳极电流分离较好,峰电流最大,因此选择B-R缓冲液作为支持电解质。
通过循环伏安法在pH 2.0~8.0范围内研究BR缓冲液的pH对没食子酸氧化峰电流的影响。由图4(b)可知,当pH增加时,没食子酸的氧化峰电位负向移动,表明质子参与电极反应[19]。氧化峰电位与理论值[17]接近。由图4(c)可知,在pH 2.0~8.0范围内,没食子酸的氧化峰电流随着pH的增加先增后减,在pH约为3.0处获得最大的峰电流响应。因此,作者选择pH为3.0的B-R缓冲液,进行下一步实验。
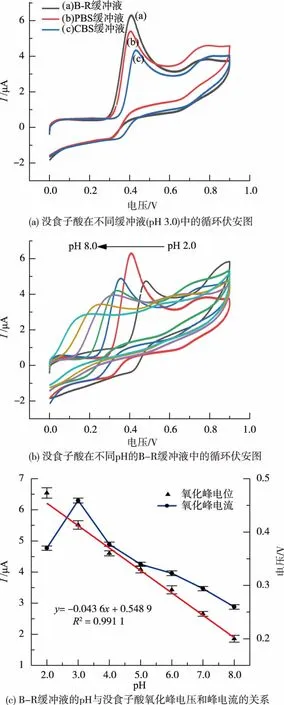
图4 缓冲液种类和pH对没食子酸氧化峰电压和峰电流的影响Fig.4 Effect of buffer types and pH on the oxidation peak potential and peak current of GA
2.3 扫描速度的影响
图5是不同扫描速度对没食子酸氧化峰电流的影响。由图5(a)可知,氧化峰电流随着扫描速度的增大而增大。由图5(b)可知,氧化峰电流与扫描速度的平方根具有良好的线性关系,线性回归方程为Ipa=3.820 2+0.234 5v1/2,这表明电极反应过程受扩散控制[20]。扫描速度超过100 mV/s时,循环伏安曲线逐渐毛糙,对实验结果产生干扰和误差,综合考虑氧化峰电流大小和循环伏安曲线的光滑程度,扫描速度选择100 mV/s为佳。
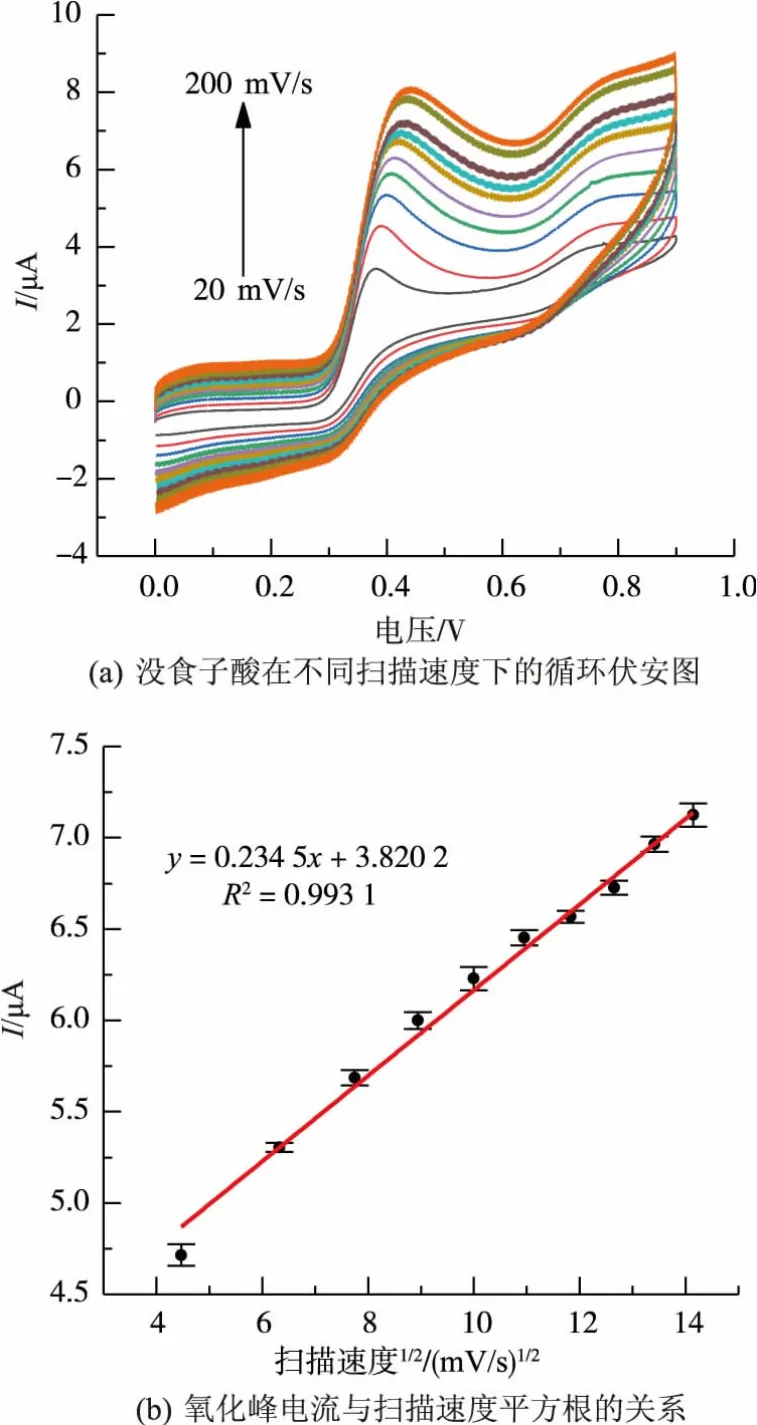
图5 扫描速度对没食子酸氧化峰电流的影响Fig.5 Effect of scan rates on the oxidation peak current of GA
2.4 进料流量的影响
图6为不同进料流量对氧化峰电流的影响。进料流量分别在0和20μL/min时,连续5次测得的氧化峰电流相对标准偏差RSD大于10%,重复性较差,分析其原因可能是微流控芯片中的液体流速过慢时,芯片内部液体分布不均匀,导致芯片电化学检测区的没食子酸浓度产生波动,影响了检测重复性;进料流量在40~200μL/min时,氧化峰电流随着进料速度的增加先减小后增加,最后趋于稳定,检测结果重复性较好(RSD小于1.7%),分析其原因可能是随着进料速度的增加,芯片内部流场逐渐稳定,但部分没食子酸的氧化产物吸附在工作电极表面,阻碍了电荷转移,降低了电极表面的反应速率[21];随着进料流量进一步增加,没食子酸在电极表面的更新速度加快,使得电极反应速度增加,当没食子酸的更新速度达到极限时,氧化峰电流逐渐稳定。综合考虑氧化峰电流、重复性和试剂用量,选择流量为40μL/min。
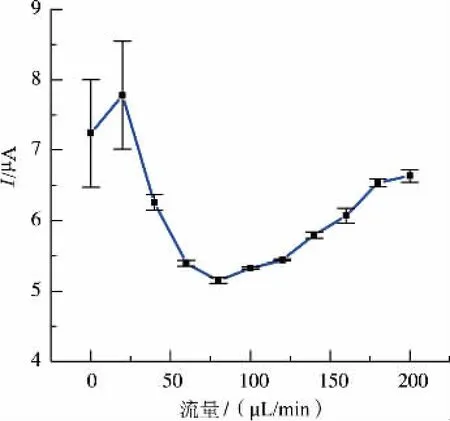
图6 氧化峰电流与进料流量的关系Fig.6 Plots of the oxidation peak current for GA as function of inject speeds
2.5 标准曲线与检出限
在最优实验条件下,采用微流控检测平台对不同浓度的没食子酸进行循环伏安检测。图7(A)为不同 浓 度(5,10,25,50,75,100,200,300,400,500,750,1 000,1 250μmol/L)没食子酸的循环伏安图,由图7(a)可知,氧化峰电流随着没食子酸浓度的增加而增加。由图7(b)可知,没食子酸浓度在5~1 250μmol/L范围内与氧化峰电流有良好的线性关系,线性回归方程为:Ipa=0.174 3+0.011 4c(Ipa,μA;c,μmol/L;R2=0.998 0),最低检出限为6.9×10-7mol/L(S/N=3),灵敏度为0.011 4μA/(μmol/L)。
2.6 重现性、再现性和稳定性
在最优实验条件下,对微流控检测平台进行了重现性、再现性和稳定性的研究。在微流控检测平台上连续检测500μmol/L的没食子酸溶液5次,测得氧化峰电流的相对标准偏差RSD为1.739%,说明检测平台具有良好的重现性。采用饱和碳酸钠溶液活化5片新的丝网印刷碳电极,并依次集成到微流控检测平台中对500μmol/L的没食子酸溶液进行测定,测得氧化峰电流的RSD为2.231%,说明检测平台具有良好的再现性。采用同一微流控检测平台连续一周对500μmol/L的没食子酸溶液进行检测(测量次数大于50次),测得氧化峰电流的RSD为2.068%,说明检测平台具有良好的稳定性。
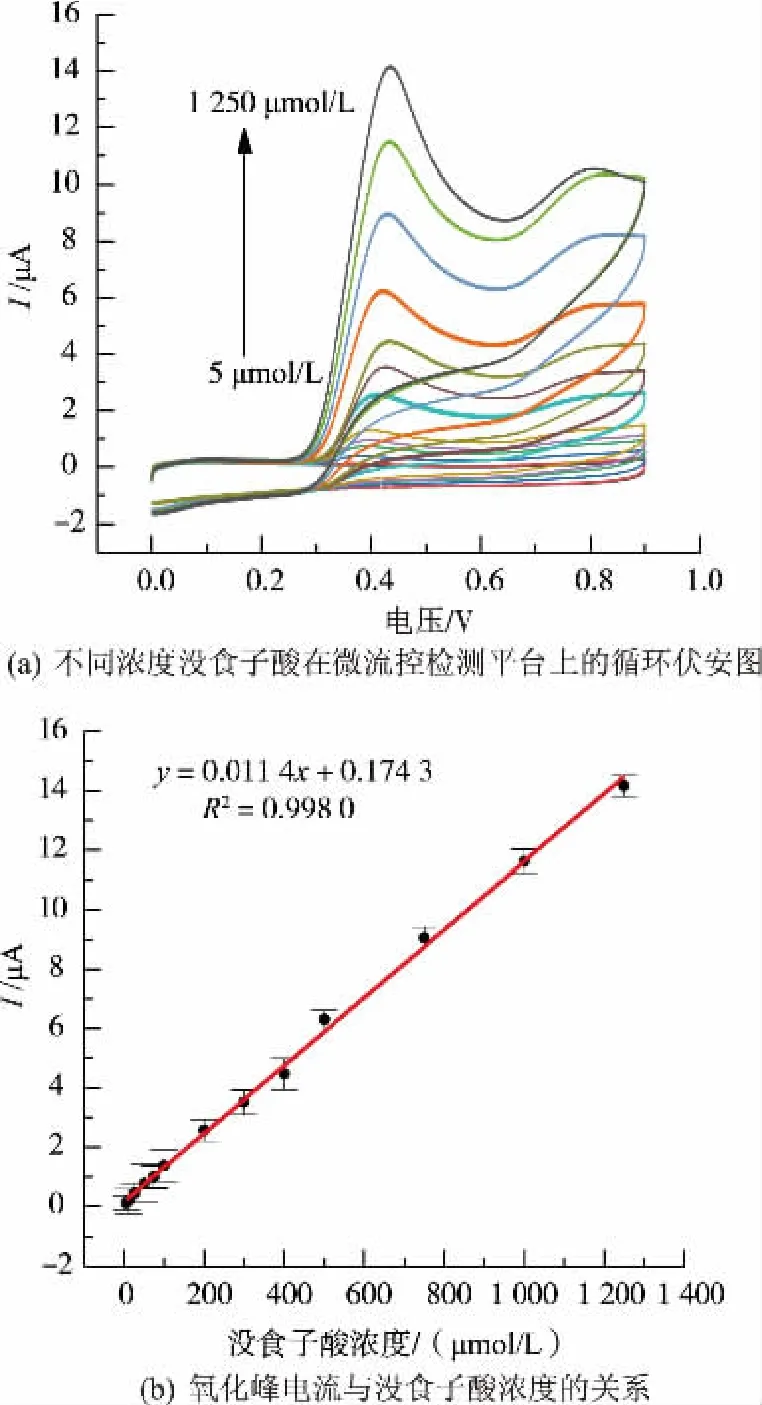
图7 没食子酸标准曲线的测定Fig.7 Determination of GA standard curve
2.7 样品分析
取4份已制备的普洱茶样品待测液,在最优实验条件下,采用标准加入法测定其氧化峰电流,平行检测3次取平均值。样品检测结果如表1所示,回收率在97.6%~104.6%之间,与福林酚法的检测结果基本一致,表明本方法可满足茶多酚常规分析要求。
3 结语
将茶多酚检测过程中的进料、混合和循环伏安检测功能集成在微流控芯片上,并设计了可集成丝网印刷碳电极的插口,降低了微电极的制作成本,采用3D打印技术制造微流控芯片,建立了微流控检测平台。
通过实验对缓冲液种类、缓冲液pH、扫描速度和进料速度4个参数进行了优化,并运用该方法测定普洱茶样品中茶多酚的含量,检测结果与福林酚法基本一致,满足茶多酚的常规分析要求。
本方法中进样、混合和循环伏安检测过程自动化进行,省去了人工操作环节,检测时间缩短为40 s,试剂用量为70μL,具有简便、低成本、准确的特点,可用于茶多酚含量的快速检测,并可推广到其他植物提取物的快速检测。

