双去甲氧基姜黄素对星型孢菌素诱导心肌细胞凋亡的影响
黎 星,霍 聪,刘 艳,许 荣,夏跃胜,贾 新,王晓明
(第四军医大学西京医院老年病科,西安 710032)
大量研究表明心肌细胞凋亡是心肌缺血再灌注损伤、扩张型心肌病、糖尿病心肌病、心力衰竭等诸多心脏疾病发生发展的重要病理生理过程[1-5],因此减少心肌细胞凋亡仍是临床治疗、减缓和逆转心脏疾病首要考虑的方法,所以寻找方便、经济、简单的心肌保护药物显得尤为重要。
姜黄素类化合物是姜黄、莪术等传统中药植物中提取的天然成份,具有抗炎、抗氧化、抗肿瘤等重要作用。主要成份有姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素(bisdemethoxycurcumin, BDMC)。研究发现姜黄素在心肌缺血再灌注损伤和心力衰竭中能减轻心肌细胞凋亡,发挥心肌保护作用[6,7]。但是姜黄素天然衍生物BDMC的心肌保护作用尚未被报道。因此本研究通过经典的线粒体途径凋亡诱导剂星型孢菌素(staurosporine, STS)建立细胞凋亡模型, 探讨BDMC对心肌细胞凋亡的影响及在凋亡过程中与细胞存活率和细胞内活性氧(reactive oxygen species,ROS)水平的关系,为BDMC能够进入临床使用提供实验依据。
1 材料与方法
1.1 材料
0~2 d的C57BL/6J小鼠乳鼠(第四军医大学动物实验中心)。5-溴-2-核苷尿嘧啶(BrdU;MP公司,美国)。BDMC(慕颐生物科技有限公司,上海),二甲基亚砜(DMSO)、STS(Sigma-Aldrich公司,美国),CCK-8细胞活性检测试剂盒、ROS活性检测试剂盒(恩晶生物科技有限公司,南京)。原位末端标记法(TdT-mediated dUTP nick end labeling, TUNEL)凋亡检测试剂盒(GeneCopoeia公司,美国)。Caspase-3酶活性检测试剂盒(Thermo公司,美国)。
1.2 方法
1.2.1 原代心肌细胞培养 75%乙醇消毒小鼠乳鼠身体,取出心脏,冰PBS清洗3次。Ⅱ型胶原酶(1 g/L)消化6~7次,每次5 min。收集消化后的细胞悬液,加入新鲜培养液终止消化,以800转/min离心6 min后弃上清,加入培养液重悬细胞,200目滤网过滤后接种于培养瓶中,37℃、5%CO2差速贴壁1 h除去成纤维细胞。将含10%胎牛血清的DMEM与10 mmol/L的BrdU以1∶100的比例混合加入细胞,37℃、5%CO2、饱和湿度培养24 h后更换培养液,然后继续培养至细胞同步搏动待用。
1.2.2 实验分组 实验分4组:对照组、STS组、BDMC预处理+STS组和 BDMC组。对照组:采用单纯培养液,不给予任何药物;STS组:培养液中加入终浓度为 4 μmol/L 的STS; BDMC 预处理+STS组:培养液中加入终浓度为100 μmol/L的BDMC预处理1 h,再加入终浓度为4 μmol/L的STS;BDMC 组:培养液中单独加入终浓度为 100 μmol/L的BDMC。

1.2.4 TUNEL检测细胞凋亡 将细胞接种至放有盖玻片的24孔板,培养至细胞搏动后按照分组加药处理6 h,吸弃培养液,加入4%的多聚甲醛 500 μl,4℃孵育30 min,冷PBS清洗3次,每次5 min。吸弃PBS,用含0.2%TritonX-100的PBS进行通透处理,室温孵育30 min,PBS清洗3次,每次5 min。每孔加100 μl TdT反应液,使其全部覆盖待测样本,室温孵育10 min。按说明配制TdT反应混合液,弃TdT反应缓冲液,每个样本滴加50 μl TdT反应混合液,置于密闭湿盒内,37℃孵育60 min,含3%BSA的PBS清洗3次,每次5 min。吸弃PBS,100 μl Andy FluorTM488-Streptavidin染色液覆盖每个样本,室温孵育30 min后,3%BSA-PBS清洗3次,每次5 min。10 mg/L DAPI染核10 min,PBS清洗3次,抗荧光淬灭剂封片,荧光显微镜观察拍照,每组随机选5个视野计算凋亡比例。
1.2.5 Caspase-3酶活性检测 将细胞接种至 96孔板,按照试剂盒说明书设置反应体系,每组设10个副孔。每孔细胞加入25 μl裂解液(每106个细胞加入50 μl裂解液),于-80℃冰箱反复冻融3次,每次5 min。按照说明书配制caspase-3底物反应混合液,每孔加入25 μl混匀,37℃孵育60 min。采用342 nm/441 nm波长检测各孔荧光值,其荧光强度与caspase-3活性成正比。
1.2.6 心肌细胞内ROS检测 将细胞接种至 96孔板,每组设8个副孔。BDMC预处理组加入BDMC预处理1 h后加入STS,培养7 h,余各组加药后培养相同时间。按照ROS检测试剂盒加入ROS荧光探针,使其终浓度为10 μmol/L,孵箱继续培养1 h。使用全波长酶标仪500 nm/530 nm检测各组心肌细胞内ROS水平,其含量与荧光强度成正比。
1.3 统计学处理
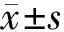
2 结 果
2.1 BDMC对STS处理后原代心肌细胞生存率的影响
相比对照组,STS组和STS+BDMC组的心肌细胞生存率降低(P<0.05)。BDMC组的心肌细胞生存率差异无统计学意义(P>0.05)。相比STS组,BDMC预处理+STS组的心肌细胞生存率明显升高(P<0.05,图1)。
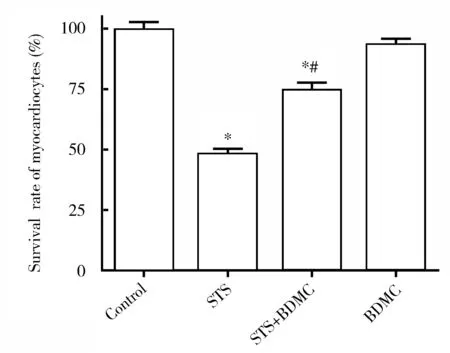
图1 心肌细胞存活率比较Figure 1 Comparison of survival rate of cardiomyocytes
2.2 BDMC能抑制STS诱导的心肌细胞凋亡
相比对照组,STS组和TUNEL阳性的凋亡细胞数量明显增加(图2)。随机选取5个视野进行细胞计数,计算心肌细胞凋亡率。相比STS组,BDMC预处理+STS组TUNEL阳性的凋亡心肌细胞数量显著下降(P<0.05,图3)。
2.3 BDMC预处理能降低STS处理后的心肌细胞caspase-3活性
相比对照组,STS组和BDCM预处理+STS组caspase-3酶活性显著增加(P<0.05,图4)。相比STS组,BDMC预处理+STS组caspase-3酶活性降低(P<0.05,图4)。
2.4 BDMC预处理对STS处理后的心肌细胞ROS水平的影响
相比对照组,STS组和BDMC预处理+STS组的ROS水平增高(P<0.05,图5)。相比STS组,BDMC预处理+STS组ROS水平下降(P<0.05,图5)。
3 讨 论
姜黄素类化合物是传统中药姜黄的主要成分,其主要成分姜黄素在心肌梗死后能减轻心肌缺血再灌注损伤,改善心脏功能[8],减弱心肌梗死后心肌纤维化[9]。同样能减轻糖尿病性心肌损伤[10]。但其易被氧化, 对光稳定性差。 而另一种天然单体成分BDMC,在体内生理条件下的稳定性强于姜黄素[11]。研究表明BDMC能抑制血小板衍生生长因子诱导的血管平滑肌迁移和增殖[12]。摄食BDMC能抑制脂肪细胞形成,改善高脂饮食导致的C57小鼠肥胖[13]。而且BDMC预处理会减轻叔丁基过氧化氢造成的细胞老化[14]。BDMC兼有姜黄素类化合物对心血管疾病的治疗及保护作用,又有稳定的药理学特性,本研究探讨了它的抗心肌凋亡作用和可能的机制。
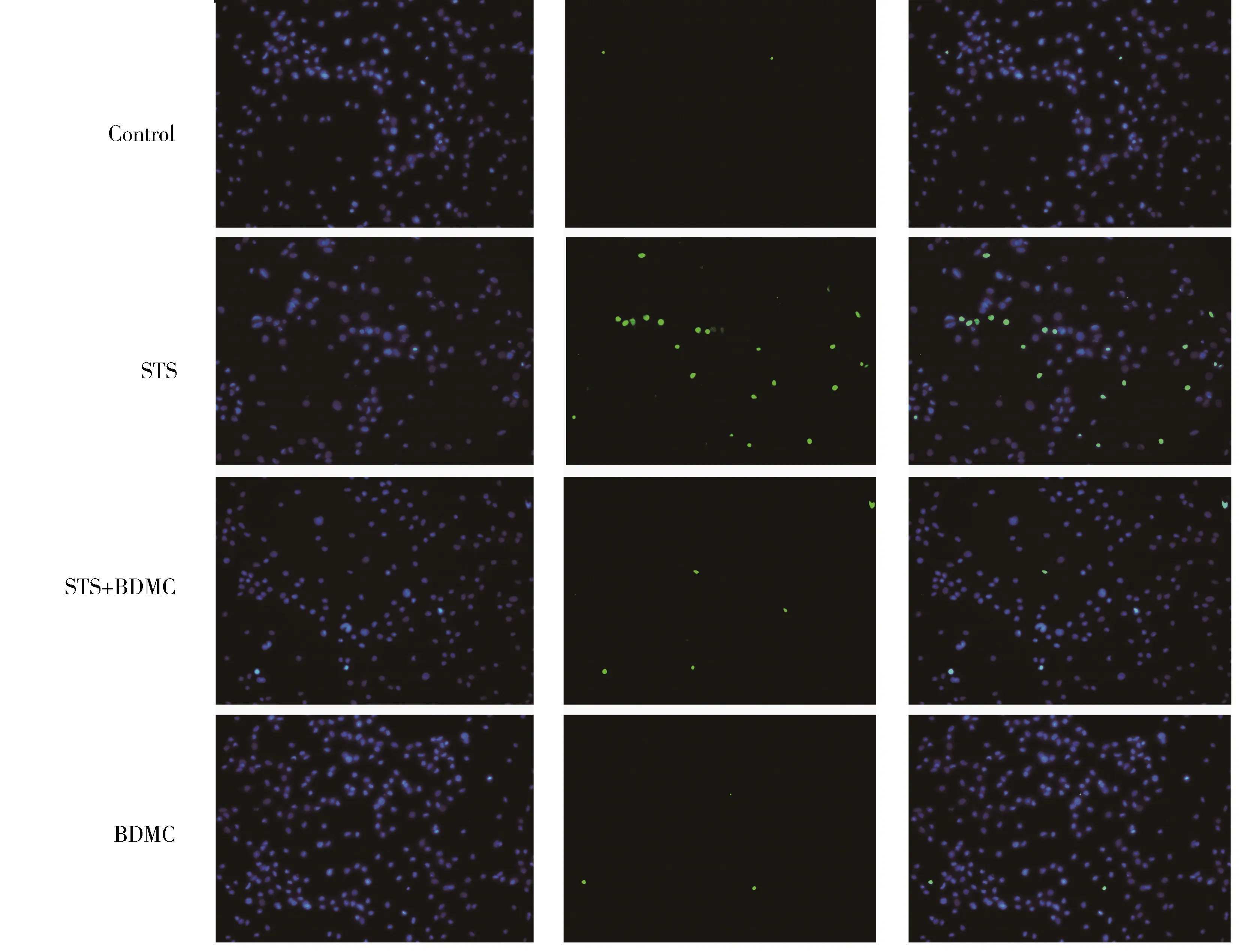
图2 BDMC预处理对STS诱导的心肌细胞凋亡的影响Figure 2 Effect of BDMC pretreatment on the myocardial apoptosis induced by STS (TUNEL staining ×200)
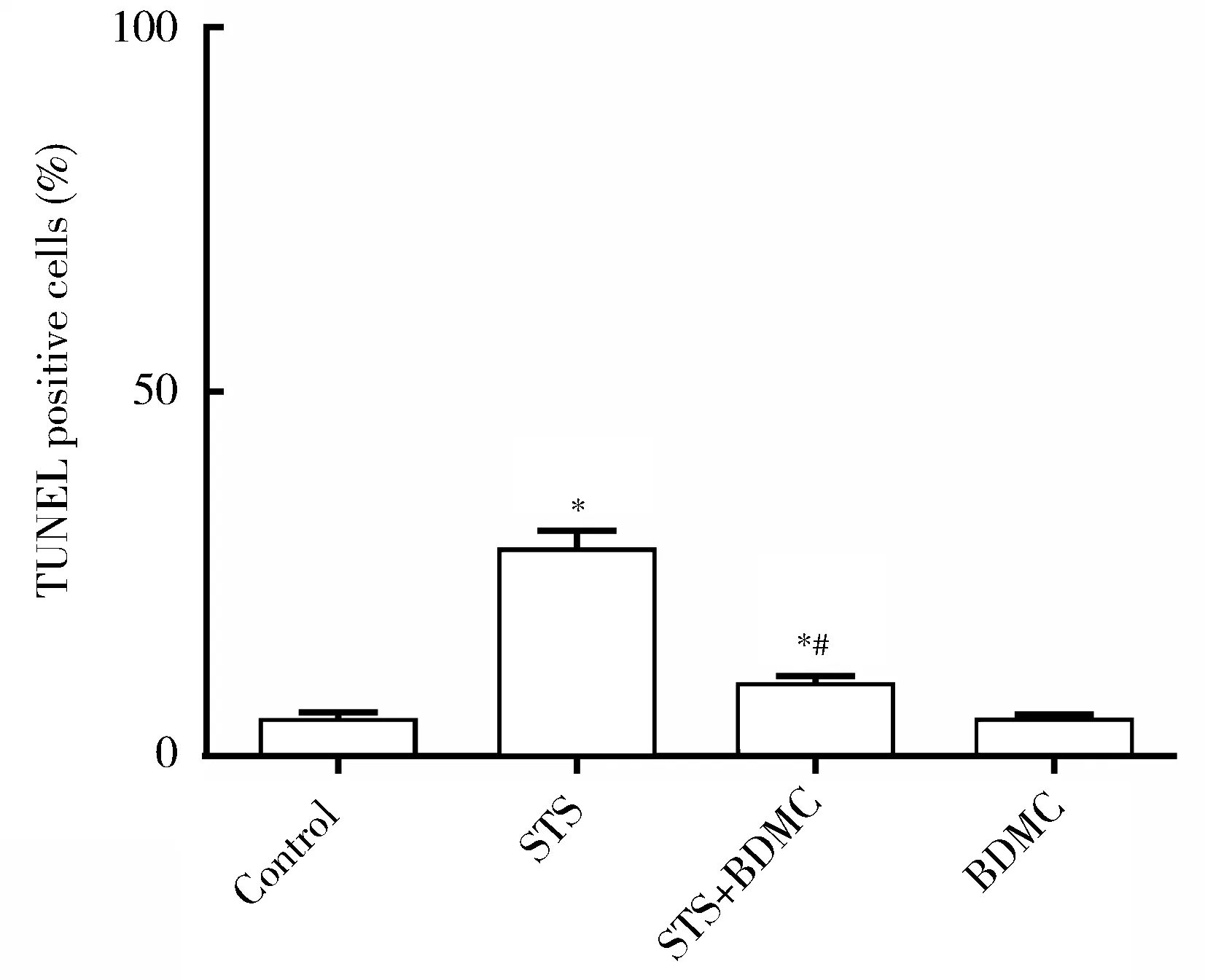
图3 TUNEL阳性凋亡心肌细胞数量比较Figure 3 Comparison of TUNEL positive myocardial
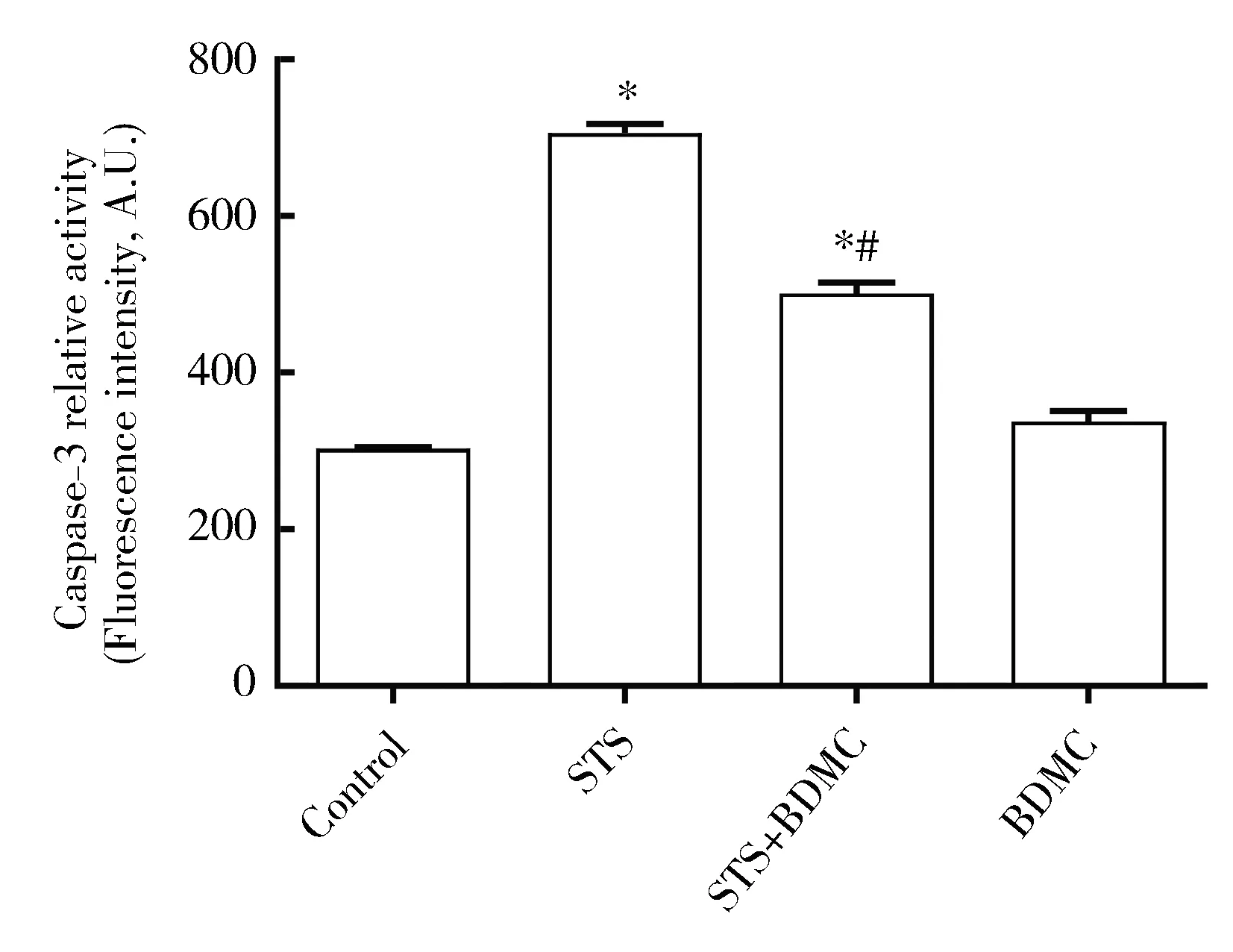
图4 Caspase-3酶活性比较Figure 4 Comparison of caspase-3 activity
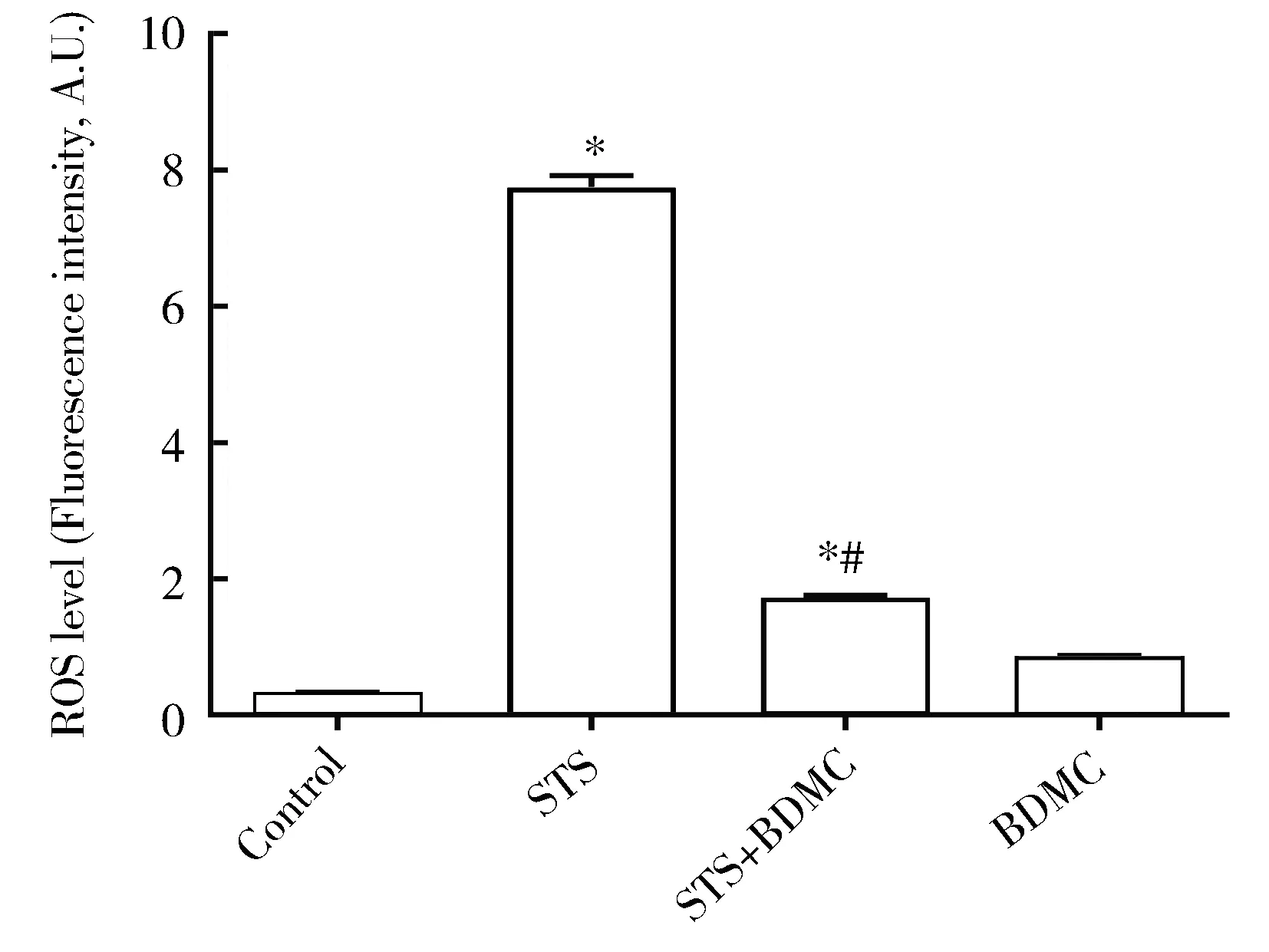
图5 心肌细胞内ROS水平比较Figure 5 Comparison of ROS level in the cardiomyocytes
STS是已知经典的线粒体途径凋亡诱导剂。本研究应用课题组前期已构建的、成熟的 STS诱导心肌细胞凋亡模型[15],给予100 μmol/L BDMC预处理后发现BDMC能够显著提高STS刺激后的细胞生存率。TUNEL染色及caspase-3活性检测结果均显示,BDMC可以抑制STS诱导的心肌凋亡性死亡的发生;为探讨可能的机制,我们检测了对细胞损伤最重要的损伤因子,细胞内氧化应激ROS的水平,结果显示STS刺激心肌细胞后,胞内ROS水平增加,而给予BDMC预处理后心肌细胞内ROS水平的增加受到明显抑制。该结果与其他研究报道结果相一致,即无论是姜黄素还是BDMC都具有很好的抗氧化作用,能减轻细胞内的氧化应激水平[16,17]。综上所述,我们首次观察到BDMC预处理心肌细胞能够显著减少STS诱导的细胞内ROS水平,明显抑制凋亡瀑布信号执行者caspase-3酶的活性,抑制心肌细胞凋亡的发生,从而达到保护受损心肌细胞的作用,该研究结果为临床新药开发提供了新的实验依据。
【参考文献】
[1] Zhao ZQ, Nakamura M, Wang NP,etal. Reperfusion induces myocardial apoptotic cell death[J].C1ardiovasc Res, 2000, 45(3): 651-660.
[2] Zhao J, Yin M, Deng H,etal. Cardiac Gab1 deletion leads to dilated cardiomyopathy associated with mitochondrial damage and cardiomyocyte apoptosis[J]. Cell Death Differ, 2016, 23(4): 695-706. DOI: 10.1038/cdd.2015.143.
[3] Sun X, Chen RC, Yang ZH,etal. Taxifolin prevents diabetic cardiomyopathyinvivoandinvitroby inhibition of oxidative stress and cell apoptosis[J]. Food Chem Toxicol, 2014, 63: 221-232. DOI: 10.1016/j.fct.2013.11.013.
[4] Hikoso S, Ikeda Y, Yamaguchi O,etal. Progression of heart failure was suppressed by inhibition of apoptosis signal-regulating kinase 1viatranscoronary gene transfer[J]. J Am Coll Cardiol, 2007, 50(5): 453-462.
[5] 杨 艺, 张存泰, 李彩萍, 等. 缺血后适应对老龄大鼠心肌缺血再灌注损伤的保护作用[J]. 中华老年多器官疾病杂志, 2014, 13(8): 611-615. DOI: 10.3724/SP.J.1264.2014.000141.
Yang Y, Zhang CT, Li CP,etal. Ischemic post-conditioning protects aged rat hearts against ischemia/reperfusion injury[J]. Chin J Mult Organ Dis Elderly, 2014, 13(8): 611-615. DOI: 10.3724/SP.J.1264.2014.000141.
[6] González-Salazar A, Molina-Jijón E, Correa F,etal. Curcumin protects from cardiac reperfusion damage by attenuation of oxidant stress and mitochondrial dysfunction[J]. Cardiovasc Toxicol, 2011, 11(4): 357-364. DOI: 10.1007/s12012-011-9128-9.
[7] Katanasaka Y, Sunagawa Y, Hasegawa K,etal. Application of curcumin to heart failure therapy by targeting transcriptional pathway in cardiomyocytes[J]. Biol Pharm Bull, 2013, 36(1): 13-17.
[8] Duan W, Yang Y, Yan J,etal. The effects of curcumin post-treatment against myocardial ischemia and reperfusion by activation of the JAK2/STAT3 signaling pathway[J]. Basic Res Cardiol, 2012, 107(3): 263. DOI: 10.1007/s00395-012-0263-7.
[9] Xiao J, Sheng X, Zhang X,etal. Curcumin protects against myocardial infarction-induced cardiac fibrosisviaSIRT1 activationinvivoandinvitro[J]. Drug Des Devel Ther, 2016, 10: 1267-1277. DOI: 10.2147/DDDT.S104925.
[10] Yu W, Wu J, Cai F,etal. Curcumin alleviates diabetic cardiomyopathy in experimental diabetic rats[J]. PLoS One, 2012, 7(12): e52013. DOI: 10.1371/journal.pone.0052013.
[11] Basile V, Ferrari E, Lazzari S,etal. Curcumin derivatives: molecular basis of their anti-cancer activity[J]. Biochem Pharmacol, 2009, 78(10): 1305-1315. DOI: 10.1016/j.bcp.2009.06.105.
[12] Hua Y, Dolence J, Ramanan S,etal. Bisdemethoxycurcumin inhibits PDGF-induced vascular smooth muscle cell motility and proliferation[J]. Mol Nutr Food Res, 2013, 57(9): 1611-1618. DOI: 10.1002/mnfr.201200852.
[13] Lai CS, Chen YY, Lee PS,etal. Bisdemethoxycurcumin inhibits adipogenesis in 3T3-L1 preadipocytes and suppresses obesity in high-fat diet-fed C57BL/6 mice[J]. J Agric Food Chem, 2016, 64(4): 821-830. DOI: 10.1021/acs.jafc.5b05577.
[14] Li YB, Zhong ZF, Chen MW,etal. Bisdemethoxycurcumin increases sirt1 to antagonize t-BHP-induced premature senescence in WI38 fibroblast cells[J]. Evid Based Complement Alternat Med, 2013, 2013: 851714. DOI: 10.1155/2013/851714.
[15] Liu AH, Cao YN, Liu HT,etal. DIDS attenuates staurosporine-induced cardiomyocyte apoptosis by PI3K/Akt signaling pathway: activation of eNOS/NO and inhibition of Bax translocation[J]. Cell Physiol Biochem, 2008, 22(1-4): 177-186. DOI: 10.1159/000149795.
[16] Huang SL, Chen PY, Wu MJ,etal. Curcuminoids modulate the PKCdelta/NADPH oxidase/reactive oxygen species signaling pathway and suppress matrix invasion during monocyte-macrophage differentiation[J]. J Agri Food Chem, 2015, 63(40): 8838-8848. DOI: 10.1021/acs.jafc.5b04083.
[17] Ahmad N, Umar S, Ashafaq M,etal. A comparative study of PNIPAM nanoparticles of curcumin, demethoxycurcumin, and bisdemethoxycurcumin and their effects on oxidative stress markers in experimental stroke[J]. Protoplasma, 2013, 250(6): 1327-1338. DOI: 10.1007/s00709-013-0516-9.

