齐墩果酸在人及其他种属肝微粒体CYP450中代谢的差异研究
邱 敏,周 林,徐亚沙,鲁艳柳,陆远富
(遵义医学院 基础药理教育部重点实验室,贵州 遵义 563099)
基础医学研究
齐墩果酸在人及其他种属肝微粒体CYP450中代谢的差异研究
邱 敏,周 林,徐亚沙,鲁艳柳,陆远富
(遵义医学院 基础药理教育部重点实验室,贵州 遵义 563099)
目的 比较齐墩果酸在人和其他种属肝微粒体CYP450酶中的代谢差异。方法 采用基于多重质量亏损(Multiple mass defect filter, MMDF)的四极杆-静电场轨道阱高分辨质谱色谱联用仪,分析齐墩果酸经人及昆明小鼠、C57小鼠、SD大鼠、猪、牛、羊、兔肝微粒体体外代谢的产物及种属差异。利用与CYP450各亚型酶的特异性抑制剂共孵育,对比不同种属参与齐墩果酸特征性代谢产物M-469的主要代谢亚型酶。结果 齐墩果酸不同种属的肝微粒体体外代谢存在明显差异。齐墩果酸特征性代谢产物M-469,在昆明小鼠的肝微粒体中生成最多,其次是C57小鼠、SD大鼠、人、猪、兔,而牛、羊体外不生成此产物。在人肝微粒体CYP450酶中,CYP3A4是齐墩果酸特征性代谢产物M-469的主要代谢酶。昆明小鼠CYP450酶中,CYP3A、CYP2E1参与了此代谢产物的生成。结论 齐墩果酸在人和不同种属肝微粒体CYP450代谢中存在差异,因此,本实验将为齐墩果酸进一步代谢研究及安全性评价提供重要参考价值。
四极杆-静电场轨道阱高分辨质谱色谱联用仪;齐墩果酸;细胞色素P450酶;种属差异
齐墩果酸(Oleanolic acid,OA),化学式C30H48O3,是一种五环三萜类化合物,以游离体或配糖体的形式广泛存在于豆科、木犀科、龙胆科、伞形科、五加科、葫芦科等食物和药用植物中[1-2],许多临床常用中药如:人参[3]、三七[4]、青叶胆、山楂、连翘、女贞子、青梅、木瓜等[5]都含有齐墩果酸。已有大量文献报道,齐墩果酸具有良好的药理作用,如保肝、降糖、降血脂、抗肿瘤、抗炎、调节免疫和抗氧化作用[6-10],临床上用于急、慢性肝炎的辅助治疗,需要长期用药,以口服制剂为主,但其口服生物利用度较低[11]。
近年来,药物代谢分析经过快速的发展已成为药物代谢动力学研究中的一个重要部分,而不断完善的高分辨液质联用技术被广泛应用于药物代谢分析研究中[12],如次乌头碱在大鼠肝微粒体的体外代谢[13],荷叶碱在不同种属肝微粒体的代谢差异[14]。大部分药物进入体内后会被代谢,然后以代谢产物的形式排出体外,不经代谢以原药形式排出体外的很少[15]。因此,对代谢产物研究就越来越受到人们关注。然而关于齐墩果酸的国内外研究主要集中在提取分离、药效学等相关领域,而在其药物代谢产物方面的研究较少,且不深入[16]。齐墩果酸在不同种属肝微粒体代谢及其代谢产物的研究鲜见报道。
本文拟采用UPLC-MS/MS的方法,观察齐墩果酸在人、SD大鼠、昆明小鼠、C57小鼠、猪、兔、牛、羊肝微粒体中的体外代谢过程,对其在人及其他种属肝微粒体中的体外代谢进行种属差异研究,利用各亚型酶的特异性抑制剂,比较不同种属CYP450酶的代谢亚型,为齐墩果酸的药物代谢研究以及药物安全性评价提供参考意义。
1 材料与方法
1.1 仪器与试剂 Q-Exactive高性能台式四级杆-轨道阱UPLC-MS/MS(HESI离子源)系统(美国Thermo公司);Genius 1022液氮发生器(英国PEAK公司);Excellence Plus天平(美国梅特勒-托利多公司);YQ-720医用超声波清洗机(上海易净超声波仪器有限公司);ZWY-110X50恒温水浴箱(上海智城分析仪器制造有限公司);XW-80A 漩涡混合仪(海门市其林贝尔仪器制造有限公司); MILLI-Q超纯水纯化系统(美国Millipore公司);Optima Max-XP超速离心机(美国贝克曼库尔特有限公司);LG-22立式高速冷冻离心机(四川蜀科仪器有限公司)。
齐墩果酸、大豆苷元(批号:110709-201206、111502-200402,重庆对照品科技有限公司);磺胺苯吡唑、奎尼丁、氯美噻唑盐酸盐、酮康唑(批号:DRE-C17000080、ASB-00017180、ZTO-C3020、ASB-00011350,上海甄准生物科技有限公司);D-葡萄糖-6-磷酸二钠盐水化合物、葡萄糖-6-磷酸脱氢酶、β-烟酰胺嘌呤二核苷酸磷酸钠盐(批号:0003671996、0009001405、0001184163);乙腈、甲醇、甲酸均为质谱级,购自Sigma-Aldrich化学制品有限公司;其它试剂均为分析纯,购自国药集团化学试剂公司;人肝微粒体(批号:SUBK,瑞德肝脏疾病研究上海有限公司)。
1.2 实验动物 雄性健康SPF级SD大鼠、昆明小鼠、C57小鼠各6只,由重庆第三军医大实验动物中心提供,生产合格证号:SCXK(渝)2012-0005。健康的雄性猪、牛、羊、新西兰白兔肝脏样品各6份,由遵义医学院动物实验中心提供。
1.3 肝微粒体的制备 实验动物断头处死后立即取肝脏,用含0.15 mol/L KCl的100 mmol/L磷酸钾缓冲液清洗,称重,按1 g∶4 mL的比例加入磷酸钾缓冲液(pH=7.4),匀浆,所有操作均在冰上进行。采取差速离心法[17],制备好分装后于-80 °C冰箱中保存备用,用BCA法测定肝微粒体蛋白浓度。按照“1.4”操作方法,定量测定孵育体系中4个CYP450亚型酶CYP2C9、CYP2D6、CYP2E1、CYP3A探针底物的代谢产物生成量,计算肝微粒代谢酶的活性,测得其活性与文献[18]报道相一致。
1.4 孵育条件和样品处理 体外孵育系统总体积100 μL,含齐墩果酸(50 μmol/L)、肝微粒体(0.5 mg/mL)、磷酸钾缓冲液(K2HPO4-KH2PO4,100 mmol/L,pH 7.4)、D-葡萄糖-6-磷酸二钠盐水化合物(10 mmol/L)、葡萄糖-6-磷酸脱氢酶(1 unit/mL)、氯化镁(4 mmol/L)、β-烟酰胺嘌呤二核苷酸磷酸钠盐(1 mmol/L)。体系在37 ℃恒温水浴摇床上孵育45 min后,加入100 μL乙腈终止反应并沉淀蛋白。14 000 rpm,4oC离心10 min,取上清进样分析。体外孵育系统,空白对照组不加齐墩果酸,阴性对照组不加β-烟酰胺嘌呤二核苷酸磷酸钠盐,均以等体积缓冲液代替,其余组成和样品组一致。体系孵育条件、样品处理方法均和样品组相同。
采用特异性抑制剂共孵育,包括磺胺苯吡唑(10 μmol/L)、奎尼丁(10 μmol/L)、氯美噻唑盐酸盐(50 μmol/L)、酮康唑(1 μmol/L),分别抑制CYP2C9、CYP2D6、CYP2E1和CYP3A等主要CYP450代谢酶活性。
1.5 UPLC-MS/MS分析条件 色谱条件:Hypersil Gold C18(150×2.1 mm,1.9 μm) 色谱柱,流动相为0.1%的甲酸水(A)和乙腈(B),洗脱条件:0~0.5 min,5% B;0.5~15 min,5%~95% B;15~18 min,95% B,18~20 min,5% B。流速为0.3 mL/min,柱温45 °C,进样体积5 μL。
质谱条件:HESI 离子化方式,负离子Full-ddMS2扫描模式,m/z检测范围100~1 500,毛细管温度350 °C,雾化温度300 °C,鞘气和辅助气流速分别为35、15 arb。分辨率采用MS Full Scan 70000 FWHM,MS/MS Full Scan 15000 FWHM。
2 结果
2.1 齐墩果酸质谱信息分析 阴性对照组样品采用1.5项下方法进行分析,结果(见图 1)。齐墩果酸保留时间为17.23 min,在负离子扫描模式下,具有明显的分子离子峰[M-H]-m/z 455.351 9。
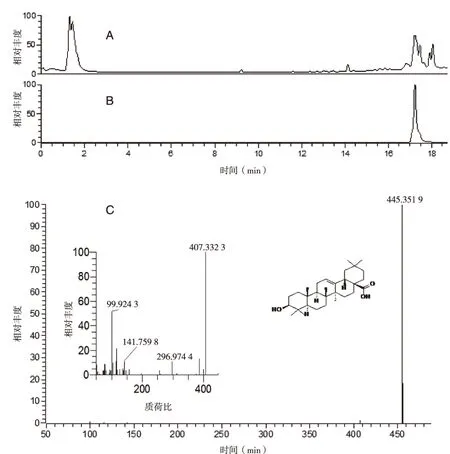
A:总离子流图;B:齐墩果酸选择离子图;C:齐墩果酸质谱图。图1 阴性对照样品总离子流色谱图和质谱图
2.2 齐墩果酸人肝微粒体代谢产物分析 借助Meta软件,采用MMDF方法,对人肝微粒体孵育反应后的样品与空白对照组、阴性对照组进行比较,分析代谢产物。由结果可知,齐墩果酸可以经人肝微粒体CYP450酶代谢,在保留时间12~17 min处色谱峰发生明显变化(见图2)。
采用精确分子量,对齐墩果酸代谢产物进行信号提取和分析,代谢产物M-469的母离子峰[M-H]-m/z为469.331 2,在16.72 min发现对应色谱峰(见图3)。
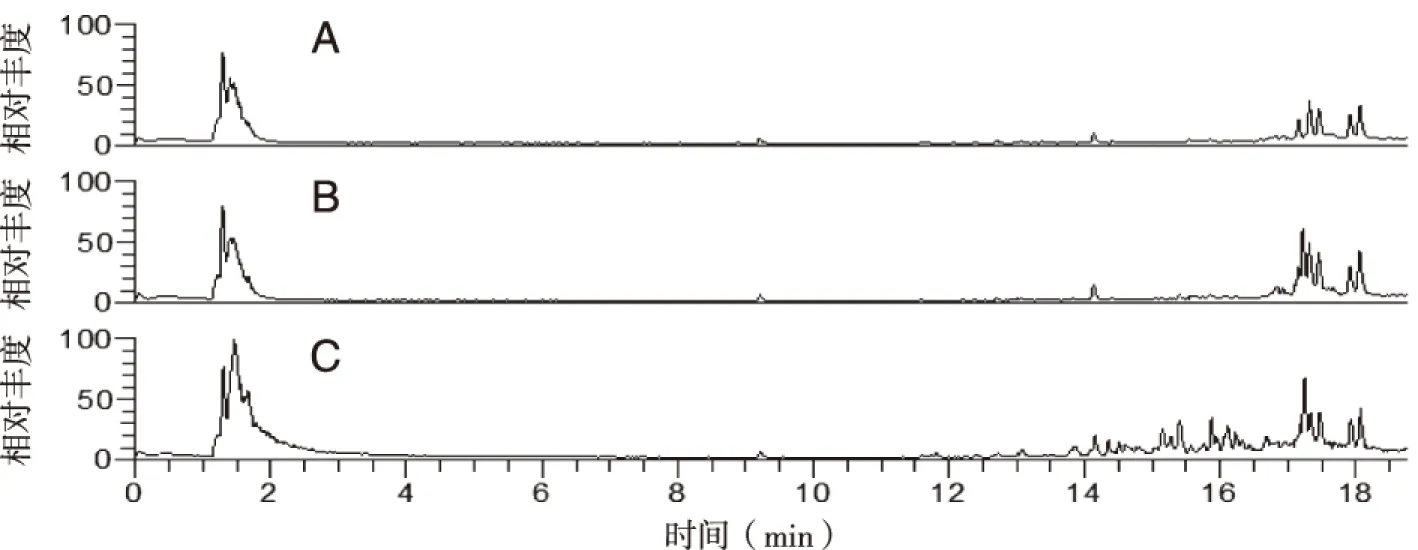
A:空白对照组;B:阴性对照组;C:齐墩果酸样品组。图2 齐墩果酸经人肝微粒体CYP450酶代谢产物总离子流图
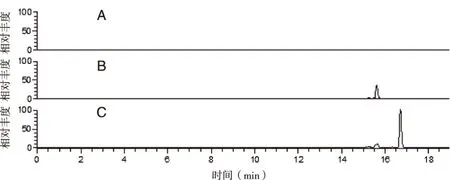
A:空白对照组;B:阴性对照组;C:齐墩果酸样品组。图3 齐墩果酸人肝微粒体代谢产物M-469选择离子图
2.3 比较齐墩果酸体外代谢产物的种属差异 比较人与SD大鼠、昆明小鼠、C57小鼠、猪、兔、牛、羊体外代谢齐墩果酸的种属差异。采用精确分子量,代谢产物M-469选择离子图显示,SD大鼠、昆明小鼠、C57小鼠、猪、兔肝微粒体代谢与人肝微粒体,均能生成该代谢产物,在16.72 min出现m/z 469.331 2的色谱峰;而牛、羊肝微粒体中在16.72 min无色谱峰(见图4)。比较相对峰面积得知,代谢产物M-469在昆明小鼠肝微粒体的生成量最高(见图5)。
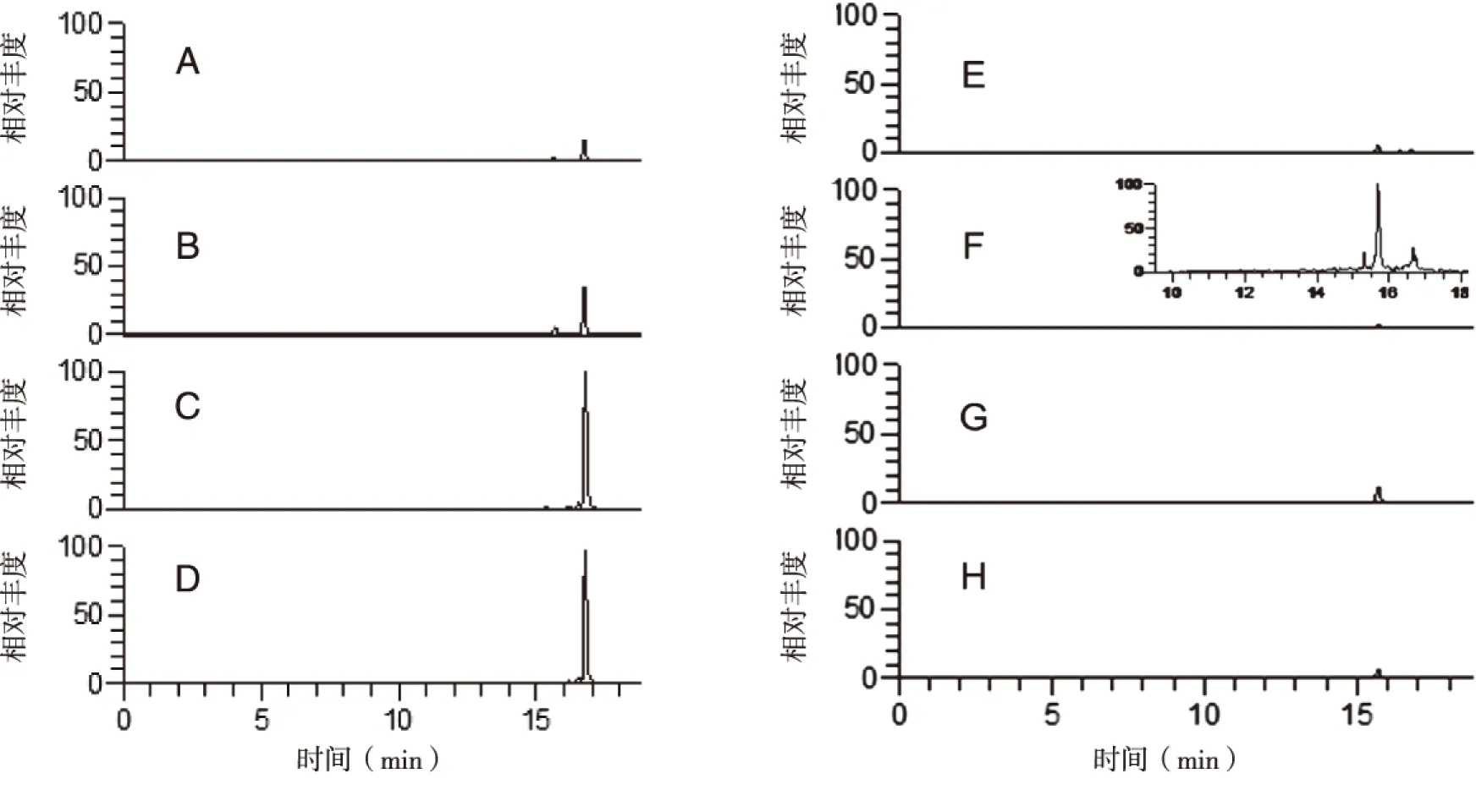
A:人;B:SD大鼠;C:昆明小鼠;D:C57小鼠;E:猪;F:兔;G:牛;H:羊。图4 齐墩果酸不同种属肝微粒体代谢产物M-469提取图

#:与人肝微粒体比较,P<0.05。 图5 齐墩果酸不同种属肝微粒体生成代谢产物M-469的比较±s,n=6)
2.4 不同种属参与齐墩果酸代谢产物M-469的CYP450亚型酶比较 在人肝微粒体中,分别加入CYP450酶特异性抑制剂共孵育。结果显示,CYP3A特异性抑制剂酮康唑能显著抑制M-469生成(见图6A)。提示在人肝微粒体中,CYP3A4参与了齐墩果酸代谢物M-469生成。
在昆明小鼠的肝微粒体中,分别加入CYP450酶特异性抑制剂共孵育。结果显示,CYP2E1特异性抑制剂氯美噻唑盐酸盐、CYP3A特异性抑制剂酮康唑均能显著抑制M-469的生成(见图6B),提示在昆明小鼠的肝微粒体中,CYP2E1、CYP3A参与了齐墩果酸代谢物M-469代谢物的生成。

#:与齐墩果酸组比较,P<0.05。图6 人(A)和昆明小鼠(B)参与齐墩果酸代谢产物M-469的CYP450亚型酶比较
3 讨论
近年推出的四极杆-静电场轨道阱高分辨质谱,通过测定各离子的震荡频率,运用傅里叶变换计算质核比(m/z),其分辨率可达100 000。采用精确质量数提取获得相应化合物的质谱响应,将充分保证方法的高选择性。齐墩果酸代谢产物M-469分子离子峰[M-H]-m/z 469.331 2,与原型分子离子峰[M-H]-m/z 455.351 9比较,分子量发生13.979 3的变化,该代谢产物可能是在CYP450酶作用下加双羟基后脱水生成,有文献报道该种代谢模式下可能产生环氧化合物[19]。由于质谱碎片信息量较少,需要进一步实验以推测其结构。
本实验采用四极杆-静电场轨道阱高分辨质谱色谱联用仪,基于多重质量亏损(MMDF)方法,比较相同蛋白浓度、不同种属肝微粒体与齐墩果酸共同孵育的结果,研究齐墩果酸种属间的代谢差异。进一步利用CYP450各亚型酶的特异性抑制剂与其共孵育,判断不同种属齐墩果酸代谢产物M-469的主要代谢亚型酶。结果显示,昆明小鼠生成齐墩果酸代谢产物M-469的活性最强;CYP3A参与了齐墩果酸在人和小鼠肝微粒体中M-469化合物形成,CYP2E1[20]只参与了齐墩果酸在小鼠肝微粒体中M-469代谢物的形成。
CYP450 酶在不同种属肝脏中的组成和相对含量存在差异[21],由于不同的 CYP450酶介导不同的代谢反应,因而CYP450酶介导的代谢反应和生成的代谢产物种类或量也存在着种属差异[22]。齐墩果酸在不同种属肝微粒体中的代谢差异性,很可能与不同种属肝脏中与齐墩果酸代谢相关的CYP450 酶有关,在本实验中也反应出此问题。参与人体药物代谢的CYP450酶主要为CYP1-3家族,临床约90%以上药物经过这些酶代谢。CYP2E1广泛分布于肝、肾、肺等各器官,肝脏为最主要的表达器官,其在毒理学研究有重要的意义[23]。CYP3A4是CYP450中最重要的组成成分,在大鼠肝脏中对应的亚型为CYP3A1/2,而在小鼠肝脏中CYP3A11与其对应,在临床半数以上的药物都要经它转化,许多药物也是它的诱导剂和抑制剂[24]。
齐墩果酸在SD大鼠、昆明小鼠、C57小鼠肝微粒体中的代谢与人肝微粒体中代谢相似,进一步对齐墩果酸在人和小鼠代谢产物M-469主要代谢酶研究,发现尽管代谢产物相似,参与的代谢酶也不尽相同。齐墩果酸曾经被用于保肝,最近已有报道齐墩果酸具有一定的肝毒性。但是其毒性和活性是其自身的直接效应还是其代谢产物的效应尚不清楚。因此,代谢途径及模式的不同对毒性及活性的影响仍可能存在。在这种情况下,选择代谢产物、代谢活性、代谢模式相近的动物进行其临床前研究及后期临床试验就显得尤其重要。
[1] 唐瑶, 陈洋, 曹婉鑫. 三萜皂苷结构及应用的研究进展[J]. 安徽化工, 2015, 41(2): 13-16.
[2] Hao J, Liu J, Wen X A, et al. Synthesis and cytotoxicity evaluation of oleanolic acid derivatives[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(7): 2074-2077.
[3] 王佳, 郑培和, 许世泉. 人参、西洋参不同部位中齐墩果酸型皂苷含量的对比分析[J].特产研究, 2015, 37(2): 23-29.
[4] 孙晓东, 李军, 韩立敏. 薄层扫描法测定三七中皂甙元齐墩果酸的含量[J]. 陕西中医, 2009, 30(3): 346-347.
[5] 査孝柱, 谢晓梅, 吕美红, 等. 含齐墩果酸和熊果酸10种果实类中药HPLC分析[J]. 中国实验方剂学杂志, 2010, 16(18): 60-62.
[6] Cheng K G, Su C H, Huang J Y, et al. Synthesis of oleanolic acid dimers linked at C-28 and evaluation of anti-tumor activity[J]. European Journal of Medicinal Chemistry, 2015, 89(1): 480-489.
[7] Liao H H, Zhang N, Ma Z G, et al. Oleanolic acid alleviated pressure overload-induced cardiac remodeling [J]. Molecular and Cellular Biochemistry, 2015, 409(1): 145-154.
[8] Nelson A T, Siegel D, Claussen K R, et al. Synthesis of oxygenated oleanolic and ursolic acid derivatives with anti-inflammatory properties [J]. Bioorganic & Medicinal Chemistry Letters, 2015, 25(19): 4342-4346.
[9] Jiménez-Arellanes A, Luna-Herrera J, Cornejo-Garrido J, et al. Ursolic and oleanolic acids as antimicrobial and immunomodulatory[J]. BMC Complementary Alternative Medicine, 2013, 13(1): 258.
[10] Somova L O, Nadar A, Rammanan P, et al. Cardiovascular antihyperlipidemic and antioxidant effects of oleanolic and ursolic acids in experimental hypertension [J]. Phytomedicine, 2003, 10(2-3): 115-121.
[11] Henry H Y T, Du Z , Wang G N, et al. Spray freeze drying with polyvinylpyrrolidone and sodium caprate for improved dissolution and oral bioavailability of oleanolic acid, a BCS Class IV compound[J]. International Journal of Pharmaceutics, 2011, 404(1-2): 148-158.
[12] 梁静,徐风,尚明英,等.赤芍化学成分没食子酸丙酯在大鼠体内的代谢研究[J].中国中药杂志,2013,38(22):3970-3976.
[13] 毕云枫, 李雪, 皮子凤, 等. UPLC-MS/MS方法研究次乌头碱在大鼠肝微粒体CYP450的体外代谢产物及代谢酶亚型[J]. 质谱学报, 2013, 34(6): 330-337.
[14] Lu Y L, He Y Q, Wang M, et al. Characterization of nuciferine metabolism by P450 enzymes and uridine diphosphate glucuronosyltransferases in liver microsomes from humans and animals[J]. Acta Pharmacologica Sinica, 2010, 31(12): 1635-1642.
[15] 王琳, 陈涵. 药物体外吸收、分布、代谢和排泄筛选模型[J].中国组织工程研究与临床康复, 2008, 50(12): 9957-9960.
[16] 王亚平, 胡园, 董瑞华, 等. 齐墩果酸和熊果酸的人肝微粒体代谢研究[J]. 军事医学, 2012, 36(5): 368-372.
[17] 刘荣飞, 刘 幸, 刘晓宇, 等. 高效液相色谱和液相色谱-电喷雾质谱联用法鉴定辛硫磷在鲫鱼肝微粒体中代谢产物及途径[J]. 分析化学研究报告, 2013, 41(6): 839-896.
[18] 沈国林,钟玉环,原梅,等. 超高效液相串联质谱法同时定量检测6个细胞色素 P450 酶探针代谢产物[J]. 分析化学研究报告, 2013, 41(4): 488-493.
[19] 周丽屏, 陈纠, 郭嘉明, 等. 中毒患者生物检材中卡马西平及其代谢物的气相色谱质谱分析[J]. 中国药理学与毒理学杂志, 2016, 30(9): 961-966.
[20] 苏延旭, 郑华, 宋慧, 等. 探针药物法评价柚皮苷对人肝微粒体CYP2E1 酶代谢活性的影响[J]. 广西医科大学学报, 2014, 31(5): 727-732.
[21] 程婕, 杨凌. 细胞色素P450氧化还原酶的研究进展[J]. 中国药理学通报, 2006, 22(2): 129-133.
[22] Zhuang X M , Lin Q H , Li C Z ,et al. In vitro comparion of rotundine metabolism in liver microsomes of human, dog and rat[J]. Chin Pharmacol Bull, 2009, 25(9): 1147-1149.
[23] 王静. Columbin对实验性2型糖尿病大鼠肝脏药物代谢酶CYP450的影响[D]. 华中科技大学, 2011: 1-67.
[24] Nelson D R, Zeldin D C, Hoffman S M,et al. Comparison of cytochrome P450 (CYP) genes from the mouse and human genomes,including nomenclature recommendations for genes, pseudogenes and alternative-splicevariants[J]. Pharmacogenetics, 2004, 14(1): 1-18.
[收稿2016-12-28;修回2017-01-18]
(编辑:王静)
Study on the differences in oleanolic acid metabolism in liver microsomes of human and other species
QiuMing,ZhouLin,XuYasha,LuYanliu,LuYuanfu
(Key Laboratory for Basic Pharmacology of Ministry of Education, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To compare the metabolism of oleanolic acid in liver microsomes of human and other species.Methods An ultra-high performance liquid chromatography/mass spectrometry (UPLC/MS) method was applied to systemically study the oleanolic acid metabolism in liver microsomes of human, rat, mouse, pig, rabbit, cattle, and sheep, and comprehensively evaluate oleanolic acid metabolitesinvitroand metabolism differences between species. The research also tested the metabolites after incubation with selective inhibitors of 4 main P450s including CYP2C9, CYP2D6, CYP2E1, and CYP3A4 in liver microsomes.Results The results showed that the most metabolite M-469 was generated in Kunming mouse liver microsomes, followed by C57 mouse, SD rat, human, pig, and rabbit. However, in the cattle and sheep liver microsome incubation system, the metabolite M-469 was not found. For human, CYP3A4 was identified as the main enzyme responsible for the metabolite M-469 of oleanolic acid. For Kunming mouse, CYP3A and CYP2E1 were involved in the production of this metabolite.Conclusion There was significant species difference in oleanolic acid metabolisminvitrobetween human and other species, providing important reference value for the further metabolism study and safety evaluation of oleanolic acid.
UPLC-MS/MS; oleanolic acid; cytochrome P450s; species differences
国家自然科学基金资助项目(NO:81460632)。
陆远富,男,博士,教授,研究方向:药物代谢与毒理学研究,E-mail:luyuanfu2000@163.com;鲁艳柳,女,博士,副教授,研究方向:药物代谢与毒理学研究,E-mail:yanliu.lu@foxmail.com。
R969.1
A
1000-2715(2017)01-0027-06

