兔高脂血症与炎性反应因子的关系
李伟 于泽谋 徐蕾 陈玉辉 王音 龚涛 黄一宁
兔高脂血症与炎性反应因子的关系
李伟 于泽谋 徐蕾 陈玉辉 王音 龚涛 黄一宁
目的 观察高脂血症与超敏C反应蛋白(hypersensitive C-reactive protein,hsCRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)的关系,探讨高脂血症引起动脉粥样硬化的发病机制。方法 将20只雄性清洁级新西兰大白兔随机分为正常饮食组和高脂饮食组(HFD),每组各10只。给予HFD组兔高脂饮食,给予正常饮食组正常喂养。于高脂喂养前以及高脂喂养后4、8、12周进行血脂、hsCRP、TNF-α及ECP水平测定。结果 HFD组兔高脂饮食4周、8周、12周血清总胆固醇(t=6.59,t=10.93,t=17.88,均P=0.000)、低密度脂蛋白(t=6.59,t=10.86,t=15.07,均P=0.000)水平较正常饮食组增高,形成高脂血症。与正常饮食组比较,4周、8周、12周时HFD组TNF-α(t=40.13,t=41.57,t=57.10,均P=0.000)及ECP(t=9.82,t=23.04,t=14.94,均P=0.000)水平升高。4周、12周时HFD组hsCRP水平较正常饮食组升高(t=5.62,P=0.025;t=2.40,P=0.029)。结论 高脂饮食可使兔血清炎性反应因子hsCRP、TNF-α及ECP表达上调,高脂血症可能通过促进炎性反应参与动脉粥样硬化的发生。
高脂血症;嗜酸性粒细胞阳离子蛋白;炎症因子;动脉粥样硬化
动脉粥样硬化(atherosclerosis,AS)性心脑血管疾病的发生和发展受很多因素的影响,炎性反应因子超敏C反应蛋白(high sensitivity C reactive protein,hsCRP)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)被认为参与了AS的慢性炎性反应过程。最近研究表明,血清嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)水平升高与AS性冠心病(简称冠心病)以及缺血性脑卒中的发生有关[1-2]。ECP是活化嗜酸性细胞释放的强碱性蛋白中的重要组分,是嗜酸性粒细胞(eosinophil,EOS)活化的重要标志[3]。高脂血症被认为可能是AS的始动因素,而AS病理表现为慢性炎性反应的特征,提示高脂血症可能与慢性炎性反应有关。本研究利用高脂血症动物模型初步探讨了高脂血症与hsCRP、TNF-α及ECP的关系。
1 材料和方法
1.1 实验动物 雄性清洁级新西兰大白兔20只,来自不同窝别,2.5月龄,体重2.5 kg左右。12 h昼夜(早晨7:00开灯),温度(20±2)℃,相对湿度40%±60%,单笼饲养(50 cm×40 cm×40 cm)。适应性饲养1周,采用随机数字表法分为正常饮食组(对照组)和高脂饮食(High fat diet,HFD)组,每组各10只。所有实验程序通过中国医学科学院医学实验动物研究所动物伦理委员会批准。
1.2 方法
1.2.1 喂养方案:于观察期间,给予对照组大白兔标准饲料饲养(0%胆固醇),给予HFD组大白兔高脂饲料(1%胆固醇+6%大豆油)饲养。饮水不限。
1.2.2 血样采集:分别于高脂喂养前(0周)以及喂养后4、8、12周末,禁食12 h后采集耳中动脉血2.5 mL,采血时间为早晨08:30~10:00,室温静置30 min,置4℃以2200 g离心15 min,分离血清并分装,保存于-80℃冰箱备用。
1.2.3 指标检测:使用北京医院检验科Beckman全自动生化分析仪对各时间点大白兔血清总胆固醇(total cholesterol,TC)、低密度脂蛋白(Low density lipoprotein,LDL)进行测定。采用增强速率透射比浊法测定血清hsCRP水平。采用兔TNF-α ELISA试剂盒(中国科诺迪生物科技公司)、兔ECP ELISA试剂盒(美国TSZ)分别测定兔血清TNF-α和ECP水平。
1.3 统计学处理 采用SPSS 24.0软件进行统计分析,对数据进行正态性及方差齐性检验,符合正态分布的计量资料以均数±标准差表示,两组间均数比较采用t检验,多组均数间比较采用单因素方差分析,两两比较采用SNK检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 血脂水平比较 对照组和HFD组兔于实验前血清TC和LDL水平比较无统计学差异(P>0.05),于高脂喂养后4、8、12周,HFD组兔血清TC和LDL水平均明显高于对照组(均P=0.000)。组内不同喂养时间点间比较,对照组和HFD组兔血清TC和LDL水平比较均有统计学意义(均P<0.05),对照组第12周TC、LDL水平高于实验前以及4、8周(均P<0.05),HFD组高脂喂养4、8、12周TC和LDL水平均高于实验前(均P<0.05)。结果见表1、2。
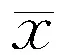
表1 两组白兔喂养不同时点血清TC水平比较 (n=10,±S,mmol/L)
注:TC:总胆固醇;HFD:高脂喂养,表2~5同;与组内其他时间点比较,aP<0.05;与对照组比较,bP<0.05
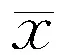
表2 两组白兔喂养不同时点血清LDL水平比较 (n=10,±S,mmol/L)
注:LDL:低密度脂蛋白;与组内其他时间点比较,aP<0.05;与对照组比较,bP<0.05
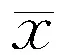
表3 两组白兔喂养不同时点血清hsCRP水平比较 (n=10,±S,mg/L)
注:hsCRP:超敏C反应蛋白;与组内实验前及8周分别比较,aP<0.05
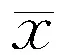
表4 两组白兔喂养不同时点血清TNF-α水平比较 (n=10,±S,ng/L)
注:TNF-α:肿瘤坏死因子α;与组内实验前比较,aP<0.05
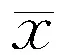
表5 两组白兔喂养不同时点血清ECP水平比较 (n=10,±S,ng/L )
注:ECP:嗜酸性粒细胞阳离子蛋白;与组内其他时间点比较,aP<0.05;与组内实验前比较,bP<0.05;与组内4、8周分别比较,cP<0.05
2.2 炎性反应指标
2.2.1 血清hsCRP水平:实验前对照组和HFD组血清hsCRP水平比较无统计学差异(P=0.432),喂养后4、12周HFD组其水平高于对照组(均P<0.05)。对照组喂养不同时点hsCRP水平比较差异无统计学意义(P=0.300),而HFD组不同喂养时间点间hsCRP水平比较差异有统计学意义(P=0.009),且喂养4、12周其hsCRP水平均低于实验前和喂养8周。结果见表3。
2.2.2 血清TNF-α水平:实验前对照组和HFD组血清TNF-α水平比较差异无统计学意义(P=0.468),其余各时点HFD组TNF-α水平均高于对照组(均P=0.000)。两组不同喂养时间点间比较差异均有统计学意义(P<0.05),两两比较,对照组喂养后4、8、12周TNF-α水平均低于实验前(均P=0.05),其余各时点间比较差异无统计学意义(P>0.05),而HFD组喂养4、8、12周TNF-α水平分别高于实验前(均P<0.05),其余各时点间差异无统计学意义(P>0.05)。结果见表4。
2.2.3 血清ECP水平:两组实验前ECP水平比较差异无统计学意义(P>0.05),其余各时点HFD组ECP水平均高于对照组(P=0.849)。组内不同时间点间ECP水平比较差异均有统计学意义(均P<0.05),两两比较,对照组12周ECP水平分别低于其他时间点(均P<0.05),其余各时点间比较差异无统计学意义(均P>0.05),而HFD组高脂喂养4、8、12周ECP水平均高于实验前(均P<0.05),且12周ECP水平低于4、8周(P<0.05)。
3 讨论
AS是一种慢性炎性反应性疾病,炎性细胞聚集、炎性反应因子释放在AS发生发展的各个环节起重要作用,而以LDL升高为特点的高脂血症被认为是这种慢性炎性反应始动和维持的基本要素。
本研究结果显示,高脂饮食后HFD组兔血清TC、LDL水平显著升高,表明高脂血症兔实验模型成功建立[4-5]。不同时间点血脂比较,HFD组第4周、第8周及第12周之间TC、LDL水平比较均无统计学差异,提示高脂喂养4周后即形成较稳定的以高TC、高LDL为特征的血脂异常,其水平不随高脂喂养时间的延长进一步增加。本实验中,对照组第12周TC及LDL较之前升高,可能与兔子生长老化有关,也可能是由于样本量偏小以及测量误差等因素引起。
hsCRP是AS疾病重要的独立危险因子和最有力的预测因子,不仅对未来心脑血管疾病风险有很好的预测作用,还与疾病严重程度和预后相关[6-7]。TNF-α是一种促炎细胞因子,由激活的单核/巨噬细胞产生,能通过促进黏附分子表达、影响脂质代谢、增加斑块不稳定性等途径促进AS疾病发生[8-10]。本研究结果显示,HFD组hsCRP和TNF-α水平均较对照组明显升高,而对照组实验前TNF-α水平高于第4、8、12周,考虑与本文样本量偏小以及测量误差有关。
在众多参与AS的炎性细胞中,EOS是其中一种。Sakai等[11]对冠心病患者血栓抽吸治疗的组织样本进行组织学分析发现,在白色血栓和红色血栓交界区观察到EOS浸润,且浸润程度与血栓大小、红色血栓占比呈正相关,认为EOS可能通过促进血栓生长在冠状动脉闭塞中起重要作用。组织学研究还发现,EOS趋化因子在AS斑块平滑肌细胞表面过度表达[12]。近年来,血EOS计数和EOS/白细胞比值被认为是冠状AS风险分层的新型生物标志物[13]。遗传学研究结果亦提示,EOS相关基因多态性与冠心病风险显著相关[14]。上述研究均提示,在AS发病过程中可能存在EOS激活。
ECP是一种新型与AS有关的炎性反应因子,由EOS分泌的强碱性蛋白,最先由Olsson等[15]于1972年从慢性粒细胞白血病患者的白细胞中分离,为富含精氨酸的单链锌蛋白,具有3种糖基化形式,相对分子量为18000~22000,具有细胞毒性和免疫调节作用,是EOS活化、转归及参与炎性反应的主要生物标志[16]。研究表明血清ECP水平与多种炎性反应性疾病的发生、发展及病情的严重程度有关,研究比较多疾病的有支气管哮喘、变应性鼻炎等。近年来研究发现血清ECP水平与AS相关性疾病有关。Niccoli等[17]研究发现冠心病患者血清ECP水平明显高于正常人群,认为ECP是冠状AS的新型生物标志物。Byazrova等[18]研究进一步证实了ECP水平还能反映冠心病的严重程度。高通量蛋白质组学分析技术的进步,为疾病标志物研究提供了新的手段,最近一项大样本队列研究对两个相对独立的队列平均随访10年,利用高通量蛋白质组学技术共检测了85种不同蛋白质,寻找可用于预测缺血性脑卒中发生的生物学标志物,结果提示血清ECP水平升高与缺血性脑卒中的发生有关[19]。
本研究结果显示,HFD组兔血清hsCRP水平、TNF-α水平均明显高于对照组,提示高脂血症可能作为始动因子,促进了炎性反应因子的表达;HFD组兔血清ECP水平亦明显高于对照组,提示ECP作为新型AS生物学标记物,其水平的升高可能与高脂血症有关,高脂血症可能通过ECP途径参与AS疾病的发生和发展。
综上所述,高脂血症可能通过多种炎性反应因子表达上调参与AS的发生与发展。各种炎性反应细胞通过相关的细胞因子、细胞间黏附分子等炎性反应因子相互关联、相互作用,从而构成复杂的网络,形成级联放大炎性反应,共同促进了AS的发展。新型AS生物学标记物ECP能预测疾病发生,并与疾病严重程度相关,提示进一步研究并评估其作为一种预后标志和潜在治疗靶标具有重要意义。
[1]Niccoli G, Calvieri C, Flego D, et al. Allergic inflammation is associated with coronary instability and a worse clinical outcome after acute myocardial infarction[J]. Circ Cardiovasc Interv, 2015, 8(8): e002554.
[2]Fyfe I. Stroke: Proteomics chip yields three new markers that predict ischaemic stroke[J]. Nat Rev Neurol, 2015, 11(12): 667-667.
[3]Topic RZ, Dodig S. Eosinophil cationic protein - current concepts and controversies[J]. Biochemia Medica, 2011, 21(2): 111-121.
[4]余艳辉, 瞿湘萍, 李智,等. 兔高脂蛋白血症模型建立及动脉粥样斑块形成的方法学[J]. 中国药理学通报, 1998, (5): 473-474.
[5]Fan J, Kitajima S, Watanabe T, et al. Rabbit models for the study of human atherosclerosis: from pathophysiological mechanisms to translational medicine[J]. Pharmacol Ther, 2015, 146: 104-119.
[6]Wilson AM, Ryan MC, Boyle AJ. The novel role of C-reactive protein in cardiovascular disease: risk marker or pathogen[J]. Int J Cardiol, 2006, 106(3): 291-297.
[7]Armstrong EJ, Morrow DA, Sabatine MS. Inflammatory biomarkers in acute coronary syndromes: part Ⅱ: acute-phase reactants and biomarkers of endothelial cell activation[J]. Circulation, 2006, 113(7): e152-155.
[8]Zhang Y, Yang X, Bian F, et al. TNF-alpha promotes early atherosclerosis by increasing transcytosis of LDL across endothelial cells: crosstalk between NF-kappaB and PPAR-gamma[J]. J Mol Cell Cardiol, 2014, 72: 85-94.
[9]McKellar GE, McCarey DW, Sattar N, et al. Role for TNF in atherosclerosis? Lessons from autoimmune disease[J]. Nat Rev Cardiol, 2009, 6(6): 410-417.
[10]Haddy N, Sass C, Droesch S, et al. IL-6, TNF-alpha and atherosclerosis risk indicators in a healthy family population: the STANISLAS cohort[J]. Atherosclerosis, 2003, 170(2): 277-283.
[11]Sakai T, Inoue S, Matsuyama T, et al. Eosinophils may be involved in thrombus growth in acute coronary syndrome histologic examination of aspiration samples[J]. Inter Heart J, 2009, 50(3): 267-277.
[12]Haley KJ, Lilly CM, Yang JH, et al. Overexpression of eotaxin and the CCR3 receptor in human atherosclerosis: using genomic technology to identify a potential novel pathway of vascular inflammation[J]. Circulation, 2000, 102(18): 2185-2189.
[13]Kounis NG, Soufras GD, Tsigkas G, et al. White blood cell counts, leukocyte ratios, and eosinophils as inflammatory markers in patients with coronary artery disease[J]. Clin Appl Thromb Hemost, 2015, 21(2): 139-143.
[14]Lian JF, Huang Y, Huang RS, et al. Meta-analyses of four eosinophil related gene variants in coronary heart disease[J]. J Thromb Thrombolysis, 2013, 36(4): 394-401.
[15]Venge P, Bystrom J, Carlson M, et al. Eosinophil cationic protein (ECP): molecular and biological properties and the use of ECP as a marker of eosinophil activation in disease[J]. Clin Exp Allergy, 1999, 29(9): 1172-1186.
[16]Boix E, Torrent M, Sanchez D, et al. The antipathogen activities of eosinophil cationic protein[J]. Curr Pharm Biotechnol, 2008, 9(3): 141-152.
[17]Niccoli G, Ferrante G, Cosentino N, et al. Eosinophil cationic protein: A new biomarker of coronary atherosclerosis[J]. Atherosclerosis, 2010, 211(2): 606-611.
[18]Byazrova F, Lopukhova V, Buza V, et al. The level of eosinophil cationic protein is correlate with severity of coronary aterosclerosis[J]. Atherosclerosis, 2016, 252: e65.
[19]Lind L, Siegbahn A, Lindahl B, et al. Discovery of new risk markers for ischemic stroke using a novel targeted proteomics chip[J]. Stroke, 2015, 46(12): 3340-3347.
(本文编辑:时秋宽)
Objective To investigate the relationship between hypersensitive C-reactive protein (hsCRP), tumor necrosis factor-α (TNF-α), eosinophil cationic protein (ECP) and hyperlipidemia, and to explore the pathogenesis of atherosclerosis induced by hyperlipidemia. Methods Twenty male New Zealand white rabbits were randomly divided into normal diet group(n=10) and high fat diet;group (HFD,n=10). HFD group was fed by high fat diet, the control group was fed normally. Serum levels of hsCRP, TNF-α and ECP were measured at different time points before, 4 weeks, 8 weeks and 12 weeks. Results Serum TC (t=6.59,P=0.000;t=10.93,P=0.000;t=17.88,P=0.000) and LDL (t=6.59,P=0.000;t=10.86,P=0.000;t=15.07,P=0.000) in the HFD group at 4 weeks, 8 weeks and 12 weeks compared with those in the normal diet group, and hyperlipidemia was formed. Compared with the normal diet group, serum levels of TNF-α (t=40.13,P=0.000;t=41.57,P=0.000;t=57.10,P=0.000) and ECP (t=9.82,P=0.000;t=23.04,P=0.000;t=14.94,P=0.05) in the HFD group at 4 weeks, 8 weeks and 12 weeks were increased. The hsCRP (t=5.62,P=0.025,t=2.40,P=0.029) level of HFD group was higher than that of the mormal diet group at 4 and 12 weeks. Conclusions The expression of inflammatory factors hsCRP, TNF-α and ECP are up-regulated after high-fat diet, and hyperlipidemia may be involved in the occurrence of atherosclerosis by promoting inflammatory response.
hyperlipidemia;eosinophil cationic protein;inflammatory factor;atherosclerosis
s:HUANG Yining,Email:ynhuang@sina.com;GONG Tao,Email:gb20598@sina.com
2017-01-09)
10.3969/j.issn.1006-2963.2017.02.010
国家自然科学基金资助项目(31271097)
北京大学第一医院神经内科(李伟、黄一宁);北京医院神经内科 国家老年医学中心(李伟、于泽谋、徐蕾、陈玉辉、王音、龚涛)
黄一宁,Email:ynhuang@sina.com;龚涛,E-mai:gb20598@sina.com
R743.3;R541.4
A
1006-2963(2017)02-0114-05
Study on the relationship between hyperlipidemia and inflammatory factors in rabbitsLIwei,YUZemou,XULei,CHENYuhui,WANGYin,GONGTao△,HUANGYining*.*DepartmentofNeurology,PekingUniversityFirstHospital,Beijing100034,China;△NeurologyDepartmentofBeijingHospital,NationalCenterofGerontology,Beijing100730,China

