法舒地尔对EAE小鼠血-脑屏障功能的保护作用及机制研究
谷青芳 张辉 李艳花 刘春云 王慧卿 肖保国 尉杰忠 马存根
法舒地尔对EAE小鼠血-脑屏障功能的保护作用及机制研究
谷青芳 张辉 李艳花 刘春云 王慧卿 肖保国 尉杰忠 马存根
目的 探讨法舒地尔(Fasudil)对实验性自身免疫性脑脊髓炎(EAE)的血-脑屏障(BBB)保护机制。方法 采用MOG35-55肽段诱导C57BL/6小鼠建立EAE模型,于免疫后第3天起Fasudil组腹腔注射Fasudil〔40 mg/(kg·d)〕干预,EAE组注射等量生理盐水,持续至免疫后第20天。于免疫后第7 d、14 d、21 d采集小鼠脑和脊髓标本,行HE染色、脱髓鞘染色和免疫荧光染色;测定脑和脊髓伊文思蓝(EB)的渗透量;采用Western blot法检测脑内细胞紧密连接蛋白Occludin和ZO-1表达情况。结果 与EAE组相比,Fasudil组小鼠中枢神经系统(CNS)炎性细胞计数和髓鞘脱失面积均明显减少〔分别98.00±33.15vs. 417.70±78.89,t=3.736,P<0.05;(11.38±1.09)%vs.(38.21±7.94)%,t=3.473,P<0.05〕。在免疫后14 d、21d,Fasudil组脑和脊髓内EB渗透量均低于EAE组(脑:9.04±0.15vs.9.93±0.25,t=5.776,P<0.05;9.09±0.089vs. 9.83±0.22,t=3.116,P<0.05;脊髓:17.28±0.38vs. 21.33±2.21,t=7.782,P<0.05;16.48±0.71vs. 21.77±0.17,t=7.256,P<0.01)。与EAE组相比,Fasudil组小鼠脑内细胞紧密连接蛋白Occludin表达上调(7 d:0.068±0.045vs. 0.127±0.022,t=6.026,P<0.05),14 d:0.185±0.011vs.0.233±0.014,t=2.609,P<0.05,21 d:0.248±0.021vs.0.364±0.121,t=2.834,P<0.01)和ZO-1(7 d:2.013±0.073vs. 2.404±0.256,t=1.467,P>0.05;14 d:1.783±0.129vs.2.003±0.184,t=2.409,P<0.05;21 d:1.332±0.052vs. 1.674±0.023,t=6.026,P<0.01)。结论 Fasudil可能通过抑制小鼠脑内细胞紧密连接蛋白Occludin和ZO-1的下调而保护BBB的完整性。
法舒地尔;实验性自身免疫性脑脊髓炎;紧密连接;血-脑屏障
血-脑屏障(blood-brain barrier,BBB)是存在于脑和脊髓内的毛细血管与神经组织之间的一个调节中枢神经系统(central nervous system,CNS)内环境的细胞屏障,BBB完整性的破坏导致其通透性改变是多发性硬化(multiple sclerosis,MS)发病的主要机制之一。最近的研究发现,多种神经系统疾病的病理过程中均Rho/Rho激酶(ROCK)信号通路的激活,引起T淋巴细胞的活化,并使其向中枢神经系统迁移,其中BBB功能障碍是MS和EAE发病过程中的瓶颈事件,因为只有活化的T淋巴细胞通过BBB迁移进入CNS才能导致后续的免疫攻击和神经损伤的发生[1]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是MS的理想动物模型,现在普遍认为MS和EAE的免疫病理过程相似[2]。盐酸法舒地尔(Fasudil)是目前临床上惟一使用的Rho激酶抑制剂,本文试图通过观察Fasudil防治EAE的实验效果,并探讨其对小鼠脑内紧密连接蛋白Occludin和ZO-1表达的影响及其在保护BBB中的可能机制,为临床诊治MS积累资料。
1 材料和方法
1.1 材料 雌性C57BL/6小鼠(18~22 g、8~10周鼠龄,购自北京维通利华公司)共48只。
小鼠髓鞘碱性蛋白(myelin oligodendrocyte glycoprotein peptides 35-55, MOG35-55)由西安联美生物科技有限公司合成;百日咳毒素(pertussis toxin,PTX)购自ALEXIS公司;完全福氏佐剂 (complete Freund’s adjuvant, CFA) 购自美国Sigma公司;结核分枝杆菌(tuberculosis bacili,TB)购自美国Becton Dickinson(BD)公司。Bio-RAD凝胶成像分析仪购自美国Bio-RAD公司;BCA蛋白定量试剂盒购自碧云天生物技术有限公司;Fasudil(批号为1210221)购自天津红日药业有限公司。
1.2 方法
1.2.1 EAE模型的制备将MOG35-55肽段12 mg溶于2.4 mL生理盐水中,TB 14.4 mg 悬于2.4 mL CFA中,将两者等体积充分混合,用注射器反复推成油包水样乳白色混悬剂。乙醚麻醉小鼠后,对2组小鼠分别于背部脊柱中线两侧,皮下四个点注射抗原乳剂0.1 mL/只。记录免疫当日为免疫后(p.i.) 0 d。于免疫当天和免疫后48 h分别腹腔注射PTX 0.5 mg/只。造模成功的标准为:有EAE临床症状且脊髓病理切片有大量炎性细胞浸润及髓鞘脱失。免疫后第10天EAE小鼠开始陆续发病,第14天进入高峰期,发病率达100%。基于此条件下的EAE模型,造模成功率100%,死亡率0%。
1.2.2 动物分组及免疫: 然后按体重18、19、20、21、22分层随机分层为EAE对照组(EAE组)和Fasudil干预组(Fasudil组),每组各24只。Fasudil组动物免疫后第3 d开始腹腔注射Fasudil(每只每次400 μg /200 μL,2次/d),EAE组同法给予等量NS作为对照,持续给药至免疫后20 d。
1.2.3 动物临床症状评分:采用国际通用的5分制评分法,于免疫后0 d起由2名观察者以盲法对实验小鼠隔天定时进行症状观察及评估,其标准如下[3]:无症状为0分;尾部肌张力低,轻度步态笨拙为1分;尾麻痹+一侧后肢肌力中度低,被动翻身可恢复为2分;尾麻痹+双后肢瘫痪,被动翻身不能恢复,为3分;尾+四肢瘫痪为4分;濒死状态为5分。评分介于两者之间以±0.5 计算。
1.2.4 标本采集:于免疫后第7 d、14 d、21 d三个不同时间点对EAE组和Fasudil组分别随机选取8只小鼠,以0.3%(质量浓度)戊巴比妥钠(0.2 mL/只)腹腔注射麻醉小鼠。将每组三个不同时间点所取的8只小鼠再随机分为三个检测组。
(1)每组选3只小鼠,经尾静脉注射2%(质量浓度)伊文思蓝(Evans blue,EB),2 h后处死,完整剥离脑和脊髓,称重,加甲酰胺溶液后打成匀浆,检测脑和脊髓中EB渗透量(mg/g);
(2)每组选2只小鼠于麻醉后用4%(质量浓度)多聚甲醛灌注,分离小鼠脑和脊髓并制备10um冰冻切片。①小鼠脊髓炎性细胞浸润及髓鞘脱失情况检测:将脊髓冰冻切片水中浸泡2 min,苏木素染色3 min,水洗1 min,5%(体积分数)盐酸酒精分化15 s,伊红染色30 s,梯度酒精脱水各15 s,二甲苯浸润各15 s,甘油封片后显微镜下观察炎性细胞浸润情况。取冰冻切片于95%(体积分数)酒精中浸泡3 min,浸于固蓝液中,57 ℃孵育24 h,去离子水中浸洗3 min,95%(体积分数)酒精浸洗3 min,切片于0.05%(质量浓度)碳酸锂溶液快速浸洗15 s,70%(体积分数)酒精分化直至白质与灰质清晰分辨,去离子水冲洗3 min,梯度酒精脱水各2 min,二甲苯透明各2 min。显微镜下观察HE染色炎性细胞核为蓝色,脊髓白质区髓鞘脱失部分颜色发白,用Image-Pro Plus软件计算小鼠整个脊髓白质区表达的炎性细胞数目并求其均数,计算小鼠髓鞘脱失面积与白质面积比值并求取平均值。②免疫荧光染色检测巨噬细胞浸润及紧密连接蛋白Occludin和ZO-1的表达:冰冻切片在室温下干燥,经PBS 洗涤5 min×3次,加入抗大鼠一抗CD68抗体(1∶1000),兔抗一抗Occludin抗体(1∶1000)和ZO-1抗体(1∶1000),置4 ℃冰箱过夜。次日PBS洗去一抗,滴加相应DyLight555、488荧光标记的抗大鼠的二抗(1∶1000),室温孵育2 h,PBS洗涤3次,甘油封片,荧光显微镜下观察Occludin、ZO-1蛋白荧光表达增强,呈绿色特异性;阳性巨噬细胞荧光染色为红色特异性,用Image-Pro Plus软件对在整个脊髓中表达的巨噬细胞进行计数并求取其均数。
(3)Western blot法检测紧密连接蛋白表达:各组取剩余3只小鼠,快速冰上取提取脑组织蛋白,Western blot检测小鼠脑中紧密连接蛋白Occludin、ZO-1蛋白表达量:用组织裂解液在4oC条件下抽提小鼠脑组织蛋白,制备蛋白上样缓冲液样品,用10% (质量浓度)SDS-PAGE凝胶电泳分离蛋白。加入兔抗一抗Occludin抗体(1∶1000)和ZO-1抗体(1∶1000)、兔抗小鼠磷酸甘油脱氢酶(GAPHD)抗体(1∶1000),HRP耦联的二抗(1∶1000)。使用Bio-RAD凝胶成像分析仪检测染色条带显影强度,如出现条带即为所用抗体检测到的相应蛋白,用Image Lab3.0软件检测蛋白条带光密度与内参GAPDH 的光密度比值表示。
1.3 统计学处理 采用Graph-Pad Prism 5软件包进行分析。计量资料以均数±标准差表示,小鼠体重及临床症状评分比较采用Two-wayANOVA检验,两组间其他指标的均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床症状比较 EAE组小鼠于免疫后9 d相继开始发病,小鼠外观皮毛缺乏光泽,进食少,精神萎靡,体重下降,在免疫后14 d开始出现明显症状,表现有尾麻痹、后肢无力、体重下降, 在免疫后20 d发展为发病高峰期,高峰期平均临床评分为(2.33±0.85)分;呈现不同程度的尾麻痹,后肢无力、继而向前爬行时剑突以下部分着地,双后肢拖地;直至发生肢体瘫痪。Fasudil组未见发病,临床症状评分为0分,平均体重上升,与EAE组相比较均增高〔14 d:(19.55±0.57)gvs.(17.46±0.18)g,P<0.01,20 d:(21.23±0.38)gvs. (17.30±0.87)g,P<0.01〕。
2.2 两组小鼠不同时间点脑组织和脊髓中EB渗透量比较 免疫后14 d、21 d Fasudil组小鼠脑内、脊髓内EB含量均低于EAE组(P<0.05或P<0.001;表1)。
2.3 两组小鼠脊髓炎性细胞浸润和髓鞘脱失情况比较 HE染色显示EAE组小鼠脊髓腰膨大白质区出现大量炎性细胞浸润,平均计数为(417.33±78.89)个,高于Fasudil组炎性细胞计数〔(98.00±
表1 不同时间点两组小鼠脑组织和脊髓中EB渗透量比较 (mg/g,±s,n=3)
33.15)个,P<0.05〕;髓鞘染色显示EAE组小鼠出现明显髓鞘脱失,脱失面积比值为(38.21±7.94)%,Fasudil组髓鞘脱失脱失面积比值〔(11.38±1.09)%〕低于EAE组(P<0.05)。CD68免疫荧光染色显示EAE组小鼠脊髓有大量CD68阳性巨噬细胞浸润,阳性巨噬细胞计数为(111.7±27.16)个, Fasudil组炎性反应轻,阳性巨噬细胞计数〔(27.67±7.86)个〕少于EAE组(P<0.05)。具体结果见表2、图1。
2.5 两组紧密连接蛋白表达比较 与EAE组比较,Fasudil组小鼠脑内细胞紧密连接蛋白Occludin和ZO-1的表达增加(P<0.05或P<0.01,表3);免疫荧光染色可见Fasudil组脑内紧密连接蛋白Occludin和ZO-1表达的荧光强度均高于EAE组(图2、3)。进一步采用Western blot检测蛋白表达,结果显示与EAE组相比,Fasudi组Occludin和ZO-1蛋白的表达量上调(均P<0.01)。具体结果见图4、5,表3。
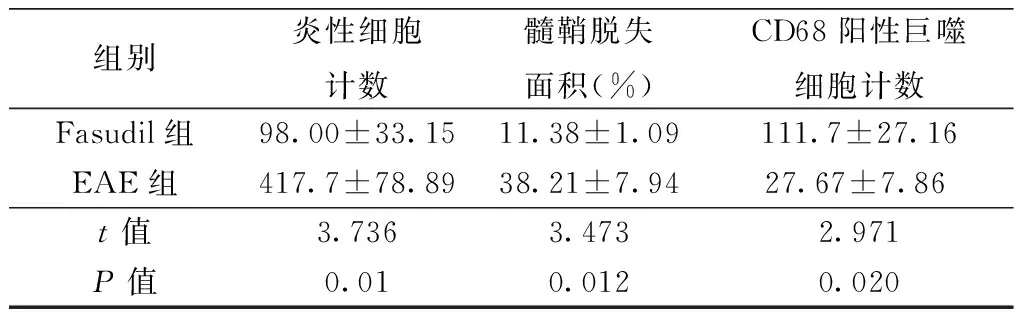
表2 两组小鼠脊髓炎性细胞浸润和 髓鞘脱失、巨噬细胞浸润比较
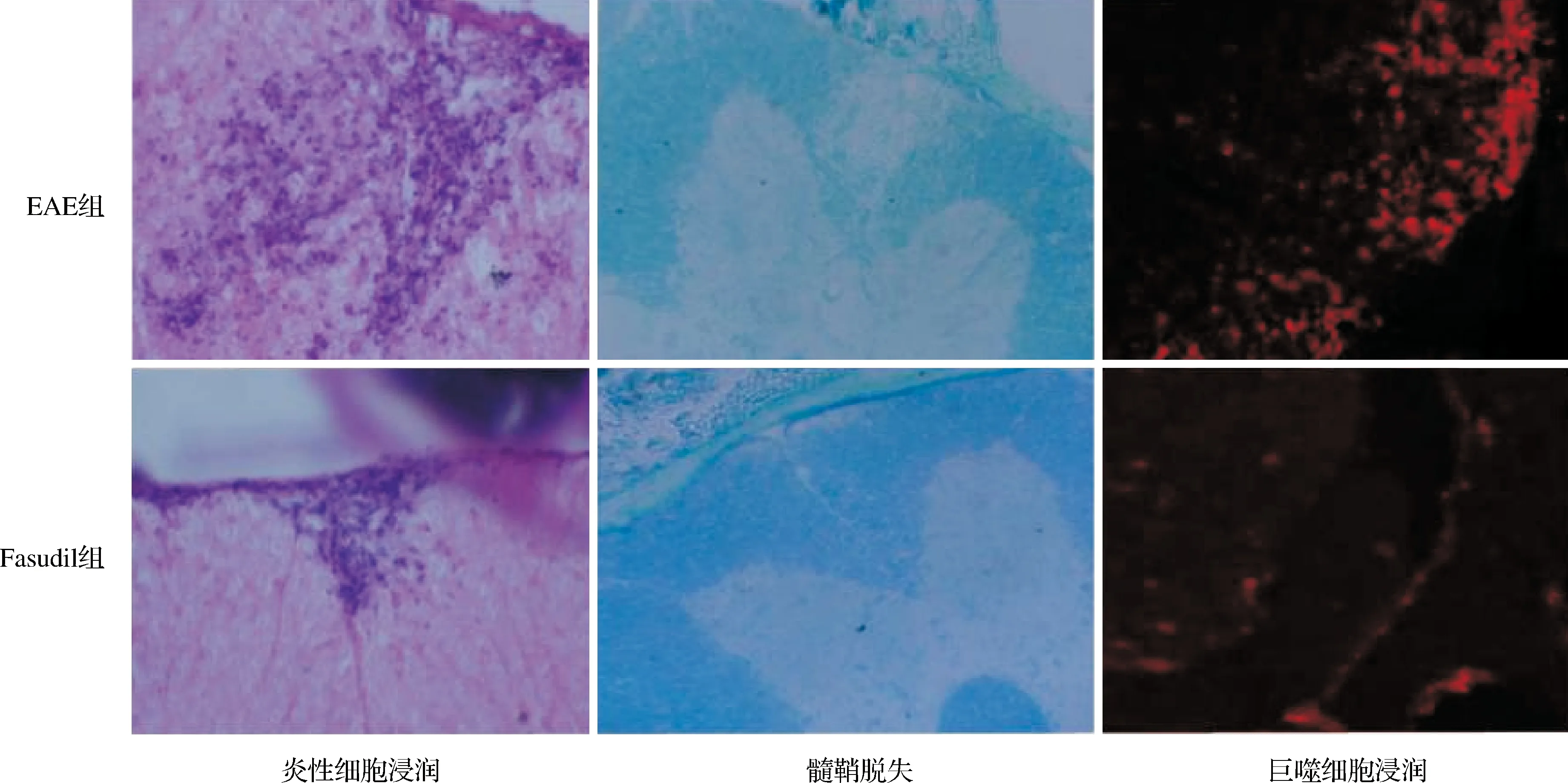
图1 两组小鼠脊髓炎性细胞浸润(HE染色)、髓鞘脱失(脱髓鞘染色)及巨噬细胞浸润(CD68免疫荧光染色)比较(×200)
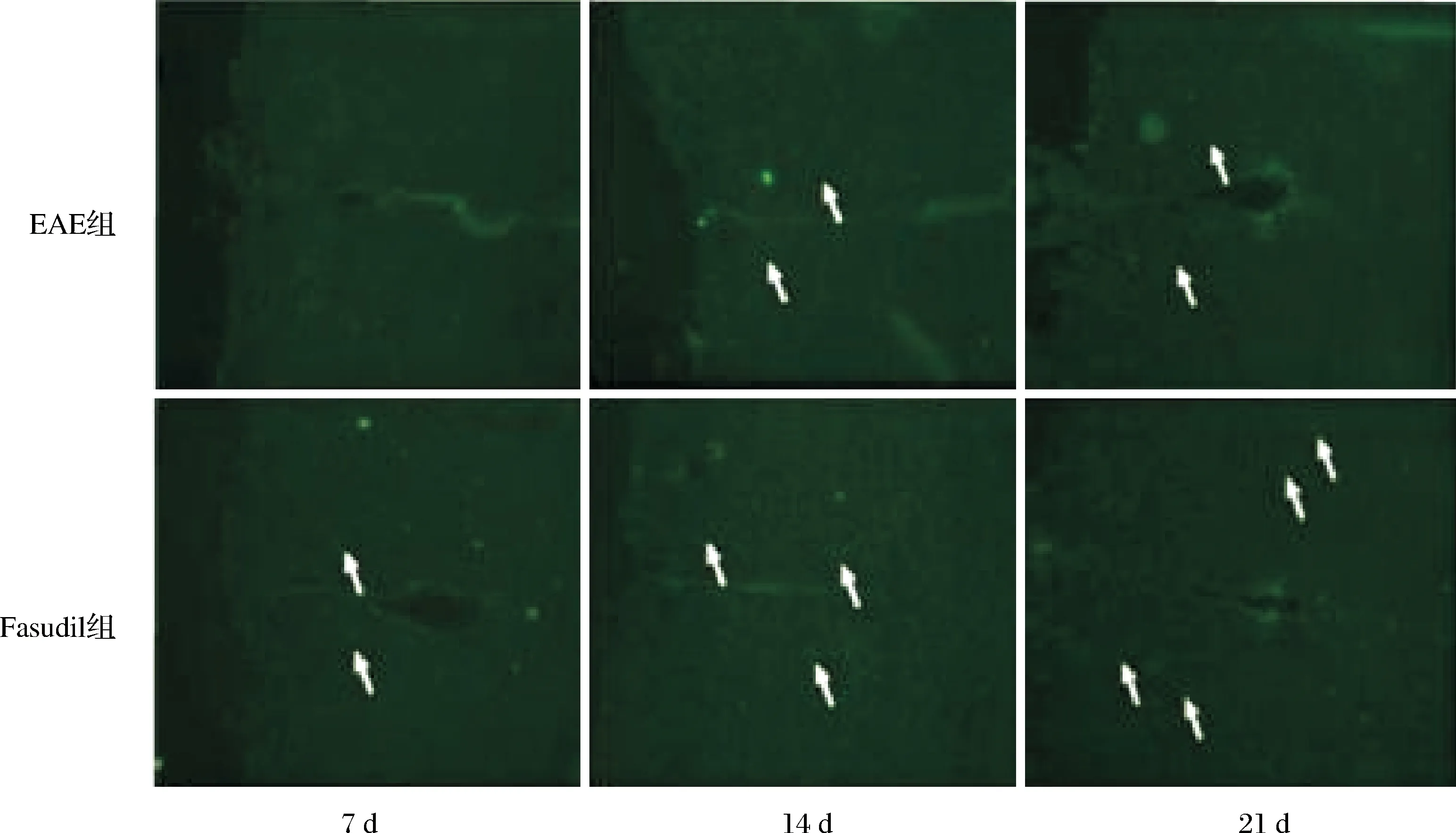
图2 两组小鼠脑内Occludin蛋白表达比较(免疫荧光染色)
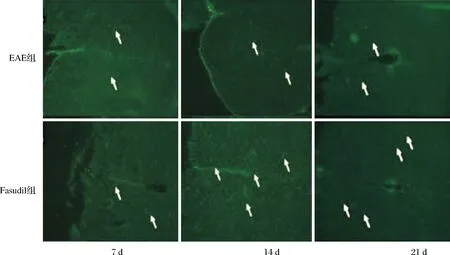
图3 两组小鼠脑内ZO-1蛋白表达比较(免疫荧光染色×200)

图4 两组小鼠脑内Occludin蛋白表达比较(Western blot)
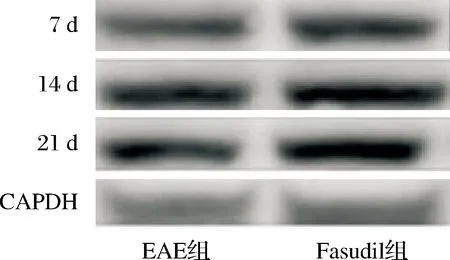
图5 两组小鼠脑内ZO-1蛋白表达比较(Western blot)

组别Occludin7d14d21dZO-17d14d21dFasudil组0.127±0.0220.233±0.0140.364±0.1212.404±0.2562.003±0.1841.674±0.023EAE组0.068±0.0450.185±0.0110.248±0.0212.013±0.0731.783±0.1291.332±0.052t值6.0262.6092.8341.4672.4096.026P值0.0270.02980.0060.0950.0160.002
3 讨论
保持BBB结构的完整性是神经组织要发挥正常功能的重要前提之一。目前已证实由于外周炎性细胞浸润CNS导致的一系列免疫反应并最终造成中枢脱髓鞘的病理过程中,BBB的破坏导致通透性增高是介导该过程的重要环节,有研究报道MS及EAE的发病最早阶段即有BBB的通透性增加。刘瑞春等[4]给EAE大鼠静脉注射2% EB后,观察发现EAE大鼠未出现临床症状之前BBB的完整性即遭到破坏,BBB的通透性增加,大鼠软脑膜下层EB广泛渗出。Fabis等[5]用氟化钠(NaF)示踪剂观察BBB动态演变过程,结果显示EAE动物出现的病理症状严重性和BBB通透性增加程度间存在明显线性相关关系,由此提示BBB完整性的破坏在MS和EAE发病过程中起着关键作用。
本研究通过腹腔注射Fasudil观察其对EAE的治疗效果,通过病理学检查发现Fasudil干预可降低EAE小鼠CNS的炎性反应,减少髓鞘脱失及巨噬细胞的浸润。巨噬细胞与EAE的发展有密切关系,它有抗原提呈的能力,分泌炎性细胞因子,参与髓鞘脱失和轴突的损伤。Takeda等[6]发现,Rho激酶抑制剂可减少炎性细胞跨内皮细胞的迁徙、聚集,进而对BBB起到保护作用。本研究通过尾静脉注射并检测EB含量动态观察EAE小鼠BBB的功能,通过对各组小鼠脑组织中、脊髓中EB渗透量来衡量BBB通透性的变化。EB是一种荧光染料,进入血液循环中大多数与白蛋白结合形成EB-复合物(ESA),正常情况下ESA很难通过BBB,当BBB的完整性遭到破坏通透性增加时,EB通过BBB的通透率会显著增加,脑组织、脊髓蓝染加重[7]。本研究结果显示,免疫后14 d、21 d Fasudil组脑和脊髓内EB渗透量较EAE组小鼠明显降低,而免疫后14 d、21d正是EAE小鼠发病的严重时期,表明Fasudil能有效降低EAE小鼠BBB的通透性,减少EB通过BBB进入中枢神经系统的量,表明Fasudil在EAE发病期间对BBB具有保护作用。
既往研究证实当EAE发生时,Rho/ROCK激活,促进内皮细胞胞质的细胞骨架蛋白-微丝肌动蛋白(F-actin)收缩,同时使内皮细胞间的紧密连接蛋白-Occludin破坏,最终导致内皮细胞间紧密连接(tight junction ,TJ)的破坏,结果使BBB的通透性增加[8-10]。在BBB的组织结构中紧密连接蛋白在维持BBB完整性中起着重要的作用,紧密连接蛋白的降解标志着BBB通透性增加。紧密连接蛋白主要包括跨膜蛋白Occludin、Claudins和胞质蛋白ZO-1。Occludin在脑组织血管内皮的表达明显高于非神经组织的血管内皮,Occludin可将跨膜蛋白和细胞骨架连接在一起,改变肌动蛋白的收缩性,影响细胞间紧密连接装配与功能,这是BBB通透性明显低于其他组织屏障的重要原因[11]。黄海波[12-13]等认为,Occludin表达水平能够代表BBB的结构状态,其下降程度可以作为BBB损伤程度的标志。ZO-1是胞质附着蛋白之一,是紧密连接复合体中一个非常重要的结构蛋白, 它一方面连接着跨膜蛋白, 另一方面又与胞内侧的细胞骨架蛋白相连接, 起到一个重要的连接枢纽作用。研究证实BBB通透性的变化也与ZO-1的表达紧密相关[14],ZO-1表达水平的下降也可以作为BBB功能破坏的标志[15]。本实验对Occludin和ZO-1这两个紧密连接蛋白进行了观察,结果显示Fasudil组EAE小鼠中枢神经系统的炎性反应减轻,小鼠脑组织内Occludin和ZO-1的下调被抑制,也提示Fasudil能有效地维持BBB的完整性,从而保护BBB的正常功能。
综上所述,Fasudil可能通过抑制脑组织内紧密连接蛋白Occludin和ZO-1的下调,从而保护BBB功能的完整性有关,但其对EAE具体的调节方式和病理条件下的分子机制还需进一步探讨。
[1]Engelhardt B, Ransohoff RM. Capture, crawl, cross: the T cell code to breach the blood-brain barriers[J]. Trends Immunol, 2012, 33(12):579-589.
[2]Wekerle H. Lessons from multiple sclerosis: models, concepts, observations[J]. Ann Rheum Dis,2008,67(3):56-60.
[3]Urban JL,Kumar V, Kono DH,et al.Restricted use of T cell receptor V genes in murine autoimmune encephalomyelitis raises possibilities for antibody therapy [J]. Cell,1988,54(4):577-592.
[4]刘瑞春,董梅,郭力,等. 实验性变态反应性脑脊髓炎发病初期血-脑屏障的变化及基质金属酶的作用研究[J]. 脑与神经病杂志,2005,132(:86-88)
[5]Fabis MJ,Scott GS,Kean RB,et al.Loss of blood-brain barrier integrity in the spinal cord is common to experimental autoimmune encephalomyelitis in knockout mouse models[J].Proc Natl Acad Scr USA,2007,104(13):5656-5661.
[6]Takeda K, Jin MB, Fujita M, et al. A novel inhibitor of Rho-associated protein kinase,Y-27632, ameliorates hepatic ischemia and reperfusion injury in rats[J]. Surgery, 2003, 133(2):197-206.
[7]郑明华.载脂蛋白E对实验性自身免疫性脑脊髓炎血-脑屏障通透性的影响[D].广西医科大学硕士论文,2014:31-36.
[8]AIarez JI, Dodelet-Devillers A, Kebir H, et al. The Hedgehog pathway promotes blood-brain barrier integrity andcns immune quiescence[J]. Science, 2011, 334(6063):1727-1731.
[9]刘岳婷,侯绍蔚,马存根,等.法舒地尔通过诱导EAE小鼠occludin表达抑制其炎性细胞浸润[J]. 中国神经免疫学和神经病学杂志, 2012,19(3):206-210.
[10] Yu JZ, Ding J, Ma CG, et al. Therapeutic potential of experimental autoimmune encephalomyelitis by fasudil, a Rho kinase inhibitor[J]. J Neurosci Res, 2010,88(8):1664-1672.
[11]Khastgir J, Khan A, Speakman M. Acute urinary retention: medical management and the identification of risk factors for prevention[J]. Nat Clin Pract Urol, 2007, 4(8):422-431.
[12]黄海波,田川,柳磊, 等. 深低温停循环后家兔脑血管内皮细胞紧密连接蛋白occluding表达变化的实验研究[J]. 中国分子心脏病学杂志,2009, 9(3):155-158.
[13]李家林,李良勇,王玉.外源性转化生长因子β1对大鼠癫痫持续状态后血-脑屏障通透性的影响[J] 蚌埠医学院学报,2012,37(7):748-752.
[14]陈铎,袁江伟,宋磊,等. 紧密连接相关蛋白Clauding-5、ZO-1在大鼠蛛网膜下腔出血后早期脑损伤中的表达及意义[J]. 中国医科大学学报,2010, 39(9):713-716.
[15]Bennett J, Basivireddy J, Kollar A , et al. Blood-brain barrier disruption and enhanced vascular permeability in the multiple sclerosis model EAE[J]. J Neuroimmunol, 2010, 229(1-2):180-191.
(本文编辑:邹晨双)
Objective To explore the protective mechanisms of Fasudil on blood-brain-barrier (BBB) in the treatment of experimental autoimmune encephalomyelitis(EAE). Methods Chronic EAE model was induced by MOG35-55in female C57BL/6 mice. Fasudil was injectedintraperitoneally in the intervention group at 40 mg/(kg·d) and normal saline was injected in the EAE group from day 3 to day 20 post-immunization (p.i.), The specimens were collected on day 7, 14, and 21 p.i. The brain and spinal cord were frozen for HE staining and myelin staining, immunofluorescence staining. The contents of Evans blue (EB) in the brain and spinal cord were detected after intravenous injection. The protein extracted from the brains was collected for the measuremens of Occludin and ZO-1 by Western blot. Results Fasudil significantly decreased inflammatory cell infiltration and demyelination in the CNS(number of inflammatory cell: 98.00±33.15vs. 417.7±78.89,t=3.736,P<0.05;demyelination area :(11.38±1.09)%vs.(38.21±7.94)%,t=3.473,P<0.05). Comparing with the EAE group,at day 14 d.and 21 d , the EB levels in brain and spinal cord of Fasudil-treated mice were significantly lower(brain:9.04±0.15vs9.93±0.25,t=5.776,P<0.05;9.09±0.089vs9.83±0.22,t=3.116,P<0.05; spinal cord:17.28±0.38vs21.33±2.21,t=7.782,P<0.05;16.48±0.71vs21.77±0.17,t=7.256,P<0.01),Fasudil also induced an up-regulation of Occludin (7 d:0.068±0.045vs0.127±0.022,t=6.026,P<0.05;14 d:0.185±0.011vs0.233±0.014,t=2.609,P<0.05;21 d:0.248±0.021vs0.364±0.121,t=2.834,P<0.01)and ZO-1 (7 d:2.013±0.073vs2.404±0.256,t=1.467,P>0.05;14 d:1.783±0.129vs2.003±0.184,t=2.409,P<0.05;21 d:1.332±0.052vs1.674±0.023,t=6.026,P<0.01) in the brain .Conclusions Fasudil may be related to inhibition of the down-regulation of Occludin and ZO-1 in the brain, revealing that Fasudil can maintain the integrity of BBB.
Fasudil; Experimental autoimmune encephalomyelitis;tight junction; Blood brain barrier
YU Jiezhong , Email:sxdtyjz@qq.com; MA Cungen, Email:macungen2001@163.com
2016-10-17)
10.3969/j.issn.1006-2963.2017.02.007
国家自然科学基金2012面上项目(81272163);山西中医学院“2011”培育计划(2011PY-1);山西省国际科技合作项目(2013081058);山西省回国留学人员重点科研资助项目(2014-重点7);大同大学校科研项目(2016K10)
037009山西大同大学脑科学研究所(谷青芳、张辉、李艳华、刘春云、尉杰忠、肖保国、马存根),037009大同市第五人民医院(王慧卿);030024山西中医学院“2011”协同创新中心/神经生物学研究中心 山西中医学院(马存根);200025复旦大学华山医院神经病学研究所(肖保国))
尉杰忠,Email:sxdtyjz@qq.com;马存根,Email:macungen2001@163.com
R744.5+1
A
1006-2963(2017)02-0099-06
Research about protective effects of fasudil on BBB function in EAE mice and study of the mechanismsGUQingfang,ZHANGHui,LIYanhua,LIUChunyun,WANGHuiqing,XIAOBaoguo,YUJiezhong*,MACungen*.*InstituteofBrainScience,ShanxiDatongUniversity,DatongShanxi037009China; “2011”CollaborativeInnovationCenter/ResearchCenterofNeurobiology,ShanxiUniversityofTraditionalChineseMedicine,TaiyuanShanxi030024,China

