TIPE3干扰质粒对SW480结肠癌细胞生长的作用及相关机制探讨①
叶宇涵 刘忠臣 齐忠权 庄国洪 殷 平
(福建医科大学基础医学院,福州350004)
·生物治疗·
TIPE3干扰质粒对SW480结肠癌细胞生长的作用及相关机制探讨①
叶宇涵 刘忠臣②③齐忠权④庄国洪④殷 平⑤
(福建医科大学基础医学院,福州350004)
目的:通过TIPE3干扰质粒转染SW480结肠癌细胞,验证干扰TIPE3表达对SW480结肠癌细胞生长的影响并探讨相关机制。方法:构建TIPE3-shRNA-pSIREN-RetroQ干扰质粒,通过脂质体转染法成功将干扰质粒导入SW480细胞,通过RT-PCR、Western blot检测重组质粒的干扰效率。应用CCK-8方法检测SW480细胞生存率。AnnexinV-FITC/PI流式细胞法检测细胞凋亡。使用Western blot检测细胞增殖、凋亡相关分子的表达情况。结果:成功设计、构建和筛选具有生物活性且干扰效率最佳的TIPE3-shRNA-pSIREN-RetroQ干扰质粒。CCK-8检测证实干扰SW480结肠癌细胞TIPE3表达可以抑制细胞生长。流式结果显示,TIPE3-shRNA3干扰组的凋亡率为(27.99±1.087)%,显著高于正常细胞组(12.10±2.213)%及转染空载质粒组(11.44±0.277 0)%。证实了降低TIPE3表达可以增加SW480对aDR5ScFv所诱导的细胞凋亡敏感性。Western blot结果显示干扰TIPE3表达可以活化caspase3蛋白,降低p-AKT、p-PDK1、PCNA等分子的表达。结论:干扰TIPE3的表达对SW480结肠癌细胞具有促进凋亡,抑制增殖的作用。
TIPE3shRNA;结肠癌;凋亡;增殖
肿瘤坏死因子-α诱导蛋白8(Tumor necrosis factor-α induced protein 8,TNFAIP8或称TIPE)家族是近年来发现的一组蛋白质,具有维持免疫平衡、调节肿瘤生长的作用[1]。哺乳动物TNFAIP8家族包括四个成员,即TIPE、TIPE1、TIPE2与TIPE3[2],它们在结构上具有高度同源性,均包含7个高度保守的α螺旋(α0~α6)以及由α螺旋组成的疏水性空腔[3]。TIPE3(又称TNFAIP8L3)作为磷脂酰肌醇通路中的第二信使转移蛋白促进肿瘤的发生[4]。TIPE3在N端具有独特的19 个氨基酸序列,称为N 端结构域(NT),TIPE 家族的其他成员没有该结构域,删除这段序列 TIPE3 将从促增殖蛋白质转换为促死亡蛋白[5]。
TIPE3在食管癌、卵巢癌、胃癌等肿瘤细胞系中表达[5,6],降低TIPE3表达对肿瘤生长的研究有助于进一步揭示TIPE3在肿瘤发生发展中的可能机制。因此我们构建TIPE3-shRNA-pSIREN-RetroQ干扰质粒,降低TIPE3在结肠癌中的表达来研究TIPE3对其生长的影响,进而了解TIPE3在肿瘤增殖、凋亡中的作用,为结肠癌治疗的分子治疗提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 主要试剂 T4 DNA Ligase、BamHⅠ限制性内切酶、EcoR Ⅰ限制性内切酶、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、DL5000 DNA marker购自宝生生物工程(大连)有限公司;PCR 产物胶回收试剂盒购于天根生化科技(北京)有限公司; ExFectTMTransfection Reagent购自 Vazyme公司;CCK购于北京全式金有限公司;流式凋亡检测试剂盒购于BD公司;PCR 引物合成由生工生物工程(上海)股份有限公司完成;质粒测序由上海英骏公司完成;辣根过氧化酶标记的山羊抗兔IgG购厦门英伟生物技术有限公司; TIPE3抗体购自药明康德新药开发有限公司;caspase3、caspase3-cleaved、AKT、pAKT、PDK、pPDK抗体购于abcam公司。
1.1.2 载体和菌种 shRNA 载体pSIREN-RetroQ 由厦门大学医学院金光辉老师馈赠,DH5α菌株购于北京全式金公司,引物及干扰片段由厦门大学医学院高淑彬老师设计,上海 Sangon 合成,人结肠癌细胞HT-29、人结肠腺癌细胞SW480、人肾胚细胞HKE293细胞株由厦门大学医学院抗癌研究中心保存。
1.2 方法
1.2.1 TNFAIP8干扰质粒的构建
1.2.1.1 RNA 干扰片段的设计与合成 取pSIREN-RetroQ为shRNA 载体。转化提取质粒pSIREN-RetroQ后,用限制性内切酶BamHⅠ和EcoRⅠ对质粒 pSIREN-RetroQ进行双酶切,双酶切后采用TIANGEN Universal DNA 纯化回收试剂盒纯化回收DNA溶液。
登陆 GeneBank 查找并获取人源性 TIPE3基因序列,从TIPE3的ORF 中选择评分最高的靶序列位点三处,分别命名为TIPE3 shRNA1;TIPE3 shRNA2;TIPE3 shRNA3(GCGAGATCTTTGATGAGCT;ACAAGACTCATCCCCTTAT;GAGCAAAATAGCCAGCAAA)。利用SiRNA Construct Builder 软件,构建TIPE3 干扰片段序列(含黏性末端)。将该序列送至上海Sangon 合成DNA单链,退火形成互补片段。酶切后的胶回收的质粒和退火片段用T4连接酶连接。
1.2.1.2 TIPE3-shRNA-pSIREN-RetroQ重组质粒的转化、鉴定及测序 将连接产物转化至感受态中。经培养后挑取饱满单克隆菌落进行培育。并进行初筛、复筛以排除假阳性克隆的出现。重组质粒的初筛鉴定引物具体序列如下(设计的引物送上海Songon合成):Forward primer=GGGCAGGAAGAGGGCCTAT;TIPE3-shRNA1 reverse primer=ACGCGTAAA-AAAGCGAGA;TIPE3-shRNA2 reverse primer=ACG-CGTAAAAAAACAAGA;TIPE3-shRNA3 reverse primer=ACGCGTAAAAAAGAGCAA;复筛采用质粒手册中的通用引物MSCV_primer和MSCV_rev_primer。
行菌液 PCR 鉴定阳性克隆,所得产物用1.5%的琼脂糖凝胶电泳,在Bio-Rad凝胶成像仪上鉴定。将阳性菌落送上海英俊公司测序。
1.2.2 重组干扰质粒的干扰效率检测及最佳干扰效率质粒的筛选
1.2.2.1 检测人结肠癌细胞HT-29、人结肠腺癌细胞SW480 细胞株TIPE3表达情况 复苏HT-29、SW480细胞,待细胞长至70%~80%后收集细胞,制备RNA样品,并逆转录为cDNA,行PCR检测TIPE3在两株结肠癌细胞中的基因水平表达情况。β-actin上游引物5′-AGCGAGCATCCCCCAAAGTT-3′;下游引物:5′-G GGCACGAAGGCTCATCATT-3′。TIPE3上游引物:5′-CGCAGCATGGA TTCGGATT-3′;下游引物:5′-TCAAAGATCTCGCTGCTGGTGT-3′。PCR 反应条件为:(1)94℃、5 min;(2)94℃、0.5 min;(3)56℃、0.5 min;(4)72℃、0.5 min;(5)72℃、5 min;其中(2)~(4)循环35次。产物存于4℃。所得产物用1.5%的琼脂糖凝胶电泳,在Bio-Rad凝胶成像仪上鉴定。行Western blot检测TIPE3在两株结肠癌细胞中蛋白水平的表达情况。PBS洗涤2次。弃上清,取细胞沉淀,加入含有蛋白酶抑制剂的蛋白裂解液裂解细胞并提取蛋白。行 SDS-PAGE电泳并转印至PVDF膜,5%脱脂奶粉室温封闭1 h后,滴加一抗(1∶1 000),4℃孵育过夜,滴加二抗(1∶10 000),室温孵育1 h,ECL显色。用已知高表达TIPE3的HEK293细胞作为对照[6]。
1.2.2.2 人结肠腺癌细胞SW480细胞转染及检测干扰效率 采用ExFectTMTransfection Reagent转染试剂将TIPE3-shRNA-pSIREN-RetroQ重组质粒转染至 SW480 细胞。选择细胞状态好且处于生长对数期的SW480细胞作为转染对象。将Transfection Reagent加入分别含pSIREN-RetroQ、GFP-pSIREN-RetroQ、TIPE3-shRNA-pSIREN-RetroQ等质粒的不完全培养基中制备成转染复合物。转染复合物与 SW480细胞混匀后将之置于恒温培养箱中进行转染。48 h后利用荧光显微镜观察GFP-pSIREN-RetroQ转染效率。取各组转染细胞制备RNA样品,并逆转录为cDNA,行PCR对TIPE3的表达进行验证和分析。行Western blot检测转染TNFAIP8-shRNA-pSIREN-RetroQ重组质粒的SW480细胞TIPE3干扰效率及TIPE3蛋白的表达。
1.2.3 CCK检测转染TIPE3-shRNA-pSIREN-RetroQ干扰质粒SW480 细胞的存活率 行CCK检测转染细胞生长情况:取3.0×103细胞接种到96孔板中,置于37℃、5%CO2饱和湿度的培养箱中培养24、48 h后,加入10%Cell Counting Kit-8(CCK-8)的完全培养基,4 h后,置于450nm波长测其吸光度。
1.2.4 AnnexinV-FITC/PI流式细胞检测aDR5ScFv诱导转染TIPE3干扰质粒SW480 细胞的凋亡情况。用流式法检测 aDR5ScFv诱导细胞凋亡情况。在消化前4 h加入终浓度150 μg/ml 的 aDR5ScFv培养基。用不含EDTA的0.25%的胰酶消化细胞,计数1×106个细胞,用遇冷的PBS 1 000 r/min,4℃离心10 min弃上清洗涤2次后,100 μl binding buffer重
悬细胞,分别加入5 μl的PI和Annexin V-FITC 避光室温孵育15 min,在1 h内上机完成检测。
1.2.5 检测转染TIPE3干扰质粒的SW480 细胞相关分子pro-caspase3、cleaved caspase3、AKT、p-AKT、PDK、p-PDK、PCNA等表达活化 将转染干扰质粒48 h后的SW480细胞提取蛋白,另设正常细胞组,空载细胞组,行Western blot检测caspase3、AKT、PDK、PCNA等相关分子的表达情况。探讨TIPE3干扰质粒影响细胞增殖、凋亡的可能机制。
1.3 统计学处理 全部数据使用SPSS13.0、GraphPad Prism5和Excel软件做统计学处理。P<0.05表示差异有统计学意义。
2 结果
2.1 TIPE3-shRNA-pSIREN-RetroQ 干扰质粒阳性克隆初筛、复筛鉴定 从连接转化后所得菌落制备PCR模板,以初筛引物进行菌液PCR初筛鉴定。取初筛为阳性的菌种作为PCR模板,以质粒pSIREN-RetroQ的通用引物MSCV_primer和MSCV_rev_primer为引物,进行复筛,将筛选为阳性的菌种送上海英俊公司测序。复筛鉴定1、2为TIPE3-shRNA1阳性克隆。鉴定3、4为TIPE3-shRNA2阳性克隆。鉴定5、6为TIPE3-shRNA3阳性克隆。复筛鉴定的PCR产物大小为410 bp(图1)。
2.2 TIPE3-shRNA-pSIREN-RetroQ测序结果比对 测序结果经DNAMAN软件比对,与设计靶序列一致(图2)。
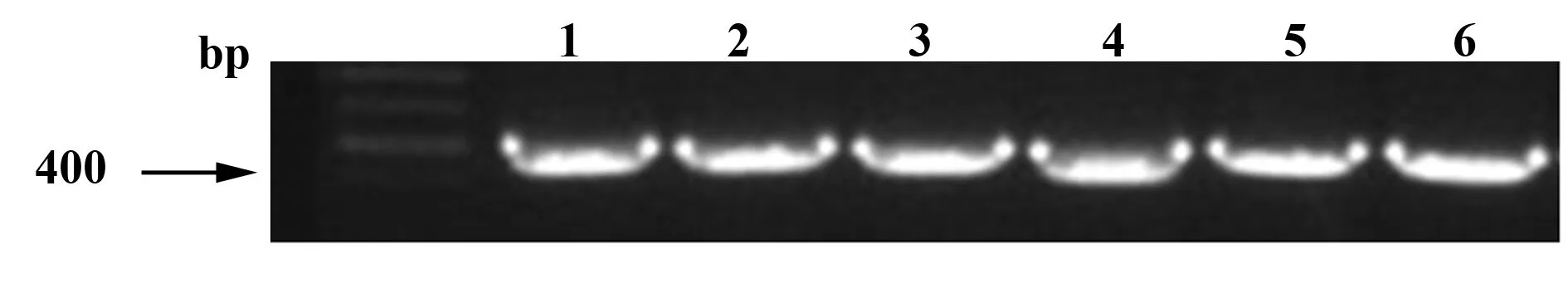
图1 重组质粒阳性克隆复筛鉴定Fig.1 Rescreen positive recombinant plasmid clonesNote: 1,2.Positive clones of TIPE3-shRNA1;3,4.Positive clones of TIPE3-shRNA2;5,6.Positive clones of TIPE3-shRNA3.

图2 TIPE3-shRNA-pSIREN-RetroQ重组质粒的测序图谱和序列比对Fig.2 Sequence comparison of TIPE3-shRNA-pSIREN-RetroQ recombinant plasmid
2.3 检测人结肠癌细胞HT-29、人结肠腺癌细胞SW480细胞株TIPE3表达情况 通过PCR及Western blot比较人肾胚细胞HEK293、人结肠癌细胞HT-29、SW480中TIPE3表达特点。文献报道TIPE3在HEK293细胞高表达,与HEK293细胞相比,TIPE3在人结肠癌细胞HT-29、SW480也为高表达,且在表达上没有差异。由此,我们选择SW480作为干扰细胞株(图3)。
2.4 人结肠腺癌细胞系SW480 细胞培养及转染 经脂质体转染48 h后,转染了GFP-pSIREN-RetroQ质粒的SW480细胞,在100倍荧光显微镜下观察,视野下大量绿色荧光蛋白表达。对比自然光光镜下SW480细胞数量,可见转染GFP-pSIREN-RetroQ质粒转染效率达70%。相对较高的转染效率为后面对所构建干扰质粒干扰效果的检测提供有力基础(图4)。
2.5 TIPE3-shRNA-pSIREN-RetroQ质粒干扰效率检测 收集转染48 h后的SW480细胞,提取RNA并逆转录为cDNA,检测TIPE3的基因表达情况。与正常细胞(泳道1)相比,转染TIPE3-shRNA1、TIPE3-shRNA2、TIPE3-shRNA3质粒(泳道2~4)的SW480细胞,TIPE3的表达量均降低,且转染TIPE3-shRNA3 质粒干扰效率最高(图5)。转染48 h后提取SW480细胞蛋白进行Western blot检测。TIPE3-shRNA3干扰组中TIPE3表达量明显降低,低于空载质粒和TIPE3-shRNA1/2干扰质粒转染组。泳道1~5分别为正常细胞、pSIREN-RetroQ、TIPE3-shRNA1、TIPE3-shRNA2和TIPE3-shRNA3质粒转染组。综上测试结果,构建的TIPE3-shRNA3-pSIREN-RetroQ干扰质粒在蛋白和RNA水平均能较好地干扰TIPE3的表达(图6)。
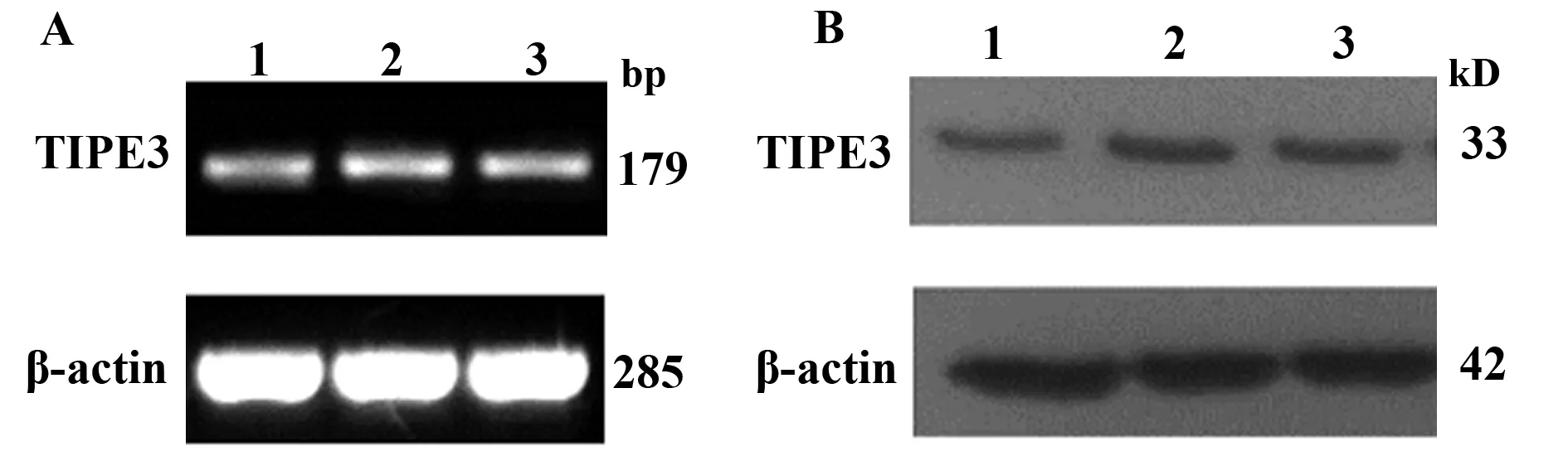
图3 SW480、HT-29与HEK293细胞TIPE3表达情况的比较 Fig.3 Comparison of expression of TIPE3 in HEK293,SW480 and HT-29Note: A.RT-PCR;B.Western blot;1.HEK293 cell;2.SW480 cell;3.HT-29 cell.
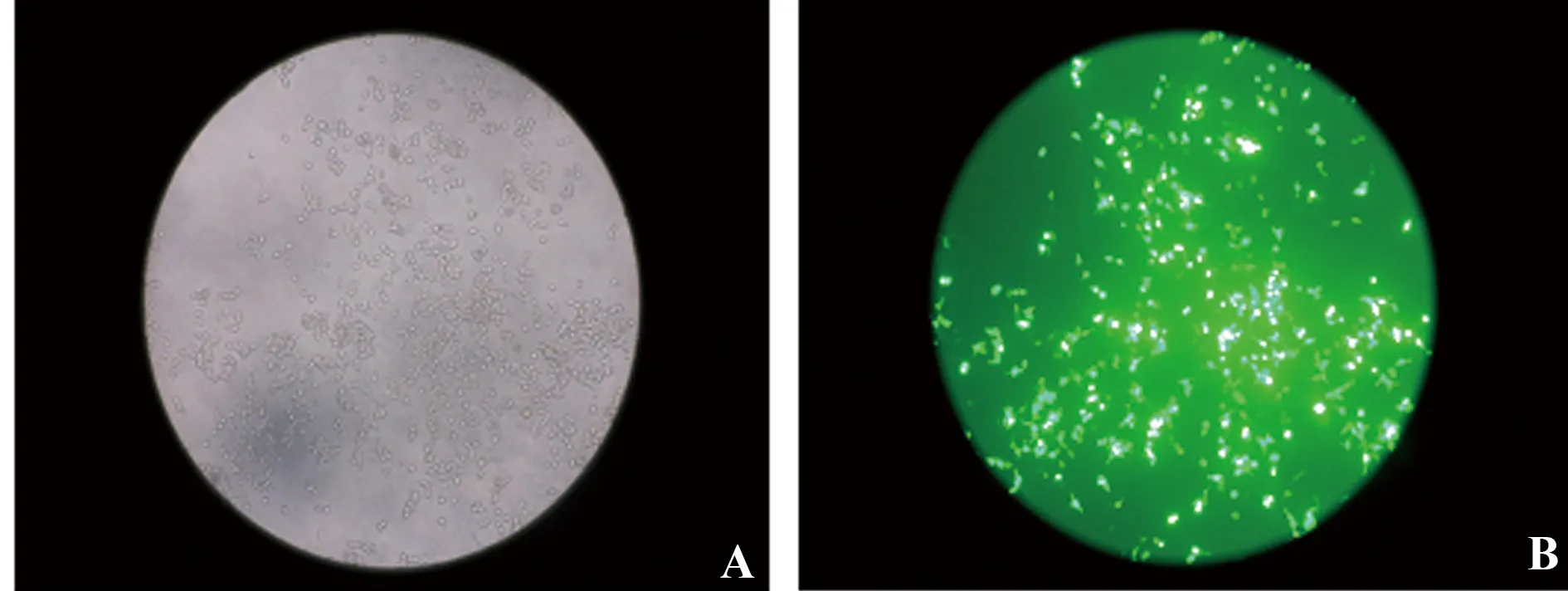
图4 同一视野下荧光显微镜观察GFP-pSIREN-RetroQ 转染SW480细胞Fig.4 SW480 cell observed by fluorescence after GFP-pSIREN-RetroQ transfection at same field of visionNote: A.Observation under natural light;B.Observation under blue light.
2.6 CCK-8检测TIPE3-shRNA-pSIREN-RetroQ干扰质粒转染后SW480细胞的生长 为了进一步验证干扰TIPE3的表达对结肠癌细胞的影响,分别在转染后24、48 h对结肠癌细胞行CCK-8检测,结果表明无论是24 h还是48 h ,与正常的细胞相比,空载组的细胞存活率远高于实验组不同干扰序列组,表明干扰TIPE3后细胞生长能力受限。且48 h时,TIPE3-shRNA3表现出最强的抑制作用,细胞存活率与TIPE3蛋白干扰时间成负相关。说明构建的TIPE3干扰质粒具有抑制肿瘤细胞生长的作用,并呈时间依赖性(图7)。
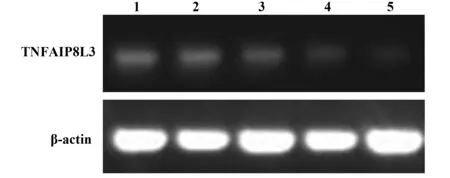
图5 应用RT-PCR检测构建质粒的干扰效果 Fig.5 Detection of interference of recommend plasmid by RT-PCRNote: 1.Normal SW480 cell;2.SW480 cell transfected with pSIREN-RetroQ empty control plasmid;3.SW480 cell transfected with TIPE3-shRNA1 plasmid;4.SW480 cell transfected with TIPE3-shRNA2 plasmid;5.SW480 cell transfected with TIPE3-shRNA3 plasmid.
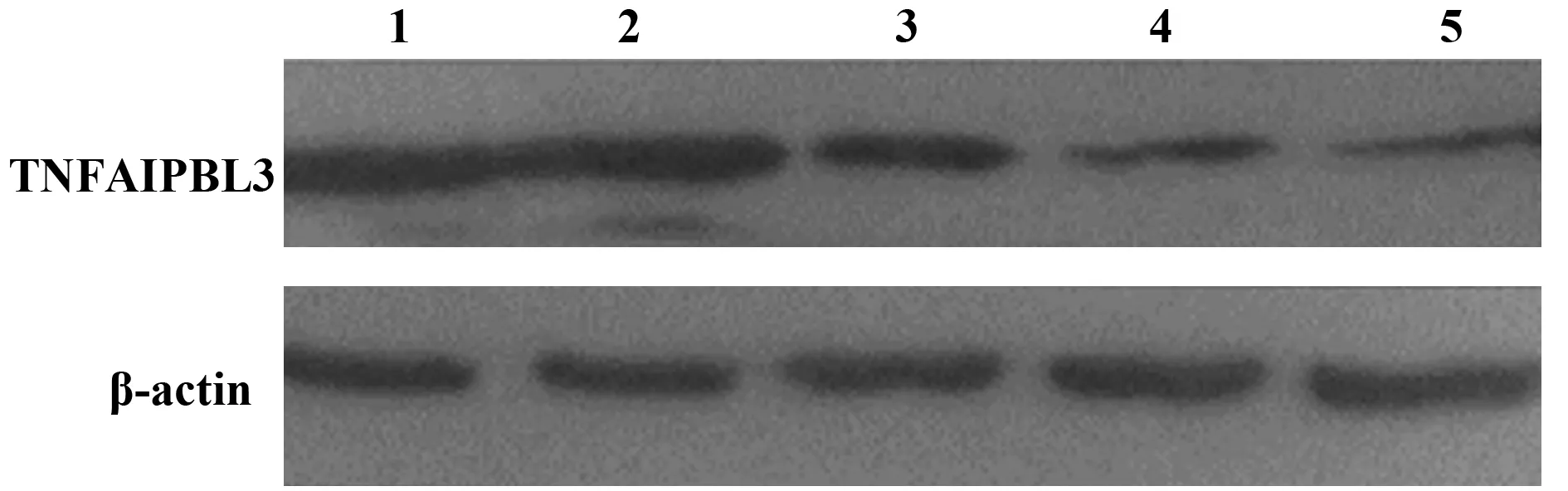
图6 TIPE3-shRNA质粒转染SW480细胞蛋白水平表达的检测Fig.6 Detection of protein expression of TNFAIP8L3-shRNA plasmid transfected SW480 cellsNote: 1.Normal SW480 cell;2.SW480 cell transfected with pSIREN-RetroQ empty control plasmid;3.SW480 cell transfected with TIPE3-shRNA1 plasmid;4.SW480 cell transfected with TIPE3-shRNA2 plasmid;5.SW480 cell transfected with TIPE3-shRNA3 plasmid.
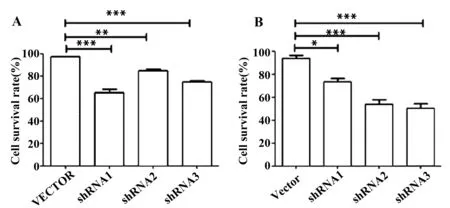
图7 CCK-8检测shRNA干扰TIPE3表达对SW480结肠癌细胞存活率的影响Fig.7 CCK-8 detect shRNA impact of SW480 cell survival rateNote: A.24 h;B.48 h,*.P< 0.05;**.P<0.01;***.P< 0.000 1.
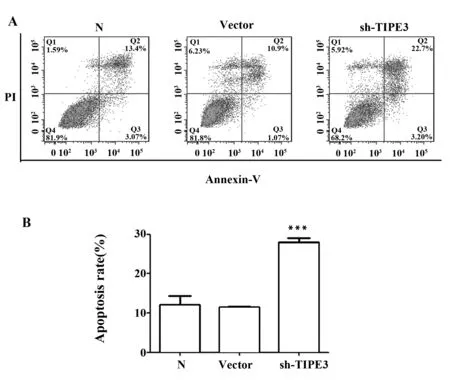
图8 流式检测aDR5ScFv诱导SW480细胞的凋亡Fig.8 Flow cytometry detect aDR5ScFv induced SW480 cells apoptosisNote: ***.P< 0.000 1.
2.7 流式检测 TIPE3-shRNA3-pSIREN-RetroQ 干扰质粒对细胞凋亡的影响 本实验室前期实验结果已证实aDR5ScFv(抗人死亡受体5单链抗体)可以通过结合DR5受体诱导肿瘤细胞的凋亡[7,8]。流式细胞术检测结果表明终浓度 150 μg/ml的 aDR5ScFv 作用6 h后,正常SW480细胞凋亡率为(12.10±2.213)%,转染空载质粒的SW480细胞凋亡率为(11.44±0.277)%,TIPE3-shRNA3干扰组的凋亡率为(27.99±1.087)%。与前两者相比干扰组细胞凋亡增加明显,差异具有统计学意义(P<0.05)。而正常SW480细胞组与转染空载质粒的SW480细胞组相比,差异无统计学意义(P>0.05)。比较正常组、空载组、干扰组细胞早期凋亡(Q3象限)发现,三者差异无统计学意义(图中未显示)。说明构建的TIPE3干扰质粒能够提高结肠癌细胞SW480对aDR5ScFv的敏感性,主要通过增加中晚期凋亡促进肿瘤细胞凋亡的作用(图8)。
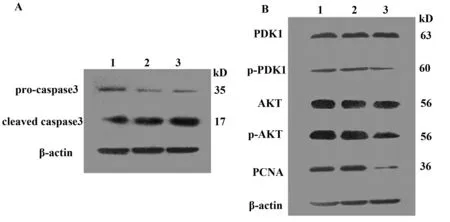
图9 Western blot检测caspase3、PDK1、AKT、PCNA等蛋白的表达Fig.9 Detection of expression of caspase3,PDK1,AKT and PCNA by Western blotNote: 1.Normal SW480 cell;2.SW480 cell transfected with empty control plasmid;3.SW480 cell transfected respectively with TIPE3-shRNA3 plasmid.
2.8 Western blot检测细胞凋亡、增殖相关蛋白分子的表达情况 应用Western blot检测caspase家族成员:pro-caspase3与cleaved caspase3的表达情况。结果可见,与正常细胞组及空载细胞组比较,SW480细胞干扰组其cleaved caspase3明显升高。caspase3作为细胞凋亡的执行者,活化的cleaved caspase3表达增高表明降低TIPE3表达可以促进了细胞凋亡(图9A)。并且在Total PDK1、AKT表达无明显差异的情况下,干扰质粒组p-PDK1、p-AKT蛋白质的表达明显下调,而正常细胞组与空载质粒组表达量没有明显差异。结果提示干扰TIPE3表达可能降低PDK1、AKT磷酸化,进而抑制磷脂酰肌醇信号通路,使结肠癌细胞增殖减少。同时细胞增殖状态的PCNA蛋白减少明显,进一步证实了结肠癌细胞生长受到抑制(图9B)。
3 讨论
超过50%的人类肿瘤细胞有异常的磷脂酰肌醇信号活化,虽然一大部分原因可以由PTEN、Ras或者PI3KCA的突变做出解释[9,10],但肯定存在其他的机制上调了该信号的活化。TIPE3作为磷脂酰肌醇转运蛋白,可以使肿瘤细胞中的磷脂酰肌醇信号的异常活跃,能够直接调节Ptdlns(3,4,5)P3、Ptdlns(4,5)P2的含量,阐述了另外一种肿瘤发生、发展的机制,可为肿瘤治疗提出了新的靶点。但现在对TIPE3的研究成果很少,PubMed中针对TIPE3的试验研究有且只有2篇。TIPE3对肿瘤的增殖、迁移、侵袭的机制有待进一步探讨,为了更好地研究其对肿瘤细胞的影响,我们构建了TIPE3-shRNA-pSIREN-RetroQ干扰质粒。
shRNA是常被用于沉默靶基因的短发夹RNA序列[11],有与内源性mRNA一致的两个短反向重复序列,是RNA干扰的靶点。我们成功构建了质粒TIPE3-shRNA1-pSIREN-RetroQ、TIPE3-shRNA2-pSIREN-RetroQ和TIPE3-shRNA3-pSIREN-RetroQ。由于载体不具有绿色荧光标记,我们用具有GFP标签的GFP-pSIREN-RetroQ质粒作为判断转染效率的标准。我们通过RT-PCR、Western blot筛选发现,TIPE3-shRNA2和TIPE3-shRNA3都可以干扰TIPE3的表达,而TIPE3-shRNA3质粒具有最佳的干扰效率,可以显著降低TIPE3在细胞中的表达。所以,我们将应用TIPE3-shRNA3质粒干扰TIPE3在SW480中的表达来探讨TIPE3对结肠癌细胞生长的影响。
我们通过CCK-8检测发现,在24 h与48 h的时间点,与正常细胞相比,空载组的细胞存活率达到90%;转染了不同干扰序列的细胞组与正常细胞组及空载组相比差异显著,差异具有统计学意义(P<0.05)。经RT-PCR、Western blot验证转染48 h的细胞存活率与24 h相比差异明显。以上结果表明干扰TIPE3表达具有抑制肿瘤细胞生存的作用。文献报道TIPE3促进肿瘤细胞的生长[5]。我们的实验结果与文献报道TIPE3在肿瘤生长方面起正向调控作用相符。干扰该基因表达,肿瘤生存受到抑制。
肿瘤的生长、存活与肿瘤凋亡、肿瘤增殖密不可分。为了验证干扰TIPE3表达,降低肿瘤生存率是通过促进肿瘤凋亡还是抑制肿瘤增殖发挥作用,我们选择具有干扰效果最强的TIPE3-shRNA3质粒转染的细胞,并进行流式细胞术检测。结果发现终浓度150 μg/ml 的aDR5ScFv作用6 h,干扰组细胞的凋亡率增加明显,与正常细胞和空载组细胞相比差异显著。Western blot结果显示,干扰组中caspase3活化增强。caspase家族参与的细胞凋亡信号转导,其中caspase3是主要的凋亡执行者[12]。干扰TIPE3在SW480细胞中的表达可以增强SW480细胞对aDR5ScFv诱导的凋亡敏感性,并且,干扰TIPE3表达可以通过激活caspase通路增加SW480细胞的凋亡。
众所周知,PDK1/AKT通路作为磷脂酰肌醇信号转导中的重要节点,调节细胞生长、增殖、分化、迁移等[13,14]。Western blot结果证实干扰TIPE3表达可以抑制AKT、PDK磷酸化、降低磷脂酰肌醇信号转导,减少肿瘤细胞增殖。PCNA作为细胞增殖蛋白,在结肠癌分期、预后判断具有重要意义[15],PCNA蛋白表达下调,表明细胞增殖受到抑制,我们的结果进一步证明干扰TIPE3表达抑制SW480细胞增殖。
综上所述,TIPE3对调控肿瘤生长具有重要作用,主要通过影响肿瘤细胞增殖、凋亡发挥效果。干扰其表达为以后临床分子靶向治疗提供新的思路。
[1] Freundt EC,Bidere N,Lenardo MJ.A different TIPE of immune homeostasis[J].Cell,2008,133(3):401-402.
[2] Sun H,Gong S,Carmody RJ,etal.TIPE2,a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J].Cell,2008,133(3):415-426.
[3] Zhang X,Wang J,Fan C,etal.Crystal structure of TIPE2 provides insights into immune homeostasis[J].Nat Struct Mol Biol,2009,16(1):89-90.
[4] Fayngerts SA,Wu J,Oxley CL,etal.TIPE3 is the transfer protein of lipid second messengers that promote cancer[J].Cancer Cell,2014,26(4):465-478.
[5] Moniz LS,Vanhaesebroeck B.A new TIPE of phosphoinositide regulator in cancer[J].Cancer Cell,2014,26(4):443-444.
[6] Cui J,Hao C,Zhang W,etal.Identical expression profiling of human and murine TIPE3 protein reveals links to its functions[J].J Histochem Cytochem,2015,63(3):206-216.
[7] 孟庆宇,程小峰,张佳锴,等.抗人DR5单链抗体诱导HepG2细胞凋亡的实验研究[J].免疫学杂志,2010,26(7):585-593.
[8] 孟庆宇,程晓峰,张佳锴,等.抗人死亡受体5单链抗体ZF1对鼠H22肝癌细胞的作用分析[J].中国免疫学杂志,2010,26(9):801-809.
[9] Yuan TL,Cantley LC.PI3K pathway alterations in cancer:variations on a theme[J].Oncogene,2008,27(41):5497-5510.
[10] Vivanco I,Sawyers CL.The phosphatidylinositol 3-kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489-501.
[11] Paddison PJ,Caudy AA,Bernstein E,etal.Short hairpin RNAs(shRNAs)induce sequence-specific silencing in mammalian cells[J].Genes Dev,2002,16(8):948-958.
[12] Porter AG,Janicke RU.Emerging roles of caspase-3 in apoptosis[J].Cell Death Differ,1999,6(2):99-104.
[13] Itoh N,Semba S,Ito M,etal.Phosphorylation of Akt/PKB is required for suppression of cancer cell apoptosis and tumor progression in human colorectal carcinoma[J].Cancer,2002,94(12):3127-3134.
[14] Lee SH,Kim HS,Park WS,etal.Non-small cell lung cancers frequently express phosphorylated Akt;an immunohistochemical study[J].APMIS,2002,110(7-8):587-592.
[15] al-Sheneber IF,Shibata HR,Sampalis J,etal.Prognostic significance of proliferating cell nuclear antigen expression in colorectal cancer[J].Cancer,1993,71(6):1954-1959.
[收稿2016-10-19 修回2016-12-27]
(编辑 张晓舟)
Effect and mechanism of TIPE3 interference plasmid on SW480 colorectal cancer growth
YEYu-Han,LIUZhong-Chen,QIZhong-Quan,ZHUANGGuo-Hong,YINPing.
TheSchoolofBasicMedicalSciences,FujianMedicalUniversity,Fuzhou350004,China
Objective:To study the effect of interference TIPE3 on the colon cancer cell growth by transfecting SW480 colon cancer cells with the TIPE3 interference plasmid were detected.Methods: Transfecting the constructed TIPE3-shRNA-pSIREN-RetroQ plasmid to SW480 cells.To determine the highest interference efficiency plasmid,the mRNA and protein levels of recombined plasmid were detected by RT-PCR and Western blot separately and tested the cell proliferation with CCK8.Meanwhile,apoptosis rate of SW480 cells was determined by flow cytometry assay with AnnexinV-FITC/PI.To further determined the effects of recombined plasmid on cell development,the level of protein involved in proliferation and apoptosis were detected by Western blot.Results: The most effecient interference plasmids were successfully constructed.We found that the cell survival rate decreased when interference TIPE3 gene expressing in colorectal cancer cells.Flow cytometry indicated that interefering the expression of TIPE3 would increase the sensitivity of SW480 cell to apoptosis induced by aDR5ScFv.The results of Western blot showed that low expression of TIPE3 would activate caspase3 and downregulate the expression of p-AKT,p-PDK1 and PCNA.Conclusion: Interference TIPE3 could promote apoptosis and inhibit proliferation in SW480 colon cancer cells.
TIPE3 shRNA;Colon cancer;Apoptosis;Proliferation
10.3969/j.issn.1000-484X.2017.03.013
①本文为国家自然科学基金(81272720)和福建省属公益类科研院所基本科研专项项目(2016R1102)资助。
叶宇涵(1991年-),女,在读硕士,主要从事结肠癌分子病理学研究,E-mail:yeyuhan2688@hotmail.com。
及指导教师:庄国洪(1969年-),女,博士,副教授,主要从事肿瘤免疫研究,E-mail:zghxmu@163.com。 殷 平(1963年-),男,博士,教授,主要从事炎症及肿瘤分子病理学研究,E-mail:yinping2002@163.com。
R735.3
A
1000-484X(2017)03-0378-06
②共同第一作者。
③同济大学第十人民医院普通外科,上海200072。
④厦门大学抗癌研究中心,器官移植研究所,厦门361004
⑤厦门大学附属中山医院病理科,厦门361004。
——一道江苏高考题的奥秘解读和拓展

