抗PD-1/PD-L1免疫治疗:筛选患者的生物标记物研究进展①
王巧红 吴 霞
(上海交通大学医学院附属仁济医院妇产科,上海200127)
抗PD-1/PD-L1免疫治疗:筛选患者的生物标记物研究进展①
王巧红 吴 霞
(上海交通大学医学院附属仁济医院妇产科,上海200127)
肿瘤细胞可以通过抑制细胞凋亡、促进血管生长、避免免疫识别和基因突变等手段获得几乎无限的生长复制能力。目前大多数早期肿瘤通过彻底手术能获得较好的预后,但对于晚期肿瘤手术联合后化疗依然无法显著降低患者死亡率,因此急需探寻更有效的联合治疗方案,如化疗联合免疫治疗或靶向治疗。免疫治疗一直是被寄予希望的治疗方法,2012年新英格兰医学杂志报道了抗程序性死亡蛋白1(Programmed death protein-1,PD-1)、程序性死亡配体1(Programmed cell death-ligand 1,PD-L1)抗体在晚期肿瘤患者中获得了持久的肿瘤消退及疾病稳定期,这两个里程碑式的临床试验使肿瘤免疫治疗进入了一个新时代[1,2]。美国《科学》杂志将癌症免疫治疗列为2013年最重大的科学突破之一,这预示着免疫治疗在恶性肿瘤治疗领域的广阔前景。迄今多个临床试验已经证实了抗PD-1/PD-L1药物在晚期黑色素瘤、非小细胞肺癌(Non-small-cell lung cancer,NSCLC)及包括膀胱癌、肾细胞癌(Renal cell carcinoma,RCC)、霍奇金淋巴瘤、卵巢癌等恶性肿瘤中的客观临床作用。然而并非所有肿瘤患者都能从抗PD-1/PD-L1免疫治疗中获益,筛选最可能从治疗中获益的患者以提高疗效,剔除不能获益的患者免于免疫治疗相关不良反应(immune-related adverse events,irAEs)的伤害成为共识。免疫治疗已成为当今肿瘤治疗不可或缺的一环,因而确定筛选患者生物标记物成了当务之急。本文就有关抗PD-1/PD-L1免疫治疗筛选患者的生物标记物研究进展作一综述。
1 免疫检查点
肿瘤细胞由于其单克隆性以及表观遗传学的改变,能被正常的免疫系统识别其独特抗原,从而引起抗肿瘤免疫应答,清除肿瘤细胞或控制其生长速度。T细胞是机体抗肿瘤免疫的核心执行者。T细胞的活化不但需要抗原提呈细胞(Antigen-presenting cells,APCs)提供的第一信号刺激,同时还需要协同刺激分子提供的第二信号刺激。协同刺激分子不但提供增强免疫的共刺激信号,而且还提供抑制免疫的共抑制信号,以达到调节免疫的作用,这些免疫抑制信号即为免疫检查点。在正常机体中,免疫检查点一方面维持对自身抗原的免疫耐受,避免过强的免疫反应造成自身免疫疾病;另一方面负反馈免疫应答,避免过度刺激造成的组织损伤[3]。目前已知的免疫检查点包括:PD-1/PD-L1/PD-L2、细胞毒T淋巴细胞相关抗原4(Cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)/CD80/CD86和T细胞受体(T-cell receptor,TCR)/淋巴细胞活化基因3(Lymphocyte activation gene 3,LAG3)[3]。
经典理论认为T细胞的活化需要双信号,第一信号由APCs上的MHC-Ag复合体与TCR特异性结合传递,APCs表达的共刺激分子与TCR的结合提供了第二信号。随着对免疫分子生物学研究的深入,发现在T细胞表面存在众多的共刺激分子和共抑制分子,共同精确调控T细胞的活化[4]。PD-1/PD-L1作为共抑制分子发挥重要的负性调节作用。当T细胞表面的PD-1与PD-L1结合后,T细胞胞质区的免疫受体酪氨酸转换基序(Immunoreceptor tyrosine-based switch motif,ITSM)的酪氨酸磷酸化,然后磷酸化的酪氨酸招募下游的蛋白酪氨酸磷酸酶2(Protein tyrosine phosphatase 2,PTP-2)后,不仅能抑制细胞外调节激酶的活化,还可以去激活磷脂酰肌醇3-激酶(Phosphatidylinositol 3-hydroxy kinase,PI3K)和丝氨酸-苏氨酸蛋白激酶(Serine/threonine kinase,AKT),从而抑制T淋巴细胞的增殖和IL-2、IL-10和IFN-γ的分泌[5]。
2 抗PD-1/PD-L1免疫治疗临床试验
目前的免疫检查点阻断治疗,通过抑制CTLA-4或PD-1/PD-L1途径,旨在恢复并促进效应T细胞特异性识别和杀伤肿瘤细胞的功能。不同于化疗和分子靶向疗法,免疫检查点阻断治疗通过对肿瘤特异性T细胞的诱导、活化和增殖,能系统性地增强全身的抗肿瘤免疫反应,产生持久的临床疗效。如抑制CTLA-4途径是晚期黑色素瘤的有效治疗方法,可带来总生存期(Overall survival,OS)的获益[6]。2011年,美国FDA批准了抗CTLA-4药物Ipilimumab用于晚期黑色素瘤的治疗。
近年来抗PD-1/PD-L1的药物研究发现,较之CTLA-4单抗,抑制PD-1/PD-L1途径可能是更强有力的抗肿瘤治疗方法。2014年,美国FDA批准第一代抗PD-1抗体 Pembrolizumab和Nivolumab用于晚期黑色素瘤。2015年,它们又获准用于NSCLC的二线治疗。越来越多关于抗PD-1/PD-L1免疫治疗的临床试验正在开展中,表1、表2总结了目前相关的临床试验,从中可见抗PD-1/PD-L1治疗在多种肿瘤的显著疗效。根据一项免疫治疗市场的预测性项目,2013-2020年这一时期免疫抑制剂市场将经历相当大的增长,从2013年大约十亿美元增加到2020年超过70亿美元(年增长率33%),涵盖美国、法国、德国、意大利、西班牙、英国和日本这七个主要市场。预计到2022年抗PD-1/PD-L1药物将占有72%的市场最高份额[7]。
表1 抗PD-1药物临床试验
Tab.1 Clinical trials of anti-PD-1 agents
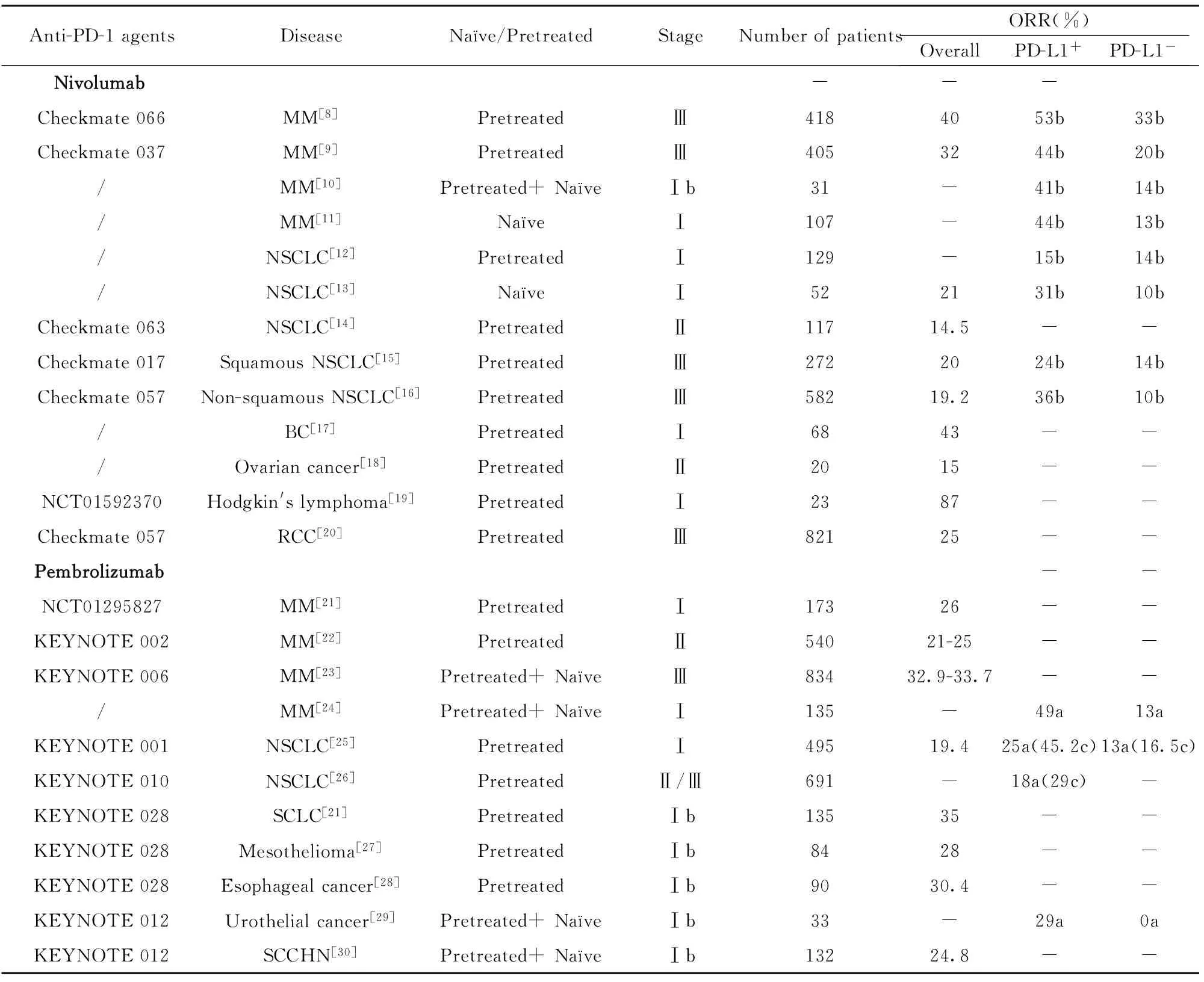
Anti-PD-1agentsDiseaseNaïve/PretreatedStageNumberofpatientsORR(%)OverallPD-L1+PD-L1-Nivolumab---Checkmate066MM[8]PretreatedⅢ4184053b33bCheckmate037MM[9]PretreatedⅢ4053244b20b/MM[10]Pretreated+NaïveⅠb31-41b14b/MM[11]NaïveⅠ107-44b13b/NSCLC[12]PretreatedⅠ129-15b14b/NSCLC[13]NaïveⅠ522131b10bCheckmate063NSCLC[14]PretreatedⅡ11714.5--Checkmate017SquamousNSCLC[15]PretreatedⅢ2722024b14bCheckmate057Non-squamousNSCLC[16]PretreatedⅢ58219.236b10b/BC[17]PretreatedⅠ6843--/Ovariancancer[18]PretreatedⅡ2015--NCT01592370Hodgkin'slymphoma[19]PretreatedⅠ2387--Checkmate057RCC[20]PretreatedⅢ82125--Pembrolizumab--NCT01295827MM[21]PretreatedⅠ17326--KEYNOTE002MM[22]PretreatedⅡ54021-25--KEYNOTE006MM[23]Pretreated+NaïveⅢ83432.9-33.7--/MM[24]Pretreated+NaïveⅠ135-49a13aKEYNOTE001NSCLC[25]PretreatedⅠ49519.425a(45.2c)13a(16.5c)KEYNOTE010NSCLC[26]PretreatedⅡ/Ⅲ691-18a(29c)-KEYNOTE028SCLC[21]PretreatedⅠb13535--KEYNOTE028Mesothelioma[27]PretreatedⅠb8428--KEYNOTE028Esophagealcancer[28]PretreatedⅠb9030.4--KEYNOTE012Urothelialcancer[29]Pretreated+NaïveⅠb33-29a0aKEYNOTE012SCCHN[30]Pretreated+NaïveⅠb13224.8--
Note:Naïve/Pretreated:Pre-treatment including chemotherapy and anti-CTLA-4 therapy;Cut off:Which defines the positive status of PD-L1.a.PD-L1 cut off 1%;b.PD-L1 cut off 5%;c.PD-L1 cut off 50%.MM.Metastatic melanoma;SCLC.Small cell lung cancer;BC.Bladder carcinoma;SCCHN.Squamous cell carcinoma of the head and neck.
表2 抗PD-L1药物临床试验
Tab.2 Clinical trials of anti-PD-L1 agents

Anti-PD-L1agentsDiseaseNaïve/PretreatedStageNumberofpatientsORR(%)OverallPD-L1+PD-L1-Atezolizumab/MM[31]PretreatedⅠ45262720/NCSLC[32]PretreatedⅠ8821--/NSCLC[33]PretreatedⅡ287---/mRCC[34]PretreatedⅠ6915--NCT01375842mRCC[35]PretreatedⅠa70-20a10a/UBC[17]PretreatedⅠ67-52b14bDurvalumab/NSCLC[36]PretreatedⅠ/Ⅱ198-39-/SCCHN[37]PretreatedⅠ2014--/SCCHN[38]PretreatedⅠ50-506
Note:Naïve/Pretreated.Pre-treatment including chemotherapy and anti-CTLA-4 therapy;Cut off.Which defines the positive status of PD-L1.a.PD-L1 cut off 1%;b.PD-L1 cut off 5%.MM.Metastatic melanoma;mRCC.metastatic renal cell carcinoma;UBC.Urothelial bladder carcinoma;SCCHN.Squamous cell carcinoma of the head and neck.
3 抗PD-1/PD-L1免疫治疗中筛选患者的生物标记物
3.1 肿瘤组织PD-L1表达 正常组织极少表达PD-L1,而多种肿瘤细胞如肺癌、恶性脑瘤、黑色素瘤、胃癌及胰腺癌细胞高表达PD-L1,此外肿瘤微环境中的髓系细胞也可表达PD-L1[39]。有研究报道在不同肿瘤类型中,肿瘤组织PD-L1的表达与患者的临床应答间存在紧密联系[40,41]。因此关于肿瘤组织PD-L1的表达对于临床疗效的预测性及其作为生物标记物筛选患者的可行性受到了广泛关注。
在CA209-003试验中,肿瘤细胞PD-L1表达与患者治疗反应间的关系最先明确化。在45例黑色素瘤、NSCLC和RCC患者中,25例为PD-L1阳性,21例为PD-L1阴性,治疗缓解情况出现在9例(36%)阳性患者中,而阴性患者中没有出现。在这一试验中,试验者运用鼠源抗人PD-L1单抗5H1对肿瘤细胞进行免疫组化(Immunohistochemistry,IHC)染色,并且界定IHC染色≥5%的患者为PD-L1表达阳性[42]。因此起初认为肿瘤组织PD-L1表达可作为筛选患者的预测因子,但随着研究的深入有许多问题出现,首先是抗体的选择。PD-L1表达的检测多通过IHC方法,那么一个能够检测经福尔马林固定和石蜡包埋的组织样本中分子的合适单抗是十分重要的。当前各临床试验应用的单抗主要有以下四种:鼠源单抗5H1、兔源单抗28-8、鼠源单抗22C3及SP142。其中22C3抗体已获FDA批准,被作为用于筛选接受Pembrolizumab治疗的NSCLC患者的伴随诊断方式[43]。目前供应的抗体都需要繁琐且不可靠的抗原修复程序,而且不同试验者运用的抗体往往各不相同,很难界定它们的优劣。
确定PD-L1表达阳性的最佳界限值是面临的又一挑战。一个良好的界限值既有助于确认更多对治疗有反应的患者,同时在阳性和阴性患者间应存在显著差异。起初,常选择IHC染色≥5%作为阳性。根据一些研究的反馈,这一界限值似乎是合理的。例如,在CA209-016试验中,在接受Nivolumab和Ipilimumab联合治疗的RCC患者中,在以1%作为界限值时,PD-L1阳性组和阴性组的客观缓解率(Objective response rate,ORR)没有差异(50% vs 55%);当界限值变为5%时,两者间出现显著差异(56% vs 25%)[44]。同样在接受Nivolumab治疗的转移性黑色素瘤患者中,以5%作为界限值,确认了更多缓解患者(ORR为44% vs 13%),而当界限值为1%时,阳性组和阴性组的差异变小(ORR为35% vs 13%)[11]。然而在另一些研究中,以1%作为界限值同样在PD-L1表达阳性和阴性的患者间显示了显著差异。在KEYNOTE-010试验中,接受Pembrolizumab治疗的晚期黑色素瘤患者中,以1%作为界限值具有显著差异。该研究也用10%作为界限值进行分析,发现其对于缓解患者的确认没有优势[45]。另外,在接受Pembrolizumab治疗的NSCLC患者中,以1%作为界限值,ORR在PD-L1阳性组、阴性组分别为25%、13%;随后以50%作为界限值区分亚群,结果显示这部分患者的ORR进一步改善(45.2%)[25]。这些结果指示单一界限值对于数据分析而言过于狭隘,因而临床试验不能依靠单一界限值,而是需要根据不同肿瘤类型与治疗方式选择不同的界限值进行分析。
关于PD-L1检测需要涵括的细胞类型亦有争议。在肿瘤微环境中,除肿瘤细胞外免疫浸润细胞、基质细胞表面同样表达PD-L1。目前多数研究仅评估了肿瘤细胞表面的PD-L1表达,而事实上免疫浸润细胞表面的PD-L1表达可能同样重要[46]。免疫浸润细胞与ORR间同样存在联系。在接受Atezolizumab治疗的实体瘤患者中,发现患者对Atezolizumab反应和肿瘤免疫浸润细胞的PD-L1表达存在显著关联,而其与肿瘤细胞的PD-L1表达无显著相关[47]。此外,样本大小、样本收集和进行IHC的时间对于检测PD-L1的表达都有可能存在不容忽视的影响,因而也都成了PD-L1表达作为潜在生物标记物的阻力。
抗PD-1/PD-L1治疗有效并非仅限于PD-L1表达阳性的患者,部分PD-L1表达阴性的患者也能从治疗中获益,这一发现使得PD-L1表达作为生物标记物来筛选患者潜在的可能性受到质疑。PD-L1的表达并非一成不变,而是动态变化的,化疗、放疗等都能影响肿瘤组织PD-L1的表达[48-50]。因此应用抗PD-1/PD-L1作为二线治疗时,肿瘤组织PD-L1的表达水平与患者未经治疗时PD-L1的表达水平并不一致。如部分患者在未经治疗前肿瘤样本PD-L1表达为阴性,当抗PD-1/PD-L1药物作为二线或其他治疗时,患者的缓解率达到了10%~20%[51]。由此具体阐明了PD-L1表达作为生物标记物尚不能准确预测治疗反应的原因。
3.2 肿瘤组织PD-L1表达与肿瘤浸润淋巴细胞 肿瘤组织PD-L1表达尚不能作为筛选患者的理想生物标记物,PD-L1表达联合肿瘤浸润淋巴细胞(Tumor infiltrating lymphocyte,TILs)有望更有效地将患者分类,并筛选出最有可能从治疗中获益的患者。肿瘤组织PD-L1的表达可能分为诱导表达和固有表达两种。TILs分泌的IFN-γ等细胞因子能够诱导肿瘤细胞表达PD-L1[52,53]。PD-L1的诱导表达很有可能是肿瘤对免疫攻击的适应性免疫抵抗,从而成为肿瘤的逃逸机制[54,55]。另有部分PD-L1的表达与TILs或IFN-γ都没有关系,这种类型的PD-L1表达被认为是致癌基因信号通路介导的固有表达,即肿瘤对免疫系统的固有抵抗[56]。Tumeh等[57]认为肿瘤侵袭边缘的CD8+TILs与PD-1/PD-L1免疫抑制轴的表达有关。研究人员建立了基于肿瘤边缘CD8+T细胞的预测性模型,并且证明在PD-1/PD-L1通路被抑制后,肿瘤衰退需要原先存在的、被PD-1/PD-L1负调控的CD8+T细胞。治疗前PD-L1的表达与临床结局相关,但是肿瘤边缘初始CD8+T细胞的密度对于抗PD-1/PD-L1治疗反应更有预测性。
近来有学者提出基于T细胞浸润及PD-L1表达水平不同的肿瘤免疫分型学说[58]。Ⅰ型为肿瘤组织PD-L1+TILs+,提示肿瘤组织内一度存在活跃的抗肿瘤免疫应答,但之后因癌细胞产生适应性免疫抵抗而阻断了免疫应答;Ⅱ型为PD-L1-TILs-,提示为免疫忽视;Ⅲ型为PD-L1+TILs-,提示PD-L1为固有表达;Ⅳ型为PD-L1-TILs+,提示可能存在其他途径诱导了免疫耐受。基因突变、癌驱动基因及组织起源的不同,使得不同肿瘤的免疫分型构成比不同。恶性黑色素瘤中Ⅰ型、Ⅱ型占比分别约为38%、41%。而在NSCLC中驱动肿瘤细胞PD-L1表达的主要因素是癌基因,因此NSCLC中Ⅲ型肿瘤的占比较高。针对不同免疫类型的肿瘤患者,需要根据个性化治疗的原则选择适合患者本身的治疗方式。
在Ⅰ型患者中,由于肿瘤组织PD-L1主要由TILs诱导表达,而TILs功能又因PD-1/PD-L1受到抑制,因而理论上这部分患者最有可能从抗PD-1/PD-L1治疗中获益[59]。尽管Ⅰ型患者是最适合单一抗PD-1/PD-L1治疗的群体,但不同肿瘤类型的Ⅰ型患者的获益情况仍然是未知的,单一抗PD-1/PD-L1在这类患者中是否能达到预期疗效仍然需要长期评估。此外肿瘤中TILs的存在还需要考虑它的密度、位置及其与PD-L1阳性表达的肿瘤微环境间的相互作用[57]。只有具有充足TILs并诱导PD-L1适应性表达的肿瘤患者才最可能从抗PD-1/PD-L1治疗中获益。因此定量评估肿瘤内TILs和PD-L1表达十分重要[60]。
抗PD-1/PD-L1治疗并不仅限于Ⅰ型患者,通过联合治疗其他类型患者仍然可能从中获益。Ⅱ型患者既缺乏PD-L1表达又没有TILs支持,由于缺乏免疫反应这类患者的预后往往不容乐观。对于单一抗PD-1/PD-L1治疗可能无效的患者,补充肿瘤内T细胞并防止其失活是一新策略。联合治疗如抗CTLA-4联合抗PD-1/PD-L1的疗效已在多项临床试验中得到验证。化疗联合抗PD-1/PD-L1治疗也不失为一个良好选择。化疗能够使肿瘤抗原释放,从而刺激肿瘤效应T细胞的产生[61]。此外,联合肿瘤疫苗、过继转输特异性T细胞等治疗方法也都能补充肿瘤内T细胞使患者获益。
在Ⅲ型患者中,PD-L1表达阳性但缺乏TILs支持,这类患者肿瘤组织PD-L1是由致癌基因信号通路介导的固有表达。这一群体证实肿瘤组织PD-L1的表达确实不能作为预测疗效的独立预测因子。由于肿瘤中TILs缺失,不太可能在抗PD-1/PD-L1治疗后引起后续T细胞反应[58]。因而,这部分患者同样需要联合其他免疫治疗补充肿瘤内T细胞(同Ⅱ型患者)。另外,联合靶向抑制致癌基因信号通路的治疗已证实了不错的治疗反应[62,63]。
对于Ⅳ型患者,仅有TILs支持但缺乏PD-L1表达,提示存在其他免疫抑制途径造成这一免疫耐受状态[61]。因而抗PD-1/PD-L1治疗可能缺乏针对性,靶向其他免疫抑制途径的治疗可能有益于这类患者。尽管目前尚无明确报告,但相关研究已在开展中。
3.3 肿瘤微卫星不稳定 微卫星又称“短串联重复序列”,单位长度为1-6bp,遍布人类基因的编码和非编码区域。DNA聚合酶在这些区域易于发生错误,合成链移动时碱基的插入或缺失以及模板链的滑动常导致DNA不匹配。随着DNA复制的进行,DNA错配修复(Mismatch repair,MMR)系统识别并校正突变基因。当MMR缺陷时,即出现微卫星不稳定(Microsatellite instability,MSI)。目前认为MSI与肿瘤的发生密切相关。
2015年Le等[64]在新英格兰杂志报道了传统治疗失败的MSI患者对抗PD-1/PD-L1治疗出现应答,这给生物标记物的研究带来了新的方向。该研究纳入了化疗无效的Ⅳ期患者,包括11例MMR缺陷的结直肠癌(Colorectal cancer,CRC),21例无MMR缺陷的CRC和9例MMR缺陷的非CRC(其中4例胆管癌、2例食管癌、2例小肠癌和1例胃癌),应用Pembrolizumab治疗后MMR缺陷CRC组、MMR缺陷非CRC组和无MMR缺陷CRC组ORR分别为40%、71%和0%;同样PFS分别为78%,67%和11%[64]。由此提示MSI水平可作为抗PD-1/PD-L1治疗的疗效预测标记物。CheckMate 142的试验结果同样支持Le等的发现。在MSI-H(高度微卫星不稳定) CRC患者中,Nivolumab联合或不联合Ipilimumab治疗的部分缓解(Partial response,PR)率分别为33.3%(9/27)和25.5%(12/47),而在微卫星稳定(Microsatellite stability,MSS)CRC组,Nivolumab联合Ipilimumab治疗PR仅为5%[65]。
MSI-H CRC中免疫反应相关基因大量上调,包括抗原伴侣分子、促炎性细胞因子和细胞毒性介质等,这提示MSI-H肿瘤具有强免疫原性[66]。Llosa等[67]通过对CRC标本的遗传学和免疫微环境分析,证实MMR缺陷肿瘤具有MSI,并且提出这些突变增加的肿瘤给免疫反应创造了新的抗原表位。换而言之即增强了肿瘤的免疫原性。Le等[64]对肿瘤组织的全外显子测序显示MSI肿瘤中平均有1 782个体细胞突变,其中预计有578个能产生新抗原;而非MSI肿瘤中仅有73个体细胞突变,预计能产生新抗原的仅21个。综上可见MSI-H肿瘤的强免疫原性可能是抗PD-1/PD-L1治疗有效率较高的内在原因。
目前已有部分实验室常规开展基于PCR的MSI检测和免疫组化的MMR表达缺失,如果MSI水平能够作为免疫检查点阻断治疗筛选患者的生物标记物,将极大增加传统治疗无效患者的获益,免疫治疗将成为他们潜在的有效治疗手段。然而目前MSI水平作为生物标记物的相关证据仍然有限,已有的临床试验样本例数过小,期待有大样本临床试验数据的支持。
4 展望
肿瘤免疫治疗已成为当今肿瘤治疗不可或缺的一环。在抗PD-1/PD-L1免疫治疗中,筛选能从治疗中获益的患者,剔除不能获益的患者免于irAEs的伤害成为大家的共识。肿瘤组织PD-L1表达尚不能作为筛选患者的理想生物标记物,PD-L1表达联合TILs能更有效地将患者分类,并筛选出最有可能从治疗中获益的患者。肿瘤微卫星不稳定水平作为筛选患者的生物标记物也有极大潜能。当下面临的主要问题是急需制定标准化的定量分析方法来准确检测肿瘤组织PD-L1表达和TILs;同时也需要更多大样本临床研究证实肿瘤MSI水平预测的有效性。相信在不久的将来,随着实验技术的发展,对各类细胞特征及肿瘤微环境信息的进一步了解,越来越多研究数据的支持,这些问题都能随之解决,免疫检查点阻断治疗也将取得更多新进展,造福更多的肿瘤患者。
[1] Brahmer JR,Tykodi SS,Chow LQ,etal.Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J].N Engl J Med,2012,366(26):2455-2465.
[2] Topalian SL,Hodi FS,Brahmer JR,etal.Safety,activity,and immune correlates of anti-PD-1 antibody in cancer[J].N Engl J Med,2012,366(26):2443-2454.
[3] Patel SP,Osada T,Osada K,etal.Modulation of immune system inhibitory checkpoints in colorectal cancer[J].Curr Colorectal Cancer Rep,2013,9(4):391-397.
[4] Yao S,Zhu Y,Chen L.Advances in targeting cell surface signalling molecules for immune modulation[J].Nat Rev Drug Discov,2013,12(2):130-146.
[5] Carter L,Fouser LA,Jussif J,etal.PD-1:PD-L inhibitory pathway affects both CD4(+)and CD8(+)T cells and is overcome by IL-2[J].Eur J Immunol,2002,32(3):634-643.
[6] Hodi FS,O′Day SJ,McDermott DF,etal.Improved survival with ipilimumab in patients with metastatic melanoma[J].N Engl J Med,2010,363(8):711-723.
[7] Webster RM.The immune checkpoint inhibitors:where are we now?[J].Nat Rev Drug Discov,2014,13(12):883-884.
[8] Robert C,Long GV,Brady B,etal.Nivolumab in previously untreated melanoma without BRAF mutation[J].N Engl J Med,2015,372(4):320-330.
[9] Weber JS,D′Angelo SP, Minor D,etal.Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment(CheckMate 037):a randomised,controlled,open-label,phase 3 trial[J].Lancet Oncol,2015,16(4):375-384.
[10] Grosso J,Horak CE,Inzunza D,etal.Association of tumor PD-L1 expression and immune biomarkers with clinical activity in patients(pts)with advanced solid tumors treated with nivolumab(anti-PD-1;BMS-936558;ONO-4538)[J].Clin Oncol,2013,31(15_suppl):3016.
[11] Hodi FS,Sznol M,Kluger HM,etal.Long-term survival of ipilimumab-naive patients(pts)with advanced melanoma(MEL)treated with nivolumab(anti-PD-1,BMS-936558,ONO-4538)in a phase I trial[J].Clin Oncol,2014,32(suppl):5s(abstr 9002).
[12] Gettinger SN,Horn L,Gandhi L,etal.Overall survival and long-term safety of nivolumab(anti-programmed death 1 antibody,BMS-936558,ONO-4538)in patients with previously treated advanced non-small-cell lung cancer[J].Clin Oncol,2015,33(18):2004-2012.
[13] Gettinger SN,Hellmann MD,Shepherd FA,etal.First-line monotherapy with nivolumab(NIVO)in advanced non-small cell lung cancer(NSCLC):Safety,efficacy,and biomarker analysis[J].Clin Oncol,2015,33(suppl):abstr8025.
[14] Rizvi NA,Mazieres J,Planchard D,etal.Activity and safety of nivolumab,an anti-PD-1 immune checkpoint inhibitor,for patients with advanced,refractory squamous non-small-cell lung cancer(CheckMate 063):a phase 2,single-arm trial[J].Lancet Oncol,2015,16(3):257-265.
[15] Brahmer J,Reckamp KL,Baas P,etal.Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J].N Engl J Med,2015,373(2):123-135.
[16] Borghaei H,Paz-Ares L,Horn L,etal.Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J].N Engl J Med,2015,373(17):1627-1639.
[17] Powles T,Eder JP,Fine GD,etal.MPDL3280A(anti-PD-L1)treatment leads to clinical activity in metastatic bladder cancer[J].Nature,2014,515(7528):558-562.
[18] Hamanishi J,Mandai M,Ikeda T,etal.Durable tumor remission in patients with platinum-resistant ovarian cancer receiving nivolumab[J].Clin Oncol,2015,33(15_suppl):5570.
[19] Ansell SM,Lesokhin AM,Borrello I,etal.PD-1 blockade with nivolumab in relapsed or refractory Hodgkin′s lymphoma[J].N Engl J Med,2015,372(4):311-319.
[20] Motzer RJ,Escudier B,McDermott DF,etal.Nivolumab versus everolimus in advanced renal-cell carcinoma[J].N Engl J Med,2015,373(19):1803-1813.
[21] Robert C,Ribas A,Wolchok JD,etal.Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma:a randomised dose-comparison cohort of a phase 1 trial[J].Lancet,2014,384(9948):1109-1117.
[22] Ribas A,Puzanov I,Dummer R,etal.Pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory melanoma(KEYNOTE-002):a randomised,controlled,phase 2 trial[J].Lancet Oncol,2015,16(8):908-918.
[23] Robert C,Schachter J,Long GV,etal.Pembrolizumab versus ipilimumab in advanced melanoma[J].N Engl J Med,2015,372(26):2521-2532.
[24] Kefford R,Ribas A,Hamid O,etal.Clinical efficacy and correlation with tumor PD-L1 expression in patients(pts)with melanoma(MEL)treated with the anti-PD-1 monoclonal antibody MK-3475[J].Clin Oncol,2014,32(suppl):5s(abstr3005).
[25] Garon EB,Rizvi NA,Hui R,etal.Pembrolizumab for the treatment of non-small-cell lung cancer[J].N Engl J Med,2015,372(21):2018-2028.
[26] Herbst RS,Baas P,Kim DW,etal.Pembrolizumab versus docetaxel for previously treated,PD-L1-positive,advanced non-small-cell lung cancer(KEYNOTE-010):a randomised controlled trial[J].Lancet,2016,387(10027):1540-1550.
[27] Alley EW,Molife LR,Santoro A,etal.Abstract CT103:Clinical safety and efficacy of pembrolizumab(MK-3475)in patients with malignant pleural mesothelioma:Preli minary results from KEYNOTE-028[J].Cancer Res,2015,75(15 suppl):CT103.
[28] Doi T,Pihapaul SA,Jalal SI,etal.Pembrolizumab(MK-3475)for patients(pts)with advanced esophageal carcinoma:Preli minary results from KEYNOTE-028[J].Clin Oncol,2015,33(15_suppl):4010.
[29] Plimack ER,Bellmunt J,Gupta S,etal.Pembrolizumab(MK-3475)for advanced urothelial cancer:Updated results and biomarker analysis from KEYNOTE-012[J].Clin Oncol,2015,33(15_suppl):4502.
[30] Seiwert T.Antitumor activity and safety of pembrolizumab in patients(pts)with advanced squamous cell carcinoma of the head and neck(SCCHN):preli minary results from KEYNOTE-012 expansion cohort[J].Clin Oncol,2015,33(15_suppl):LBA6008.
[31] Hamid O,Sosman JA,Lawrence DP,etal.Clinical activity,safety,and biomarkers of MPDL3280A,an engineered PD-L1 antibody in patients with locally advanced or metastatic melanoma(mM)[J].Clin Oncol,2013,31(15_suppl):9010.
[32] Horn L,Spigel DR,Gettinger SN,etal.Clinical activity,safety and predictive biomarkers of the engineered antibody MPDL3280A(anti-PDL1)in non-small cell lung cancer(NSCLC):update from a phase Ia study[J].Clin Oncol,2015,33(15_suppl):8029.
[33] Spira AI,Park K,Mazieres J.Efficacy,safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC(POPLAR)[J].Clin Oncol,2015,33(15_suppl):8010.
[34] McDermott DF,Sznol M,Sosman JA,etal.Immune correlates and long term follow up of a phase Ⅰa study of mpdl3280a,an engineered pd-l1 antibody,in patients with metastatic renal cell carcinoma [J].Ann Oncol,2014,25(suppl 4):280-304.
[35] McDermott DF,Sosman JA,Sznol M,etal.Atezolizumab,an anti-programmed death-ligand 1 antibody,in metastatic renal cell carcinoma:long-term safety,clinical activity,and immune correlates from a phase ia study[J].Clin Oncol,2016,34(8):833-842.
[36] Rizvi NA,Brahmer JR,Ou SHI,etal.Safety and clinical activity of MEDI4736,an anti-programmed cell death-ligand 1(PD-L1)antibody,in patients with non-small cell lung cancer(NSCLC)[J].Clin Oncol,2015,33(15_suppl):8032.
[37] Segal NH,Ou SHI,Balmanoukian AS.Safety and efficacy of MEDI4736,an anti-PD-L1 antibody,in patients from a squamous cell carcinoma of the head and neck(SCCHN)expansion cohort[J].Clin Oncol,2015,33(15_suppl):3011.
[38] Fury M,Ou SI,Balmanoukian A,etal.Clinical activity and safety of medi4736,an anti-pd-l1 antibody,in patients with head and neck cancer [J].Ann Oncol,2014,25(suppl 4):340-356.
[39] Zou W,Chen L.Inhibitory B7-family molecules in the tumour microenvironment[J].Nat Rev Immunol,2008,8(6):467-477.
[40] Topalian SL,Hodi FS,Brahmer JR,etal.Safety,activity,and immune correlates of anti-PD-1 antibody in cancer[J].N Engl J Med,2012,366(26):2443-2454.
[41] Weber JS,Kudchadkar RR,Yu B,etal.Safety,efficacy,and biomarkers of nivolumab with vaccine in ipilimumab-refractory or-naive melanoma[J].Clin Oncol,2013,31(34):4311-4318.
[42] Topalian SL,Sznol M,Brahmer JR.Nivolumab(anti-PD-1;BMS-936558;ONO-4538)in patients with advanced solid tumors:Survival and long-term safety in a phase i trial[J].Clin Oncol,2013,31(15_suppl):3002.
[43] Sul J,Blumenthal GM,Jiang X,etal.FDA approval summary:pembrolizumab for the treatment of patients with metastatic non-small cell lung cancer whose tumors express programmed death-ligand 1[J].Oncologist,2016,21(5):643-650.
[44] Hammers HJ,Plimack ER,Lnfante JR,etal.Expanded cohort results from CheckMate 016:a Phase I study of nivolumab in combination with ipilimumab in metastatic renal cell carcinoma(mRCC)[J].Clin Oncol,2013,31(15_suppl):4516.
[45] Herbst RS,Gordon MS,Fine GD.A study of MPDL3280A,an engineered PD-L1 antibody in patients with locally advanced or metastatic tumors[J].Clin Oncol,2013,31(15_suppl):3000.
[46] Taube JM,Klein A,Brahmer JR,etal.Association of PD-1,PD-1 ligands,and other features of the tumor immune microenvironment with response to anti-PD-1 therapy[J].Clin Cancer Res,2014,20(19):5064-5074.
[47] Herbst RS,Soria JC,Kowanetz M,etal.Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J].Nature,2014,515(7528):563-567.
[48] Formenti SC,Demaria S.Combining radiotherapy and cancer immunotherapy:a paradigm shift[J].Nat Cancer Inst,2013,105(4):256-265.
[49] Ramakrishnan R,Assudani D,Nagaraj S,etal.Chemotherapy enhances tumor cell susceptibility to CTL-mediated killing during cancer immunotherapy in mice[J].Clin Invest,2010,120(4):1111-1124.
[50] Twymansaint VC,Rech AJ,Maity A,etal.Radiation and dual checkpoint blockade activate non-redundant immune mechanisms in cancer[J].Nature,2015,520(7547):373-377.
[51] Kerr KM,Tsao MS,Nicholson AG,etal.Programmed death-ligand 1 immunohistochemistry in lung cancer:in what state is this art?[J].Thorac Oncol,2015,10(7):985-989.
[52] Dong H,Strome SE,Salomao DR,etal.Tumor-associated B7-H1 promotes T-cell apoptosis:a potential mechanism of immune evasion[J].Nat Med,2002,8(8):793-800.
[53] Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-264.
[54] Gowrishankar K,Gunatilake D,Gallagher SJ,etal.Inducible but not constitutive expression of PD-L1 in human melanoma cells is dependent on activation of NF-κB[J].PLoS One,2015,10(4):e0123410.
[55] Guidoboni M,Gafà R,Viel A,etal.Microsatellite instability and high content of activated cytotoxic lymphocytes identify colon cancer patients with a favorable prognosis[J].Am J Pathol,2001,159(1):297-304.
[56] Nosho K,Baba Y,Tanaka N,etal.Tumour-infiltrating T-cell subsets,molecular changes in colorectal cancer,and prognosis:cohort study and literature review[J].J Pathol,2010,222(4):350-366.
[57] Tumeh PC,Harview CL,Yearley JH,etal.PD-1 blockade induces responses by inhibiting adaptive immune resistance[J].Nature,2014,515(7528):568-571.
[58] Teng MW,Ngiow SF,Ribas A,etal.Classifying cancers based on T-cell infiltration and PD-L1[J].Cancer Res,2015,75(11):2139-2145.
[59] Massi D,Brusa D,Merelli B,etal.The status of PD-L1 and tumor-infiltrating immune cells predict resistance and poor prognosis in BRAFi-treated melanoma patients harboring mutant BRAFV600[J].Ann Oncol,2015,26(9):1980.
[60] Crawford A,Angelosanto J,Kao C,etal.Molecular and transcriptional basis of CD4+T cell dysfunction during chronic infection[J].Immunity,2014,40(2):289-302.
[61] Kalbasi A,June CH,Haas N,etal.Radiation and immunotherapy:a synergistic combination[J].Clin Invest,2013,123(7):2756-2763.
[62] Choueiri TK,Figueroa DJ,Fay AP,etal.Correlation of PD-L1 tumor expression and treatment outcomes in patients with renal cell carcinoma receiving sunitinib or pazopanib:results from COMPARZ,a randomized controlled trial[J].Clin Cancer Res,2015,21(5):1071-1077.
[63] Hodi FS,Lawrence D,Lezcano C,etal.Bevacizumab plus ipilimumab in patients with metastatic melanoma[J].Cancer Immunol Res,2014,2(7):632-642.
[64] Le DT,Uram JN,Wang H,etal.PD-1 blockade in tumors with mismatch-repair deficiency[J].N Engl J Med,2015,372(26):2509-2520.
[65] Squibb BM.A study of nivolumab and nivolumab plus Ipilimumab in recurrent and metastatic colon cancer(checkMate 142)[J].Clin Oncol,2016,34(suppl):abstr3501.
[66] Banerjea A,Ahmed S,Hands RE,etal.Colorectal cancers with microsatellite instability display mRNA expression signatures characteristic of increased immunogenicity[J].Mol Cancer,2004,3(1):87-90.
[67] Llosa NJ,Cruise M,Tam A,etal.The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints[J].Cancer Discov,2014,5(1):43-51.
[收稿2016-07-27 修回2016-09-25]
(编辑 许四平)
10.3969/j.issn.1000-484X.2017.03.031
①本文受国家自然科学基金面上项目(81472843)和上海市科学技术委员会上海市科研计划项目(14ZR1424700)资助。
王巧红(1993年-),女,在读硕士,主要从事妇科恶性肿瘤临床与基础研究,E-mail:wqh930814@126.com。
及指导教师:吴 霞(1973年-),女,博士,副主任医师,副教授,硕士生导师,主要从事妇科恶性肿瘤临床与基础研究,E-mail: wuxia1225@aliyun.com。
R711.75
A
1000-484X(2017)03-0457-07

