丹参酮ⅡA对树突状细胞表型的影响及对功能的调控
夏金华 夏建川 谢丽燕 廖传英
(广州卫生职业技术学院,广州510450)
丹参酮ⅡA对树突状细胞表型的影响及对功能的调控
夏金华 夏建川①谢丽燕 廖传英
(广州卫生职业技术学院,广州510450)
目的:提取小鼠骨髓树突状细胞(DCs),体外给予丹参酮ⅡA干预,观察药物刺激后DCs功能的改变,从而探讨丹参酮ⅡA在免疫系统中的作用机制。 方法:提取小鼠的骨髓DCs,体外给予10 ng/ml GM-CSF及IL-4的完全培养液培养,并在第5天,磁珠分选得到纯度90%以上的树突状细胞,体外给予一定浓度的丹参酮ⅡA及LPS刺激,收集细胞及上清,运用流式细胞技术检测DCs表型,ELISA方法检测细胞上清TNF-α、 IL-12含量变化,同种混合淋巴细胞反应检测树突状细胞刺激淋巴细胞增殖及分化的能力。 结果:在丹参酮ⅡA浓度为500 ng/ml时,药物对DCs抑制作用达到最大,因此选取该浓度为实验作用浓度;即在500 ng/ml作用下,实验组与对照组相比,DCs表达MHCⅡ、CD86及CD80水平均显著降低(P<0.05);实验组DCs分泌的TNF-α及IL-12含量均显著降低(P<0.05);实验组DCs刺激淋巴细胞增殖反应能力明显降低(P<0.05);实验组DCs刺激T淋巴细胞分泌IL-4含量明显高于对照组,IFN-γ含量明显低于对照组(P<0.05)。 结论:丹参酮ⅡA可以通过降低LPS诱导的DCs成熟状态,来参与免疫系统或自身免疫性疾病的发生发展。
树突状细胞;丹参酮ⅡA;脂多糖;成熟
作为从中国中草药丹参中的提取物,丹参酮ⅡA(Tanshinone ⅡA)在机体内具有多种药理作用,包括改善体内微循环、清除体内自由基、抗癌抗氧化、抗菌消炎等[1]。鉴于其广泛的药物作用,在临床与科研方面已开展了多种研究,尤其针对其调节免疫功能方面得到了高度的重视。已有研究将其应用于免疫疾病方面,取得了较大的进展。作为体内最重要的抗原提呈细胞,树突状细胞(Dendritic cells,DCs)在免疫系统及自身免疫性疾病中起着重要作用,其不同的成熟状态可显著影响疾病的进展[2]。因此,本研究提取小鼠骨髓DCs,体外给予丹参酮ⅡA刺激,观察丹参酮ⅡA对DCs成熟功能的影响,从而从细胞领域探讨丹参酮ⅡA的免疫调节作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57小鼠,雌性,8~10周,购于广州省医学实验动物中心[合格证编号:SYXK(粤)2013-0085]。
1.1.2 实验试剂 丹参酮ⅡA购于盖德化工网,脂多糖(Lipopolysaccharide,LPS)购于Sigma公司,重组细胞因子GM-CSF及IL-4购于Peprotech公司,CD11C磁珠购于美天旎公司,CD11C、MHCⅡ、CD86及CD80流式抗体购于eBioscience公司,细胞因子IL-12、TNF-α、IL-4、IFN-γ检测试剂盒购于Biolegend公司,MTS细胞增殖试剂盒购于Promega公司。
1.2 方法
1.2.1 DCs的培养 颈椎脱位法处死小鼠,浸泡于75%酒精5 min,然后置于超净台操作。无菌操作下取出小鼠的股骨,用1 ml注射器抽取RPMI1640溶液冲洗股骨骨髓腔,收集冲洗液,离心,用RPMI1640溶液清洗,红细胞裂解液常温裂解3 min,再应用含10%血清的RPMI1640溶液中和裂解液,离心,RPMI1640清洗细胞备用。无菌条件下制备DCs完全培养基,即应用含10%血清的RPMI1640溶液并添加GM-CSF及IL-4细胞因子(使终浓度均为10 ng/ml)。将离心所得的细胞重悬于DCs完全培养基,置于CO2培养箱培养(即为第1天)。第3天全量换液,弃去悬浮细胞,添加新的培养基再次置于孵箱培养。每隔1 d半量换液,直至培养第5天后,收集悬浮细胞,经CD11C磁珠分选,得到纯度>90%的细胞,并应用CD11C流式抗体标记,鉴定合格后,进行后续实验。在第5天收集纯化后的细胞应用完全培养基重悬(使细胞密度为5×105),取3 ml铺于6孔板中,置于孵箱静置培养24 h,然后将培养孔均分为2组。一组为实验组,其在第6天先给予最佳浓度的丹参酮 Ⅱ A预处理24 h,然后在第7天给予LPS(1 μg/ml)再次刺激24 h;一组为对照组,在第6天向细胞培养孔中先加入等量(与丹参酮 Ⅱ A同等体积)的PBS溶液,然后在第7天给予LPS(1 μg/ml)再次刺激24 h。两组均收集细胞及培养上清,进行相关检测。
1.2.2 ELISA方法检测药物最佳浓度 取纯化的细胞应用完全培养基重悬,使细胞密度为5×105,取3 ml铺于6孔板中,向孔板中加入不同浓度的丹参酮ⅡA,使其终浓度为100、300、500、700、900 ng/ml,将孔板置于37℃、5%CO2培养箱中培养24 h,再加入LPS(1 μg/ml)刺激24 h。于培养结束后取上清进行TNF-α细胞因子检测,并选择抑制TNF-α作用较强,而用量较小的浓度作为药物最佳作用浓度。
1.2.3 流式细胞仪检测细胞表型 收集实验组及对照组细胞,清洗后重悬于PBS溶液中,向细胞悬液里加入MHC Ⅱ、CD86及CD80及同种型抗体,4℃孵育30 min。应用流式细胞仪检测,Flowjo软件分析。
1.2.4 细胞因子检测 取实验组及对照组细胞培养上清,应用ELISA方法检测IL-12及TNF-α的含量,操作步骤严格按照说明书进行。
1.2.5 混合淋巴细胞反应 取C57小鼠脾脏,碾磨后上过滤网,用PBS清洗后,应用含10%血清的RPMI1640溶液重悬,置于CO2培养箱培养24 h,培养结束后,弃去贴壁细胞,取悬浮细胞即为T淋巴细胞备用。取刺激后的DCs应用丝裂霉素C(25 μg/ml)刺激30 min,PBS清洗后,调整细胞浓度为1×106ml-1,取100 μl置于96孔板中。应用含10%血清的RPMI1640溶液重悬淋巴细胞,调整细胞为1×106ml-1,取100 μl置于孔板中,使每孔终浓度为200 μl,并置于5%CO2培养箱中培养48 h。培养结束后,实验分成两部分,一部分向96孔板每孔添加20 μl的MTS溶液,再置于培养箱中培养2 h,然后应用酶标板读取光密度值,以光密度值来代表淋巴细胞增殖能力;另一部分,取细胞上清检测相关细胞因子IL-4、IFN-γ分泌情况。

2 结果
2.1 DCs纯度鉴定 未经磁珠分选的细胞,CD11C纯度较低,经磁珠分选后的细胞,CD11C纯度可达90%以上,见图1,符合实验要求。
2.2 药物最佳作用浓度 DCs由不同药物浓度的丹参酮ⅡA刺激后,与未刺激组相比,当药物浓度为100、300、500、700及900 ng/ml时,TNF-α分泌量均显著降低(P<0.05),但当药物浓度为500、700及900 ng/ml时,实验组细胞因子TNF-α分泌量变化无统计学意义(P>0.05),因此选取500 ng/ml为药物作用最佳浓度,具体见图2。
2.3 DCs表面分子表达 与对照组相比,实验组DCs表达MHCⅡ、CD86及CD80水平均显著降低(P<0.05),结果见图3及表1。

图1 流式细胞术分析并纯化DCsFig.1 Evaluation and purify of DCs by fluorescence-activated cell sorting system
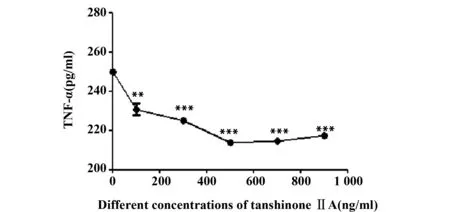
图2 不同药物浓度DCs细胞因子分泌变化Fig.2 Cytokine secretion of DCs with different concentrations of tanshinone Ⅱ±s,n=5)Note: Vs the unstimulated group,**.P<0.01,***.P<0.001.
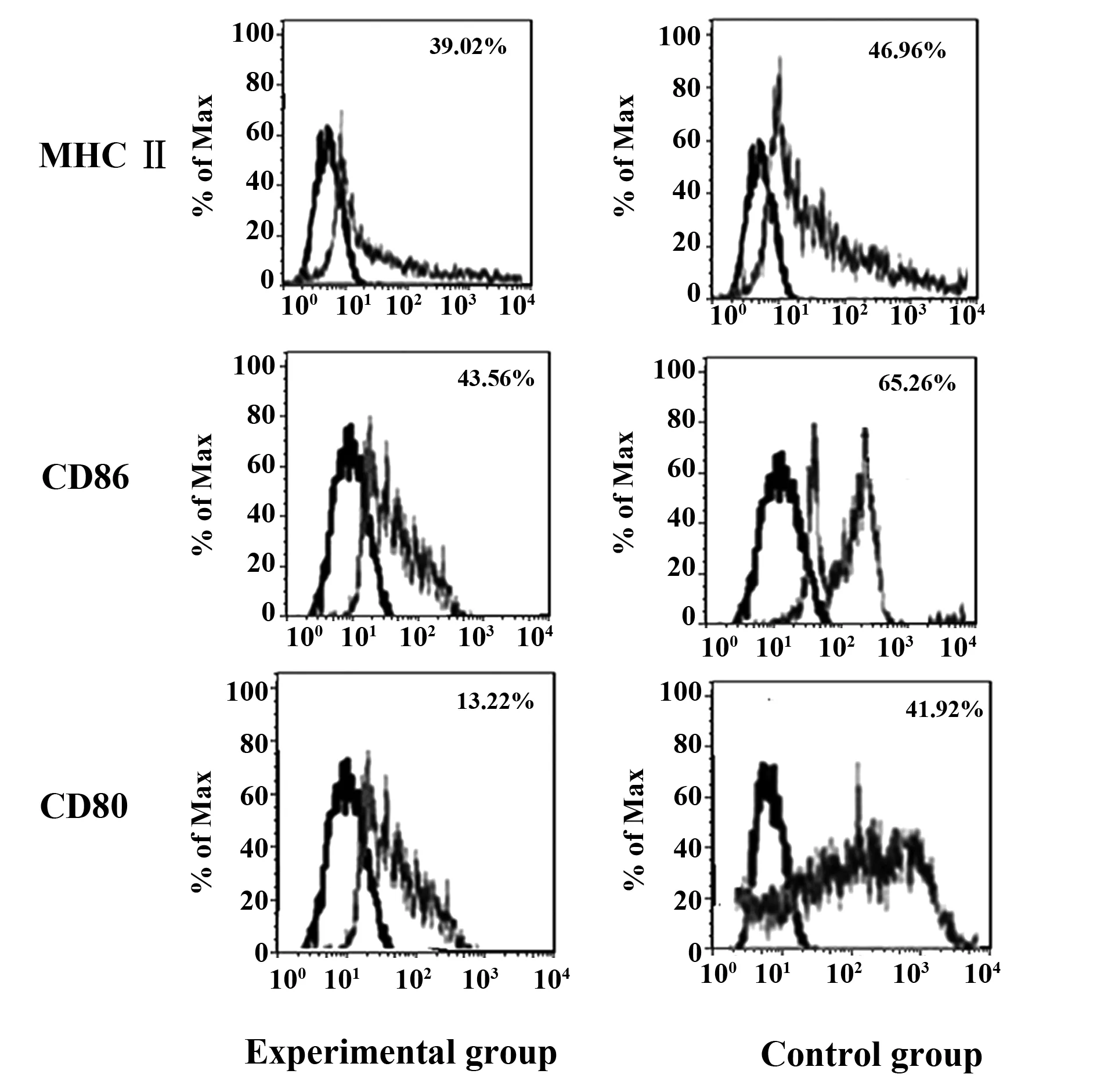
图3 DCs表面共刺激分子表达变化Fig.3 Phenotype expression of DCs in each group

GroupsCD80CD86MHCⅡExperimentalgroup15.4±5.91)45.2±5.91)35.1±6.81)Controlgroup40.9±5.662.6±5.151.7±6.5
Note:Vs the control group,1)P<0.05.
2.4 DCs细胞因子分泌 与对照组相比,实验组DCs分泌的TNF-α及IL-12含量均显著降低(P<0.05),具体见表2。
2.5 DCs刺激淋巴细胞增殖反应 与对照组相比,实验组DCs刺激淋巴细胞增殖反应能力明显降低(P<0.05),具体见表3。
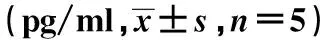

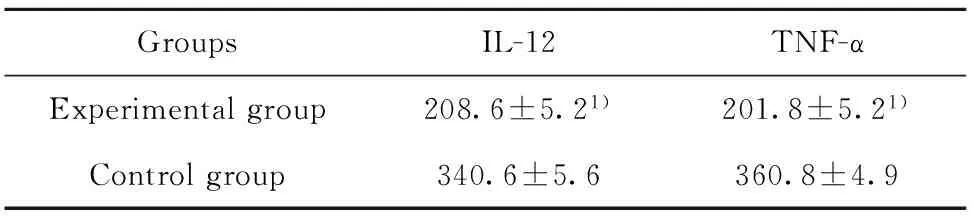
GroupsIL-12TNF-αExperimentalgroup208.6±5.21)201.8±5.21)Controlgroup340.6±5.6360.8±4.9
Note:Vs the control group,1)P<0.05.

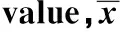

GroupsODExperimentalgroup1.6±0.41)Controlgroup3.2±0.3
Note:Vs the control group,1)P<0.05.
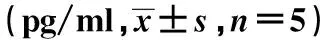


GroupsIL-4IFN-γExperimentalgroup343.4±4.71)145.9±6.11)Controlgroup205.8±4.3315.4±6.4
Note:Vs the control group,1)P<0.05.
2.6 DCs刺激T淋巴细胞分化 实验组与对照组相比,DCs刺激T淋巴细胞分泌IL-4含量明显高于对照组,IFN-γ含量明显低于对照组,各组差异均存在统计学意义(P<0.05),具体见表4。
3 讨论
DCs作为目前功能最强的专职抗原提呈细胞,具有独特的诱导T细胞活化的能力,是连接固有免疫和适应性免疫的“桥梁”。DCs在体内多以未成熟状态存在,抗原提呈能力较强,但刺激T细胞的能力较弱,表现为多种表面因子及炎性细胞因子分泌较少[3]。当病菌等外来微生物刺激后,即可激活成活化状态,可高表达多种表面分子,如CD86、CD80、MHCⅡ等,高分泌多种细胞因子,如TNF-α、IL-12,诱导幼稚的T细胞分化成熟,促进T细胞活化,从而激活免疫应答[4]。随着 DCs研究的深入,发现该细胞的抗原呈递能力及成熟状态,可直接干预机体的免疫调节,影响机体稳态[5]。LPS作为最常见刺激DCs活化的物质,可较大程度地上调DCs的多种共刺激分子,体外模拟炎性因子刺激状态。研究已证实,成熟的DCs可以诱导并加重多种自身免疫性疾病的发生发展,如多发性硬化、类风湿性关节炎[6,7]。因此选择药物抑制DCs成熟状态已经成为改善多种免疫性疾病的突破口。
作为丹参药物活性提取物之一,丹参酮ⅡA具有广泛的生理作用,包括清除多种细菌,抑制炎症;减少自由基和脂质过氧化物的形成,并促进抗氧化物质的合成;抑制多种胶原、透明质酸的合成,从而抑制肝脏纤维化,保护肝功能;促进氧自由基的代谢,降低自由基水平,保护脑神经元,对脑血管疾病也有一定的治疗作用[8]。因其广泛的药理作用,丹参酮ⅡA在临床的应用也极为广泛。丹参酮ⅡA可应用于心肌炎、心脏手术、多种心律失常等心脏疾病,脑血管病及抗肿瘤的治疗等。并且最新研究表明,丹参酮ⅡA可以减弱关节炎的免疫反应,改善多发性硬化疾病动物模型-自身免疫性脱髓鞘疾病的症状[9,10]。然而有关丹参酮ⅡA对DCs功能的调节却仍鲜有研究。
本研究可以看出,即便在LPS刺激下,一定浓度的丹参酮ⅡA(500 ng/ml)仍可以较大程度地抑制LPS导致的DCs的表面因子MHCⅡ、CD86及CD80的升高,丹参酮ⅡA刺激组的DCs分泌的TNF-α及IL-12含量也明显降低。在刺激T淋巴细胞增殖和分化方面,丹参酮ⅡA可通过DCs抑制了LPS导致的细胞增殖。并且,经过丹参酮ⅡA预处理的DCs可刺激T细胞分泌较多的TH2型细胞因子(IL-4),较少量的Th1型细胞因子(IFN-γ),提示丹参酮ⅡA可通过干预DCs诱导T淋巴细胞向Th2炎性细胞方向偏移,说明了该药物可抑制LPS诱导的DCs的成熟状态,从而调节 Th1/Th2平衡来参与机体疾病的发生发展。已有动物实验显示,丹参酮ⅡA可减缓关节炎及多发性硬化的免疫反应[9,10],但具体机制未知。本研究初步阐明了丹参酮ⅡA可通过抑制DCs功能及成熟度,从而影响T细胞分化,使T细胞向Th2方向偏移,导致体内抑炎性因子分泌增多,炎性因子分泌减少,从而起到减缓自身免疫性疾病的作用,表明丹参酮ⅡA可以通过调控DCs的功能来干预自身免疫性疾病的发生发展。
综上所述,丹参酮ⅡA可以降低LPS诱导的DCs表面共刺激分子表达及细胞因子分泌,降低T淋巴细胞增殖,通过调控DCs的成熟状态来干预机体免疫系统,从而参与自身免疫性疾病的发生发展。
[1] 虞建新,吴 奇,杨 欢,等.丹参酮ⅡA 对高糖诱导人脐静脉内皮细胞凋亡的作用[J].中国病理生理杂志,2015,31(9):1720-1723.
[2] 李 望,张升宁,冉江华,等.树突状细胞的培养及成熟的鉴定[J].昆明医科大学学报,2015,36(3):34-37,44.
[3] 胡 玲,刘 莉.常山酮对树突状细胞成熟的影响及其在大鼠同种异体心脏移植免疫耐受中的作用[J].中国生化药物杂志,2014,35(7):40-42,45.
[4] 刘敬敬,周 红,解鸿翔,等.Toll样受体4在β2GPI诱导小鼠骨髓来源树突状细胞成熟过程中的作用[J].细胞与分子免疫学杂志,2014,30(1):15-18.
[5] 褚 帅,李海侠,李 欣,等.GSK-3β对小鼠骨髓树突状细胞成熟和功能的调控作用[J].南方医科大学学报,2015,35(12):1809-1814.
[6] 谭德敏,向 阳,谭千林,等.狼疮性肾炎患者外周血树突状细胞功能的研究[J].中国免疫学杂志,2016,32(4):570-572.
[7] 刘信攸,周阳春,王 瑶,等.microRNA-27a 对树突状细胞表型及功能的影响[J].中国免疫学杂志,2015,31(1):31-35,39.
[8] 廖瑞雪,刘彦慧,王媛婕,等.丹参酮ⅡA对新生大鼠缺血缺氧性脑损伤脑组织IL-1β和TNF-α水平的影响[J].中风与神经疾病杂志,2014,31(11):1002-1004.
[9] 李世梅,王黎明,陈继正,等.鹿瓜多肽、丹参酮ⅡA联合DMARDs治疗类风湿性关节炎疗效观察[J].陕西医学杂志,2015,44(6):744-746.
[10] Yang X,Yan J,Feng J.Treatment with tanshinone IIA suppresses disruption of the blood-brain barrier and reduces expression of and chemokines in experimental autoimmune encephalomyelitis[J].Eur J Pharmacol,2016,771:18-28.
[收稿2016-08-12 修回2016-11-08]
(编辑 倪 鹏)
A novel role for tanshinone ⅡA in modulation of dendritic cells maturation and function
XIAJin-Hua,XIAJian-Chuan,XIELi-Yan,LIAOChuan-Ying.
GuangzhouHealthScienceCollege,Guangzhou510450,China
Objective:Bone marrow-derived dendritic cells(DCs) were extracted and gave tanshinone ⅡA to intervene,and we observed the change of DCs function,which investigate the effects of tanshinone ⅡA in immune system. Methods: Extract bone marrow-derived DCs,and cells were cultured in complete medium with 10 ng/ml GM-CSF and IL-4.On day 5,magnetic cell sorting was used to purify DCs,and the purify must be up to 90%.Then,a certain concentration of tanshinone ⅡA or LPS was gave to the cell culture,and cells and supernatant were collected for following experiments.We used flow cytometry to detect phenotype ,and enzyme-linked immunosorbent assay(ELISA) was used to detect cytokine production of TNF-α and IL-12.Also,allogeneic mixed lymphocyte reaction was used to detect the ability of DCs to induce T cell proliferation and polarization. Results: When the concentration of tanshinone ⅡA was 500 ng/ml,the inhibition of secretion of TNF-α was maximal.So we chose that concentration.Compared with the control group,DCs in experimental group had reduced expression of CD80,CD86 and MHCⅡ(P<0.05).Compared with the control group,DCs in experimental group displayed the reduced level of IL-12 and TNF-α(P<0.05).Compared with the control group,DCs in experimental group had reduced ability to induce T cell proliferation(P<0.05).Compared with the control group,DCs in experimental group induced T cell to secret increased level of IL-4,and reduced level of IFN-γ(P<0.05).Conclusion: Tanshinone ⅡA can inhibit the dendritic cells maturation induced by LPS,which takes part in immune system and autoimmune diseases.
Dendritic cells;Tanshinone ⅡA;LPS;Maturation
10.3969/j.issn.1000-484X.2017.03.012
夏金华(1964年-),男,硕士,副教授,主要从事肿瘤免疫治疗、细胞因子与自身免疫病方面的研究。
R392.12
A
1000-484X(2017)03-0374-04
①中山大学附属肿瘤医院,广州510060。

