2012至2016年广西血红蛋白组分室间质量评价结果的回顾性分析*
唐娟,周微雅,周向阳,刘晓春,何毅
(广西壮族自治区人民医院广西临床检验中心,南宁 530021)
·质量管理研究·
2012至2016年广西血红蛋白组分室间质量评价结果的回顾性分析*
唐娟,周微雅,周向阳,刘晓春,何毅
(广西壮族自治区人民医院广西临床检验中心,南宁 530021)
目的 评价实验室对血红蛋白组分中血红蛋白A2(HbA2)和血红蛋白F(HbF)的检测能力。方法 2012至2016年每年进行2次有关HbA2和HbF的室间质量评价,每次评价5个样本;按室间质量评价流程要求,各实验室在规定时间内检测样本并上传检测结果,依据回报结果统计各检测系统5年的使用分布情况、各实验室的合格率,计算并分析各检测系统、各检测方法的离散程度及不同浓度水平质控品检测结果变异情况。结果 2016年,高效液相色谱法(HPLC)和毛细管电泳法(CE)使用率分别提高至46.1%(82/178)、18.0%(32/178);2012至2016年,HbA2和HbF合格率由51.5%(34/66)、60.6%(40/66)分别提高至93.3%(166/178)、92.1%(164/178);各检测系统的平均变异系数(CV)逐年缩小;Bio-Rad VariantⅡ和Sebia CAPILLARYS 2检测系统高、中、低值HbA2质控品检测结果平均CV较好,可控制在6.0%内;HPLC和CE可定量分析HbA2和HbF指标,总体检测能力优于琼脂糖凝胶电泳法。结论 通过室间质量评价考核实验室检测HbA2和HbF能力,量化HbA2和HbF指标,为地中海贫血筛查和防治工作提供质量保证与数据支持。
地中海贫血;血红蛋白A2;血红蛋白F;室间质量评价
地中海贫血(以下简称“地贫”)表型分析指标除红细胞平均容积(MCV)、红细胞平均血红蛋白量(MCH)外,另一组重要指标是血红蛋白A2(haemoglobin A2,HbA2)和血红蛋白F(haemoglobin F,HbF)[1]。本研究通过对2012至2016年HbA2和HbF室间质量评价(external quality assessment,EQA)结果及存在问题进行回顾性分析,比较参评实验室、不同检测系统(仪器、试剂、方法学)HbA2和HbF检测质量,以了解广西地贫实验室检测能力。
1 材料与方法
1.1 EQA样本制备 根据国际血液学标准化委员会(ICSH)建议,采用新鲜血为原料制备质控品。收集HbA2和HbF高、低值新鲜EDTA-K2抗凝全血,ABO血型相同者按比例混合,调整HbA2和HbF浓度。HbA2高值调整为占血红蛋白量的4%~6%,中值为2.5%~3.5%,低值为1.5%~2.5%;HbF高值调整为占血红蛋白量的35%~50%,中值为10%~30%,低值为1%~5%;分装完成后各浓度质控品随机抽取10支,用Bio-Rad VariantⅡ和Sebia CAPILLARYS 2完成瓶间差异检测,检测值都在均值±2%范围内为瓶间差异合格。质控品从制备到发放、检测等整个流程在21 d内完成[2]。
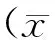
1.3 统计学分析 用Clinet统计软件及Microsoft Excel 2007软件对各参评实验室检测结果进行统计和分析。单个样本检测结果在允许范围内计20分,成绩≥80分为合格。计算2012至2016年各实验室的满分率、合格率,各检测系统的平均变异系数(CV)及各浓度段质控品的平均CV。
2 结果
2.1 检测系统和方法 HbA2和HbF的检测系统共有7种,检测方法主要有3种。2012年大多数实验室采用琼脂糖凝胶电泳法,占72.7%(48/66)。2013年后,使用高效液相色谱法(high performance liquid chromatography, HPLC)的Bio-Rad VariantⅡ仪及毛细管电泳法(capillary electrophoresis,CE)的Sebia CAPILLARYS 2仪的实验室逐渐增多,2016年分别占46.1%(82/178)和18.0%(32/178)。见表1。

表1 2012至2016年广西Hb组分EQA各检测系统使用情况(n)
2.2 实验室满分率和合格率 2012年第1次EQA HbA2和HbF合格率分别是51.5%(34/66)和60.6%(40/66)。2013年后HbA2和HbF合格率均大幅度提高,2016年实验室合格率分别达93.3%(166/178)和92.1%(164/178)。HbA2和HbF满分率从2012年的30.3%(20/66)和34.9%(23/66)提高到2016年的86.5%(154/178)和78.1%(139/178)。
2.3 各检测系统及方法离散程度的比较 7种检测系统HbA2和HbF检测结果的平均CV逐年缩小。琼脂糖凝胶电泳法HbA2检测结果的平均CV(12.1%~22.0%)优于HbF(15.8%~24.9%)。3种不同检测方法检测结果显示,HPLC、CE 5年EQA的平均CV均在6.0%以内,小于琼脂糖凝胶电泳法的平均CV(12.1%~24.9%)。见表2。
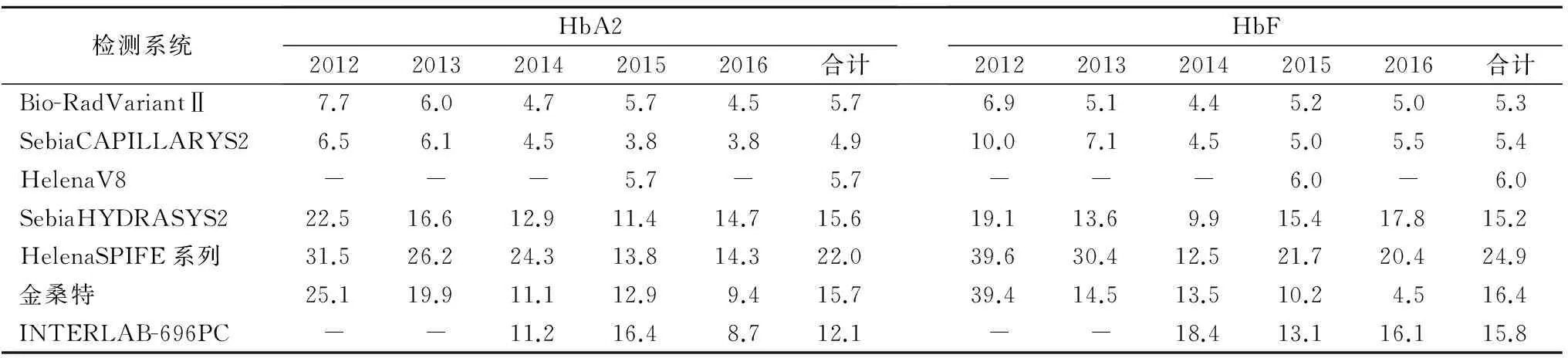
表2 不同检测系统HbA2和HbF检测结果的平均CV(%)
注:-,无数据。
2.4 高、中、低值HbA2的EQA结果 高、中、低值HbA2质控品3种方法检测结果显示,低值HbA2质控品的5年平均CV较中、高值大。HPLC和CE检测高、中、低值HbA2质控品的5年EQA平均CV相差不大,均≤6.0%(分别为4.2%、4.7%、6.0%)。琼脂糖凝胶电泳法检测高、中、低值HbA2质控品5年EQA平均CV分别为15.2%、11.5%、10.1%。
3 讨论
HbA2定量分析是地贫表型分析的重要参数[4],HbF升高对中间型、重型β地贫及δβ地贫诊断有重要意义[5]。因此,HbA2和HbF室间质量评价是地贫防治的重要质量保证。
2012年第1次HbA2和HbF项目实验室合格率均较低,主要原因是以往无该项目的EQA,无法与其他实验室比对,且部分实验室所用方法学误差较大。目前,HbA2/HbF常用的3种检测方法中,HPLC、CE为定量检测[6],琼脂糖凝胶电泳法为半定量检测。2012年参评实验室使用琼脂糖凝胶电泳法较多,占72.7%。琼脂糖凝胶电泳法的操作是先将血红蛋白各组分通过电泳分开再对各组分条带显色,电脑扫描显色图,人工判断HbA2和HbF切割点,利用软件计算各组分的相对含量。不同操作人员对切割点的判断、图片扫描质量及软件对显色深浅识别的差异均会带来较显著的分析误差。此外,部分使用琼脂糖凝胶电泳法的实验室未能有效开展日常室内质量控制和校准,检测的重复性和准确性得不到保证。2013年后部分实验室更换了HPLC和CE定量检测法,加强室内质量控制和日常校准,其日间CV可控制在3%以内。同时,EQA促进了实验室相关人员对HbA2/HbF检测质量控制知识的学习与持续改进,其精密度和准确性进一步提高,各参评实验室EQA成绩合格率明显提升。
本研究采用新鲜人全血样本作为EQA质控品,接近患者检测样本,较好地克服了冻干品或商品质控品添加稳定剂及其他物质所存在的基质效应和干扰。EQA数据显示,实验室使用Bio-Rad VariantⅡ(HPLC)和Sebia CAPILLARYS 2(CE)检测系统检测HbA2和HbF的平均室间CV在6.0%以内,其他检测系统的平均CV也逐年递减。
为了解参评实验室对临床诊断的检测质量,我们设计了高值、中值和低值质控品。由于HbA2参考区间窄(2.5%~3.5%)[7],要求检测方法的变异控制在一定范围,若变异较大,将影响临床判断。HPLC和CE检测HbA2高、中、低值质控品平均CV可控制在6.0%以内,与意大利Paleari等[8]报道的7.1%较为接近,基本可以满足临床对检测变异的要求。但琼脂糖凝胶电泳法高值室间变异高达15.8%,其检测精度有待进一步提高。
随着国际临床化学和实验室医学联盟(IFCC)HbA2和HbF工作组标准化工作的推进[5,7],有望进一步解决该项目参考方法、参考物质和溯源问题。实验室规范日常校准、室内质量控制,结合EQA与持续改进,可进一步改善HbA2和HbF检测的重复性和准确性,为临床筛查和地贫防治提供实验室质量保证和支持。
[1]唐娟,周向阳,刘晓春,等. 地中海贫血血细胞质控品的研制和评价[J].临床检验杂志,2015,33(11):864-867.
[2]Stephens AD, Angastiniotis M, Baysal E,etal. ICSH recommendations for the measurement of haemoglobin A2[J]. Int J Lab Hematol, 2012, 34(1): 1-13.
[3]何法霖, 王薇, 钟堃,等. 血红蛋白A2和F的室间质量评价结果分析[J]. 现代检验医学杂志,2015,30(2): 156-159.
[4]Paleari R, Munoz A, Mosca A. Towards the development of a certified reference material for hemoglobin A2 [J]. Clin Chem Lab Med,2010,48(11) :1611-1618.
[5]Stephens AD, Angastiniotis M, Baysal E,etal. ICSH recommendations for the measurement of haemoglobin F[J]. Int J Lab Hematol, 2012, 34(1): 14-20.
[6]Van DP, Lenters E, Bakker VM,etal. Evaluating five dedicated automatic devices for haemoglobinopathy diagnostics in multi-ethnic populations[J]. Int J Lab Hematol, 2009, 31(5):484-495.
[7]Stephens AD, Angastiniotis M, Baysal E,etal. ICSH recommendations for the measurement of haemoglobin A2[J].Int J Lab Hematol. 2012,34(1):1-13.
[8]Paleari R,Giambona A, Cannata M,etal. External quality assessment of hemoglobin A2 measurement: data from an Italian pilot study with fresh whole blood samples and commercial HPLC systems[J]. Clin Chem Lab Med, 2007, 45(1):88-92.
(本文编辑:王海燕)
Retrospective analysis of external quality assessment results for hemoglobin measurement in Guangxi Province during 2012 to 2016
TANGJuan,ZHOUWei-ya,ZHOUXiang-yang,LIUXiao-chun,HEYi
(ClinicalLaboratoryCenterofGuangxi,ThePeople′sHospitalofGuangxiZhuangAutonomousRegion,Nanning530021,Guangxi,China)
Objective To evaluate the detection competence of HbA2 and HbF in Guangxi medical laboratories. Methods The external quality assessment(EQA) of HbA2 and HbF was conducted twice a year and five samples was detected each time during 2012 to 2016. The laboratories participated in EQA completed the samples′ detection and submitted the detection results at specified time according to the requirements of EQA. The distribution of each detection system, the qualification rate of each laboratory, the variation degrees of each detection system and each detection method, and the variations of results for different levels of quality control(QC) materials during 5 years were analyzed based on the returned results. Results The application of high performance liquid chromatography(HPLC) and capillary electrophoresis(CE) increased year by year and their usage rates in 2016 reached up to 46.1%(82/178) and 18.0%(32/178), respectively. The qualification rates of HbA2 and HbF increased from 51.5%(34/66) and 60.6%(40/66) in 2012 to 93.3%(166/178) and 92.1%(164/178) in 2016, respectively. The average coefficient of variation(CV) of each detection system decreased year by year. There were goodCVs for the results of high, medium and low levels of HbA2 QC materials detected by the Bio-Rad Variant Ⅱ and Sebia CAPILLARYS 2 systems, and they were less than 6.0%. HPLC and CE could quantitatively detect the HbA2 and HbF levels, and their total detection competence was superior to that of agarose gel electrophoresis. Conclusion EQA can assess the ability of one laboratory detecting HbA2 and HbF, and quantitatively analyze the levels of HbA2 and HbF, which may provide the quality assurance and data support for the screening and prevention of thalassemia.
thalassemia; haemoglobin A2; haemoglobin F; external quality assessment
10.13602/j.cnki.jcls.2017.02.17
广西壮族自治区卫计委科研课题(z2014221)。
唐娟,1983年生,女,主管技师,硕士,主要从事临床血液检验质量控制研究。
周向阳,副主任技师,E-mail:zhouxyang@126.com。
R446
A
2016-11-16)

