肺泡表面活性蛋白D、血管性血友病因子及白介素8对脓毒症诱发急性呼吸窘迫综合征的预测和预后意义
宗晓龙,李真玉,魏殿军,陈妍妍,孙光
(1.天津医科大学研究生院,天津300070;2.天津医科大学第二医院 a.检验科,b.ICU,天津 300211;3.天津市公安医院检验科,天津 300000)
·临床实验研究·
肺泡表面活性蛋白D、血管性血友病因子及白介素8对脓毒症诱发急性呼吸窘迫综合征的预测和预后意义
宗晓龙1,2a,李真玉2b,魏殿军2a,陈妍妍2a,孙光3
(1.天津医科大学研究生院,天津300070;2.天津医科大学第二医院 a.检验科,b.ICU,天津 300211;3.天津市公安医院检验科,天津 300000)
目的 从D二聚体(D-dimmer)、血管性血友病因子(von Willebrand factor,vWF)、血小板(Platelet,PLT)、氨基末端B型钠尿肽前体(N terminal-pro brain natriuretic peptide, NT-ProBNP)、白介素6(interleukin-6, IL-6)、白介素8(interleukin-8, IL-8)、肺泡表面活性蛋白D (Surfactant Protein D,SP-D)中筛选对脓毒症并发急性呼吸窘迫综合征(ARDS)具有预测价值的生物标志物。方法 对48例脓毒症合并ARDS的患者和同期40例脓毒症患者进行前瞻性对照研究;在进入ICU 24 h内抽取静脉血标本,定量检测7种生物标志物的浓度/活性水平;构建脓毒症并发ARDS的风险预测模型和死亡预测模型,用Logistic回归筛选具有预测价值的生物标志物和临床指标。结果 SP-D、vWF、IL-8 预测脓毒症合并ARDS的ROC曲线下面积分别为0.758(P<0.01)、0.783(P<0.01)、0.747(P<0.01);三者联合时为0.847(P<0.001);IL-8、年龄≥60岁、APACHE Ⅱ积分≥20对脓毒症合并ARDS具有死亡预测价值,OR值分别为12.138(lnIL-8)(P=0.022)、6.157(P=0.040)、7.415(P=0.014)。结论 SP-D、vWF、IL-8对脓毒症合并ARDS具有早期预测价值,三者联合可以提高预测准确度;IL-8对脓毒症合并ARDS具有死亡预测价值,建议在临床实践中结合APACHE II评分、年龄综合评估。
急性呼吸窘迫综合征;肺损伤;脓毒症;白介素8;血管性血友病因子;肺表面活性蛋白D
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是多种肺内外因素导致的,以肺泡毛细血管通透性增强,弥漫性肺泡浸润(除外心源性肺水肿),进行性低氧血症为主要表现的临床综合征。脓毒症是ARDS的最常见诱因[1],18%~38%脓毒症患者发生ARDS,其死亡率高达40%以上[2]。
自1967年Ashbaugh首次提出ARDS的概念以来,其定义和诊断标准已逐渐改进和完善。但目前对ARDS的诊断仍局限于临床特征、影像学特点、氧合情况等表观水平的综合评估,不利于临床早期诊断、早期干预[3]。ARDS发病是由炎症细胞活化、炎性因子释放、肺泡上皮和肺血管内皮受损、微血栓形成等一系列病理生理反应机制共同作用的结果[4-5]。本研究选择上述机制中具有代表性的D二聚体(D-dimmer)、血管性血友病因子(von Willebrand factor,vWF)、血小板(platelet,PLT)、氨基末端B型钠尿肽前体(N terminal-pro brain natriuretic peptide, NT-ProBNP)、白介素6(interleukin-6, IL-6)、白介素8(interleukin-8, IL-8)、肺泡表面活性蛋白D (surfactant protein D,SP-D)7种生物标志物,结合临床指标建立预测模型,通过Logistic回归筛选对脓毒症并发ARDS具有预测价值和预后意义的生物指标。
1 资料与方法
1.1 研究对象 前瞻性研究。观察2015年2月至2016年10月天津医科大学第二医院ICU收治的48例脓毒症合并ARDS患者和40例脓毒症患者。脓毒症和ARDS分别按2001年国际脓毒症定义和2012年ARDS柏林诊断标准诊断[6-7]。凡伴随以下疾病的研究对象均予以剔除:肿瘤、血液病、免疫系统疾病、既往器官功能不全、心源性肺水肿等。2组患者治疗情况均为原发病抗感染治疗、辅助通气、液体管理等基本治疗。本研究已获所有研究对象知情同意,并通过天津医科大学第二医院医学伦理学委员会审查和批准。
1.2 标本采集与处理 于研究对象进入ICU后24 h内采集全血2 mL,EDTA-K2抗凝,用于检测PLT、NT-ProBNP;采集全血3 mL,枸橼酸钠抗凝,3 000×g离心10 min后收集血浆,用于检测D-dimer、vWF;采集全血3 mL,2 000×g离心10 min后收集约1 mL血清于EP管,-20 ℃保存,用于检测IL-6、IL-8、SP-D。PLT、D-dimer、vWF、NT-ProBNP在抽血后2 h内完成检测;冷冻血清样本室温下复溶后集中检测IL-6、IL-8、SP-D。
1.3 主要仪器与试剂 BC6800/6900血液分析仪及其配套试剂(深圳迈瑞公司);VIDAS30全自动免疫分析仪及D-dimmer配套试剂(法国梅里埃公司);CS-5100凝血分析仪及vWF配套试剂(日本希森美康公司);RAMP生物快速检测仪(北京锐普公司)及 NT-ProBNP试剂盒(加拿大瑞邦公司);IL-6、IL-8、SP-D定量ELISA试剂盒(上海沪峰公司),Bio-Rad680全自动酶标仪(美国伯乐公司)。
1.4 检测方法 用库尔特原理检测PLT;用免疫荧光法检测NT-ProBNP和D-dimmer;用免疫比浊法检测vWF活性;用酶联免疫吸附法检测IL-6、IL-8、SP-D。
1.5 跟踪研究 跟踪研究48例ARDS患者,时间为28 d。48例ARDS患者中,28 d内因肺衰竭死亡22例(45.8%),其中19例在第2-24天院内死亡,3例自主出院后跟踪确认死亡。存活组中19例好转后转入普通病房,7例在第28天未能转出ICU病房,但已恢复自主呼吸。
1.6 统计学分析 用SPSS Statistics 21.02进行。患者基本资料中年龄和APACHEⅡ评分为偏态分布,以中位数和范围表示,用Mann WhitneyU检验比较;其他资料为计数资料,用χ2检验或Fisher确切概率法比较,P<0.05为差异有统计学意义。为控制自变量间共线性对回归分析的干扰,首先通过单因素Logistic回归对候选自变量(生物标志物/临床指标)筛选,以P<0.2为入选标准。分别以是否发生ARDS和28 d内是否死亡为因变量,以单因素分析后入选的生物标志物和临床指标为自变量(后退法,Backward LR)进行多因素二元Logistic回归,P<0.05为有统计学意义。
2 研究结果
2.1 基本资料 两组间年龄、性别、吸烟史、原发病、APACHE Ⅱ评分、糖尿病合并率差异均无统计学意义(P均>0.05)。见表1。
2.2 生物标志物检测结果 经两独立样本的t检验,SP-D、vWF、IL-8、NT-ProBNP、D-dimmer差异均有统计学意义(P均<0.05),PLT、IL-6差异均无统计学意义(P均>0.05)。见表2。
2.3 发生ARDS的Logistic回归分析 以是否发生ARDS为因变量的单因素Logistic回归结果显示IL-6、IL-8、D-dimer、vWF、SP-D符合P<0.2的筛选标准,进入多因素Logistic回归。多因素回归结果显示IL-8(P<0.001)、vWF(P<0.001)、SP-D(P=0.001)对脓毒症诱发ARDS具有早期预测价值,生物指标每改变一个ln单位对应的OR值及95%置信区间分别为4.608(1.032~20.532)、6.081(1.314~28.147)、4.603(1.554~13.669)。
2.4 生物指标预测ARDS发生的ROC分析 绘制IL-8、vWF、SP-D及三者联合预测脓毒症诱发ARDS的ROC曲线,见图1。SP-D、vWF、IL-8 预测脓毒症合并ARDS的ROC曲线下面积分别为0.758(P<0.001)、0.783(P<0.001)、0.747(P<0.001),三者联合时为0.847(P<0.001)。当cut-off值分别为68.5 g/L、203.25%、62.5 g/L时,SP-D、vWF、IL-8及三者联合预测脓毒症并发ARDS的敏感性分别为0.667、0.646、0.771、0.729;特异性分别为0.775、0.85、0.625、0.775;阳性预测值分别为0.781、0.838、0.711、0.75;阴性预测值分别为0.66、0.667、0.694、0.700。
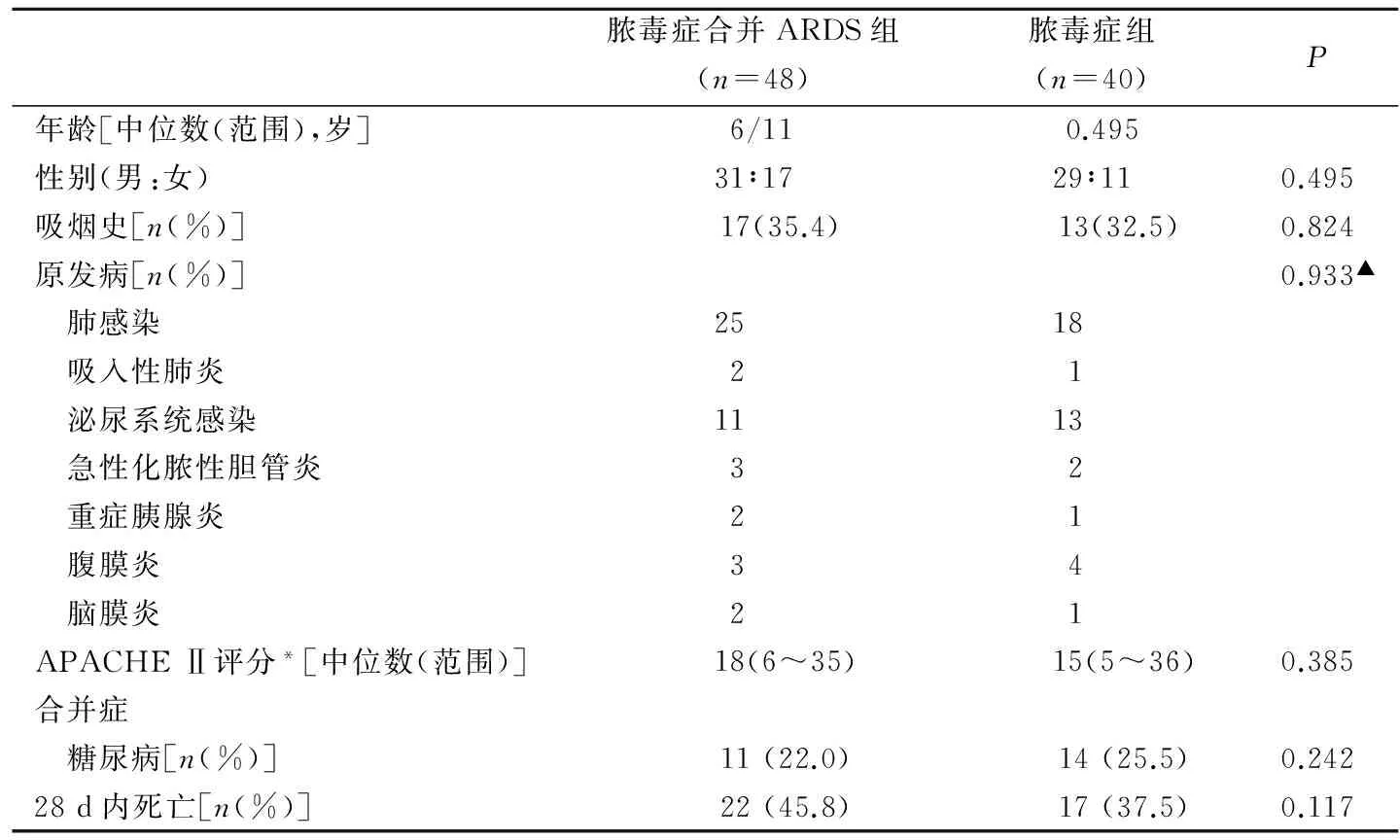
表1 两组患者的统计学特征及基本临床特点
注:*,急性生理与慢性健康评分;▲,比较采用R×C表χ2检验。
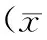
表2 两组患者7种生物标志物的检测结果±s)

图1 SP-D、vWF、IL-8及三者联合预测脓毒症并发ARDS的ROC曲线
2.5 ARDS预后分析 对ARDS患者28 d预后的多因素回归分析显示,IL-8(P=0.022)、年龄≥60岁(P=0.040)、APACHE Ⅱ积分≥20(P=0.014)具有死亡预测价值,OR值及95%置信区间分别为12.138(1.425~103.375,IL-8改变一个ln单位)、6.157(1.090~34.768)、7.415(1.512~36.353)。
3 讨论
肺脏是脓毒症发病过程中最早且最易受累的器官。脓毒症导致肺损伤的基本病理生理机制为:内毒素刺激炎症介质和黏附分子释放,进而促使中性粒细胞与内皮细胞黏附并向组织移行,释放各种蛋白酶,导致上皮细胞和内皮细胞受损,毛细血管通透性增强,肺泡组织水肿,肺间质纤维化,微血栓形成,最终换气功能障碍[8]。本研究中对脓毒症并发ARDS具有预测价值的3种生物指标IL-8、vWF、SP-D分别代表上述机制中的炎症反应,血管内皮损伤和肺泡上皮损伤。
IL-8是中性粒细胞的趋化因子和激活因子,在炎症反应中具有重要作用。本研究ARDS组IL-8水平高于非ARDS组(P<0.001),IL-8预测ARDS的曲线下面积为0.747(P<0.001),高于文献[9]曲线下面积0.61的报道。同时,本研究显示高水平IL-8提示ARDS预后不良,与Ware等[10]报道一致。
SP-D主要功能是辅助巨噬细胞吞噬病原微生物。除外ARDS,SP-D水平升高还可见于重症肺炎、哮喘、COPD等肺损伤相关疾病[11],说明不同程度肺损伤会引起血SP-D水平升高。SP-D升高水平是否与ARDS严重程度和ARDS预后相关,目前尚无定论。本研究中血清SP-D对发生ARDS具有预测价值,但没有预后价值,与2010年Ware等[10]报道不一致,与2014年Terpstra等[12]对3 753例ARDS患者的meta分析结果一致。ARDS典型的病理表现为肺水肿,透明膜形成和弥漫性肺泡损伤[5]。1995年Matsubara等[13]发现vWF是透明膜的组份之一,证明ARDS存在肺泡上皮和肺血管内皮的双重损伤。本研究ARDS组患者vWF水平显著高于非ARDS患者,再次印证了这一点。vWF稳定凝血Ⅷ因子,同时介导血小板聚集。王铁华等[14]曾报道血小板减少是ARDS不良预后的危险因素,本研究未能重现其结果,可能和本文为横断面研究,缺少对血小板数量的动态监测有关。
ARDS具有临床和生物学异质性[15],对其有效的研究应该建立在控制异质性的基础上。本文单纯研究脓毒症相关的ARDS,通过Logistic回归筛选最具预测价值的生物标志物,结果表明IL-8、SP-D、vWF对脓毒症并发ARDS具有预测价值,IL-8对脓毒症合并ARDS具有预后评估价值。本文也有明显不足,缺乏对生物指标的动态监测,不能了解ARDS的进展过程。同时,ARDS潜在的标志物众多,本文未能全面研究,有待更多投入以开展深入研究。
[1]Piantadosi CA, Schwartz DA. The acute respiratory distress syndrome[J]. Ann Intern Med, 2004, 141(6):460-470.
[2]Villar J, Blanco J, Aón J,etal. The ALIEN study: incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation[J]. Intensive Care Med, 2011,37(12):1932-1941.
[3]Birukov KG, Birukova AA, Dudek SM,etal. Shear stress mediated remodelling and cortactin translocation in pulmonary endothelial cells[J]. Am J Respir Cell Mol Biol, 2002,26(4):453-464.
[4]Orfanos SE, Mavrommati L, Korovesi I,etal. Pulmonary endothelium in acute lung injury: from basic science to the critically ill[J]. Intensive Care Med,2004,30 (9):1702-1714.
[5]门剑龙,徐凤华,刘文来,等. 急性呼吸窘迫综合征患者抗凝血及纤溶系统功能状态改变的观察[J]. 临床检验杂志,2000,18(6): 371-372.
[6]姚咏明,盛志勇,林洪远,等. 脓毒症定义及诊断的新认识[J].中国危重病急救医学,2004,16(06):321-324.
[7]ARDS Definition Task Force, Ranieri VM, Rubenfeld GD,etal. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012,307(23):2526-2533.
[8]Frost RA,Nystrom GJ,Lang CH.Lipopolysaecharide regulates proinflammatory cytokine expression in mouse myoblasts and skeletal muscle[J].Am J Physiol Regul Integr Comp Physiol,2002,52(3):698.
[9]Ware LB, Koyama T, Zhao Z,etal.Biomarkers of lung epithelial injury and inflammation distinguish severe sepsis patients with acute respiratory distress syndrome[J]. Critical Care, 2013, 17(5):R253.
[10]Ware LB, Koyama T, Billheimer DD,etal. Prognostic and pathogenetic value of combining clinical and biochemical indices in patients with acute lung injury[J]. Chest, 2010,137(2):288-96.
[11]郭小倩.慢性阻塞性肺疾病和支气管哮喘患者血清肺表面活性蛋白-水平改变及临床意义[D]. 太原:山西医科大学, 2015,1-39.
[12]Terpstra ML, Aman J, van Nieuw Amerongen GP,etal. Plasma biomarkers for acute respiratory distress syndrome: a systematic review and meta-analysis[J]. Crit Care Med,2014,42(3):691-700.
[13]Matsubara O. Alveolar basement membrane breaks down in diffuse alveolar damage: An immunohistochemical study[J]. Pathol Int, 1995, 45 (7):473-482.
[14]Wang T, Liu Z, Wang Z,etal. Thrombocytopenia is associated with acute respiratory distress syndrome mortality: an international study[J]. PLoS ONE, 2014,9(4): e94124.
[15]Calfee CS, Delucchi K, Parsons PE,etal. Subphenotypes in acute respiratory distress syndrome: latent class analysis of data from two randomised controlled trials [J]. Lancet Respir Med,2014,2(8):611-620.
(本文编辑:王海燕)
Predictive and prognostic evaluation of surfactant protein D, von Willebrand factor and interleukin-8 for sepsis-induced acute respiratory distress syndrome
ZONGXiao-long1,2a,LIZhen-yu2b,WEIDian-jun2a,CHENYan-yan2a,SUNGuang3
(1.GraduateSchoolofTianjinMedicalUniversity,Tianjin300070; 2.a.DepartmentofClinicalLaboratory,b.ICU,TheSecondHospitalofTianjinMedicalUniversity,Tianjin300211; 3.DepartmentofClinicalLaboratory,TianjinPublicSecurityHospital,Tianjin300000,China)
Objective To select valuable biomarkers for diagnosis and predicting outcome of sepsis-related acute respiratory distress syndrome(ARDS) from D-dimmer (DD), von Willebrand factor(vWF), platelet(PLT), N terminal-pro brain natriuretic peptide (NT-ProBNP), interleukin-6(IL-6), interleukin-8(IL-8) and surfactant protein D(SP-D). Methods A total of 48 sepsis accompanied with ARDS patients and 40 sepsis patients were prospectively studied with comparison. The clinical characteristics of all the patients were recorded in detail. The blood samples were obtained within 24 hours of ICU admission. The concentration or activity of the seven biomarkers was quantitatively assayed and the results were recorded. To select the most valuable biomarkers as clinical indices, diagnosis model and death predictive model were constructed by Logistic regression. Results Among the seven candidate biomarkers, SP-D, vWF and IL-8 showed the most value. Their area under the receiver operator characteristic curve(ROC) were 0.758(P<0.01),0.783(P<0.01) and 0.747(P<0.01) respectively, and raised to 0.847(P<0.001) when the three biomarkers were combined. IL-8, age greater than or equal to 60 years and APACHE Ⅱ score greater than or equal to 20 were related to ARDS death with 12.138(lnIL-8)(P=0.022),6.157(P=0.040) and 7.415(P=0.014) ofORvalues respectively. Conclusion SP-D, vWF, IL-8 should be valuable for early prediction of sepsis-induced ARDS and the diagnostic accuracy raised through combined utilization. IL-8 may be predictable for prognosis of sepsis related ARDS and the comprehensive evaluation combining clinical indices with IL-8 should be suggested in clinical practice.
acute respiratory distress syndrome;acute lung injury;sepsis;IL-8; vWF;SP-D
10.13602/j.cnki.jcls.2017.02.10
宗晓龙,1983年生,男,主管技师,硕士研究生,主要从事临床检验工作与研究。
魏殿军,教授,博士,E-mail:weidianjun01@163.com。
R446.11+2;R56
A
2016-11-05)

