基于参考实验室网络定值的人血清样本量值传递效果评价*
孙慧颖,史光华,黄宪章,王惠民,胡卫江,吕磊,胡滨,王建兵,王建新,刘春龙,陈宝荣,吕京
(1.北京航天总医院检验科,北京 100076;2.中国合格评定国家认可委员会技术处,北京 100062;3.广东省中医院检验医学部医学校准实验室,广州 518034;4.南通大学附属医院检验科,江苏南通 226001;5.浙江清华长三角研究院浙江省应用酶学重点实验室,浙江嘉兴 314006;6.四川迈克生物科技股份有限公司参考系统部,成都 610097;7.北京利德曼生化股份有限公司质量技术中心,北京 100176)
·质量管理研究·
基于参考实验室网络定值的人血清样本量值传递效果评价*
孙慧颖1,史光华2,黄宪章3,王惠民4,胡卫江5,吕磊6,胡滨1,王建兵3,王建新4,刘春龙7,陈宝荣1,吕京2
(1.北京航天总医院检验科,北京 100076;2.中国合格评定国家认可委员会技术处,北京 100062;3.广东省中医院检验医学部医学校准实验室,广州 518034;4.南通大学附属医院检验科,江苏南通 226001;5.浙江清华长三角研究院浙江省应用酶学重点实验室,浙江嘉兴 314006;6.四川迈克生物科技股份有限公司参考系统部,成都 610097;7.北京利德曼生化股份有限公司质量技术中心,北京 100176)
目的 研究基于参考实验室网络定值的人血清样本对改进临床实验室丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、α-淀粉酶(Amy)、碱性磷酸酶(ALP)等7个酶学指标量值传递的效果。方法 依托华北、华南、华东、西南4个区域的5家参考实验室辐射区域内的各级医疗机构,建立相应的常规实验室量值传递/溯源网络;北京航天总医院提供互换性良好、具有标准物质特性的冰冻人血清样品(校准品、评估样品1、评估样品2),由4个区域5家参考实验室联合赋值;将样品发送至全国48家实验室,各实验室按各自的标准操作规程先测量2个评价样品,再用提供的冰冻人血清样品作为校准品校准厂家系统后再次测量2个评价样品,依据WS/T 403-2012卫生行业标准判断各实验室测量结果正确度的变化,ALT、AST观察结果一致性的变化。结果 Amy、ALP、GGT、CK、LDH的校准品、样品1及样品2网络定值结果分别为138.7 U/L、278.5 U/L、68.3 U/L,265.3 U/L、94.5 U/L、134.4 U/L,195.8 U/L、89.0 U/L、158.9 U/L,393.7 U/L、260.0 U/L、645.3 U/L,302.0 U/L、250.0 U/L、452.7 U/L;常规测量系统Amy、ALP、GGT量值传递前样品1及样品2满足WS/T 403-2012偏移要求的百分率分别为65.9%、61.0%,76.6%、78.7%,66.7%、70.8%,量值传递后分别为89.2%、83.8%,86.7%、80.0%,85.4%、91.7%,CK、LDH量值传递前样品2满足行标要求的百分率为64.6%、58.3%,量值传递后为93.5%、84.8%;ALT、AST实验室常规测量系统量值传递前后一致性:量值传递前样品1及样品2为12.9%、11.3%,10.2%、8.9%,量值传递后为9.3%、8.2%,5.6%、5.9%。结论 基于参考实验室网络定值人血清样本建立的校准常规系统量值传递路径明显提高了我国各级医疗机构临床实验室Amy等7个酶学项目检验结果的可比性,值得进一步推广。
量值传递;溯源;参考实验室网络;正确度
临床实验室在采用不同测量原理、测量技术的商品试剂盒测量相同检验指标时不可避免会带来检验结果可比性的问题[1]。ISO 17511[2]、ISO 15189[3]等实验室质量管理文件及我国政府部门发布的检验结果统一互认的相关文件[4]均要求临床实验室建立适当方法解决临床检验结果的量值溯源[5-6]问题。本研究依托我国近十年来建立的医学参考实验室网络[7],以γ-谷氨酰基转移酶(GGT)、肌酸激酶(CK)、乳酸脱氢酶(LDH)、淀粉酶(Amy)、碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)为待评价溯源传递指标,自2013至2015年对上述7个参考体系完整的临床常规生化指标设计了互换性良好[8]、具有标准物质特性的冰冻人血清样本校准厂家系统的量值传递路径,并在我国西南、华南、华东、华北4个地区的48家三级、二级、一级医院临床实验室试应用,以探讨该路径对检验结果标准化的改进效果。
1 材料和方法
1.1 参与定值的参考实验室网络 华北地区为北京航天总医院参考实验室(通过CNAS、JCTLM认可),华东地区为南通大学附属医院参考实验室(通过CNAS、JCTLM认可)和清华长三角研究院参考实验室(已申请CNAS认可),华南地区为广东省中医院参考实验室(通过CNAS、JCTLM认可),西南地区是迈克公司参考系统部(通过CNAS、JCTLM认可)。
1.2 参与量值传递效果评价的实验室及测量系统 华北地区12家,包括Olympus AU、Hitachi、Beckman系列仪器;华东地区5家,包括Olympus AU、Hitachi系列仪器;华南地区21家,包括Olympus AU、Hitachi、Abbott、Beckman、东芝迈瑞、Advia、Roche系列仪器;西南地区10家,包括Olympus AU、Hitachi、迪瑞系列仪器;以上测量系统均含配套及开放性质。
1.3 校准品及评价样品 为无添加物冰冻保存的人血清基质,由北京航天总医院研制,均匀性、稳定性均符合国家标准物质特性,互换性良好。每个项目校准品1个浓度,评价样品2个浓度,均由参考实验室网络定值。
1.4 校准品及评价样品定值方法的选择 7个酶学项目的定值方法为国际临床化学与检验医学联合会(IFCC)37 ℃酶活性浓度参考测量程序,ALT、AST为添加磷酸吡哆醛的方法,定值实验室数量ALT、AST、GGT各4家,ALP、Amy、CK、LDH各5家。
1.5 评价样本测量方法 实验室按各自标准操作规程(SOP)测量样品1和样品2各3次;用参考实验室网络定值的冰冻人血清作为校准品按SOP校准,校准后再重新测量2个浓度样品各3次。
1.6 正确度评价标准 以国家卫生行业标准WS/T 403-2012临床生物化学常规检验项目分析质量指标[9]中“允许偏移”作为全国各类实验室测量结果正确度的判定标准。
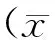
2 结果
2.1 人血清样本参考实验室网络定值结果及判断标准 见表1,其中部分实验样品为国家二级标准物质。

表1 5个项目参考实验室网络定值结果及正确度判断标准
注:#,为二级标准物质;-,不作为正确度判断标准。
2.2 量值传递前后测量结果的正确度通过率 分别计算48家实验室项目测量结果的偏移,按WS/T 403-2012标准中允许偏移判断测量结果正确度是否通过,汇总后判断评估样品的正确度通过率,CK、LDH由于样品1发放错误无统计结果。表2为各项目量值传递前后评价样本测量结果的正确度通过率。5个酶的正确度通过率在量值传递前正确度通过率53.7%~78.7%,量值传递后正确度通过率75.6%~93.5%。ALP效果量值传递前后不明显,其他4个项目效果显著。图1~图3为双样品测量结果的Youden图,X轴与Y轴分别为评估样品1、2的结果,以WS/T 403-2012的允许偏移为合格框,图中可明显观察到测量结果正确度通过率提高。

表2 Amy 5个项目评估样品量值传递前后正确度通过率(%)

注:A,量值传递前;B,量值传递后。
图1 Amy测量系统量值传递前后测量结果正确度Youden图

注:A,量值传递前;B,量值传递后。
图2 ALP测量系统量值传递前后测量结果正确度Youden图

注:A,量值传递前;B,量值传递后。
图3 GGT测量系统量值传递前后测量结果正确度Youden图
2.3 ALT、AST量值传递前后测量结果的一致性 计算48家实验室ALT、AST结果量值传递前后的测量变异系数(CV),见表3。ALT、AST量值传递前48家实验室测量结果总的变异系数为8.9%~12.9%,量值传递后为5.6%~9.3%。

表3 ALT、AST评估样品测量变异的结果[CV(%)]
3 讨论
根据ISO 17511讨论稿等[10]采用有互换性、可溯源的样品校准常规系统是解决常规系统测量结果正确度的有效途径。为验证该路径解决临床实验室检验结果准确可比的效果,2013~2015年在我国4大区域48家各级医院临床实验室进行实验,取得了满意的效果,见表2、3及图1~3。
有调查显示,我国7个酶学项目的偏移符合率很低[11],改善血清酶分析质量首先需要解决正确度的问题,因此迫切需要解决能够保证检测结果溯源性的有效量值传递路径。本研究结果显示,Amy、CK、LDH、GGT经过量值传递后单一样品正确度通过率和双样品正确度通过率均能达到80%以上,说明该量值传递路径可明显提高我国各级医疗机构临床实验室Amy等常规酶学项目检验结果的溯源性,有效解决测量结果的正确度。但在研究中发现,48家实验室酶学测量系统复杂,部分实验室测量结果的精密度较差,个别实验室测量结果与其他实验室差异较大,这可能会导致部分测量结果不能真实体现实验室测量结果的正确度。因为测量精密度是保证正确度的前提,因此各实验室在解决测量结果正确度之前,须保证测量方法的性能符合要求。
对于ALT、AST,由于国内大部分测量系统采用不添加磷酸吡哆醛(PAP)的方法,与IFCC方法原理不一致,因此本次实验结果仅以测量变异系数来观察量值传递效果,结果显示,该量值传递路径可提高测量结果的一致性。在今后的研究中可进行无磷酸吡哆醛方法的正确度验证,以满足国内常规检测的需要。
值得注意的是,ALP在酶学研究中起步最晚,且常规测量系统中缓冲体系不一致,有2-氨基-2-甲基-1-丙醇(AMP)、2-乙基氨基乙醇等。量值传递前ALP双样品正确度通过率接近70%,虽然量值传递后正确度通过率提升不明显,但结果更集中。另外,CK、LDH的样品1由于定值样品与发放样品不一致,因此未能进一步统计结果。
综上,利用有互换性、可溯源的样品校准常规系统的量值传递路径可有效改善Amy等临床常规酶学项目测量结果的溯源性,但不能解决ALP等项目测量结果溯源性的问题,还需关注溯源性评价标准的问题。
[1]Jansen R,Schumann G,Baadenhuijsen H, et al.Trueness verification and traceability assessment of results from commercial systems for measurement of six enzyme activities in serum: an international study in the EC4 framework of the Calibration 2000 project[J].Clin Chim Acta, 2006, 368(1-2): 160-167.
[2]ISO 17511. In vitro diagnostic medical devices measurementofquantities in samples of biological origin-metrological traceability of values assigned to calibrators and control materials[S].International Standards Organization, 2003.[3]ISO 15189.Medical laboratories-Particular requirements for quality and competence[S].International Standards Organization,2012.
[4]卫办医发[2006]32号. 卫生部办公厅关于医疗机构间医学检验、医学影响检查有关问题的通知[S]. 卫生部办公厅,2006.
[5]International vocabulary of metrology——Basic and general concepts and associated terms (VIM)[S]. International Standards Organization/International Electro technical Commission,2007.
[6]陈宝荣.临床检验结果量值溯源存在的问题与思考[J].临床检验杂志,2012,30(12):943-945.
[7]杨振华.建设我国检验医学参考体系任重道远[J].临床检验杂志,2012,30(10):734-736.
[8]王军,刘毅.ISO 17511 临床检验量值溯源国际标准修订解读[J].中华临床实验室管理电子杂志,2015,3(3):168-170.
[9]WS/T 403-2012.临床生物化学检验常规项目分析质量指标[S].中华人民共和国卫生部,2012.
[10]Greg Miller. Presented at the JCTLM Members and Stakeholders Meeting[EB/OL].(2015-12-07)[2016-10-29].http://www.bipm.org/cc/AllowedDocuments.jsp?cc=JCTLM.html
[11]汪静,曾洁,闫颖,等.我国七个血清酶检验项目检测质量分析[J].中华检验医学杂志,2015,38(5):313-317.
(本文编辑:王海燕)
Investigations on the effect of measuring value transfer for human serum samples assigned by the reference laboratory network
SUNHui-ying1,SHIGuang-hua2,HUANGXian-zhang3,WANGHui-min4,HUWei-jiang5,LVLei6,HUBin1,WANGJian-bing3,WANGJian-xin4,LIUChun-long7,CHENBao-rong1,LVJing2
(1.DepartmentofLaboratoryMedicine,BeijingAerospaceGeneralHospital,Beijing100076; 2.OfficeofTechnology,ChinaNationalAccreditationServiceforConformityAssessment,Beijing100062; 3.MedicalCalibrationLaboratory,DepartmentofLaboratoryMedicine,GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou518034,Guangdong; 4.DepartmentofClinicalLaboratory,AffliatedHospitalofNantongUniversity,Nantong226001,Jiangsu; 5.KeyLaboratoryofAppliedEnzymologyofZhejiangProvince,YangtzeRiverDeltaInstituteofTsinghuaUniversity,Jiaxing314006,Zhejiang; 6.DepartmentofReferenceSystem,SichuanMakerBiotechnologyCo.,Ltd,Chengdu610097,Sichuan; 7.CenterforQualityTechnology,BeijingLeadmanBiochemistryCo.,Ltd,Beijing100176,China)
Objective To investigate the effect of measuring value transfer for human serum samples assigned by the reference laboratory network on improving the trueness of seven enzyme activities in clinical laboratories, such as ALT, AST, GGT, LDH, CK, AMY and ALP. Methods Depending on the medical institutions at all levels contacted by 5 reference laboratories in North China, South China, East China and Southwest China, the corresponding clinical laboratory measuring value transfer/traceability network was established. The frozen human serum samples with good interchangeability and standard material characteristics, including calibrator, sample 1 and sample 2, were provided by Beijing Aerospace General Hospital, and were assigned by 5 reference labotatories in four regions. These samples were sent to 48 clinical laboratories. These clinical laboratories measured sample 1 and sample 2 according to their standard operating procedures, and then measured the two samples again after adjusting their measurement system by using the supplied calibrator. The changes of trueness of detection results in these laboratories were evaluated according to the WS/T 403-2012 standard, and the changes of consistency for ALT and AST before and after measuring value transfer were investigated. Results The results of AMY, ALP, GGT, CK and LDH calibrator, sample 1 and sample 2 assigned by the established network were 138.7 U/L, 278.5 U/L and 68.3 U/L, 265.3 U/L, 94.5 U/L and 134.4 U/L, 195.8 U/L, 89.0 U/L and 158.9 U/L, 393.7 U/L, 260.0 U/L and 645.3 U/L, and 302.0 U/L, 250.0 U/L and 452.7 U/L, respectively. The percentages of sample 1 and sample 2 which met the bias requirements of the WS/T 403-2012 standard before measuring value transfer for AMY, ALP and GGT were 65.9% and 61.0%, 76.6% and 78.7%, and 66.7% and 70.8%, respectively, while after measuring value transfer, they were 89.2% and 83.8%, 86.7% and 80.0%, and 85.4% and 91.7%, respectively. The percentages of sample 2 which met the bias requirements of the WS/T 403-2012 standard before measuring value transfer for CK and LDH were 64.6% and 58.3%, respectively, while after measuring value transfer, they were 93.5% and 84.8%, respectively. The coefficients of variation (consistency) of sample 1 and sample 2 for ALT and AST before measuring value transfer were 12.9% and 11.3%, and 10.2% and 8.9%, respectively, while after measuring value transfer, they were 9.3% and 8.2%, and 5.6% and 5.9%, respectively. Conclusion The calibration of routine measurement systems based on the measuring value transfer for human serum samples assigned by the reference laboratory network may improve the comparability of 7 enzyme activities measurement results in clinical laboratories at all levels obviously, which deserves to be further spread.
measuring value transfer; traceability; reference laboratory network; trueness
10.13602/j.cnki.jcls.2017.02.16
国家质检公益性行业科研指标 (201210066);北京市科技计划(Z141107006614010)。
陈宝荣,主任技师,硕士研究生导师,E-mail:jyk711@sina.com;吕京,研究员,博士,E-mail:lvj@cnas.org.cn。
R446
A
2016-11-14)
作者介绍:孙慧颖,1978年生,女,副主任技师,大学本科,主要从事临床标准化研究。

