miR-181在动脉粥样硬化相关血管炎症和免疫调节中的研究进展*
陆攀,宋佳希 综述,汪俊军 审校
(南京大学医学院附属金陵医院/南京军区南京总医院解放军临床检验医学研究所,南京 210002)
·综述·
miR-181在动脉粥样硬化相关血管炎症和免疫调节中的研究进展*
陆攀,宋佳希 综述,汪俊军 审校
(南京大学医学院附属金陵医院/南京军区南京总医院解放军临床检验医学研究所,南京 210002)
动脉粥样硬化(atherosclerosis,As)是病变从内膜开始的一种慢性炎症性疾病,主要累及全身大中动脉,是危害人类健康的主要疾病之一。近年来,研究发现微小核糖核酸(microRNAs,miRNAs)参与As的发生、发展。其中,miR-181家族通过调控血管炎症和免疫相关的信号通路在As发生、发展中起着重要作用,如调控下游NF-κB信号通路、内皮细胞激活相关靶点的表达和免疫细胞稳态等。该文就近年来miR-181在As相关炎症和免疫反应的研究进展作一综述。
动脉粥样硬化;miR-181;炎症;免疫调节
研究表明,动脉粥样硬化(atherosclerosis,As)形成是血管壁对血脂紊乱和内皮细胞压力的慢性炎症反应,包括淋巴细胞的炎症招募和自身血管细胞的激活[1]。高血脂、高血压、免疫损伤和炎症刺激等多种危险因素可致内皮细胞损伤,促进As的发生与发展。miRNA是生物生长期间基因表达的主要调控因子,与诸多人类疾病的发生密切相关,参与炎症反应、免疫细胞分化和脂质代谢过程的调节[2],影响 As病变的发生、发展。本文就近年来miR-181在As血管炎症和免疫调节方面的相关研究进展进行综述。
1 miR-181家族
人类基因组中存在至少2 000个成熟的miRNAs (http://www.mirbase.org/)。人类miR-181家族包括4个高度保守的成员:miR-181a、miR-181b、miR-181c和miR-181d[3]。其中,hsa-miR-181a-1和hsa-miR-181b-1位于1号染色体,hsa-miR-181a-2和hsa-miR-181b-2位于9号染色体,hsa-miR-181c和hsa-miR-181d位于19号染色体。miR-181家族成员包含相似的种子序列,只有1~4个核苷酸不同。例
如:成熟的miR-181a和miR-181c序列、miR-181b和miR-181d序列只有一个核苷酸不同[4]。两个成熟的miRNAs从同一miRNA前体上的两个臂上产生,从前体5′端或3′端上产生的成熟miRNAs分别用-5p或-3p后缀表示。来源于-5p和-3p的miR-181成员是否有相似的生物学功能目前还不清楚。由于-5p和-3p的miR-181成员种子区域不同,它们可能靶向作用于不同的基因和通路。虽然-5p来源的miR-181有相同的种子区域,但其基因靶点不同。如白血病抑制因子是miR-181d而不是miR-181a的靶点[5]。
研究表明,miR-181可通过调控血管炎症和免疫反应参与As的进程,如miR-181a可以在转录水平下调白细胞介素-1α(Interleukin-1α,IL-1α)的表达而减轻炎症[6];靶向树突状细胞(dendritic cells,DCs)中关键的炎症性转录因子c-Fos反馈抑制ox-LDL诱导的免疫炎症反应[7];高水平的miR-181a还可以增强T细胞对抗原的敏感性[8]。miR-181b可通过调节内皮细胞中NF-κB信号通路来调节血管炎症反应[9];miR-181c通过与白细胞介素-2(IL-2)结合,影响CD4+T细胞的激活[10]。见表1。
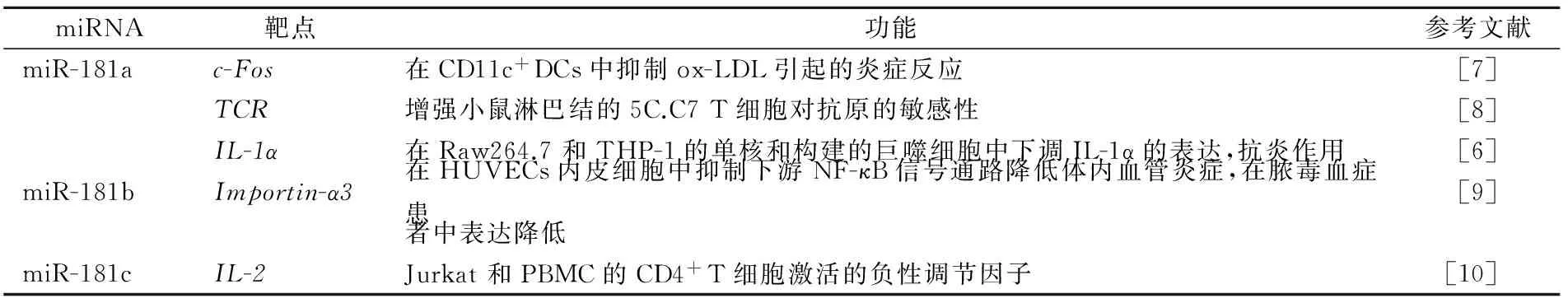
表1 miR-181的靶点和功能
2 miR-181家族的潜在临床价值
目前,有关miR-181家族成员的临床研究主要集中于自身免疫病、血液病和肿瘤等疾病,是潜在的一些疾病的诊断或预后指标。临床实验结果表明,miR-181a可作为SLE活动度评估的标志物[11],是非小细胞肺癌患者潜在的生存预后指标[12];miR-181b不仅与晚期胃癌、肺癌[13]和结肠癌[14]的预后相关,还有望成为甲状腺癌的诊断指标[15],亦是慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)进展期的标志物[16]。miR-181c可能参与胰腺癌[17]、肺腺癌[18]和卵巢癌[19]的恶化,是乳腺癌潜在的治疗靶点[20]以及诊断胃癌的标志物[21]。miR-181d有望成为类风湿性关节炎和子宫内膜癌的早期诊断指标[22-23]。Marcucci等[24]报道miR-181家族在白血病细胞中表达下调,可能促进急性髓细胞白血病(acute myelocytic leukemia,AML)的进展。
近年来,有学者发现miR-181家族参与炎症反应[9]。
Pessi等[25]研究细菌刺激24 h后miRNA在颈动脉内膜切除术患者平滑肌细胞(AthSMCs)和健康人平滑肌细胞(HSMCs)内的表达谱发现,miR-181a-5p和miR-181b-5p在AthSMCs和HSMCs中表达有显著差异。另有研究发现,与正常血管相比,人As斑块中miR-181a的表达明显升高,miR-181a过表达可促进氧化应激导致的内皮细胞(endothelial cells,ECs)功能紊乱。BCL-2是miR-181a在ECs中直接的作用靶点,其在As斑块中表达与miR-181a呈负相关;提示抑制miR-181a的表达可能有助于As的治疗[26]。As患者血清中miR-181b的表达水平明显降低[27],可能调控血管炎症和免疫相关的信号通路。缺血性脑卒中是As性脑血管疾病,另有多项研究发现,脑缺血时miR-181家族表达发生变化。如在经过大脑中动脉闭塞(MCAO)模拟脑缺血的大鼠模型中,脑组织中miR-181d表达持续上调[28];在类似的小鼠模型中亦发现miR-181a在小鼠缺血中心区表达上调,在海马半影区及小神经胶质细胞中表达下调[29],这些结果亟需临床实验的进一步验证。迄今,有关miR-181在As性心脑血管疾病的临床研究报道仍较少,但miR-181在疾病中的作用日趋受到关注,已成为其当前研究的热点之一。
3 miR-181家族在As相关血管炎症中的作用
血管炎症性内皮损伤已被认为是As发生的始动环节。已发现大量miRNAs在ECs中表达,可能参与调节ECs功能,如炎症反应等[27]。研究表明,ECs中miR-181家族成员可通过调节NF-κB信号通路、内皮细胞激活相关分子[9]和免疫细胞稳态等来调控血管炎症反应[8]。
NF-κB信号通路与ECs的激活和功能紊乱密切相关。炎症反应时,细胞因子和病原相关分子(pathogen-associated molecular patterns,PAMPs)通过刺激Toll样受体(Toll-like receptors,TLRs)等细胞表面受体引发ECs内信号级联反应,激活NF-κB,启动目的基因的表达以介导细胞增殖、释放抗菌分子和细胞因子,从而诱导免疫反应发生[30]。Sun等[9]研究结果显示:miR-181b可以调控NF-κB介导的血管炎症反应。Importin-α3(IPOA3)是NF-κB核转移的关键蛋白质,miR-181b可通过靶向抑制IPOA3蛋白的表达,抑制 NF-κB的核转移,使NF-κB调控的下游蛋白质表达减少,如血管黏附分子1(VCAM-1)和E-选择素,进而缓解炎症反应。该课题组还发现[31],经高脂饮食诱导的As小鼠(ApoE-/-),其大动脉内膜中miR-181b表达较正常小鼠显著降低;给予miR-181b类似物静脉注射后,高脂饮食的ApoE-/-小鼠As形成受阻,炎症标志物的表达减少,巨噬细胞、CD4+T细胞等的炎症细胞汇聚受到抑制,进一步在体内证实miR-181b可通过抑制其靶基因IPOA3的表达,缓解炎症,抑制As形成。这些研究发现,miR-181b可能为诸如As这样的慢性炎症性疾病提供了一个新的治疗方法[32]。
4 miR-181家族在As中的免疫调节作用
炎症和免疫细胞的激活是As发生、发展的重要因素。多种miRNA参与调控免疫反应的过程。研究发现,miR-181不仅在单核/巨噬细胞[6]以及DCs[7]中具有介导抗炎的作用,而且在淋巴细胞的分化、激活和血管炎症方面发挥重要作用。
4.1 miR-181调节单核细胞、巨噬细胞和树突状细胞的功能 IL-1α可由活化的巨噬细胞分泌,是引起全身炎症反应最重要的因子之一[33]。研究表明,在小鼠和人的单核/巨噬细胞中miR-181a可以通过靶向IL-1α发挥抗炎作用;脂多糖(lipopolysaccharides,LPS)刺激THP-1和Raw264.7巨噬细胞24 h后,IL-1α的mRNA显著增加,而miR-181a的表达水平降低;给予miR-181a类似物后,可显著抑制IL-1α表达的增加。结果提示miR-181a可以在转录水平下调IL-1α的表达,进而调节炎症反应[6]。研究已证实,血浆中高水平氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是As发生的强危险指标[34]。Wu等[7]研究发现,miR-181a在高脂饮食ApoE-/-的小鼠中表达上调。miR-181a通过靶向DCs中关键的炎症性转录因子c-Fos反馈抑制ox-LDL诱导的免疫炎症反应。提示在As过程中,miR-181a可能是ox-LDL刺激引起的免疫炎症一个关键因子。
4.2 miR-181调节淋巴细胞的功能 研究发现在As病变区附近的动脉外膜中存在T淋巴细胞和B淋巴细胞。Zhou等[35]发现作为自身抗原的ox-LDL驱动的特异性CD4+T细胞免疫应答能加速As的发展。在易发生As的小鼠中,抗原递呈细胞(antigen-presenting cell,APC)与主动脉中的CD4+T细胞相互作用,可造成局部T细胞的活化和增殖,促进细胞因子(干扰素-γ,肿瘤坏死因子-α)的分泌,从而通过慢性炎症、诱导泡沫细胞的形成加速As进程[36]。Fayyad-Kazan等[37]研究发现,在活化的CD4+T细胞中,miR-181表达下调,同时干扰素-γ(IFN-γ)分泌增加;且证实miR-181可靶向调控IFN-γ的表达。在成熟T细胞中过表达miR-181a可增强T细胞对抗原的敏感性,可能与miR-181a在转录后水平调节T细胞受体(TCR)相关,提示miR-181a可作为T细胞发育过程中内在抗原敏感性的“信号变阻器”[8]。另有研究发现在miR-181a-1/b-1敲除的小鼠中,T细胞对自身抗原的内在反应性增强,但不引起自发的自身免疫,该结果表明miR-181a-1/b-1的缺失使外周血T细胞中TCR介导的信号通路受到抑制,从而调节免疫耐受[38]。Xue等[10]研究发现,在CD4+T细胞的激活过程中miR-181c的表达减少,转染miR-181c类似物后可部分抑制Jurkat细胞和外周血中CD4+T细胞的激活、增殖。进一步研究发现,miR-181c可以与IL-2的3′非编码区域结合,通过抑制转录降低其表达水平。提示miR-181c是CD4+T细胞激活的负性调节因子。
目前,有关As与B淋巴细胞的相关研究报道相对较少。Ait-Oufella 等[39]报道B淋巴细胞缺陷可减缓小鼠As病变进程。miR-181a对B细胞分化具有调节作用:miR-181优先表达于小鼠骨髓B淋巴细胞,其在造血干细胞/祖细胞中的异位表达可导致B系细胞比例增加[40]。恒定型自然杀伤T细胞(Invariant natural killer T-cells,iNKT)是天然免疫的重要组成细胞之一,是NKT细胞的亚型。已报道NKT细胞在As的形成中发挥重要作用[41]。Zietara等[42]发现miR-181a/b-1缺乏的小鼠iNKT细胞的早期发育几乎完全被阻滞,导致胸腺和外周血中iNKT细胞数急剧降低,提示miR-181a/b-1参与调控iNKT细胞的分化和发育,参与调控As进程。
5 展望
综上,miR-181家族成员是潜在的自身免疫性疾病和肿瘤等疾病的标志物。特别是miR-181b,有关其临床表达水平和下游调控机制的研究已多有涉及,为新的抗As的治疗药物的开发提供了理论依据。然而现有关于miR-181家族在As中的临床研究较少,且较为零散,缺乏系统性。因此,进一步系统性的探明As性疾病患者循环miR-181的表达、存在形式和相关炎症调控机制将为As性疾病的诊断,预后评估及治疗提供新思路。
[1]Weber C, Schober A, Zernecke A. MicroRNAs in arterial remodelling, inflammation and atherosclerosis[J]. Curr Drug Targets, 2010,11(8):950-956.
[2]于瑞杰, 汪俊军.microRNA在动脉粥样硬化发病机制中的作用[J]. 医学研究生学报, 2013, 26(9): 970-973.
[3]Ji J, Yamashita T, Budhu A,etal. Identification of microRNA-181 by genome-wide screening as a critical player in EpCAM-positive hepatic cancer stem cells[J]. Hepatology, 2009,50(2):472-480.
[4]Sun X, Sit A, Feinberg MW. Role of miR-181 family in regulating vascular inflammation and immunity[J]. Trends Cardiovasc Med, 2014,24(3):105-112.
[5]Belkaya S, Silge RL, Hoover AR,etal. Dynamic modulation of thymic microRNAs in response to stress[J]. PLoS One, 2011,6(11):e27580.
[6]Xie W, Li M, Xu N,etal. MiR-181a regulates inflammation responses in monocytes and macrophages[J]. PLoS One, 2013,8(3):e58639.
[7]Wu C, Gong Y, Yuan J,etal. microRNA-181a represses ox-LDL-stimulated inflammatory response in dendritic cell by targeting c-Fos[J]. J Lipid Res, 2012,53(11):2355-2363.
[8]Li QJ, Chau J, Ebert PJ,etal. miR-181a is an intrinsic modulator of T cell sensitivity and selection[J]. Cell, 2007,129(1):147-161.
[9]Sun X, Icli B, Wara AK,etal. MicroRNA-181b regulates NF-kappaB-mediated vascular inflammation[J]. J Clin Invest, 2012,122(6):1973-1990.
[10]Xue Q, Guo ZY, Li W,etal. Human activated CD4(+) T lymphocytes increase IL-2 expression by downregulating microRNA-181c[J]. Mol Immunol, 2011,48(4):592-599.
[11]陈明坤, 石磊, 谷明莉,等. 系统性红斑狼疮患者血清miR-181a检测的临床意义[J]. 中国实验诊断学, 2013, 17(12):2201-2204.
[12]Gao W, Yu Y, Cao H,etal. Deregulated expression of miR-21, miR-143 and miR-181a in non small cell lung cancer is related to clinicopathologic characteristics or patient prognosis[J]. Biomed Pharmacother, 2010,64(6):399-408.
[13]Zhu W, Shan X, Wang T,etal. miR-181b modulates multidrug resistance by targetingBCL2 in human cancer cell lines[J]. Int J Cancer, 2010,127(11):2520-2529.
[14]Zhao LD, Zheng WW, Wang GX,etal. Epigenetic silencing of miR-181b contributes to tumorigenicity in colorectal cancer by targeting RASSF1A[J]. Int J Oncol, 2016,48(5):1977-1784.
[15]Li D, Jian W, Wei C,etal. Down-regulation of miR-181b promotes apoptosis by targetingCYLDin thyroid papillary cancer[J]. Int J Clin Exp Pathol, 2014,7(11):7672-7680.
[16]Visone R, Veronese A, Rassenti LZ,etal. miR-181b is a biomarker of disease progression in chronic lymphocytic leukemia[J]. Blood, 2011,118(11):3072-3079.
[17]Chen M, Wang M, Xu S,etal. Upregulation of miR-181c contributes to chemoresistance in pancreatic cancer by inactivating the Hippo signaling pathway[J]. Oncotarget, 2015,6(42):44466-44479.
[18]龚雪, 莫冬萍,杨大恒,等.miRNA-181c对人肺腺癌细胞系SPC-A1增殖和侵袭的影响[J].临床检验杂志, 2015, 33(12): 900-903.
[19]Yao L, Wang L, Li F,etal. MiR181c inhibits ovarian cancer metastasis and progression by targetingPRKCDexpression[J]. Int J Clin Exp Med, 2015,8(9):15198-15205.
[20]Zhang WL, Zhang JH. miR-181c promotes proliferation via suppressingPTENexpression in inflammatory breast cancer[J]. Int J Oncol, 2015,46(5):2011-2020.
[21]Cui MH, Hou XL, Lei XY,etal. Upregulation of microRNA 181c expression in gastric cancer tissues and plasma[J]. Asian Pac J Cancer Prev,2013,14(5):3063-3066.
[22]Wang W, Zhang Y, Zhu B,etal. Plasma microRNA expression profiles in Chinese patients with rheumatoid arthritis[J]. Oncotarget, 2015,6(40):42557-42568.
[23]Widodo, Djati MS, Rifa′i M. Role of MicroRNAs in carcinogenesis that potential for biomarker of endometrial cancer[J].Ann Med Surg (Lond), 2016,7:9-13.
[24]Marcucci G, Radmacher MD, Maharry K,etal. MicroRNA expression in cytogenetically normal acute myeloid leukemia[J].N Engl J Med, 2008,358(18):1919-1928.
[25]Pessi T, Viiri LE, Raitoharju E,etal. Interleukin-6 and microRNA profiles induced by oral bacteria in human atheroma derived and healthy smooth muscle cells[J]. Springerplus, 2015, 4(1):1-8.
[26]Liu G, Li Y, Gao X,etal. microRNA-181a is upregulated in human atherosclerosis plaques and involves in the oxidative stress-induced endothelial cell dysfunction through direct targetingBcl-2[J]. Eur Rev Med Pharmacol Sci, 2016, 20(14):3092-3100.
[27]李晓丽,曹国良. 动脉粥样硬化患者血清微小RNA-181b的异常表达及其作用[J].中华心血管病杂志, 2015, 43(6): 516-520.
[28]Liu X, Li F, Zhao S,etal. MicroRNA-124-mediated regulation of inhibitory member of apoptosis-stimulating protein of p53 family in experimental stroke[J]. Stroke, 2013, 44(7):1973-1980.
[29]Ouyang Y B, Lu Y, Yue S,etal. miR-181 regulatesGRP78 and influences outcome from cerebral ischemia in vitro and in vivo[J]. Neurobiol Dis, 2012, 45(1):555-563.
[30]Hayden MS, Ghosh S. Shared principles in NF-kappaB signaling[J]. Cell, 2008,132(3):344-362.
[31]Sun X, He S, Wara AK,etal. Systemic delivery of microRNA-181b inhibits nuclear factor-kappaB activation, vascular inflammation, and atherosclerosis in apolipoprotein E-deficient mice[J]. Circ Res, 2014,114(1):32-40.
[32]Sun X, Belkin N, Feinberg M W. Endothelial microRNAs and atherosclerosis.[J]. Curr Atheroscler Rep, 2013, 15(12):608-612.
[33]Rider P, Carmi Y, Guttman O,etal. IL-1α and IL-1β recruit different myeloid cells and promote different stages of sterile inflammation[J]. J Immunol, 2011,187(9):4835-4843.
[34]Wang JJ, Han AZ, Meng Y,etal. Measurement of oxidized lipoprotein (a) in patients with acute coronary syndromes and stable coronary artery disease by 2 ELISAs: using different capture antibody against oxidized lipoprotein (a) or oxidized LDL[J].Clin Biochem, 2010,43(6):571-575.
[35]Zhou X, Robertson AK, Hjerpe C,etal. Adoptive transfer of CD4+T cells reactive to modified low-density lipoprotein aggravates atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2006,26(4):864-870.
[36]Koltsova EK, Garcia Z, Chodaczek G,etal. Dynamic T cell-APC interactions sustain chronic inflammation in atherosclerosis[J].J Clin Invest, 2012,122(9):3114-3126.
[37]Fayyad-Kazan H, Hamade E, Rouas R,etal. Downregulation of microRNA-24 and -181 parallels the upregulation of IFN-gamma secreted by activated human CD4 lymphocytes[J]. Hum Immunol, 2014,75(7):677-685.
[38]Schaffert SA, Loh C, Wang S,etal. Mir-181a-1/b-1 modulates tolerance through opposing activities in selection and peripheral T cell function[J]. J Immunol, 2015,195(4):1470-1479.
[39]Ait-Oufella H, Herbin O, Bouaziz JD,etal. B cell depletion reduces the development of atherosclerosis in mice[J]. J Exp Med, 2010,207(8):1579-1587.
[40]Chen CZ, Li L, Lodish HF,etal. MicroRNAs modulate hematopoietic lineage differentiation[J]. Science, 2004,303(5654):83-86.
[41]Bondarenko S, Catapano AL, Norata GD. The CD1d-natural killer T cell axis in atherosclerosis[J]. J Innate Immun, 2014,6(1):3-12.
[42]Zietara N, Lyszkiewicz M, Witzlau K,etal. Critical role for miR-181a/b-1 in agonist selection of invariant natural killer T cells[J]. Proc Natl Acad Sci USA, 2013,110(18):7407-7412.
(本文编辑:王海燕)
10.13602/j.cnki.jcls.2017.02.12
国家自然科学基金(81271904,81572074,81572073);国家重大科学仪器设备开发专项(2012YQ03026109)。
陆攀,1991年生,女,硕士研究生,研究方向为临床检验诊断学。
汪俊军,教授,博士研究生导师,E-mail:wangjj9202@163.com。
R446;R54
A
2016-10-28)

