木薯渣中乳酸菌的分离鉴定及其产酸能力分析
杨承剑,谢芳,梁辛,梁贤威*,李孟伟,李丽莉,彭开屏
(中国农业科学院广西水牛研究所广西水牛遗传繁育重点实验室,广西南宁530001)
木薯渣中乳酸菌的分离鉴定及其产酸能力分析
杨承剑,谢芳,梁辛,梁贤威*,李孟伟,李丽莉,彭开屏
(中国农业科学院广西水牛研究所广西水牛遗传繁育重点实验室,广西南宁530001)
该研究利用传统培养法从自然发酵木薯渣中分离得到9株菌,通过菌株形态、生理生化特征及16SrDNA基因序列分析方法对菌株进行鉴定。结果显示,这9株菌均为乳杆菌属(Lactobacillussp.),其中菌株Y5、Y13、M14为干酪乳杆菌(Lactobacillus casei),菌株Y6、Y12、M12为植物乳杆菌(Lactobacillusplantarum),菌株Y7为丘状乳杆菌(Lactobacilluscollinoides),菌株M9为副干酪乳杆菌(Lactobacillus paracasei),菌株M11为类布氏乳杆菌(Lactobacillus parabuchneri);产酸及耐酸试验结果表明这5种菌均具有较强的产酸能力及耐酸性,发酵6 h后发酵液中pH值可达4.5以下,其中菌株Y12和M14的产酸能力最强,在15 h后其pH值均在3.6以下,可用于木薯渣或其他青贮饲料发酵剂的研制。
木薯渣;乳酸菌;发酵;分离;产酸
广西是中国木薯生产的主产区,全区年产鲜薯250万~300万t,木薯经深加工后剩余众多废渣,如处理不当,会给周围环境带来严重污染问题。木薯渣是一种比较廉价的农作物附产物,含有多种氨基酸和对动物体有益的维生素。广西是水牛养殖大省,水牛资源丰富,全区水牛养殖总量达400多万头,把木薯渣作为水牛饲粮来源之一在广西是一种普遍现象。但木薯渣被用于饲料存在着蛋白质含量低、不易贮存和适口性差等缺陷[1-3]。利用接种特定种类微生物来发酵木薯渣并发生一系列复杂的生物化学反应,可改变木薯渣的物理化学性质,从而解决上述缺陷[1-2]。木薯渣自然发酵过程是一个复杂的微生物菌群更替过程,有大量的乳酸菌和酵母菌参与,主要由乳酸菌利用厌氧环境,迅速生长产生大量的乳酸和乙酸,从而抑制霉菌等腐败菌的生长。乳酸菌在青贮饲料发酵过程中起主要作用,接种乳酸菌使饲料pH迅速下降,抑制腐败菌迅速生长引起的大量蛋白水解[1],所以筛选优良的乳酸菌是木薯渣等青贮饲料化发酵成功的关键[2]。乳酸菌是促使木薯渣自然发酵的主要微生物,将其应用于饲料的微生物添加剂,可有效调节木薯渣内微生物区系,抑制有害菌的繁殖[3]。目前,关于从各种食品及环境样品中分离乳酸菌的报道较为常见[4-5],但对自然堆贮发酵木薯渣中乳酸菌的分离的研究尚少见。本试验采用菌株形态、生理生化学、生物梅里埃分析产品公司(analytic products incorporation,API)细菌鉴定系统及16S rDNA基因序列相结合的方法从自然发酵的堆贮木薯渣中筛选出繁殖速度快、产酸及耐酸能力强的优良乳酸菌并进行耐酸特性分析,以期为将其扩大培养后发酵木薯渣、调控木薯渣发酵过程、提高木薯渣堆贮发酵品质及后续制备饲料化乳酸菌发酵剂提供理论与实践依据。
1 材料与方法
1.1 材料与试剂
木薯渣样品:广西水牛研究所水牛种畜场。
MRS固体培养基:北京陆桥技术有限责任公司;M17固体培养基:青岛日水生物技术有限公司;MRS肉汤培养基:广东凯环生物科技公司;API 20 E及API 50 CH细菌鉴定系统:法国生物梅里埃股份有限公司;G1060革兰氏染色试剂盒:北京索莱宝科技有限公司;Ezup柱式细菌基因组DNA抽提试剂盒:生工生物工程(上海)股份有限公司;30%过氧化氢:天津市科密欧化学试剂有限公司;氯化钠:成都金山化学试剂有限公司;碳酸钙(CaCO3):西安裕华生物科科技有限公司;葡萄糖:上海依赫生物科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
尼康ECLIPSE 50i型正置生物显微镜:日本Nikon公司;DYCP-31DN DNA型电泳槽、DYY-5型稳压电泳仪:北京六一仪器厂;DK-8D型电热恒温水槽:上海一恒科学仪器有限公司;FR980型凝胶成像仪:上海复日科技仪器有限公司;2720型聚合酶链反应(polymerase chain reaction,PCR)仪:美国应用生物系统公司;SPX-150型生化培养箱:北京科伟永兴仪器有限公司;SW-CJ-1F型超净工作台:苏州苏洁净化设备有限公司;HC-2518R型冷冻高速离心机:北京京立离心机有限公司。
1.3 试验方法
1.3.1 木薯渣中乳酸菌的分离纯化
取混合均匀的木薯渣样品10 g溶解于90 mL无菌生理盐水中,在涡旋仪上充分混匀,梯度稀释成10-1~10-6浓度的样液。分别取各稀释度的样液200 μL,用无菌玻璃刮铲均匀涂布于含CaCO3的MRS固体培养基和M17固体培养基,于37℃培养24 h。挑取肉眼可见、生长较快、单个、有溶钙圈的菌落进行划线,反复分离、纯化,取纯化后典型菌落进行革兰氏染色镜检、过氧化氢酶试验[6-7]。选取革兰氏染色结果阳性、过氧化氢酶试验阴性的菌株,分别接种于灭菌的MRS肉汤培养基中增殖培养12 h,将菌株编号,于4℃冰箱中保存备用。
1.3.2 乳酸菌株的鉴定[6-8]
菌株的形态及初步鉴定:将纯化后的菌落接种于MRS固体培养基中,观察菌落形态,并进行革兰氏染色镜检,在生化显微镜下观察菌体形态特征。同时进行过氧化氢酶试验、发酵葡萄糖产气试验试验,考察菌株在不同pH(3.0、3.5、4.0、4.5、5.0、7.5)条件下的生长情况。
菌株生理生化鉴定:采用API 50 CH及API 20 E细菌鉴定系统检测乳酸菌对葡萄糖、果糖、棉籽糖等49种不同碳源的发酵能力。API 50CH鉴定系统专用于乳酸杆菌和相关菌的鉴定,API 20 E作为API 50CH的补充或球菌的鉴定[9],具体操作方法按产品说明书进行[10],将培养24 h的API试剂条分别取出读数,将结果输入API生化分析鉴定系统查询,即得到菌株的种属信息,对符合率>80%的,可认定为该菌株的具体种属[11]。乳酸菌DNA提取:使用生工Ezup柱式细菌基因组DNA抽提试剂盒,对菌株DNA进行提取,具体操作步骤参照产品说明书。
PCR扩增条件:使用康为世纪2×EsTaqMaster Mix进行PCR扩增,反应体系:2×EsTaqMaster Mix 25 μL,正向引物27F(10 μmol/L)1 μL,反向引物1492R(10 μmol/L)1 μL,模板DNA(<0.5 μg)1 μL,ddH2O 22 μL。反应条件:94℃预变性2 min,94℃变性30 s,56℃退火30 s,72℃延伸30 s,35个循环;72℃终延伸2 min。将乳酸菌基因PCR扩增成功的电泳目的条带片段回收,送生工生物(上海)有限公司进行测序。
系统进化树构建:运用BLAST程序将乳酸菌的代表序列与Genbank数据库中的序列进行比对(http://blast. ncbi.nlm.nih.gov/Blast)以寻找相似性最高的已知序列。用ClustalX 1.83软件进行多重比对,通过Mega 4.0软件计算出序列的系统进化距离,采用邻近法构建系统发育树,1 000次随即抽样,计算自举值以评估系统进化树的置信度。
1.3.3 菌株产酸速率测定
将乳酸菌按5%的接种量接种于MRS肉汤培养基中,37℃、3 000 r/min摇床培养,每隔3 h检测一次各乳酸菌发酵液的pH值,以培养时间为横坐标,菌株发酵液pH值为纵坐标绘制产酸速率曲线[12]。
2 结果与分析
2.1 木薯渣样品中乳酸菌的菌株形态、生理生化特征
本试验从木薯渣样品中共分离出9株乳酸菌(即菌株Y5、Y6、Y7、Y12、Y13、M9、M11、M12、M14),所有菌落均呈圆形,中央隆起,表面光滑湿润,边缘整齐,乳白色,周边有溶钙圈。木薯渣样品中乳酸菌的各菌株形态及生理生化特征结果如图1及表1所示。

图1 木薯渣中乳酸菌的细胞形态Fig.1 Cell morphology of lactic acid bacteria isolated from cassava residues
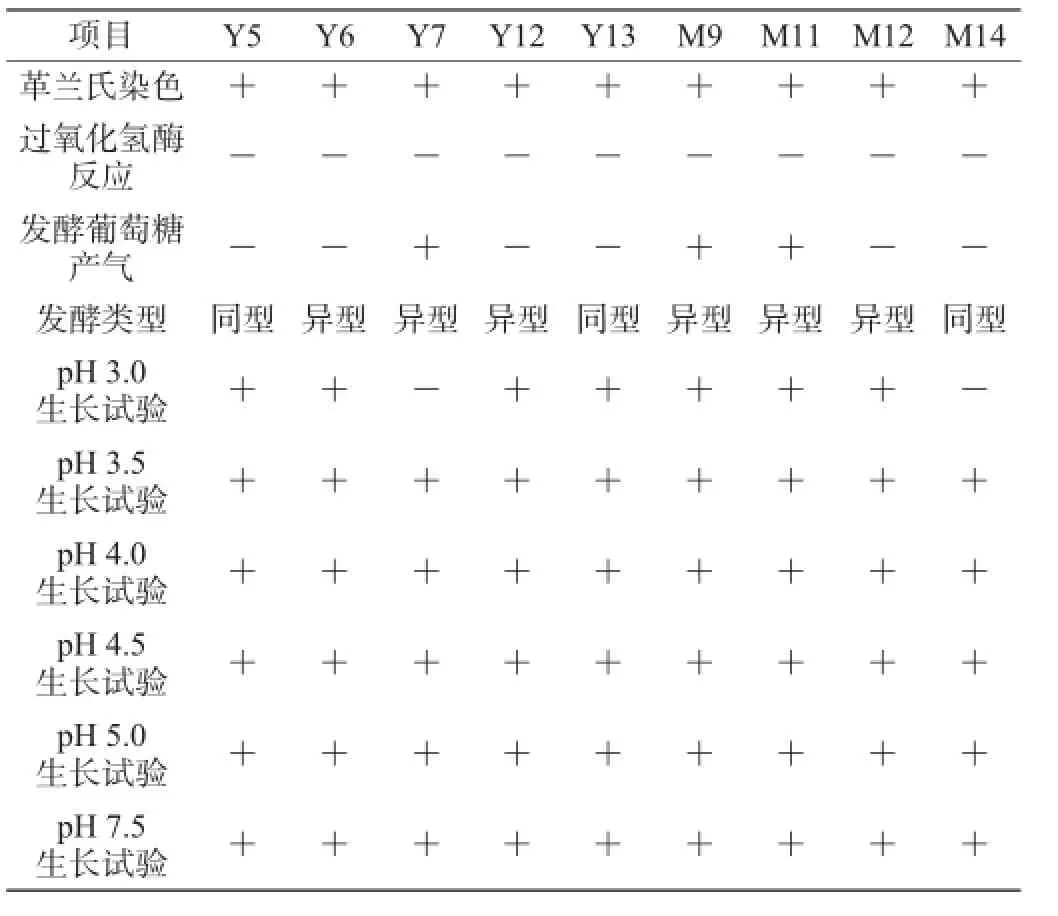
表1 木薯渣中乳酸菌生理生化特性鉴定结果Table 1 Identification results of physiological and biochemical characteristics of lactic acid bacteria isolated from cassava residues
由图1及表1可知,经革兰氏染色镜检观察,9株乳酸菌在显微镜下皆呈长杆、短杆状,不运动。所有菌株均为革兰氏阳性菌,在pH 3.5~7.5范围内都能够生长良好。
根据API对乳酸菌在不同碳源下的发酵特性可以初步判定菌株种属,其结果见表2。由表2可知,与干酪乳杆菌(Lactobacillus casei)相符合的菌株有3株,其符合率为95.2%;与植物乳杆菌(Lactobacillus plantarum)相符合的菌株有3株,其符合率为99.1%;与丘状乳杆菌(Lactobacillus collinoides)、副干酪乳杆菌(Lactobacillus paracasei)、类布氏乳杆菌(Lactobacillus parabuchneri)相符合的菌株各1株,其符合率均>88%。API鉴定系统可以快速鉴定菌株,较传统生化试验省时省力,但仅限于可培养菌的鉴定,对于非可培养菌的鉴定有一定限制,必须结合分子生物学技术来共同完成。因此,仍需要对目的菌株的16S rDNA进行扩增测序。
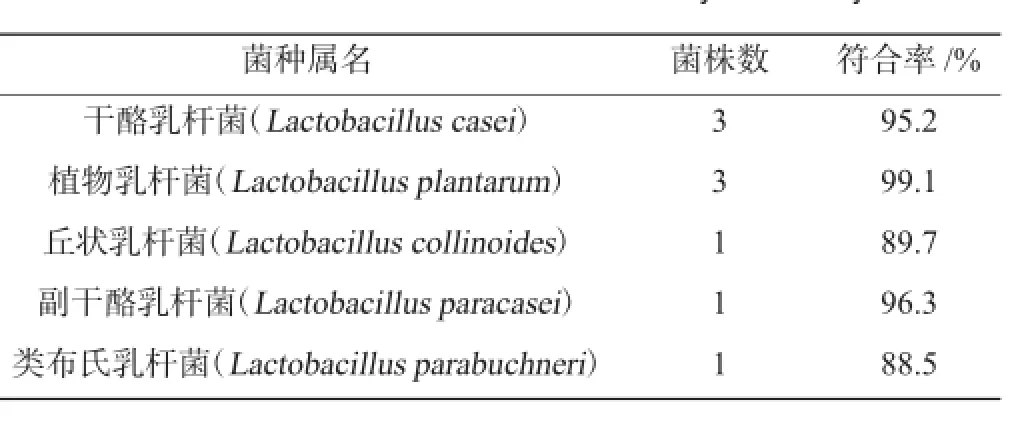
表2 菌株的API鉴定结果Table 2 3 Identification results of stains by API analysis
2.2 菌株16S rDNA鉴定结果
将分离到的9株乳酸菌,利用Ezup柱式细菌基因组DNA抽提试剂盒,提取其乳酸菌总基因组,对基因组进行16S rDNA基因PCR扩增[9],对扩增产物进行琼脂糖凝胶电泳分析,结果见图2。将所得菌株序列在NCBI数据库进行Blast对比,获得相似性较高的已知菌序列,然后运用Clustalx 1.83、Mega4等软件,以大肠杆菌(Escherichia coli)(NCBI登录号:X80725)为外群构建系统进化树,结果如图3所示。
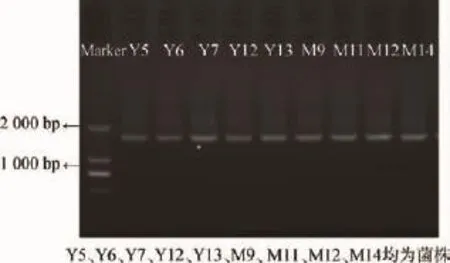
图29 株菌16S rDNA PCR扩增产物电泳图Fig.2 Electrophoretograms of 16S rDNA PCR amplified products of nine strains

图3 菌株16S rDNA基因序列系统发育树Fig.3 Phylogenetic tree of 16S rDNA gene sequence of strains
由图2可知,9株乳酸菌的16S rDNA PCR扩增产物大小为1 500 bp左右。与NCBI核酸数据库中的已知序列进行同源性比对,结果显示最相似已知菌皆为乳杆菌属(Lactobacillussp.),其中与干酪乳杆菌(Lactobacillus casei)最相似的菌株有3株(Y5、Y13、M14),与植物乳杆菌(Lactobacillus plantarum)最相似的菌株有3株(Y6、Y12、M12),与丘状乳杆菌(Lactobacillus collinoides)最相似的菌株有1株(Y7),与副干酪乳杆菌(Lactobacillus paracasei)最相似的菌株有1株(M9),与类布氏乳杆菌(Lactobacillus parabuchneri)最相似的菌株有1株(M11),其相似性均在99%以上。由图3可知,本试验所分离到的菌株分别位于乳酸菌属的两大分支上,但菌株Y6、Y12、M11、Y7及Y5在遗传距离上与其他已知菌株仍相隔较远。
2.4 菌株产酸速率比较
产酸速率与产酸量是筛选优良乳酸菌的重要指标。本试验对自然发酵木薯渣堆贮中筛选出的乳酸菌的产酸特性进行研究,5种乳酸菌发酵过程中产酸速率曲线如图4所示。

图45 种菌株产酸速率曲线Fig.4 Acid-producing speed curves of five strains
由图4可知,随着发酵时间的延长,5株乳酸菌发酵液中pH值逐渐下降,其中0~6 h降低幅度最大,6 h后即可达到pH 4.0~4.5,然后逐渐趋于平缓。除菌株M11外,其余的pH在15 h后均下降到4.0以下,其中菌株Y12和M14的产酸能力最强,在发酵15 h后,其pH值分别达到3.50和3.57。所分离的乳酸菌的产酸能力由强至弱的顺序为:菌株Y12(植物乳杆菌)>菌株M14(干酪乳杆菌)>菌株Y7(丘状乳杆菌)>菌株M9(副干酪乳杆菌)>菌株M11(类布氏乳杆菌)。MCDONLD P等[13-14]提出,青贮发酵剂的微生物应具有均一发酵途径,可利用葡萄糖等各种糖类快速发酵产生大量乳酸,从而快速降低pH,使pH降到4.0以下,以抑制其他微生物的生长;席琳乔等[15]从玉米青贮饲料中分离得到了2株干酪乳杆菌,可在pH 4.0~8.0条件下生长。
3 结论
本试验采用传统分离培养及16S rDNA基因序列分析方法从自然发酵的堆贮木薯渣中筛选出产酸及耐酸能力强的9株乳酸菌,分别为3株干酪乳杆菌(Lactobacillus casei)、3株植物乳杆菌(Lactobacillus plantarum)、1株丘状乳杆菌(Lactobacillus collinoides)、1株副干酪乳杆菌(Lactobacillus paracasei)、1株类布氏乳杆菌(Lactobacillus parabuchneri)。所筛选的菌株在pH 3.50~7.50均能生长,6 h产酸能力均达pH 4.5以下,其中菌株Y12和M14的产酸能力最强,在发酵15 h后,其pH值均在3.60以下,具有较强的产酸及耐酸性,完全符合WHITTENBURY R[16]制定的乳酸菌剂筛选标准的核心观点,皆可用于木薯渣堆贮的发酵,为后续制备木薯渣发酵饲料的乳酸菌发酵剂奠定了基础。
[1]WEINBERG Z,ASHBELL G,HEN Y,et al.The effect of applying lactic acidbacteriaatensilingontheaerobicstabilityofsilages[J].J Appl Bacteriol,1993,75(6):512-518.
[2]SEALE D R.Bacterial inoculants as silage additives[J].J Appl Bacteriol,1986,61(15):9-26.
[3]马静静,王小芬,程序,等.乳酸菌发酵使木薯淀粉残渣饲料化研究[J].农业工程学报,2008,24(6):267-272.
[4]朱军莉,赵进,朱雅霏.自然发酵蔬菜制品中降解亚硝酸盐乳酸菌的分离与鉴定[J].中国酿造,2015,34(6):39-42.
[5]娄利娇,胡萍,湛剑龙,等.分离自贵州侗族苗族发酵肉中两株乳酸菌的耐受特性分析[J].中国酿造,2015,34(11):126-130.
[6]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:3-5,54-57,100-102.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:370-410.
[8]BUCHNAN R,GIBBONS E.伯杰细菌鉴定手册[M].北京:科学出版社,1984:591-622.
[9]何蕾.我国传统奶制品中乳酸菌多样性研究[D].雅安:四川农业大学,2010.
[10]BOYD M A,ANTONIO M A D,HILLIER S L.Comparison of API 50 CH strips to whole-chromosomal DNA probes for identification ofLactobacillus species[J].J Clin Microbiol,2005,43(10):5309-5311.
[11]汪瑞忠,吴燕芬,刘艳,等.自制GNW21E反应板和API20E在革兰阴性杆菌鉴定中的结果比较[J].检验医学,2002,17(2):111-112.
[12]张慧杰,玉柱,王林,等.青贮饲料中乳酸菌的分离鉴定及优良菌株筛选[J].草地学报,2011,19(1):137-141.
[13]MEDONALD P,HENDERSON A R,HERON S J E.The biochemistry of silage[M].Marlow,UK:Chalcombe Publications,1991:399.
[14]WOOLFORD M K.The detrimental effects of air on silage[J].J Appl Bacteriol,1990,68:101-112.
[15]席琳乔,吴书奇,史卉玲,等.青贮玉米优良乳酸菌的分离与筛选[J].贵州农业科学,2016,44(3):102-105.
[16]WHITTENBURY R.An investigation of the lactic acid bacteria[J]. Curr Opin Biotech,1962,7(4):449-456.
Isolation,identification and acid-producing ability of lactic acid bacteria from cassava residues
YANG Chengjian,XIE Fang,LIANG Xin,LIANG Xianwei*,LI Mengwei,LI Lili,PENG Kaiping
(Guangxi Key Laboratory of Buffalo Genetics,Breeding and Reproduction,Guangxi Buffalo Research Institute, Chinese Academy of Agricultural Sciences,Nanning 530001,China)
Nine strains were isolated from natural fermentation cassava residues by traditional culture method and identified by morphology of strain, physiological and biochemical characteristics and 16S rDNA sequence analysis.The results showed that nine strains wereLactobacillussp.,and strains Y5,Y13 and M14 wereLactobacillus casei,strains Y6,Y12 and M12 wereLactobacillus plantarum,strain Y7 wasLactobacillus collinoides, strain M9 wasLactobacillus paracasei,strain M11 wasLactobacillus parabuchneri.The results of acid-producing and acid-resisting experiments showed that five strains all had stronger acid-producing ability and acid resistance.After fermentation of 6 h,the pH in fermentation liquor could be less than 4.50.The acid-producing ability of strains Y12 and M14 was the strongest,and the pH of strains Y12 and M14 were both less than 3.6 after fermentation of 6 h.It could be used for development and preparation of cassava residues or other silage starter cultures.
cassava residues;lactic acid bacteria;fermentation;isolation;acid-producing
Q939.9
0254-5071(2017)02-0089-04
10.11882/j.issn.0254-5071.2017.02.019
2016-09-05
广西自然科学基金面上项目(2014GXNSFAA118082);广西水产畜牧兽医局科技项目(桂渔牧科201352039);农业部948项目(2011-G26);广西水牛研究所人才小高地创新团队项目(水牛人才1501)
杨承剑(1981-),男,副研究员,博士,主要从事水牛营养与饲料科学研究工作。
*通讯作者:梁贤威(1962-),男,研究员,硕士,主要从事水牛营养与繁殖研究工作。

