玉米赤霉烯酮生物脱毒与降解的研究进展
刘盼,蔡俊*
(湖北工业大学生物工程与食品学院发酵工程教育部重点实验室工业发酵湖北省协同创新中心,湖北武汉430068)
玉米赤霉烯酮生物脱毒与降解的研究进展
刘盼,蔡俊*
(湖北工业大学生物工程与食品学院发酵工程教育部重点实验室工业发酵湖北省协同创新中心,湖北武汉430068)
玉米赤霉烯酮(ZEN)是由镰刀菌属(Fusarium.sp)产生的污染范围比较广的一种毒素,它在自然界中广泛存在。物理、化学脱毒法成本高且对人类、动植物有一定的损害,生物法因其具有高效性、无污染且降解率高而被科学界关注。该文概述了玉米赤霉烯酮的物理、化学和生物脱毒方法,并对脱毒后的产物进行了简要介绍,对不同降解菌株的降解机制以及降解酶基因的表达和产物毒性进行了综述。
真菌毒素;玉米赤霉烯酮;脱毒;生物降解
玉米赤霉烯酮(zearalenone,ZEN)是STOB M等[1]在1962年从有赤霉病的玉米中得到的一种真菌毒素,由镰刀菌产生,具有类雌激素性质,又称F-2毒素。1966年URRYW H等[2]确定了ZEN的化学结构,其化学名为6-(10-羟基-6-氧基-十一碳烯基)β-雷锁酸内酯,分子式为C18H22O5,具有内脂结构。它的分子质量为318 u,熔点为165℃,对热较稳定,120℃加热4 h不被降解。ZEN不溶于水、二硫化碳和四氯化碳,但可溶于碱性水溶液、乙醚、苯、氯仿、二氯甲烷、乙酸乙醋、醇类和酸类等物质,微溶于石油醚。研究发现ZEN的甲醇溶液在紫外光下呈现出明亮的绿-蓝色荧光[3]。在自然界中ZEN存在多种衍生物,比较常见的是α-zearalenol和β-zearalenol。其中α-zearalenol的毒性是ZEN毒性的3~4倍,但β-zearalenol的毒性要比ZEN的低[4-5]。
玉米赤霉烯酮具有很强的生殖毒性,能够与雌激素受体产生竞争性结合继而表现出雌激素活性。雌激素受体与ZEN结合后受体构型发生改变,转移到细胞核中进一步与染色质结合,调节基因转录和蛋白质合成这两大过程,因此使细胞的分裂和生长受到影响[6]。CONKOVA E等[7]给家兔口服ZEN,家兔血浆中碱性磷酸酶(alkaline phosphatase,ALP)浓度在7~14 d大幅度升高,与此同时丙氨酸氨基转移酶(alanine aminotransferase,ALT)和γ-谷氨酞胺转移酶(γ-glutamine tansferase,γ-GT)的浓度也有所升高,因此可知ZEN具有肝毒性。BANJERDPONGCHAI R等[8]通过实验验证了由ZEN引起的人类白血病细胞死亡的方式和机制。
世界各地的谷物以及农副产品中都能检测到ZEN的存在,王金勇等[9]调查发现中国饲料中玉米赤霉烯酮检出率也比较高。世界大部分国家规定粮食谷物和食品中的ZEN的含量为60~1 000 μg/kg[10],我国饲料卫生标准规定饲料中ZEN允许量<500 μg/kg[11],食品安全国家标准规定食品中ZEN的限量标准为60 μg/kg[12]。
玉米赤霉烯酮(ZEN)是由镰刀菌属产生的污染范围比较广的一种毒素,会进入人和动物体内产生雌激素效应的综合症状,特别是对于雌性哺乳动物而言,会影响其乳房发育、抑制多倍排卵,生殖周期紊乱,给种养殖业带来了很大的损失。本文对玉米赤霉烯酮的物理、化学和生物脱毒方法,以及对脱毒后的产物进行了简要的介绍,并对不同降解菌株的降解机制以及降解酶基因的表达和产物毒性进行了综述。以期通过研究微生物法降解ZEN的毒性,同时提高微生物酶在市场中的应用。
1 玉米赤霉烯酮的脱毒方法
玉米赤霉烯酮的脱毒方法有很多,主要分为物理法、化学法、微生物降解法。在进行脱毒的过程中需满足:(1)去除玉米赤霉烯酮毒性或者使之失去活性;(2)处理过的饲料不产生任何有毒的副产物;(3)破坏产玉米赤霉烯酮毒素的孢子或菌丝体;(4)脱毒时不能严重破坏产品的营养成分,保持其原有的营养价值;(5)要求考虑成本,技术具有可操作性。
物理法降解玉米赤霉烯酮包括高温处理、辐照处理、物理吸附等。高温处理是将被玉米赤霉烯酮污染过的粮食、谷物等在温度约为110~160℃烘烤,使能够产生ZEN的菌被杀死,这种方法较为古老,现在已经不采用。辐照法是指用电离辐射线辐照受污染的玉米,使菌体死亡。赵琳等[13]用γ-射线降解玉米粉中的ZEN,发现在辐照剂量为50 kGy时能降解43.28%的ZEN,该降解过程符合一级反应动力学。物理吸附法是采用毒素吸附剂来吸附ZEN,目前常用的吸附剂有蒙脱石、葡聚糖、活性炭等。GIRISH C K等[14]对火鸡分别喂养被真菌毒素污染过的玉米、没有被真菌毒素污染过的玉米、加入了一定量葡甘聚糖后被真菌毒素污染过的玉米,探究发现喂养被真菌毒素污染过的玉米的火鸡体内的淋巴细胞数减少,加入了一定量葡甘聚糖后火鸡体内被真菌毒素污染过的玉米毒素量降低,说明葡甘聚糖可以吸附ZEN。
化学法主要包括碱处理和氧化处理。通过玉米赤霉烯酮毒素与碱、氧化剂等的化学作用来降解谷物原料中的ZEN。MCKENZIE K S等[15]在含有ZEN的水溶液中通入质量分数为2%、10%、20%的臭氧,结果发现通入质量分数为10%的臭氧后可在15 s内完全降解ZEN,并用高效液相色谱法检测不到有毒的物质。
物理法成本过高,仅适合于部分食品生产过程中对ZEN的清除,并不适合大批量的储藏过程中受ZEN污染的粮食。化学法在添加化学试剂时会带来不确定的危害,而且用此方法脱毒时成本也较高。微生物法是利用微生物资源对玉米赤霉烯酮毒素进行降解,包括微生物吸附和微生物降解两种。表1对几种方法的实施方式以及其优缺点进行了总结。
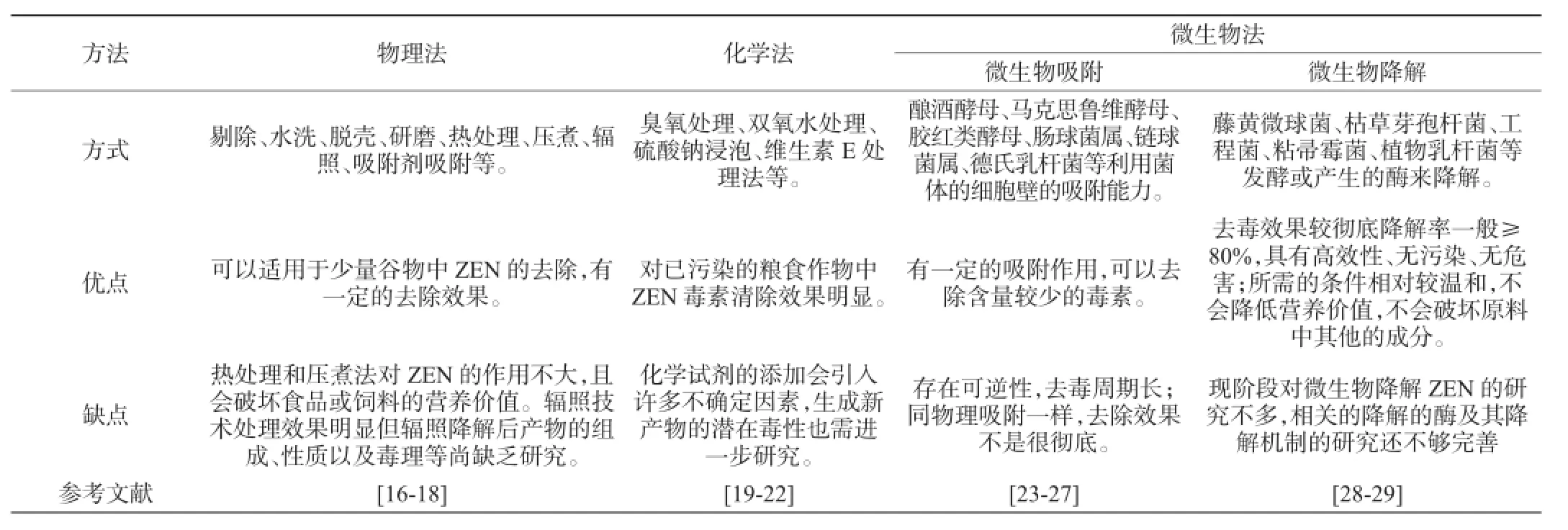
表1 玉米赤霉烯酮的脱毒方法Table 1 Detoxification methods of zearalenone
2 生物法降解玉米赤霉烯酮
从20世纪60年代起,科学家们开始用生物学的方法降解玉米赤霉烯酮毒素。研究发现微生物在吸附和降解玉米赤霉烯酮毒素时有重要作用,相比较物理化学法而言,生物法由于其没有毒副作用、效率高、专一性强,因此越来越受到学术界的关注。
2.1 微生物吸附玉米赤霉烯酮毒素
目前国内外研究发现,酵母细胞的细胞壁对玉米赤霉烯酮具有吸附作用。其吸附主体主要是细胞壁上的β-D-葡聚糖等多糖,吸附作用主要是这些多糖的疏水作用。当对酵母细胞进行热处理或酸处理时,细胞壁上的肽聚糖等多糖的糖苷键或肽键断裂从而使得肽聚糖结构变薄,孔径增大,增强了菌体对真菌毒素的吸附能力[30-31]。荣迪[32]以酵母细胞壁为原料提取β-D-葡聚糖作为ZEN一种吸附剂,并对得到的β-D-葡聚糖进行硫酸酯化改性处理,得到另一种ZEN吸附剂,对小鼠分别喂养ZEN和这两种不同的吸附剂,结果表明,喂养这两种吸附剂的小鼠肝脏损伤都得到缓解,且经过硫酸酯化改性处理的吸附剂对ZEN的吸附量更大。
YIANNIKOURIS A等[33]通过建立实验模型来验证酵母细胞壁提取物对ZEN的吸附作用,结果表明酵母细胞壁提取物是一种有效的吸附剂,对ZEN的吸附效果达到40%。ARMANDO M R等[34]用不同浓度的酿酒酵母与真菌毒素结合,实验发现不同浓度的酿酒酵母对ZEN均有一定的吸附能力。
TINYIRO S E等[35]研究表明枯草芽孢杆菌(Bacillus subtilis)168和纳豆芽孢杆菌(Bacillus natto)CICC 24640不仅对ZEN有吸附作用同时也有降解作用,这在目前也是一个新的发现。
2.2 微生物降解玉米赤霉烯酮
2.2.1 玉米赤霉烯酮降解产物的毒性
研究发现一些微生物法降解玉米赤霉烯酮可得到多种不同的产物,不同的产物结构有不同的毒性。由表2可知,一些酵母菌、根霉菌等能使ZEN降解为毒性低于它本身的物质或降解为无毒的物质,但当产物为α-zearalenol时其毒性高于ZEN,这种方式的转化是不可取的。
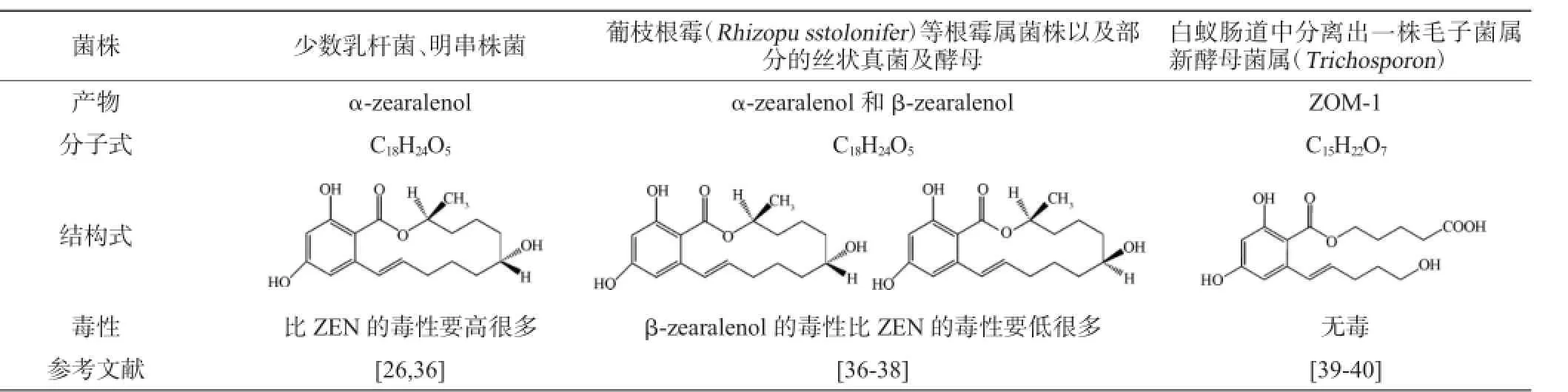
表2 玉米赤霉烯酮降解产物的类型Table 2 Types of degradation products of zearalenone
2.2.2 微生物酶降解玉米赤霉烯酮
目前,已发现很多微生物可以产生能降解ZEN的酶,其中某些内酯水解酶、蛋白酶、过氧化物酶等对ZEN的降解作用已得到国内外研究者的证实。余元善等[41-44]从以ZEN为唯一的碳源和能源的培养基上分离出一株不动杆菌(Acinetobacter)SM04,实验初期发现不动杆菌SM04在M1培养基中可以降解ZEN,并通过人乳腺癌细胞(MCF-7)增殖实验探究到降解过程中产生了微量的过氧化物,再用G50凝胶柱层析分离得到了能够降解ZEN的thiol-redoxin过氧化物酶,这种过氧化物酶的基因已经得到扩增,并成功地获得了表达,将会逐步应用于ZEN的检测和去除。
B.subtilis168和B.nattoCICC 24640在条件为30℃厌氧培养24 h可分别降解81%和100%ZEN(20 μg/mL),降解的产物是无雌激素毒性的,经初步判断这个降解过程中ZEN的脱羧反应与金属蛋白酶有关[35]。因此金属蛋白酶在降解ZEN时使ZEN结构发生变化也为研究人员在后续探究机制提供了一种合理的思路。
内酯酶也对玉米赤霉烯酮有降解能力。JUTERMARKJ等[38]从粉红粘帚霉(Gliocladium roseum)中得到一种可以促进ZEN进行水解的内酯酶,其作用的机制是通过去碳酸基将ZEN结构中的环形物打开,使ZEN失去毒性。
TAKAHASHI-ANDO N等[45-48]发现了一种由粉红螺旋聚孢霉产生的酶可降解ZEN,并得到了一种酵母重组基因ZHD101,将重组基因ZHD101进行表达得到重组酶,由于重组酶在降解ZEN的过程中产生了大量毒性低于ZEN的物质—β-zearalenol,因此在后续的实验中将这种重组酶的酶解条件进行优化,使其在28℃酶解48 h(或37℃酶解8 h)可完全降解ZEN且产物中无β-zearalenol聚集。
通过研究能够降解ZEN的酶的结构和性质,寻找降解ZEN酶的编码基因,并成功扩增基因片段进行活性表达,具有很好的应用前景。ALTALHI A D等[49-50]从土壤中分离出一株假单胞菌(Pseudomonassp.)ZEA-1,该菌株能够使ZEN降解为无毒或毒性很低的物质,并从中克隆出长度约5.5 kbp且包含能降解ZEN的编码基因,并成功地将这段基因在埃希氏肠杆菌中进行表达,表达后的产物依然能高效降解ZEN。
程波财等[51]将粉红螺旋聚孢霉(Gliocladium roseum)中能够降解ZEN的蛋白酶的基因进行扩增得到ZEN-jjm基因,通过序列比对和原核表达来确认这种蛋白酶具有降解玉米赤霉烯酮毒素的能力。谭强来等[52]构建了ZEN-jjm表达载体,用质粒pPIC9分泌表达载体,电转化至毕赤酵母(Pichia pastoris)GS115,通过聚丙烯酰胺凝胶电泳技术筛选出能表达降解酶的重组酵母,并采用高效液相色谱法证实重组酵母同样具有降解ZEN的能力。
3 总结与展望
玉米赤霉烯酮的生殖毒性严重影响着人和动物的健康,物理、化学法除ZEN存在着很大的弊端,微生物法去毒效果显著具有高效性且能将ZEN降解为无毒或毒性很低的物质,因此微生物法是最好的选择,这种去除方法也被越来越多的科学家所关注,主要研究ZEN的结构和毒性、微生物法降解ZEN的机制、降解产物的结构、降解酶等。
特别是微生物酶降解具有一定的市场价值。虽然能够降解ZEN的酶制剂已经在生产中得到了初步应用,但是市场的需酶量远远要高于,目前微生物降解玉米赤霉烯酮的产物分析及降解机制的分析仍然不够完善,因此为了保障人类及动植物的健康,应该投入更多的精力去研究关于玉米赤霉烯酮毒素的微生物降解。通过此研究可以提取出具有吸附作用的有效成分结合益生菌制出脱毒剂,也可将能够降解ZEN的酶分离纯化后得到酶制剂以此降低ZEN在日常生活中的毒性危害。
[1]STOB M,BALDWIN R S,TUITE J,et al.Isolation of an anabolic, uterotrophic compound from corn infected withGibberella zeae[J].Nature,1962,196(4861):1318.
[2]URRY W H,WEHRMEISTER H L,HODGE E B,et al.The structure of zearalenone[J].Tetrahedron Lett,1966,7(27):3109-3114.
[3]CHENG F Y,HAN M S,ONG C N.Intracellular thiol depletion causes mitochondrial permeability transition in ebselen-induced apoptosis[J]. Arch Biochem Biophys,2000,380(2):319-330.
[4]EL-SHARKAWAY S H,SELIM M I,AFIFI M S,et al.Microbial transformation of zearalenone to a zearalenone sulfate[J].Appl Environ Microbiol,1991,57(2):549-552.
[5]SAEGER S D,SIBANDA L,PETEGHEM C V.Analysis of zearalenone and α-zearalenol in animal feed using high-performance liquid chromatography[J].Anal Chim Acta,2003,487(2):137-143.
[6]邓友田,袁慧.玉米赤霉烯酮毒性机理研究进展[J].动物医学进展,2007,28(2):89-92.
[7]CONKOV□E,LACIAKOV□A,P□STOROV□B,et al.The effect of zearalenone on some enzymatic parameters in rabbits[J].Toxicol Lett, 2001,121(3):145-149.
[8]BANJERDPONGCHAI R,KONGTAWELERT P,KHANTAMAT O,et al.Mitochondrial and endoplasmic reticulum stress pathways cooperate in zearalenone-induced apoptosis of human leukemic cells[J].J Hematol Oncol,2010,3(1):104-108.
[9]王金勇,刘颖莉.2011年第三季度中国饲料和原料中霉菌毒素污染调查报告[J].今日养猪业,2012(1):30-31.
[10]ZINEDINE A,SORIANO J M,MOLTO J C,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:An oestrogenic mycotoxin[J].Food Chem Toxicol,2007, 45(1):1-18.
[11]中华人民共和国国家质量监督检验检疫总局.GB 13078.2—2006饲料卫生标准-饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量[S].北京:中国标准出版社,2006.
[12]中华人民共和国卫生部.GB 2761—2011食品中真菌毒素限量[S].北京:中国标准出版社,2011.
[13]赵琳,张瑞英,兰静,等.γ-射线降解玉米粉中玉米赤霉烯酮的效果及降解动力学研究[J].食品工业科技,2016,37(7):56-60.
[14]GIRISH C K,SMITH T K.Effects of feeding blends of grains naturally contaminated withFusariummycotoxins on small intestinal morphology of turkeys[J].Poult Sci,2008,87(6):1075-1082.
[15]MCKENZIE K S,SARR A B,MAYURA K,et al.Oxidative degradation and detoxification of mycotoxins using a novel source of ozone[J]. Food Chem Toxicol,1997,35(8):807-820.
[16]CHOI H J,AN T J,KIM J,et al.Postharvest strategies for deoxynivalenolandzearalenonereductioninstoredadlay(Coixlachryma-jobiL.) grains[J].J Food Prot,2014,77(3):466-471.
[17]YUKSEL C,BULLERMAN L B.Evaluation of reduced toxicity of zearalenone by extrusion processing as measured by the MTT cell proliferation assay[J].J Agr Food Chem,2005,53(16):6558-6563.
[18]尹青岗.玉米中玉米赤霉烯酮辐照降解技术研究[D].重庆:西南大学,2009.
[19]OUANES Z,ABID S,AVED I,et al.Induction of micronuclei by zearalenone in Vero monkey kidney cells and in bone marrow cells of mice:protective effect of vitamin E[J].Mutat Res,2003,538(1-2):63-70.
[20]ALLA E S A.Zearalenone:Incidence,toxigenic fungi and chemical decontamination inEgyptian cereals[J].Nahrung,1997,41(6):362-365.
[21]TRENHOLM H L,CHARMLEY L L,DAN B P,et al.Washing procedures using water or sodium carbonate-solutions for the decontamination of three cereals contaminated with deoxynivalenol and zearalenone [J].J Agr Food Chem,1992(11):335-341.
[22]POLAK M,GAJECKI M,KULIK T,et al.The evaluation of the efficacy of sodium carbonate as zearalenone destructor in feeding stuffs[J]. Pol J Vet Sci,2009,12(1):103-11.
[23]JOUANY J P.Methods for preventing,decontaminating and minimizing the toxicity of mycotoxins in feeds[J].Anim Feed Sci Tech,2007,137 (3):342-362.
[24]YIANNIKOURIS A,JOUANY J P.Mycotoxins in feeds and their fate in animals:a review[J].Anim Res,2002,51(2):81-99.
[25]BAKUTIS B,BALIUKONIENЁ V,PAЁ KEVI□IUS A.Use of biological method for detoxification of mycotoxins[J].Botanica Lithuanica, 2005,7:123-129.
[26]NIDERKORN V,MORGAVI D P,PUJOS E,et al.Screening of fermentative bacteria for their ability to bind and biotransform deoxynivalenol,zearalenone and fumonisins in anin vitrosimulated corn silage model[J].Food Addit Contam,2007,24(4):406-415.
[27]ELNEZAMI H,POLYCHRONAKI N,SALMINEN S,et al.Binding rather than metabolism may explain the interaction of two food-Grade Lactobacillusstrains with zearalenone and its derivative α-z earalenol [J].Appl EnvironMicrobiol,2002,68(7):3545-9.
[28]郝小龙.玉米赤霉烯酮降解工程菌的发酵优化及其应用[D].郑州:河南工业大学,2013.
[29]刘海燕,孙长波,伍松陵,等.玉米赤霉烯酮降解酶基因的克隆及在毕赤酵母中的表达[J].中国粮油学报,2011,26(5):12-17.
[30]NIDERKORN V,BOUDRA H,MORGAVI D P.Binding ofFusarium mycotoxinsbyfermentativebacteriainvitro[J].J Appl Microbiol,2006, 101(4):849-856.
[31]HANI E N,NEKTARIA P,KUN L Y,et al.Chemical moieties and interactions involved in the binding of zearalenone to the surface ofLactobacillus rhamnosusstrains GG[J].J Agr Food Chem,2004,52(14):4577-4581.
[32]荣迪.酵母β-D-葡聚糖及衍生物对玉米赤霉烯酮吸附效果的研究[D].武汉:华中农业大学,2012.
[33]YIANNIKOURIS A,KETTUNEN H,APAJALAHTI J,et al.Compari-son of the sequestering properties of yeast cell wall extract and hydrated sodium calcium aluminosilicate in threein vitromodels accounting for the animal physiological bioavailability of zearalenone[J].Food Addit Contam,2013,30(9):1641-1650.
[34]ARMO M R,PIZZOLITTO R P,DOGI C A,et al.Adsorption of ochratoxin A and zearalenone by potential probioticSaccharomyces cerevisiaestrains and its relation with cell wall thickness[J].J Appl Microbiol, 2012,113(2):256-264.
[35]TINYIRO S E,WOKADALA C,XU D,et al.Adsorption and degradation of zearalenone byBacillusstrains[J].Folia Microbiol,2011,56(4):321-327.
[36]ELNEZAMI H S,CHREVATIDIS A,AURIOLA S,et al.Removal of commonFusariumtoxinsin vitroby strains ofLactobacillusandPropionibacterium[J].Food Addit Contam,2002,19(7):680-686.
[37]JANOS V,ZSANETT P,KATALIN T,et al.Degradation of ochratoxin A and other mycotoxins byRhizopus isolates[J].Int J Food Microbiol,2005,99(3):321-328.
[38]UTERMARK J,KARLOVSKY P.Role of zearalenone lactonase in protection ofGliocladium roseumfrom fungitoxic effects of the mycotoxin zearalenone[J].Appl Environ Microbiol,2007,73(2):73-637.
[39]MOLNAR O,SCHATZMAYR G,FUCHS E,et al.Trichosporon mycotoxinivoranssp.nov.,a new yeast species useful in biological detoxification of various mycotoxins[J].Syst Appl Microbiol,2004,27(6):661-671.
[40]VEKIRU E,HAMETNER C,MITTERBAUER R,et al.Cleavage of zearalenone byTrichosporon mycotoxinivoransto a novel nonestrogenicmetabolite[J].Appl Environ Microbiol,2010,76(7):2353-2359.
[41]YU Y,QIU L,WU H,et al.Degradation of zearalenone by the extracellular extracts ofAcinetobactersp.SM04 liquid cultures[J].Biodegradation,2011,22(3):613-22.
[42]YU Y,HUI W,TAGN Y,et al.Cloning,expression of a peroxiredoxin gene fromAcinetobactersp.SM04 and characterization of its recombinant protein for zearalenone detoxification[J].Microbiol Res,2012, 167(3):121-126.
[43]YU Y,QIU L,WU H,et al.Oxidation of zearalenone by extracellular enzymes fromAcinetobactersp.SM04 into smaller estrogenic products [J].World J Microb Biot,2011,27(11):2675-2681.
[44]TANG Y,XIAO J,YI C,et al.Secretory expression and characterization of a novel peroxiredoxin for zearalenone detoxification inSaccharomyces cerevisiae[J].Microbiol Res,2013,168(1):6-11.
[45]TAKAHASHI-ANDO N,TOKAI T,HAMAMOTO H,et al.Efficient decontamination of zearalenone,the mycotoxin of cereal pathogen,by transgenic yeasts through the expression of a synthetic lactonohydrolase gene[J].Appl Microbiol Biot,2005,67(6):838-844.
[46]NAOKO T A,SHUICHI O,TAKEHIKO S,et al.Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene fromClonostachys rosea[J].Appl Environ Microbiol,2004, 70(6):3239-3249.
[47]HIGA-NISHIYAMA A,TAKAHASHI-ANDO N,SHIMIZU T,et al.A model transgenic cereal plant with detoxification activity for the estrogenicmycotoxinzearalenone[J].Transgenic Res,2005,14(5):713-717.
[48]TOMOKO I,NAOKO T A,NORIYUKI O,et al.Reduced contamination by theFusariummycotoxin zearalenone in maize kernels through genetic modification with a detoxification gene[J].Appl Environ Microbiol,2007,73(5):1622-1629.
[49]ALTALHI A D,ALTALH A D.Plasmid-mediated Detoxification of mycotoxin zearalenone inPseudomonassp.ZEA-1[J].Am J Biochem Biotech,2007,3(3):150-158.
[50]ALTALHI A D,EL-DEEB B.Localization of zearalenone detoxification gene(s)in pZEA-1 plasmid ofPseudomonas putidaZEA-1 and expressed inEscherichia coli[J].J Hazard Mater,2009,161(2-3):1166-1172.
[51]程波财,史文婷,罗洁,等.玉米赤霉烯酮降解酶基因(ZEN-jjm)的克隆、表达及活性分析[J].农业生物技术学报,2010,18(2):225-230.
[52]谭强来,徐锋,黎鹏,等.玉米赤霉烯酮降解酶毕赤酵母表达载体的构建及其表达[J].中国微生态学杂志,2010,22(12):1061-1064.
Research progress on biological detoxification and degradation of zearalenone
LIU Pan,CAI Jun*
(Hubei Collaborative Innovation Center for Industrial Fermentation,Key Laboratory of Fermentation Engineering(Ministry of Education), College of Biological Engineering and Food,Hubei University of Technology,Wuhan 430068,China)
Zearalenone,a kind of toxin produced byFusariumsp.and the wide pollution range is widespread in nature.The physical and chemical detoxification method had high cost and certain harmful to humans,animals and plants.Due to the high efficiency,non-pollution and high degradation rate,the biological method is concerned by the scientific community.The physical,chemical and biological detoxification method of zearalenone was summarized,the products after detoxification were introduced briefly,and the degradation mechanism of different degradation strains,expression of degrading enzyme gene and toxicity of products were summarized.
mycotoxin;zearalenone;detoxification;bio-degradation
S859.8
0254-5071(2017)02-0001-05
10.11882/j.issn.0254-5071.2017.02.001
2016-09-01
国家自然科学基金(31401807)
刘盼(1992-),女,硕士研究生,研究方向为玉米赤霉烯酮的生物降解。
*通讯作者:蔡俊(1968-),男,教授,博士,研究方向为发酵工程。

