产高光学纯度L-乳酸菌株HY-38发酵培养基优化
李秀康,徐慧,刘建军,*
(1.山东农业大学食品科学与工程学院,山东泰安271018;2.山东省食品发酵工业研究设计院,山东济南250013)
产高光学纯度L-乳酸菌株HY-38发酵培养基优化
李秀康1,徐慧2,刘建军1,2*
(1.山东农业大学食品科学与工程学院,山东泰安271018;2.山东省食品发酵工业研究设计院,山东济南250013)
以产L-乳酸光学纯度为99.3%的粪肠球菌(Enterococcus faecium)HY-38作为出发菌株,通过Plackett-Burman试验设计确定影响L-乳酸的产量的主要因素,筛选出3个有显著影响效应的因素,分别为葡萄糖、酵母膏及乙酸钠,最陡爬坡试验逼近影响因素最佳值区域,采用Box-Behnken设计及响应面分析对L-乳酸发酵培养基成分进行优化。结果表明,L-乳酸发酵培养基成分确定为葡萄糖148 g/L、酵母膏12.4 g/L、碳酸钙80 g/L、乙酸钠5.0 g/L、磷酸二氢钾1.0 g/L、硫酸镁1.2 g/L、硫酸锰0.04 g/L,在此条件下,L-乳酸的产量达到134.7g/L,比优化前(108.3 g/L)提高了24.3%。
L-乳酸;发酵优化;响应面法
乳酸(2-羟基丙酸)是一种简单且重要的有机酸,广泛应用于食品、医药、轻纺、化工和环保等领域[1]。在食品行业,乳酸主要用于酸奶和奶酪的生产以及食品防腐[2]。乳酸的构型可以分为L-乳酸、D-乳酸和DL-乳酸[3],由于人和动物体内只有代谢L-乳酸的酶,摄入过量D-乳酸会引起代谢紊乱甚至酸中毒[4],因此,与消旋的DL-乳酸相比,高光学纯度的L-乳酸具有更高的工业价值[5]。
据估计,乳酸的需求量以每年5%~8%的速率增长[6],预计到2017年,食品安全级的L-乳酸需求量将达到376300t,远远超出了目前的供给能力[7-8],全世界绝大部分乳酸的生产是通过微生物发酵合成的,乳酸生物合成的关键是同型发酵细菌[9],迄今为止,对以乳杆菌属为代表的多种属的细菌的研究取得了一些进展,对于肠道细菌发酵乳酸的研究较少,且产量较高的菌株L-乳酸的光学纯度不高,产品品质相对较低。本实验室多年来一直开展L-乳酸的研究,从牛瘤胃内容物中筛选出一株高产L-乳酸且光学纯度为99.3%的粪肠球菌(Enterococcus faecium)HY-38菌株。本研究在前期培养基单因素优化的基础上,采用Plackett-Burman试验、最陡爬坡试验及Box-Behnken试验对E.faeciumHY-38菌株产L-乳酸的发酵培养基进行优化,进一步提高L-乳酸的产量,以期为其工业化生产高光学纯度L-乳酸提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
粪肠球菌(Enterococcus faecium)HY-38:由山东省食品发酵工程重点实验室筛选保存。
1.1.2 培养基
斜面培养基:葡萄糖20 g/L,酵母膏4 g/L,磷酸二氢钾2 g/L,硫酸镁1 g/L,琼脂20 g/L。
种子培养基:葡萄糖20 g/L,酵母膏4 g/L,磷酸二氢钾2 g/L,硫酸镁1 g/L,碳酸钙10 g/L。
基础发酵培养基:葡萄糖120 g/L,酵母膏8 g/L,乙酸钠3 g/L,磷酸二氢钾2 g/L,硫酸镁1 g/L,硫酸锰0.1 g/L,碳酸钙70 g/L(碳酸钙与其他成分分开灭菌,在无菌条件下加入培养基),pH自然。
以上所有培养基均在121℃条件下灭菌20 min。
1.1.3 主要化学试剂
葡萄糖、酵母膏、乙酸钠(均为分析纯):北京奥博星生物技术有限责任公司;碳酸钙(分析纯):天津市广成化学试剂有限公司;磷酸二氢钙、硫酸镁、硫酸锰(均为分析纯):国药集团化学试剂有限公司;L-/D-乳酸检测试剂盒:爱尔兰Megazyme公司;L-乳酸标准品(色谱纯):上海源叶生物科技有限公司。
1.2 仪器与设备
U3000高效液相色谱仪(high performance liquid chromatograph,HPLC)、UltiMate 3000系列VWD-3000可变波长检测器:戴安(中国)有限公司;Prontosil1202102 C18色谱柱(10 μm,4.6 mm×250 mm):美国Thermo公司;Anke TDL-5-A台式离心机:上海安亭科学仪器厂;722可见分光光度计:上海菁华科技仪器有限公司;JY2002天平:上海精密科学仪器有限公司;UB-10pH计:丹佛仪器(北京)有限公司;GNP-9080型隔水式恒温培养箱:上海精宏实验设备有限公司;立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 培养方法
种子培养:从斜面培养基上挑取一环活化好的菌体HY-38接种到种子培养基(装液量为60 mL/250 mL)中,在37℃恒温培养箱中100 r/min振荡培养10 h。
摇瓶培养:将种龄为10 h的种子液按5%的接种量加入到发酵培养基(装液量为60 mL/250 mL)中,在37℃恒温培养箱中100 r/min振荡培养72 h。
1.3.2L-乳酸含量测定及L-乳酸标准曲线的测定
发酵液经12 000 r/min离心10 min除去菌体和多余的碳酸钙,取100 μL上清液稀释20倍,以0.22 μm微孔滤器过滤即为待测液。
采用高效液相色谱法测定发酵液中L-乳酸含量。色谱条件为:色谱柱为Prontosil 1202102 C18柱(10 μm,4.6 mm× 250 mm);UltiMate 3000系列VWD-3000可变波长检测器;流动相0.1 mol/L KH2PO4,磷酸调节pH至2.5;进样体积为20μL;流速为0.5mL/min;检测波长为210nm;柱温为30℃。
取0.250 gL-乳酸标准品充分溶解定容至25 mL的容量瓶中,分别吸取2mL、4mL、6mL、8mL定容于10mL容量瓶中,制得质量浓度梯度为2 g/L、4 g/L、6 g/L、8 g/L、10 g/L的L-乳酸标准溶液。标准曲线回归方程为Y=12.71X-0.378(R2=0.999 9)。
1.3.3 L-乳酸光学纯度测定
利用L-/D-乳酸检测试剂盒测定乳酸的光学纯度。L-乳酸的光学纯度的计算公式如下:

1.3.4 Plackett-Burman试验设计
Plackett-Burman设计是一种经济而有效的2水平试验方法,可以较少的试验快速地从众多影响因素中筛选出显著影响因素[10-11]。本试验在前期单因素试验的基础上,选用N=12的Plackett-Burman设计,选取葡萄糖、酵母膏、碳酸钙、乙酸钠、磷酸二氢钾、硫酸镁、硫酸锰7个因素进行考察,用Minitab 16软件对试验数据进行处理,以L-乳酸产量(Y)为响应值,Plackett-Burman试验设计因素与水平见表1。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments
1.3.5 最陡爬坡试验
响应面拟合方程只有在考察的邻域里才充分近似真实情形,首先要逼近最佳值区域后才能建立有效的响应面拟合方程[12]。通过Plackett-Burman试验设计结果筛选出显著影响因素,根据效应的大小设定步长及变化方向,以快速逼近最佳区域[13],而其他非显著因素的取值则根据各因素效应的正负来确定,正效应的因素均取较高值,负效应的因素均取较低值。找到L-乳酸产量最高的培养基方案,作为响应面分析的中心点,确定最大响应值的区域。
1.3.6 响应面分析试验方法
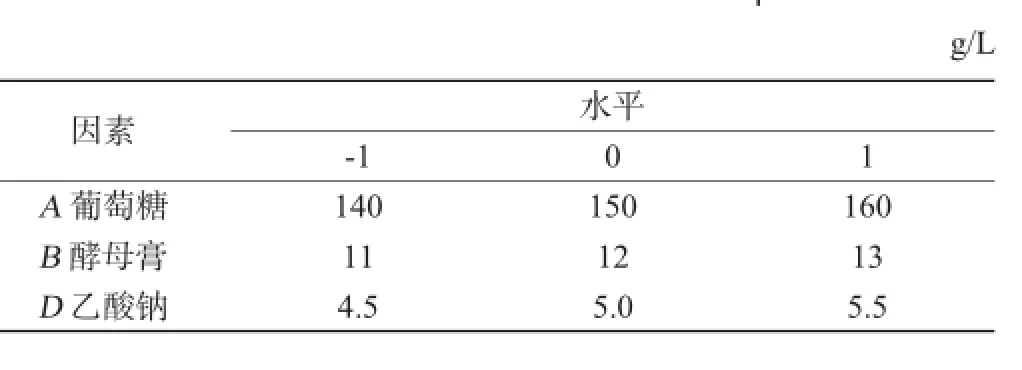
表2 Box-behnken试验因素与水平Table 2 Factors and levels of Box-behnken experiments
通过Plackett-Burman试验确定3个显著因素,最陡爬坡试验确定了3个显著因素响应区域的中心点,从3个显著因素的响应区域各取3水平[14],根据Box-Behnken试验的中心组合设计原理,用Minitab16软件设计Box-Behnken试验[15-16]并进行数据分析,Box-Behnken试验因素与水平见表2。
2 结果与分析
2.1 Plackett-Burman设计及结果分析
按Plackett-Burman设计进行试验,每组进行3次平行试验,摇瓶发酵72 h,以L-乳酸产量为响应值,结果取3次的平均值。Plackett-Burman试验设计及结果见表3,各因素效应及显著性分析见表4。

表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experimental design
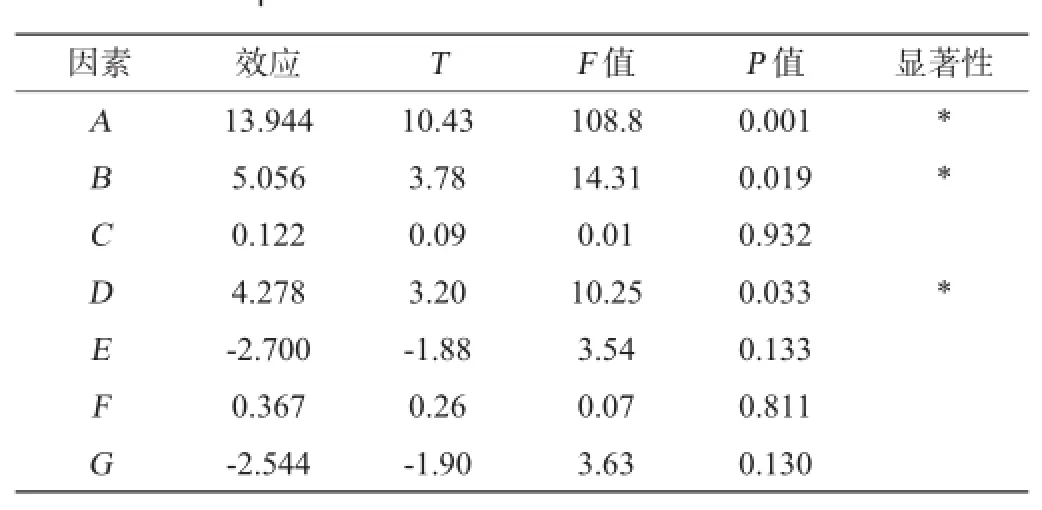
表4 Plackett-Burman试验显著因子分析Table 4 Analysis of significant factors of Plackett-Burman experiments
由表4可知,葡萄糖、酵母膏、碳酸钙、乙酸钠、硫酸镁对L-乳酸产量表现为正效应,磷酸二氢钾和硫酸锰对L-乳酸产量表现为负效应。其中葡萄糖、酵母膏、乙酸钠,表示其对L-乳酸产量有显著性影响(P<0.05),由P值的大小可知,发酵培养基中葡萄糖添加量对L-乳酸影响最大,其次为酵母膏添加量和乙酸钠添加量。而碳酸钙、磷酸二氢钾、硫酸镁、硫酸锰对L-乳酸产量影响不显著。因此确定葡萄糖、酵母膏、乙酸钠为主要影响因素进行下一步试验。
2.2 最陡爬坡试验设计及结果
根据Plackett-Burman设计分析结果,葡萄糖、酵母膏和乙酸钠表现为显著正效应,所以最陡爬坡试验设计沿葡萄糖、酵母膏和乙酸钠添加量增大的方向移动。显著因素的变化步长及方向的最陡爬坡试验设计及结果见表5。

表5 最陡爬坡试验设计及结果Table 5 Design and results of steepest ascent path experiments
由表5可知,第3组L-乳酸的产量最高,即葡萄糖150g/L,酵母膏12 g/L,乙酸钠5 g/L时,L-乳酸产量为133.3 g/L,因此选择第3组的水平作为响应面设计的中心点,即葡萄糖150 g/L,酵母膏12 g/L,乙酸钠5 g/L。
2.3 Box-Behnken试验设计及响应面试验分析
通过最陡爬坡试验确定了葡萄糖、酵母膏和乙酸钠的最佳添加量范围,以L-乳酸产量(Y)为响应值。依据Box-Behnken试验的中心组合设计原理,在显著因素的响应区取3个水平,利用Minitab 16软件设计3因素3水平的响应面试验,Box-Behnken试验设计及结果见表6,方差分析结果见表7。

表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken experiments
利用软件Minitab 16对表6数据结果进行回归分析,获得葡萄糖、酵母膏和乙酸钠的二次回归方程为:
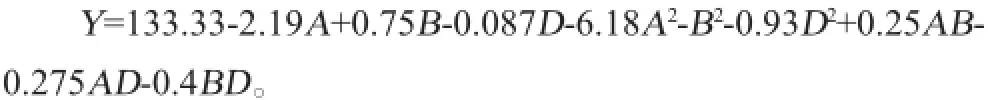

表7 回归模型的方差分析Table 7 Variance analysis of regression model
由表7可知,因素A、B、A2、B2和D2的影响达到显著水平(P<0.05),而因素D、AB、AD、BD的影响未达到显著水平(P>0.05),说明在试验设计范围内,葡萄糖和酵母膏对L-乳酸产量影响显著,乙酸钠影响不显著。模型P<0.001,失拟项P值为0.402 4>0.05,表明该方程模型回归显著,失拟不显著,试验方法可行。该模型的决定系数R2=0.995 5,调整决定系数R2Adj=0.987 3,说明回归方程的拟合程度较好,通过该方程得到的预测值与实测值之间有较高的相关性,可以用于L-乳酸产量的理论预测。
2.4 最佳培养基浓度的预测与验证
利用软件Design-Expert绘制各因素交互作用的响应曲面及等高线,确定葡萄糖、酵母膏及乙酸钠添加量对E.faeciumHY-38产L-乳酸的影响,响应面和等高线见图1。
由图1可知,随着葡萄糖、酵母膏、乙酸钠的添加量的增加L-乳酸产量都出现先增大后减小的趋势,其中葡萄糖对L-乳酸产量影响最大,乙酸钠对L-乳酸产量影响最小。葡萄糖、酵母膏和乙酸钠在试验范围水平内交互作用不显著,三个响应面都呈抛物面状,说明有极值点。为了进一步求证最佳值,对回归方程分别求一阶偏导得到发酵培养基最佳成分为:葡萄糖、酵母膏、乙酸钠的添加量分别为148.3 g/L、12.37 g/L、4.95 g/L,在此条件下,L-乳酸产量的预测为133.7 g/L。为了验证建立的模型与实验结果是否相符,同时考虑到实际操作的可行性,将培养基成分调整为葡萄糖148 g/L,酵母膏12.4 g/L,乙酸钠5.0 g/L,进行3组平行试验,得到L-乳酸的平均产量为134.7 g/L,与预测值接近,比优化前(108.3 g/L)提高了24.3%,进一步说明响应面法优化E.faeciumHY-38产L-乳酸最佳培养基成分是可行的。

图1 葡萄糖、酵母膏和乙酸钠交互作用对L-乳酸产量影响的响应面和等高线Fig.1 Response surface plots an contour line of effects of interaction between glucose,yeast extract and sodium acetate on L-lactic acid yield
2.5 L-乳酸光学纯度检测结果
E.faeciumHY-38在最佳培养基条件下进行发酵培养,所得的L-乳酸通过试剂盒检测,L-乳酸光学纯度纯度为99.3%,说明该培养基条件对L-乳酸的光学纯度无影响。E.faeciumHY-38所产L-乳酸的光学纯度高于MOON S K等[17]报道的野生型乳酸菌所产的L-乳酸光学纯度(96.6%)和NGUYENCM等[18]研究的干酪乳杆菌LactobacillusparacaseiLA104所产的L-乳酸的光学纯度(97.3%)。
3 结论
本研究通过Plackett-Burman试验设计,得到葡萄糖、酵母膏和乙酸钠是影响E.faeciumHY-38菌株产L-乳酸的主要因素,通过最陡爬坡试验,获得了3个主要因素响应区域的中心点,为进行响应面分析确立了变化区间。采用Box-Behnken试验设计,得到摇瓶发酵产L-乳酸的最佳培养基配方为:葡萄糖148g/L、酵母膏12.4g/L、碳酸钙80 g/L、乙酸钠5.0 g/L、磷酸二氢钾1.0 g/L、硫酸镁1.2 g/L、硫酸锰0.04 g/L,经发酵培养后L-乳酸的产量达到134.7 g/L,与回归方程的预测值很接近,说明得到的模型可靠,比优化前(108.3 g/L)提高了24.3%,说明了响应面试验的有效性,且该菌种在优化培养基中进行发酵培养后,所产的L-乳酸光学纯度仍为99.3%,为其工业化生产高光学纯度L-乳酸提供了理论基础。
[1]秦浩,张伟国,葛向阳,等.高产L-乳酸干酪乳杆菌的选育及发酵条件研究[J].食品工业科技,2011,32(7):223-225.
[2]MARTINEZ F A C,BALCIUNAS E M,SALGADO J M,et al.Lactic acid properties,applications and production:a review[J].Trend Food Sci Technol,2013,30(1):70-83.
[3]张婵婵,潘丽军,赵丹丹.细菌发酵产L-乳酸优良菌株的选育[J].农产品加工,2006(10):23-26.
[4]于雷,雷霆,裴晓林,等.应用基因组改组选育耐糖L-乳酸高产菌株[J].食品科学,2007,28(9):369-373.
[5]ABDEL-RAHMAN M A,TASHIRO Y,SONOMOTO K.Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria:overview and limits[J].J Biotechnol,2011,156(4):286-301.
[6]李晓飞.拟干酪乳杆菌L-乳酸发酵工艺优化及中心碳代谢网络构建[D].上海:华东理工大学,2015.
[7]YADAV A K,CHAUDHARI A B,KOTHARI R M.Bioconversion of renewable resources into lactic acid:an industrial view[J].Crit Rew Biotechnol,2011,31(1):1-19.
[8]梁欣泉,李宁,任勤,等.代谢工程改造酿酒酵母生产L-乳酸的研究进展[J].中国生物工程杂志,2016,40(2):109-114.
[9]周颖,高晓峰,周晶,等.一株仅产L-乳酸的乳酸乳球菌发酵培养基的优化[J].食品科学,2015,36(9):84-88.
[10]张为巍,李元媛,周铭锋,等.产L-乳酸的鼠李糖乳杆菌发酵培养基的优化[J].广州化工,2012,39(7):79-82.
[11]刘松,李祝,周礼红,等.响应面法优化黑曲霉产纤维素酶的发酵条件[J].食品科学,2013,34(17):225-229.
[12]邢宏观,林建国,钟雪兆,等.响应面法优化丁酸梭菌发酵培养工艺[J].食品工业科技,2016,37(19):237-243.
[13]王建,罗红霞,于佳弘,等.响应面法优化复合乳酸菌培养条件[J].中国酿造,2016,35(2):66-69.
[14]王晓霞,赵晨,赵祥颖,等.响应面法优化假单胞菌产胞外多糖发酵培养基[J].中国酿造,2016,35(3):80-83.
[15]吴再强,邹慧斌,季更生,等.一株干酪乳杆菌ZW-63A产高光学纯L-乳酸的发酵优化研究[J].食品工业科技,2013,34(17):226-231.
[16]范宜晓,赵祥颖,张家祥,等.利用响应面法优化Bacillus subtilis SF4-3产3-羟基丁酮发酵培养基[J].食品科技,2013,38(3):18-22.
[17]MOON S K,WEE Y J,CHOI G W.A novel lactic acid bacterium for the production of high purity L-lactic acid,Lactobacillus paracaseisubsp.paracaseiCHB2121[J].J Biosci Bioeng,2012,114(2):155-159.
[18]NGUYEN C M,KIM J S,HWANG H J,et al.Production of L-lactic acid from a green microalga,Hydrodictyon reticulum,byLactobacillus paracaseiLA104 isolated from the traditional Korean food,makgeolli [J].Bioresource Tech,2012,110(6):552-559.
Optimization of fermentation medium for high optical purityL-lactic acid production by strain HY-38
LI Xiukang1,XU Hui2,LIU Jianjun1,2*
(1.College of Food Science and Engineering,Shandong Agricultural University,Taian 271018,China;2.Shandong Food& Fermentation Industry Research&Design Institute,Jinan 250013,China)
Using theEnterococcus faeciumHY-38 with 99.3%optical purity L-lactic acid as original strain,the main factors influencing the L-lactic acid yield were determined by Plackett-Burman experiments.The three factors with significant effect were screened,including glucose,yeast extract and sodium acetate,and optimum value of the main factors were determined steepest ascent path experiments.The results showed that the optimum components of L-lactic acid fermentation medium were as followed:glucose 148 g/L,yeast extract 12.4 g/L,CaCO380 g/L,sodium acetate 5.0 g/L, KH2PO41.0 g/L,MgSO41.2 g/L and MnSO40.04 g/L.Under the conditions,the yield of L-lactic acid could reach 134.7 g/L,which was 24.3%higher than that of before optimization(108.3 g/L).
L-lactic acid;fermentation optimization;response surface methodology
Q815
0254-5071(2017)02-0030-05
10.11882/j.issn.0254-5071.2017.02.007
2016-11-24
泰山学者建设工程专项(NO.ts20130919)
李秀康(1991-),男,硕士研究生,研究方向为工业微生物。
*通讯作者:刘建军(1962-),男,研究员,博士,研究方向为微生物资源利用。

