臭豆腐卤水微生物群落及其接种发酵
赵国忠,谢小芳,邸海波,陈卫*
(1.江南大学食品学院,江苏无锡214122;2.天津市静海区卫生监督所,天津301600)
臭豆腐卤水微生物群落及其接种发酵
赵国忠1,谢小芳1,邸海波2,陈卫1*
(1.江南大学食品学院,江苏无锡214122;2.天津市静海区卫生监督所,天津301600)
对样品臭豆腐卤水中微生物分离,应用传统微生物鉴定、细菌16S rRNA鉴定,探索不同微生物种属组成结构对臭豆腐品质作用以及风味的影响。分离鉴定了臭豆腐卤水中的主要细菌为漫游球菌(Vagococcuscarniphilus)、嗜冷杆菌属(Psychrobactersp.)、沙克乳杆菌(Lactobacillus sakei)、地衣芽孢杆菌(Enterococcus avium)、鸟肠球菌(Enterococcus devriesei),并在无菌条件下采用纯菌种以及混合菌种直接进行豆腐发酵。单一菌种发酵比混合菌种发酵的臭卤所制得的臭豆腐总体感官评价结果偏低。除空白发酵结果以外,菌株St2(嗜冷杆菌)发酵的臭豆腐样品总体评价最差。菌株St5(鸟肠球菌)发酵所得的臭豆腐样品色泽较好,香气成分也较浓郁。
臭豆腐;微生物分离鉴定;发酵
臭豆腐被西方人称为“东方奶酪”,是我国传统发酵豆制品,闻起来臭,吃起来香是臭豆腐的显著特点。臭豆腐是以大豆为原料加工成型的豆腐坯块后经臭卤浸渍制成的非即食性产品。其中制备臭豆腐的臭卤是用一些蔬菜、香辛料等植物为原料,经过加工、配制、发酵而成的汁液,具有特异的植物发酵液风味。臭豆腐的质量受豆腐坯的鲜嫩程度、卤汁的配方比例以及温度高低、时间长短的直接影响。臭豆腐生产的类型是根据环境条件、生活习性不同而定的。微生物在臭豆腐特殊风味以及高营养价值的形成过程中起到至关重要的作用[1]。臭豆腐卤水中的蛋白质可以被微生物分解为多肽及氨基酸,且释放出大量的氨及其它化合物,从而形成了臭豆腐的特殊风味[2]。
近年来,有关从臭豆腐卤水中分离出各种微生物的研究报道很多,但对于臭豆腐中微生物结构组成以及各种微生物在发酵过程中作用的研究较少。因此,通过研究臭豆腐中的微生物组成,研究其与品质的关系。为制备有风味贡献价值的多菌种发酵剂及臭豆腐的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
臭豆腐卤水:安徽农家自制。
实验所用试剂均为市售分析纯。
MRS培养基:蛋白胨10g/L,牛肉膏10g/L,酵母膏5g/L,柠檬酸氢二铵2 g/L,葡萄糖20 g/L,乙酸钠5 g/L,磷酸氢二钾2 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,琼脂18 g/L,pH 6.2~6.6。
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,琼脂18 g/L,pH 7.2。
平板计数琼脂(plate count agar,PCA)培养基:胰蛋白胨5g/L,酵母浸粉2.5g/L,葡萄糖1g/L,琼脂15g/L,pH 7.0。1.2仪器与设备
SW-CJ-2FD型超净工作台:苏州尚田洁净技术有限公司;MLS-3750型灭菌锅、-80℃超低温冰箱:日本三洋公司;GRP-9080型隔水式恒温培养箱:上海森信实验仪器有限公司;DYCP-31BN琼脂糖电泳槽:北京六一生物科技有限公司;Gel Doc XR+型凝胶成像仪、T100型PCR仪:美国BioRad公司;Allegra 6R冷冻离心机:德国贝克曼公司;101A-7B电热鼓风干燥箱:常州杰博森仪器有限公司;QP2010气质联用仪:日本岛津公司。
1.3 试验方法
1.3.1 菌落计数
采用平板涂布法,并用生理盐水对样品进行十倍梯度连续稀释,选取10-1~10-4四个稀释度,分别吸取200 μL样品稀释液均匀涂布于LB固体平板培养基上,于37℃好氧培养48 h后,根据生长情况选择合适的稀释梯度进行计数并记录。
1.3.2 菌株形态观察及菌株16S rRNA基因测序
显微镜观察:将培养基上形态不同的单菌落分别编号,观察平板上不同菌株的菌落形态特征并做及时记录与拍照。同时,选取特征菌株转至新的固体平板培养基上,作革兰氏染色后显微镜(油镜)下观察,并及时记录与拍照。根据革兰氏染色结果,选取不同形态特征的菌株活化后进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。其中上游引物27F序列:5′-AGAGTTTGATCCTGGCCTCA-3′,下游引物1492R序列:5′-GGTTACCTTG TTACGACTT-3′,扩增片段为1 500 bp。PCR体系50 μL:10×buffer5μL;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)5 μL;上游引物(25 μmol/L)0.5 μL;下游引物(25 μmol/L)0.5 μL;TaqDNA聚合酶0.5 μL;模板DNA 1.5 μL;ddH2O 37 μL。PCR扩增条件为:95℃预变性3 min;95℃变性10 s;55℃退火30 s;72℃延伸1 min;72℃延伸5 min,2~4步进行30个循环。产物送测序[3]。
1.3.3 接种发酵
以自然发酵编号0为对照,将平板形态特征不同的5株菌编号1~5,混合菌株编号6,加入豆腐中培养发酵(37℃好氧),对每种菌株的生长进行菌落计数,观察记录菌落计数结果[4]。
1.3.4 感官评价
经过基本筛选、培训和考核选取16名嗅觉灵敏的品尝员组成感官分析品评小组。臭豆腐的感官鉴定主要从色泽、形态、香气等几个品质指标进行分析。感官评定评分标准见表1[5]。

表1 臭豆腐感官评定标准Table 1 Sensory evaluation standard of stinky tofu
2 结果与分析
2.1 臭豆腐卤液中主要微生物的分离
分别对臭豆腐卤汁中的细菌和真菌菌落总数进行了测定[6]。臭豆腐样品在LB培养基上的菌落形态结果如表2所示。臭豆腐卤水微生物在培养基上表型不一样,证明卤水中所含的微生物多种多样。
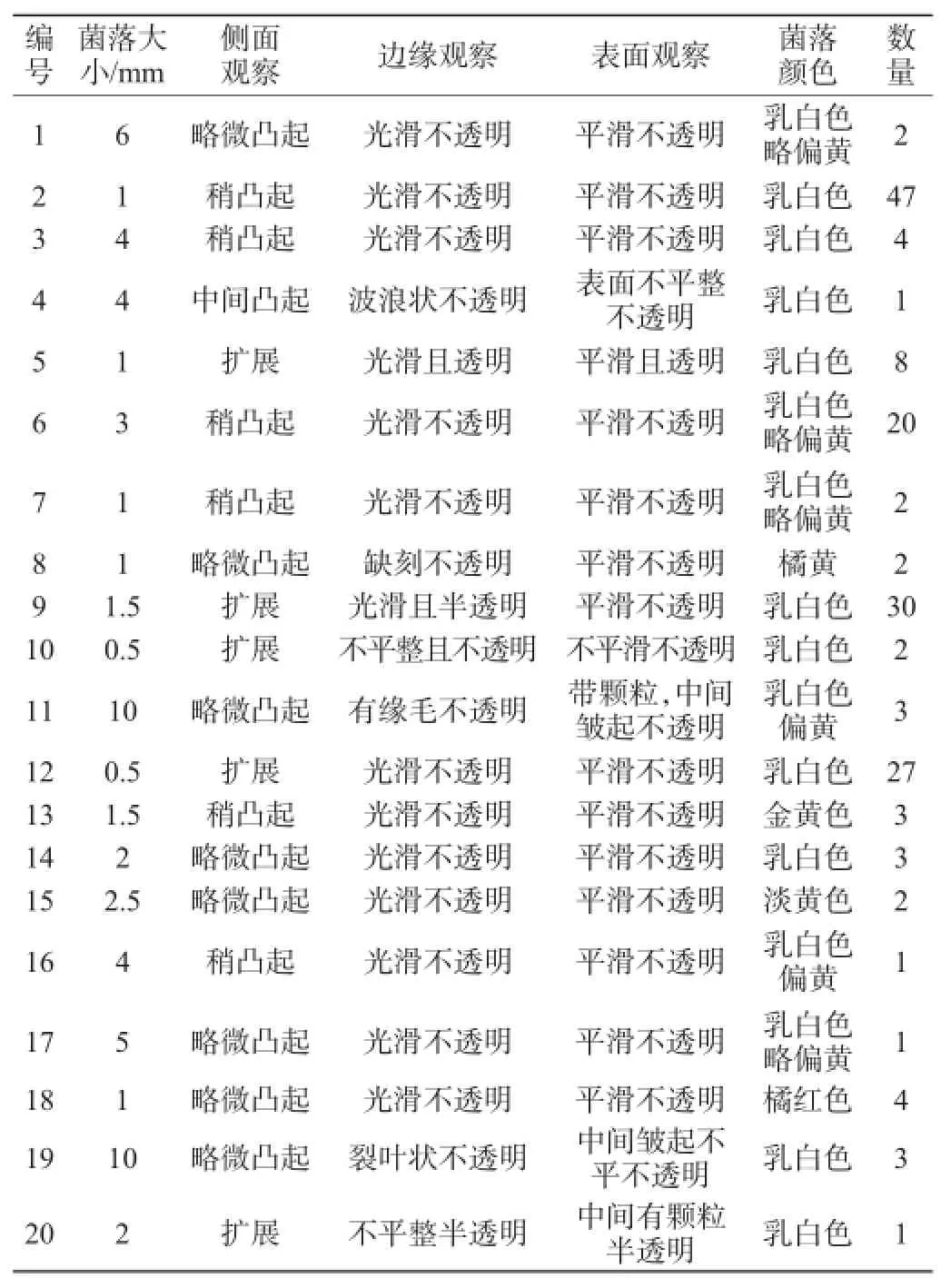
表2 臭豆腐LB培养基上的菌落形态Table 2 Colonial morphology of stinky tofu in LB plates
2.2 革兰氏染色
挑选形态不同的过氧化氢酶反应呈阳性的5株菌株,(菌株St1、St2、St3、St4、St5)经革兰氏染色后,在油镜下观察细菌的细胞形态,结果见图1。
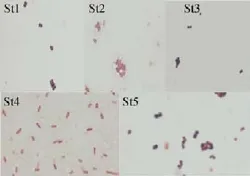
图1 菌株个体形态油镜观察结果(×1000)Fig.1 Cellular morphology observed by oil microscope(×1000)
由图1可知,从LB培养基中分离到5株形态不同的菌株。菌株St1为革兰氏阳性,紫色球菌;菌株St2为革兰氏阴性,是芽孢杆菌;菌株St3为革兰氏阳性,紫色的小球菌;菌株St4为革兰氏阴性,也是芽孢杆菌;菌株St5为革兰氏阳性的紫色球菌。
通过初步的菌株鉴定,根据细胞形态特征和革兰氏染色结果可以分离纯化得到这五种微生物,但具体菌株的种属仍不清楚,所以需要进行进一步实验来鉴定菌株种属。
2.3 细菌16S rRNA基因测序鉴定
细菌PCR扩增结果如图2所示,细菌16S rRNA鉴定结果见表3。
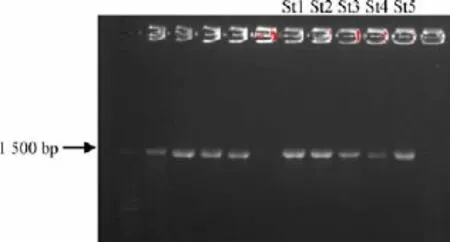
图2 细菌16S rRNA PCR琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of 16S rRNA PCR products

表3 细菌16S rRNA鉴定结果Table 3 Identification results of bacteria by 16S rRNA
由图2可知,5株菌都在1 500 bp左右处有亮条带。由表3的进一步16S rRNA鉴定结果可知,菌株St1为漫游球菌属(Vagococcus carniphilus);菌株St2为嗜冷杆菌(Psychroba-ctersp.);菌株St3为沙克乳杆菌(Lactobacillus sakei);菌株St4为地衣芽孢杆菌(Enterococcus avium);菌株St5为鸟肠球菌(Enterococcus devriesei);这些结果都与前面革兰氏染色初步鉴定的结果是一致的。
由图3可知,臭豆腐卤液中的菌株主要都是细菌。参考已报道的研究成果也能得知:郭华等[8]从臭豆腐的发酵卤液中分离得到的2个主要菌株经鉴定后初步确定是环状芽孢杆菌属以及奈瑟氏菌属。卢义伯等[9]采用定性、定量培养的方法,从臭豆腐的卤液中分离筛选得到的优势菌株则是荧光假单孢菌。而本实验分离得到的嗜冷杆菌,也在黑龙江克东腐乳、山东水豆豉中发现过同属菌株。
在臭豆腐卤液中真菌数量远小于细菌。真菌在臭豆腐发酵过程中起的作用则需进一步的研究。在臭豆腐形成的体系中,真菌,如丝孢酵母、毕赤酵母,在臭卤的制备以及发酵前期,它们和细菌是共生的作用,酵母主要起到分解的作用,然而后期浸卤过程中会由于食盐浓度的升高以及后面的氧气减少,细菌逐渐占据优势地位,而真菌慢慢停止生长。最后这些留在臭豆腐成品中的细菌对臭豆腐风味的形成起着重要的作用。推测臭豆腐中不同菌在不同组合下因为相互作用可能会有不同生长状况。因此,通过在无菌的条件下采用纯菌种以及混合菌株直接进行发酵,观察主要菌株在豆腐中的生长情况。
2.4 臭豆腐接种发酵
漫游球菌、嗜冷杆菌、沙克乳杆菌、地衣芽孢杆菌、鸟肠球菌5种单独菌株发酵的臭豆腐样品中,鸟肠球菌发酵的臭卤液中的菌落数最多,从某种程度上说,该菌株在好氧条件下于臭豆腐样品中生长的最好。地衣芽孢杆菌的菌落数最少,这种菌株在好氧条件下于臭豆腐样品中生长的最缓慢。相比于5种单独菌株的发酵,混合菌株在发酵后菌落数上升最明显,并且混合菌株在臭豆腐样品中的生长最旺盛。由此可见,微生物在豆腐样品中的生长是相互协同作用的结果,菌群协调才能使豆腐更好地发酵[10]。
混合菌株接种发酵前各菌属的比例是1∶1∶1∶1∶1,但是发酵以后,鸟肠球菌是主要优势菌株,漫游球菌数次之,而地衣芽孢杆菌的比例最低。由此可以推测,在臭豆腐样品发酵过程中,鸟肠球菌可能抑制了其他菌的生长,逐渐成为优势菌[11]。
2.5 感官评定结果
表4是对自然发酵、5种菌株单独发酵以及混合菌株发酵制得实验样品进行感官评价的结果(每项都是多次评价后取平均值)。其中0为自然发酵,1~5为St1~St5菌株单独发酵,6为混合菌株发酵(1∶1∶1∶1∶1)。

表4 臭豆腐样品感官评价结果Table 4 Sensory evaluation results of stinky tofu samples
由表4可以看出,实验样品0的臭豆腐感官评价最差,而实验样品6的臭豆腐感官评价最高。可见,在自然发酵情况下的臭豆腐样品的品质最差,而这些单一菌株相比于混合菌株制备发酵的臭卤所制得的臭豆腐总体感官评价结果都不高。其中菌株St3(沙克乳杆菌)发酵出的臭豆腐样品是总体评价中最好的,而菌株St2(嗜冷杆菌)发酵出的臭豆腐样品是总体评价中最差的。总体来看,这5种菌株对臭豆腐形态的影响都非常小,基本并没有太大的改变。在色泽方面,菌株St5(鸟肠球菌)发酵所制得的臭豆腐样品的色泽比较好,它制得的臭豆腐样品的香气成分也是较浓郁[12]。这些感官方面的差异可能跟不同菌种作用所产生的酶的种类不同有关,而酶活力大小也是影响臭豆腐样品品质的原因之一[13]。这说明单一菌株对臭豆腐样品的结构、品质、香气的影响主要表现在某个特定方面,对其最终风味形成的贡献还是相对单薄的[14]。而多种菌株之间会存在相互协同作用,这才是真正改变臭豆腐产品结构质地,继而改变臭豆腐的风味形成的主要原因[15]。
3 结论
本实验以臭豆腐卤水为研究对象,在特定条件下于不同的固体培养基上培养后,分离样品臭豆腐中的主要可培养微生物。从该臭卤样品中分离筛选出5种具有产生臭豆腐特征风味物质能力的菌株,再对菌株进行鉴定分别为:漫游球菌属(Vagococcus carniphilus)、嗜冷杆菌(Psychrobactersp.)、沙克乳杆菌(Lactobacillus sakei)、地衣芽孢杆菌(Enterococcus avium)以及鸟肠球菌(Enterococcus devriesei)。霉菌为近平滑念珠菌(Candida parapsilosis)、涎沫念珠菌(Candida zeylanoides);酵母为丝孢酵母(Trichosporon montevideense)、毕赤酵母(Pichia membranifaciens)。臭豆腐卤水中虽然也存在霉菌和酵母,但是比例较低。模拟臭豆腐的生产工序,用分离得到的单一菌株以及将它们混合后的菌株来制备发酵臭豆腐,对以此制得的实验样品进行分析,发现混合发酵比单一菌株发酵有更好的感官得分。
[1]亓顺平,翁新楚.非发酵臭豆腐挥发性风味物质的研究[J].食品科学,2007,28(12):400-404.
[2]HAN B Z,ROMBOUTS F M,NOUT M R.Amino acid profiles of sufu,a Chinese fermented soybean food[J].J Food Compos Anal,2004,17(6):689-698.
[3]徐寅,陈霞,顾瑞霞.臭豆腐乳酸菌多样性及耐酸乳酸菌的筛选分离[J].中国酿造,2010,29(2):22-24.
[4]邓放明,李罗明,尹华,等.碎鲜辣椒发酵制品发酵用乳酸菌的选育与接种发酵试验[J].食品科学,2005,26(3):106-109.
[5]张爱霞,生庆海.食品感官评定的要素组成分析[J].中国乳品工业,2006,34(12):51-53.
[6]孙贵朋,张雪娇,王妍,等.臭豆腐卤液中细菌多样性研究[J].现代食品科技,2010,26(10):1087-1091.
[7]赵志军,华兆哲,刘登如,等.碱性过氧化氢酶高产菌的筛选、鉴定及发酵条件优化[J].微生物学通报,2007,34(4):667-671.
[8]郭华,廖兴华,周建平,等.臭豆腐菌种分离鉴定与酿造工艺研究[J].食品科学,2004,25(4):109-115.
[9]卢义伯,潘超,祝义亮.臭豆腐发酵菌种的筛选与鉴定[J].食品科学,2007,28(6):246-249.
[10]韩江雪,丁筑红,李仲军,等.不同乳酸菌强化接种发酵辣椒挥发性风味成分分析[J].食品科学,2012,33(10):179-183.
[11]燕平梅,薛文通,畅晓晖,等.自然发酵和接种发酵方法对白菜品质的影响[J].农业工程学报,2008,24(3):286-290.
[12]刘玉平,苗志伟,黄明泉,等.臭豆腐中挥发性香成分提取与分析[J].食品科学,2011,32(24):228-231.
[13]蒋丽,王雪莹,杨洲,等.自然发酵与接种发酵泡菜香气成分分析[J].食品科学,2011,32(22):276-279.
[14]郑小芬,苏悟,蒋立文.两种臭豆腐卤水中挥发性成分的比较[J].中国酿造,2013,32(10):122-125.
[15]刘玉平,苗志伟,黄明泉,等.臭豆腐中挥发性香成分提取与分析[J].食品科学,2011,32(24):228-231.
Microbial species of stinky tofu brine and the inoculated fermentation
ZHAO Guozhong1,XIE Xiaofang1,DI Haibo2,CHEN Wei1*
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China; 2.Health Supervision Institute of Jinghai,Tianjin 301600,China)
Themicrobesofstinkytofubrinewasisolated,andidentifiedbytraditionalmicrobiologicalidentificationandbacterial16SrRNAidentification. Theeffectofdifferentrelationshipbetweenmicrobialdiversity,communitystructureofstinkytofubrineonstinkytofuqualityandflavorwasresearched. The results showed that the main bacteria in stinkytofu brine wereVagococcus carniphilus,Psychrobactersp.,Lactobacillus sakei,Enterococcus avium,Enterococcus devriesei.In aseptic condition,the stinky tofu was fermented using single strains and multi-strains.Results showed that the sensory evaluationofstinkytofufermented bysingle strain waslower than thatfermented bymulti-strains.In addition to blank fermentation,the sensoryscore of thestinkytofufermentedbyPsychrobactersp.St2wasthelowestintheseproducts,buttheproductfermentedbyEnterococcusdevrieseiSt5wasbetterin colorandflavor.
stinky tofu;isolation and identification of microorganism;fermentation
TS214.2
0254-5071(2017)02-0021-04
10.11882/j.issn.0254-5071.2017.02.005
2016-10-11
国家自然科学基金青年科学基金(31401682);江苏省科技计划项目青年基金(BK20140146);江南大学2015年本科教改项目(JG2015096)
赵国忠(1983-),男,副教授,博士,研究方向为食品微生物学。
*通讯作者:陈卫(1966-),男,教授,博士,研究方向为食品微生物学。

