蛇床子素对宫颈癌Hela细胞凋亡的作用研究*
于有江,彭建明,叶记林,苏兰娣,罗 雪
(扬州职业大学医学院,江苏扬州 225009)
蛇床子素对宫颈癌Hela细胞凋亡的作用研究*
于有江,彭建明#,叶记林,苏兰娣,罗 雪
(扬州职业大学医学院,江苏扬州 225009)
目的 探讨蛇床子素对人宫颈癌Hela细胞增殖、凋亡的作用及可能的机制。方法 经不同浓度蛇床子素处理体外培养的宫颈癌Hela细胞,采用四甲基偶氮唑盐(MTT)法检测细胞增殖活性,流式细胞仪检测细胞凋亡率和细胞内活性氧(ROS)水平,半定量RT-PCR法检测Bcl-2和Bax mRNA 的表达。结果 与对照组比较,不同浓度的蛇床子素均可明显抑制人宫颈癌Hela细胞增殖、诱导细胞凋亡,增高细胞内ROS水平,降低Bcl-2/Bax的表达比例,且具有一定的剂量依赖性。结论 蛇床子素抑制人宫颈癌Hela细胞增殖并促进细胞凋亡,与升高细胞ROS水平、促进激活促凋亡因子Bax的表达和抑制抗凋亡因子Bcl-2的表达有关。
宫颈肿瘤;蛇床子素;细胞凋亡
蛇床子素(Osthole)是从中药蛇床子中提取的一种香豆素,其化学名称为7-甲氧基-8-异戊烯基香豆素,具有多种药理学和生物化学活性[1-2]。现代研究表明,蛇床子素具有多种药理学功能,不仅能保护肝脏、保护神经、抗骨质疏松、抗炎等,还有较强的抗癌活性[2-4]。目前为止关于蛇床子素在宫颈癌中的研究较少,本研究以人宫颈癌细胞Hela为模型,观察蛇床子素抗宫颈癌的作用,并探讨其可能的作用机制。
1 材料与方法
1.1 材料 人宫颈癌Hela细胞购自中国科学院上海细胞生物学研究所细胞库。蛇床子素购自上海诗丹德生物公司(纯度98%),用二甲基亚砜(DMSO)配成200 mmol/L 的贮存液;RPMI-1640培养基和胎牛血清购自美国Gibco公司;四甲基偶氮唑盐(MTT)为AMRESO产品;Annexin V-PI细胞凋亡和细胞内活性氧(reactive oxygen species,ROS)检测试剂盒购于上海碧云天生物技术公司。
1.2 方法
1.2.1 细胞培养 细胞接种于RPMI-1640培养液(含10%胎牛血清),置于37 ℃、5%CO2细胞培养箱中培养。取对数生长期细胞用于以下各实验。
1.2.2 MTT法测定细胞增殖 取对数生长期细胞,调整细胞浓度为5×104个/ mL,接种于96孔板中,每孔100 μL。24 h后按分组要求加入不同剂量的蛇床子素(20、40、80、120、160、200 μmol/L),溶剂对照组加等体积的0.1%DMSO,同时设不加细胞只加培养液的孔为空白对照(对照组)。终止培养前4 h每孔加入10 μL MTT。培养4 h后,吸弃上清液,每孔加入100 μL DMSO溶解反应产物,在酶标仪上检测492 nm的吸光度值(OD)。抑制率计算如下:
抑制率=(1-OD药物组/OD对照组)×100%。
1.2.3 流式细胞仪检测细胞凋亡 将各处理组(蛇床子素100、150、200 μmol/L)细胞用胰酶消化,离心收集细胞,PBS 洗涤2 次后用500 μL Binding buffer重悬细胞,并加入Annexin V和碘化丙啶(PI)轻轻混匀,室温避光孵育15 min后,利用流式细胞仪检测细胞凋亡。
1.2.4 DCFH-DA法观察细胞ROS水平 采用荧光探针DCFH-DA进行ROS检测。取经蛇床子素处理48 h后的Hela细胞,胰酶消化后,用无血清培养基重悬,加入DCFH-DA溶液,37 ℃孵育30 min后利用流式细胞仪检测细胞的ROS水平。
1.2.5 RT-PCR法检测Bcl-2和Bax mRNA的表达 取经蛇床子素处理48 h后的Hela细胞,用TRIzol 抽提细胞总RNA,逆转录为互补DNA(cDNA),取适量cDNA为模板,PCR法检测Bcl-2和Bax mRNA的表达。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,进行组间差异比较。引物如下:Bcl-2上游引物为5′-GGT CGC CAG GAC CTC GCC GC-3′,下游引物为5′-AGT CGT CGC CGG CCT GGC G-3′;Bax上游引物为5′-GAG CTG CAG AGG ATG ATT GC-3′,下游引物为5′- AGC CCA ACA GCC GCT CCC GG-3′;GAPDH上游引物为5′-GAG TCA ACG GAT TTG GTC GT-3′,下游引物为5′-GAC AAG CTT CCC GTT CTC AG-3′。
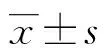
2 结 果
2.1 各组肿瘤细胞增殖率比较 通过MTT法观察不同浓度蛇床子素对宫颈癌Hela细胞增殖的影响,结果显示,蛇床子素对宫颈癌Hela细胞的增殖具有明显的抑制作用,蛇床子素各剂量组与对照组比较,差异均有统计学意义(P<0.05),而且随药物浓度的增加,其抑制作用逐渐增强,见图1。
a:P<0.05,b:P<0.01,与对照组比较。
图1 蛇床子素处理后对Hela细胞增殖的作用
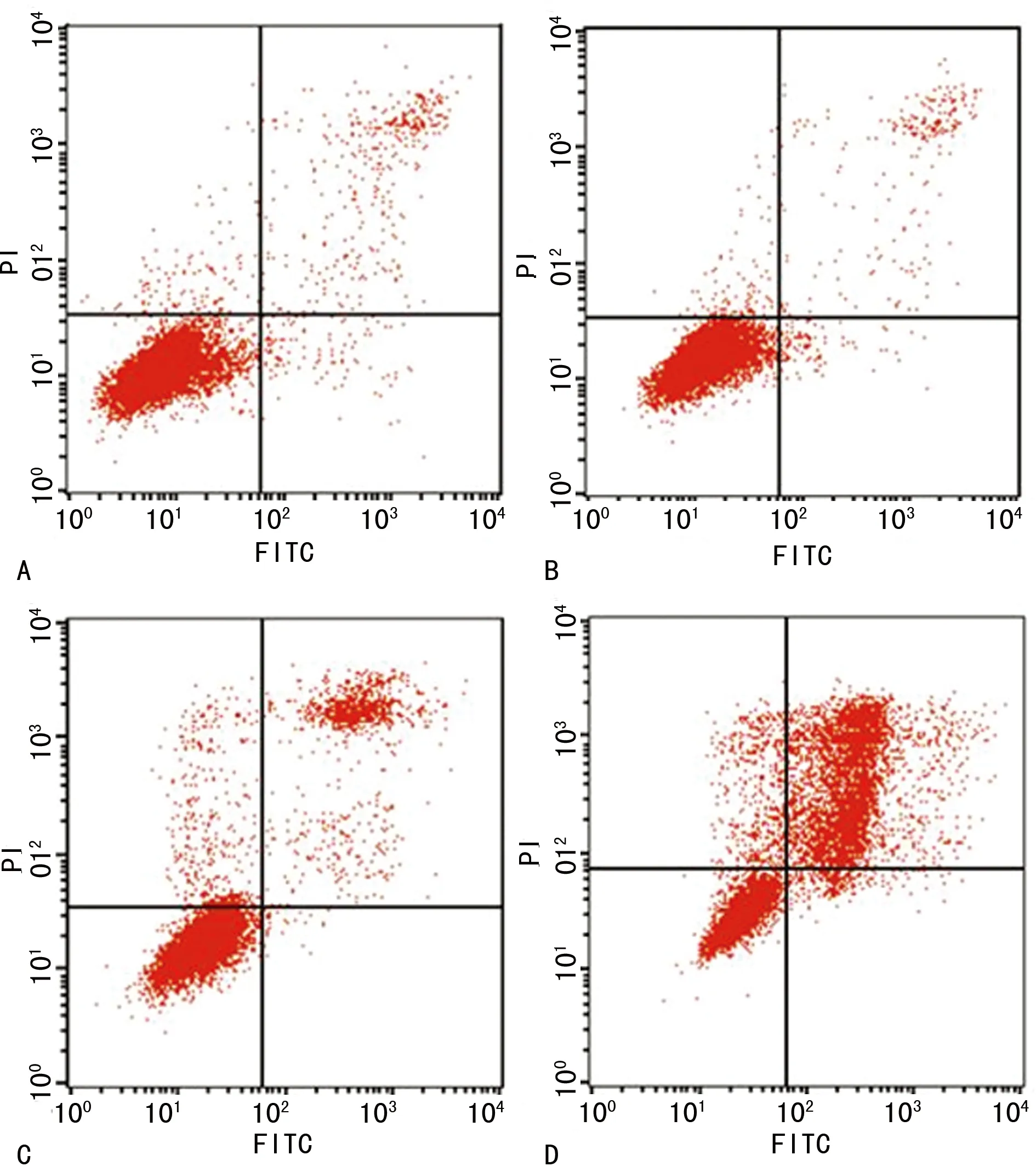
A:对照组;B:100 μmol/L组;C:150 μmol/L组;D:200 μmol/L组。
图2 各处理组细胞的流式细胞仪检测结果
2.2 各组宫颈癌Hela细胞凋亡率比较 Annexin V和PI双染各处理组细胞,流式细胞仪检测细胞凋亡。结果显示,100 μmol/L蛇床子素处理宫颈癌Hela细胞48 h后其凋亡率为(4.42 ± 1.94)%,与对照组(4.34 ± 0.26)%比较,差异无统计学意义(P>0.05);150 μmol/L和200 μmol/L蛇床子素处理宫颈癌Hela细胞48 h后其凋亡率分别为(9.66 ± 0.12)%和(41.51 ± 0.30)%,与对照组(4.34 ± 0.26)%比较,差异有统计学意义(P<0.01),见图2。
2.3 各组Hela细胞ROS水平比较 利用DCFH-DA法观察细胞ROS水平,结果显示,100、150、200 μmol/L蛇床子素处理组细胞内ROS为(1.26±0.04)%、(2.15±0.14)%和(3.12±0.42)%,与对照组(1.00±0.05)%比较,差异有统计学意义(P<0.05),见图3。

a:P<0.05,b:P<0.01,与对照组比较。
图3 各组Hela细胞ROS水平比较
2.4 蛇床子素对宫颈癌Hela细胞Bcl-2和Bax mRNA表达的影响 蛇床子素处理48 h后,RT-PCR 检测Bcl-2和Bax mRNA 的表达,与对照组比较,各蛇床子素药物处理组Bcl-2 mRNA 表达量下降,而Bax mRNA 表达量明显升高,Bcl-2/Bax比值显著下降,差异有统计学意义(P<0.05),见图4。

A:对照组;B:150 μmol/L组;C:200 μmol/L组;a:P<0.05,b:P<0.01,与对照组比较。
图4 RT-PCR测定各组Hela细胞Bcl-2和Bax的表达
3 讨 论
蛇床子素具有比较广谱的抗癌作用,对包括胃癌、乳腺癌、黑色素瘤、肝癌、白血病、前列腺癌、肺癌等都具有较好的抗癌活性[4-9]。但对于蛇床子素在宫颈癌中的抗癌作用研究较少。本研究对蛇床子素抗人宫颈癌Hela细胞的作用进行了研究,结果显示蛇床子素能有效地抑制人宫颈癌Hela细胞增殖和诱导肿瘤细胞凋亡。
ROS是一类具有比分子氧更活泼的化学反应性的含氧物,主要包括离子状态的超氧阴离子、羟根离子和非离子状态的过氧化氢等。正常生理条件下生物体内存在着一套完善的氧化/抗氧化体系,可将ROS维持在一个稳定的范围内。当ROS过度产生,超过了机体抗氧化防御的能力,就会促使细胞发生转化、导致恶性肿瘤的发生[10-12]。近年来的研究发现,多种临床应用的抗癌药物如三氧化二砷、烷化剂、多柔比星、紫杉醇和喜树碱等,能通过诱导ROS的大量增加来诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖,从而达到抗癌的目的[10,13-14]。Groninger等[15]用长春新碱(vincristine,VCR)作用于初发急性淋巴细胞性白血病(ALL)患儿的骨髓白血病细胞和ALL细胞株Jurkat细胞。在VCR作用的早期即可在Jurkat细胞检测到ROS的存在,应用ROS清除剂作用后,ROS的产生被抑制,并且Caspase酶系活性降低,进而抑制Jurkat细胞凋亡。但是,蛇床子素能够通过诱导ROS的增加来诱导宫颈癌细胞凋亡,目前尚无研究报道。本研究结果显示,蛇床子素诱导宫颈癌Hela细胞凋亡与其诱导氧化应激、升高ROS水平有关。
越来越多的研究显示,Bcl-2蛋白家族成员在细胞凋亡的线粒体途径中起重要调控作用。Bcl-2家族包括两类功能相反的蛋白质:抑制凋亡的蛋白(Bcl-2、bcl-xL)和诱导凋亡的蛋白(Bax、Bak、Bid和Bim)[11]。Bcl-2和Bax分别是Bcl-2家族中最有代表性的抗凋亡蛋白和促凋亡蛋白。在凋亡发生过程中,Bax在某些凋亡相关因素的激活下,可从胞浆迁移至线粒体膜上,Bax形成线粒体膜通道,导致线粒体膜电位无法维系,膜的完整性遭到破坏,从而导致细胞色素C释放,经过Caspase活化级联反应,最终导致凋亡发生。本研究发现,当蛇床子素作用于宫颈癌Hela细胞后,Bax mRNA的表达显著升高,而Bcl-2 mRNA的表达明显降低,提示蛇床子素通过诱导Bcl-2/Bax失衡,进而促发凋亡。
综上所述,蛇床子素通过影响宫颈癌细胞ROS水平,打破氧化还原平衡,从而改变线粒体膜通透性,促进激活促凋亡因子Bax,抑制抗凋亡因子Bcl-2,经过级联反应,诱导细胞凋亡。
[1]董晓华,孟宪勇,张力,等.蛇床子素对AD 大鼠神经元凋亡及细胞周期的影响[J].神经药理学报,2012,2(3):7-14.
[2]徐燕,廖建华,吴龙火.蛇床子素的生物学活性与作用机制研究进展[J].湖北农业科学,2013,52(18):4313-4318.
[3]李慧.蛇床子素及其衍生物抗肿瘤作用机制研究进展[J].中药药理与临床,2015,31(3):208-214.
[4]徐小嫚,张毅,曲丹,等.蛇床子素对人肺鳞癌NCI-H520细胞系增殖、凋亡的影响[J].中国医刊,2013,48(3):35-37.
[5]苏立平,薛明明,陈立,等.蛇床子素对大鼠肝癌动物模型肝细胞生物行为学特性及血管特征的影响[J].中国生化药物杂志,2014,34(6):35-37.
[6]杨大朋,王海啸,彭延延,等.蛇床子素对人乳腺癌细胞增殖、细胞周期及凋亡的影响[J].南京师大学报(自然科学版),2010,33(2):76-80.
[7]张毅,佟笑竹,徐小嫚,等.蛇床子素体外对人前列腺癌DU145细胞增殖的抑制作用及机制[J].实用药物与临床,2013,16(2):96-98.
[8]吕金敏.蛇床子素诱导人肺腺癌细胞进入G2/M阻滞并引起凋亡性死亡研究[J].浙江中西医结合杂志,2015,25(2):115-117.
[9]Jarzab A,Grabarska A,Kielbus M,et al.Osthole induces apoptosis,suppresses cell-cycle progression and proliferation of cancer cells[J].Anticancer Res,2014,34(11):6473-6480.
[10]Shen K,Xie J,Wang H,et al.Cambogin induces Caspase-Independent apoptosis through the ROS/JNK pathway and epigenetic regulation in breast cancer cells[J].Mol Cancer Ther,2015,14(7):1738-1749.
[11]Bonora M,Pinton P.The mitochondrial permeability transition pore and cancer:molecular mechanisms involved in cell death[J].Front Oncol,2014(4):302.
[12]Kello M,Drutovic D,Chripkova M,et al.ROS-dependent antiproliferative effect of brassinin derivative homobrassinin in human colorectal cancer CaCO2cells[J].Molecules,2014,19(8):10877-10897.
[13]Wang Y,Xu K,Zhang H,et al.Retinal ganglion cell death is triggered by paraptosis via reactive Oxygen species production:a brief literature review presenting a novel hypothesis in glaucoma pathology[J].Mol Med Rep,2014,10(3):1179-1183.
[14]Palit S,Kar S,Sharma G,et al.Hesperetin induces apoptosis in breast carcinoma by triggering accumulation of ROS and activation of ASK1/JNK pathway[J].J Cell Physiol,2014,230(8):1729-1739.
[15] Groninger E,Meeuwsen-De Boer T,Koopmans P,et al.Vincristine pharmacokinetics and response to vincristine monotherapy in an up-front window study of the Dutch Childhood Leukaemia Study Group (DCLSG)[J].Eur J Cancer,2005,41(1):98-103.
Effect of osthole on apoptosis of human cervical carcinoma Hela cells*
YuYoujiang,PengJianming#,YeJilin,SuLandi,LuoXue
(MedicalCollegeofYangzhouPolytechnicCollege,Yangzhou,Jiangsu225009,China)
Objective To investigate the effect and the possible mechanism of osthole on proliferation and apopotosis of human cervical carcinoma Hela cells and its passible mechanism.Methods After cervical carcinoma Hela cells were incubated with different concentrations osthole,the cell proliferation activity was examined by MTT assay.The apoptosis rate and cellular ROS level were measured by flow cytometry.The Bcl-2 and Bax mRNA expression was determined by semi-quantitative RT-PCR.Results In comparison with the control group,osthole with different concentrations could obviously inhibit the Hela cells proliferation and accelerated the cellular apoptosis,lowered the expression rate of Bcl-2/Bax,raise the cellular ROS level in a osthole dose-dependent manner.Conclusion Osthole may inhibit Hela cell proliferation and accelerates the cells apoptosis,which might be associated with the increasing the cellular ROS level,promoting Bax expression and inhibiting Bcl-2 expression.
uterine cervical neoplasms;osthole;apoptosis
��·基础研究
10.3969/j.issn.1671-8348.2017.07.006
江苏省卫生厅卫生职业技术教育科研资助项目(NJ201112)。 作者简介:于有江(1963-),副教授,本科,主要从事细胞凋亡、生物化学与分子生物学研究。#共同第一作者:彭建明(1984-),讲师,硕士研究生,主要从事医学神经生物学研究。
R34
A
1671-8348(2017)07-0883-03
2016-08-16
2016-11-30)

