徐闻普哥滨珊瑚土曲霉XWC21-10代谢产物活性及其活性物质的研究
姚远蓓, 班海侠, 雷晓凌, 钟 敏
(广东海洋大学食品科技学院 广东省水产品加工与安全重点实验室 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088)
海洋生态系统中,珊瑚礁生态系统物种多样性程度最高,同时代谢产物结构最为多样化,已成为海洋天然产物研究的热点[1-2]。但因为骨骼和钙质的结构,作为重要珊瑚组成类型的石珊瑚的研究则相对较少[3-4]。普哥滨珊瑚[5]是中国种类最多,大陆面积最大的珊瑚礁——徐闻珊瑚保护区中的一种主要造礁石珊瑚。许多海洋共附生真菌分离的化合物与宿主本身产生的天然产物结构极其相似,根据共附生理论一直被认为是具有活性的天然化合物真正的产生者[6]。珊瑚共附生真菌,代谢产物具有良好生物活性多样性。Zhang等[7]从6种南海珊瑚中分离出具有抑菌活性的珊瑚共附生真菌。王亚楠等[8]对1株柳珊瑚共附生真菌的代谢产物和生物活性的研究,得到了抑菌较强的化合物。张翼等[9]对44 株海洋真菌的抗老年痴呆相关活性成分进行了筛选与追踪,分离出较强的乙酰胆碱酯酶抑制活性的化合物。由此可见,许多具有抗菌活性的先导化合物便是来源于珊瑚共附生真菌,也为乙酰胆碱酯抑制活性天然产物的来源提供可能。本课题组李军等[10]对普哥滨珊瑚中的23株珊瑚真菌进行多样性和抑菌活性的研究,确定了该种属珊瑚共附生真菌具有良好活性;班海侠等[11]对徐闻珊瑚样品中的43株真菌进行活性测定,确定了土曲霉XWC21-10具有良好的抑菌、乙酰胆碱酯酶抑制活性。本研究在此基础上,确定不同萃取物的抑菌、乙酰胆碱酯酶活性,对活性效果较好的萃取物进行分离及成分分析,为进一步研究抑菌和乙酰胆碱酯酶的活性物质提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 土曲霉XWC21-10(Aspergillusterreus,登录号:JQ717327.1)分离自普哥滨珊瑚(Poritespukoensis),现保存于东省微生物所保藏中心,保藏编号为GDMCC No:60004。
1.1.2 培养基 马铃薯葡萄糖琼脂培养基(PDA,Potato dextrose agar),马铃薯葡萄糖肉汤(PDB,Potato dextrose broth),以上培养基均用海水(70%湛江东海岛的海水,放于阴凉处2 d备用)配制。
1.1.3 抗菌活性指示菌 大肠埃希菌(Escherichiacoli)、金黄色葡萄球菌(Staphlococcusaureus)、藤黄八叠球菌(Sarcinalutea),本实验室保存菌种;假交替单胞菌属SL-1(登录号:FJ404757.1,Pseudoalteromonassp.)、吉氏库特菌SL-2(登录号:EF032-685.1,Kurthiagibsoniisp.)、金黄色杆菌SL-4(登录号:HM625714.1,Chryseobacteriumsp.),课题组从冷冻对虾中分离的优势腐败菌。
1.1.4 试剂 甲醇、丙酮、乙酸乙酯、氯仿、二氯甲烷、石油醚、正丁醇均为分析纯;碳酸氢钠、磷酸二氢钠、磷酸氢二钠;乙酰胆碱酯酶(AChE)、十二烷基硫酸钠、5,5′-二硫代-2-硝基苯甲酸(DTNB)、碘化硫代乙酰胆碱(ATCh);甲醇,为色谱纯等。
1.1.5 仪器 立式压力蒸汽灭菌锅LS-B50l(上海华线医用核子仪器有限公司),DC-R 氮吹仪(上海安谱科学仪器有限公司),Multiskan MK3 酶标仪(上海雷波分析仪器有限公司),高效液相色谱仪(Agilent 1200, USA),N-1100 旋转蒸发仪(上海爱郎仪器有限公司)。
1.2 方法
1.2.1 XWC21-10发酵液和菌丝体不同萃取物的制备 挑取经活化的土曲霉XWC21-10分别接种于PDA液体培养基中,28 ℃、160 r/min摇床培养9 d。随后将发酵产品采用抽滤的方式得到发酵液和菌丝体。取发酵液5份,分别用等体积不同极性的有机试剂如甲醇、正丁醇、乙酸乙酯、二氯甲烷和石油醚溶液充分萃取,经减压真空干燥浓缩至干,配置浓度为30 mg/mL。另取4份菌丝体,分别用甲醇、氯仿、丙酮和乙酸乙酯抽滤,除去菌丝体残余物,减压浓缩干燥,配置浓度为30 mg/mL,置4 ℃冰箱备用。
1.2.2 XWC21-10发酵液不同萃取物抗菌活性测定 ①指示菌菌悬液的制备:指示菌在琼脂斜面培养基上传代一次后,分别接种到相应的肉汤液体培养基中,37 ℃摇床培养12~18 h,再用LB液体培养基将指示菌稀释至细菌数为106cfu/mL。②抗菌活性测定:采用牛津杯双层培养基法[12]测量发酵液不同极性组分的抗菌活性,加入终浓度为30 mg/mL待测样品100 μL,每组实验重复3次,并设置不加粗提物作为阴性对照,阳性对照选择盐酸四环素(1 mg/mL)。37 ℃恒温培养,48 h后观察结果,并用十字交叉法测量并记录抑菌圈直径。
1.2.3 XWC21-10发酵液和菌丝体不同萃取物AChE抑制作用测定 采用改进Ellman法对乙酰胆碱酯酶活性测定[13-14],酶标仪读取吸光度值(405 nm)。用磷酸缓冲液稀释待测样品终浓度至2 mg/mL,其中设置样品本底对照孔,石杉碱甲溶液代替待测样品为完全抑制对照孔对照,以及空白对照。阳性对照为他克林(Tacrine),抑制率计算公式:
抑制率(%)=(((空白-完全抑制)-(样品-样品本底))/(空白-完全抑制))×100%
1.2.4 XWC21-10发酵液活性导向的分离与成分分析 ①硅胶柱层析分离:对菌株发酵液的活性最优组分萃取物浸膏进行初分离,通过氯仿-甲醇体系(C∶M=20∶1)进行梯度洗脱,每个梯度洗脱1 000 mL,并对流下的洗脱液进行收集。对收集的洗脱液每3~5个级分进行合并,使其旋转蒸发,甲醇溶解,然后分别对其进行TLC板检测,对斑点一致的级分进行合并,回收试剂,对其编号并进行抑菌和乙酰胆碱酯酶活性抑制试验,抑菌试验配置样品浓度为5 mg/mL,乙酰胆碱酯酶浓度为1 mg/mL。②高效液相色谱(HPLC)检测:对活
性较强的馏分进行HPLC分析,色谱条件为C18色谱柱,进样量为15 μL,流速为1 mL/min,流动相为甲醇和水(65∶35),柱温25 ℃,检测波长为254 nm。③TLC检测代谢产物的成分:通过TLC板检测,根据喷洒显色剂后出现的斑点变化,初步判断其所含物质的成分。对其进行还原性化合物,氨基酸、胺与氨基糖类化合物,酚类和羟酰胺酸类化合物,生物碱和某些含氮化合物,高级醇、甾类及精油类,蒽醌类化合物,黄酮类化合物,芳香胺类化合物,共轭基团化合物等的检测。
2 结果与分析
2.1 XWC21-10发酵液不同萃取物抗菌作用比较
对XWC21-10菌株发酵液不同萃取物抑菌作用进行测定,其结果见表1。由表1结果可知,4种发酵液萃取物对6种指示菌有明显的抑制作用,均具有广谱抑菌作用。其中乙酸乙酯萃取物对金黄色葡萄球菌抑制最明显,正丁醇对大肠埃希菌抑制最明显对金黄色杆菌的抑菌活性明显低于其他菌;甲醇萃取物对这几种指示菌并没有显示抑菌效果,说明发酵液中极性较高的化合物没有抑菌作用或者其极性相对比较高的化合物含量小因而抑菌作用不显著。图1是XWC21-10发酵液不同萃取物对SL-4(金黄色杆菌)的抑菌活性。
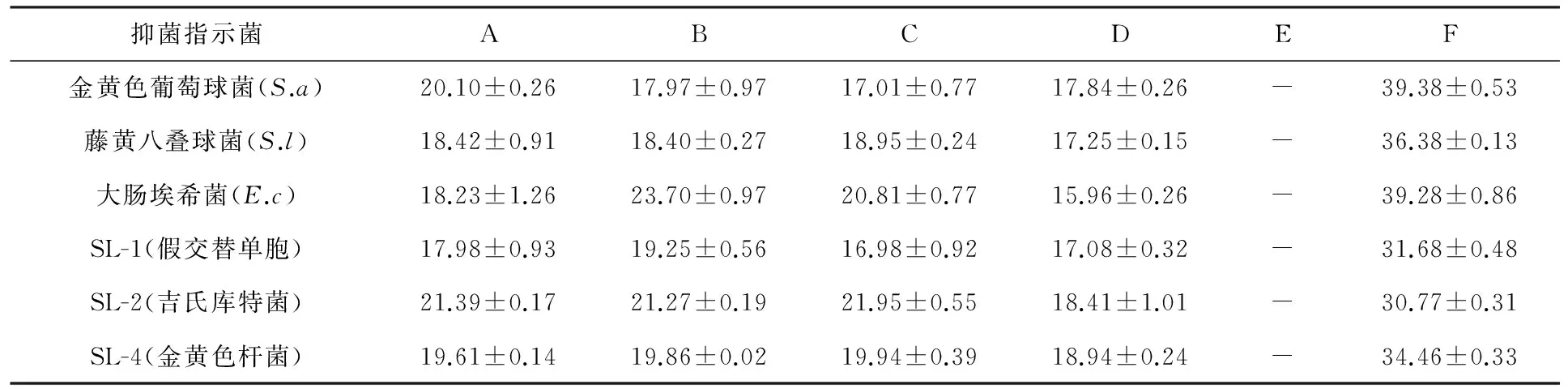
表1 XWC21-10发酵液不同萃取物对抑菌活性的比较(抑菌圈直径/mm)
注:A:乙酸乙酯萃取物;B:正丁醇萃取物;C:二氯甲烷萃取物;D:石油醚萃取物;E:甲醇萃取物;F:阳性对照:盐酸四环素;“-”表示无抑菌圈;数值表示±S,n=3
2.2 XWC21-10发酵液和菌丝体萃取物AChE抑制作用比较
对XWC21-10菌株发酵液和菌丝体的不同萃取部分进行了AChE抑制活性检测,结果见表2。不同部分的菌株发酵液萃取部分和菌丝体萃取部分有不同AChE抑制作用,其中发酵液除甲醇以外的4种萃取物都有良好的乙酰胆碱酯酶抑制活性,活性最好的乙酸乙酯萃取物抑制率达到(67.04±1.96)%。菌丝体的4种萃取物活性都比较好,氯仿萃取物部分的AChE抑制作用最为明显,其抑制率达到(79.37±1.53)%。其中乙酸乙酯发酵液和菌丝体的萃取物都比较好。

图1 XWC21-10发酵液不同萃取物对SL-4(金黄色杆菌)的抑菌活性Fig.1 Inhibition effect of XWC21-10 extracts from fermentation broth for SL-4(Chryseobacterium sp.)A:乙酸乙酯萃取物;B:正丁醇萃取物;C:二氯甲烷萃取物;D:石油醚萃取物A: ethyl acetate extract; B: n-butyl alcohol extract; C: dichloromethane extracts; D: the petroleum ether extract
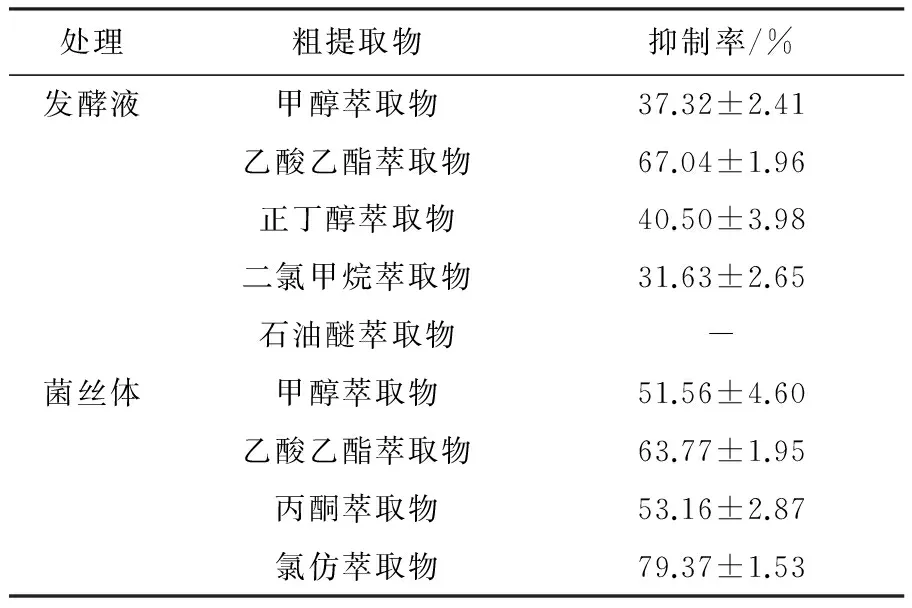
处理粗提取物抑制率/%发酵液甲醇萃取物37.32±2.41乙酸乙酯萃取物67.04±1.96正丁醇萃取物40.50±3.98二氯甲烷萃取物31.63±2.65石油醚萃取物-菌丝体甲醇萃取物51.56±4.60乙酸乙酯萃取物63.77±1.95丙酮萃取物53.16±2.87氯仿萃取物79.37±1.53
注:“-”表示无AChE抑制作用;数值表示±S,n=3
2.3 XWC21-10发酵液活性导向的分离与成分分析
2.3.1 硅胶柱层析成分分离及活性跟踪 用活性显著的乙酸乙酯萃取物进行分离及活性跟踪研究,萃取物经硅胶柱层析分离收集190份级分,通过薄层层析分析合并为11个级分。对11个级分进行抗菌、乙酰胆碱抑制活性分析,结果见表3。

表3 11硅胶柱层析级分的抑菌作用和AchE抑制作用检测
注:“-”表示没有抑菌圈生成;数值表示±S,n=3
由表3结果可知,级分6、7对6种指示菌均表现出较强的抗菌作用,级分8对大肠埃希菌(Escherichiacoli)和藤黄八叠球菌(Sarcinalutea)有较明显的抑菌效果,级分10对藤黄色八叠球菌有抑制作用。其他级分对6种指示菌均没有体现出抗菌作用。11个组分的AChE抑制活性存在很大差异,其中级分8、11对乙酰胆碱酯酶抑制活性较为明显,抑制率均达到20%以上。
2.3.2 活性级分的高效液相色谱(HPLC)分析 经初步分析综合检测级分6、7、8、11的活性最好,对其进行HPLC分析,图谱如图2。对4个级分的HPLC图谱进行分析,级分6、7的HPLC图谱峰型比较相似,所含主要化合物成分相近。级分8的活性成分含量的活性成分也较为丰富。含有最单一活性成分的是级分11。主峰主要集中在3~5 min之间,说明所含活性成分大多是极性较小的化合物。
2.3.3 活性级分的TLC检测分析 通过TLC板法不同显色方法可知,级分6、7中所含成分比较相似,其主要含有还原性物质和酚类、高级醇、甾类及精油、共轭基团化合物;级分8中含有还原性化合物和氨基酸、胺与氨基糖类、生物碱和某些含氮化合物、高级醇、甾类及精油、蒽醌类化合物及共轭基团化合物;而级分11通过不同显色方法,仅在紫外下呈现出斑点,说明仅含有共轭基团化合物。TLC检测代谢产物的成分结果与HPLC检测相符,综合结果,级分11含有的活性成分相对简单,可进行纯化分离和进一步组分的分析。




图2 相同条件下不同级分的HPLC图性Fig.2 HPLC of different fractions in the same conditiona~d分别为级分6、7、8和11的HPLC检测图谱a-d:The HPLC analysis of different fractions in 6,7,8 and 11
3 讨 论
本研究以活性追踪法对来自普哥滨珊瑚的土曲霉XWC21-10菌株的代谢产物活性及其活性成分进行初步研究。该属珊瑚真菌代谢产物研究较少,还未见活性单体物质分离的报道。研究结果表明:XWC21-10菌株不同萃取物中除甲醇萃取物外,其余萃取物均具有广谱抑菌作用。Wang等[15]分别从柳珊瑚共附生真菌中分离出抗菌活性的化合物,Zheng 等[16]从来自南海的软珊瑚共附生真菌的发酵液中分离得到具有广谱的抗菌活性的化合物。珊瑚共附生真菌已经成为研究天然抑菌剂的研究热点;通过柱色谱技术,WXC21-10菌株发酵液浸膏最后得到11个级分,确定了活性较好的6、7、8、11四个级分,特别是具有良好乙酰胆碱酯抑制活性的级分11成分简单,为以后化合物的分离纯化提供了很好的前期基础。乙酰胆碱酯酶抑制剂主要集中在药用植物[17-18]、食用菌[19]等陆生生物,对海洋微生物代谢产物相关活性研究较少,本实验表明珊瑚真菌也可成为多样化的抗老年痴呆活性物质的来源之一。与传统的天然产物研究先分化合物再进行活性筛选模式相比,活性追踪分离法具有目标性和针对性。本研究对XWC21-10菌株各级分的组分进行了初步研究,研究发现该菌株代谢产物含有的化合物相对比较丰富,但仍需进一步组分分析及其代谢产物的提取纯化条件进行研究。
[1] Lampert Y, Kelman D, Nitzan Y, et al. Phylogenetic diversity of bacteria associated with the mucus of Red Sea corals[J]. Fems Microbiology Ecology, 2008, 64(2): 187-198.
[2] Raghukumar C, Ravindran J: Fungi and Their Role in Corals and Coral Reef Ecosystems[J].Biology of Marine Fungi, 2012,53(5): 89-113.
[3] 赵诗瑶, 张金荣, 严小军. 石珊瑚化学成分和生物活性的研究进展[J].天然产物研究与开发, 2016, 28(5): 800-809.
[4] Bae BH, Im KS, Choi WC, et al. New acetylenic compounds from the stony coralMontiporasp.[J]. Journal of Natural Products, 2000, 63(11): 1511-1514.
[5] 廖宝林, 刘丽, 刘楚吾. 徐闻珊瑚礁的研究现状与前景展望[J]. 广东海洋大学学报, 2011, 31(4): 91-96.
[6] 许静, 徐俊. 海洋共附生微生物天然产物生物合成基因研究进展[J]. 微生物学报, 2008, (7): 975-979.
[7] Zhang XY, Bao J, Wang GH, et al. Diversity and Antimicrobial Activity of Culturable Fungi Isolated from Six Species of the South China Sea Gorgonians[J]. Microbial Ecology, 2012, 64(3): 617-627.
[8] 王亚楠, 郑彩娟, 邵长伦, 等. 柳珊瑚共附生真菌Alternariasp.(WZL003)抑菌化合物的分离及其作用机制初步研究[J]. 中国海洋药物, 2015, 34(2): 10-16.
[9] 张翼, 鲍海燕, 聂影影, 等. 海洋真菌抗老年痴呆相关活性成分的筛选与追踪研究[J]. 现代食品科技, 2016, 32(11): 63-71,34.
[10]Li J, Zhong M, Lei X L, et al. Diversity and antibacterial activities of culturable fungi associated with coral Porites pukoensis[J]. World Journal of Microbiology & Biotechnology, 2014, 30(10): 2551-2558.
[11]班海侠, 钟敏, 雷晓凌, 等. 具抗菌及乙酰胆碱酯酶抑制活性珊瑚真菌的筛选[J]. 微生物学杂志, 2015, 35(5): 23-27.
[12]阮征, 项坤, 梁兰兰, 等. 双层平板法快速选育高产蛹虫草菌株[J]. 农产品加工, 2015, (15): 1-4,8.
[13]Ellman GL, Courtney K D, Andres V, et al. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology, 1961, 7(2): 88-95.
[14]Dong LH, Fan SW, Ling QZ, et al. Indentification of huperzine A-producing endophytic fungi isolated from Huperzia serrata[J]. World J Microbiol Biotechnol, 2014, 30(3): 1011-1017.
[15]Wang JF,Liu PP,Wang Y,et al. Antimicrobial Aromatic Polyketides from Gorgonian-Associated Fungus, Penicillium commune 518[J]. Chinese Journal of chemistry, 2012, 30(6): 1236-1242.
[16]Zheng CJ, Shao CL, Wu LY, et al. Bioactive Phenylalanine Derivatives and Cytochalasins from the Soft Coral-Derived Fungus, Aspergillus elegans[J]. Marine Drugs, 2013, 11(6): 2054-2068.
[17]杨中铎, 周静怡, 杨明俊. 药用植物内生真菌的分离及其次生代谢产物抗乙酰胆碱酯酶活性研究[J]. 中医药学报, 2011, (4): 69-71.
[18]Na R, Jiajia L, Dongliang Y, et al. Indentification of vincamine indole alkaloids producing endophytic fungi isolated from Nerium indicum, Apocynaceae[J]. Microbiological Research, 2016, 192: 114-121.
[19]曾瑾, 罗霞, 郑林用, 等. 灵芝醇提物对记忆障碍模型小鼠学习记忆的影响[J]. 中药药理与临床, 2009, (4): 42-44.

