p38 MAPK信号通路在TLR4促进胰腺癌血管生成中的作用*
孙运良,马建霞,满晓华,吴红玉
(1.江苏省连云港市赣榆区人民医院消化内科 222100;2.上海复旦大学附属华东医院消化内科,上海 200338;3.第二军医大学附属长海医院消化内科,上海 200433)
p38MAPK信号通路在TLR4促进胰腺癌血管生成中的作用*
孙运良1,马建霞2△,满晓华3,吴红玉3
(1.江苏省连云港市赣榆区人民医院消化内科 222100;2.上海复旦大学附属华东医院消化内科,上海 200338;3.第二军医大学附属长海医院消化内科,上海 200433)
目的 探讨Toll样受体-4(TLR4)和p38丝裂原活化蛋白激酶(p38MAPK)信号通路在胰腺癌血管生成中的作用。方法 以脂多糖(LPS)、TLR4-siRNA及p38MAPK信号通路阻断剂SB203580分别作用于体外培养的胰腺癌PANC-1细胞,Westernblot检测TLR4、血管内皮生长因子(VEGF)、磷酸化p38丝裂原活化蛋白激酶(p-p38)蛋白表达。收集各种因素处理后的PANC-1细胞培养液,观察其对人脐静脉内皮细胞(HUVECs)增殖、迁移和管腔形成的影响。结果LPS组的HUVECs增殖率、迁移数目和管腔形成个数分别为(139.2±12.6)%、48.1±9.1和47.8±9.6,均显著高于对照组(P<0.05)。TLR4-siRNA组的HUVECs增殖率、迁移数目和管腔形成个数分别为(60.2±8.7)%、31.3±4.5和17.2±3.3,均显著低于对照组(P<0.01);SB203580组的HUVECs增殖率[(79.6±8.9)%]、迁移数目(21.6±4.3)和管腔形成个数(23.5±4.3)均较对照组显著减少(P<0.05);且TLR4-siRNA+LPS、B203580+LPS组的HUVECs增殖率、迁移数目和管腔形成个数均分别显著低于LPS组(P<0.01)。与对照组相比,LPS组VEGF、p-p38蛋白表达均明显增加,TLR4-siRNA组、SB203580组TLR4、VEGF、p-p38蛋白表达明显减少;且TLR4-siRNA+LPS组、SB203580+LPS组VEGF、p-p38表达较LPS组明显减少。结论TLR4可促进胰腺癌的血管生成,其机制与激活p38MAPK信号通路、促进VEGF表达有关。
Toll样受体4;胰腺肿瘤;血管生成;p38丝裂原活化蛋白激酶信号通路;血管内皮生长因子
Toll样受体(Toll-like receptors,TLRs)是近年来发现的Ⅰ型跨膜蛋白质。其中,TLR4是最早发现的,同时也是研究最为广泛的TLRs家族成员,主要识别革兰阴性细菌细胞壁成分脂多糖(lipopolysaccharide,LPS)。近年来研究表明,TLR4在肿瘤细胞呈高表达,与多种肿瘤的发生、发展密切相关,但其促肿瘤的确切机制尚未完全阐明[1-3]。血管生成已被证实在肿瘤的生长、侵袭和转移中发挥重要作用[4-5]。本课题组前期研究发现,TLR4在胰腺癌组织中呈高表达,且高表达的TLR4与胰腺癌的血管生成有关[2],但TLR4促血管生成的机制有待于进一步明确。血管内皮生长因子(VEGF)是目前已知的最重要的促血管生成因子,在诸多调控VEGF表达的信号通路中,p38丝裂原活化蛋白激酶(p38 MAPK)信号通路已被证实具有重要的作用[6-7]。本研究以LPS、TLR4-siRNA及p38 MAPK信号通路阻断剂SB203580分别作用于体外培养的胰腺癌PANC-1细胞,收集各组细胞培养液作用于人脐静脉血管内皮细胞(HUVECs),观察HUVECs增殖、迁移及管腔形成的变化,分析TLR4对p38 MAPK信号通路及VEGF表达影响,探讨TLR4促胰腺癌血管生成的作用及其机制。
1 材料与方法
1.1 材料 人胰腺癌细胞株PANC-1购自美国ATCC公司;HUVECs购自中国科学院上海细胞生物学研究所;TLR4-siRNA(上游:5′-CUU UAU CCA ACC AGG UGC AUU UU-3′;下游:5′-AAU GCA CCU GGU UGG AUA AAG UU-3′)由上海吉玛生物技术有限公司合成;LPS和SB203580均为Sigma公司产品;兔抗人TLR4、VEGF多克隆抗体购自Santa Cruz公司;鼠抗人磷酸化P38丝裂活化蛋白激酶(p-p38)的单克隆抗体和p38的多克隆抗体均购自Cell Signaling公司;Transwell小室购自Coster公司;Matrigel购自BD公司。
1.2 方法
1.2.1 细胞培养 PANC-1细胞和HUVECs在含有10%胎牛血清(FBS)的DMEM培养液中,37 ℃,5%CO2条件下培养,培养液中含青霉素、链霉素各100 U/mL。将PANC-1细胞以每孔1×106的量加入6孔板,待细胞贴壁后,进行下列的分组实验。对照组:不加任何处理因素;LPS组:加入1 μg/mL的LPS处理24 h;TLR4-siRNA组:加入100 pmol/mL的TLR4-siRNA处理4 h;TLR4-siRNA+LPS组:加入100 pmol/mL的TLR4-siRNA处理4 h后继续加入1 μg/mL的LPS处理24 h;SB203580组:加入20 μmol/L的SB203580处理2 h;SB203580+LPS组:加入20 μmol/L的SB203580处理2 h后继续加入1 μg/mL的LPS处理24 h。收集各组细胞培养液上清液分别作用于体外培养的HUVECs。
1.2.2 TLR4-siRNA转染 将PANC-1细胞以1×106/孔的量加入6孔板,待细胞贴壁后,弃去培养液,进行后续的TLR4-siRNA转染实验。具体转染步骤如下:将100 pmol TLR4-siRNA加入到100 μL的无血清的DMEM培养基柔和混匀;用100 μL无血清的DMEM稀释5 μL lipofectamin2000试剂,轻轻混匀,室温放置5 min;将稀释好的TLR4-siRNA和lipofectamin2000试剂混合,轻柔混匀,室温放置20 min,以形成TLR4-siRNA/lipofectamin复合物;将6孔板的每孔中加入上述200 μL TLR4-siRNA/lipofectamin复合物和800 μL无血清的DMEM培养基,继续培养4 h后,弃去培养液,加入或不加入LPS继续培养24 h。
1.2.3 四甲基噻唑蓝(MTT)法检测HUVECs增殖 将HUVECs以5×103/孔的量加入96孔板,待细胞贴壁后,更换为各组PANC-1细胞培养液,37 ℃,5%CO2条件下继续培养48 h后,每孔加入20 μL MTT溶液(5 mg/mL)。继续培养4 h后吸去孔内培养液,每孔加入150 μL二甲基亚砜(DMSO),置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪波长570 nm处测量各孔的吸光度值(A值)。细胞增殖率=(实验孔A值/对照孔A值)×100%。
1.2.4 Transwell小室检测HUVECs的迁移能力 常规培养HUVECs,收集细胞,用各组PANC-1细胞培养液上清液将HUVECs备成5×105/mL细胞悬液,取200 μL细胞悬液接种至Transwell上室,在下室加入700 μL含10% FBS的DMEM培养液。继续培养24 h后,取出Transwell小室,用棉签将小室上层的细胞擦除,磷酸盐缓冲液(PBS)轻轻冲洗,晾干,然后用0.1%结晶紫染色10 min,去除多余结晶紫染液,普通光学显微镜下观察。每个滤膜随机选取5个400倍视野,计数穿膜细胞数,以穿膜细胞的数目表示HUVECs的迁移能力。
1.2.5 Matrigel检测HUVECs的管腔形成能力 常规培养HUVECs,收集细胞,用PANC-1细胞培养液上清重新悬浮,以1×105/孔的量接种于预铺Matrigel的24孔板中。37 ℃,5% CO2条件下继续培养24 h后,倒置显微镜下观察。选取3个视野计算所形成管腔个数的平均值。
1.2.6 Western blot检测PANC-1细胞TLR4、p38、p-p38和VEGF蛋白表达 用RIPA裂解液制备细胞总蛋白,蛋白分析系统测定蛋白浓度,上样于20%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转移到硝酸纤维膜。室温下用含5%脱脂奶粉的1×TBS封膜2 h。加入TLR4、p38、p-p38、VEGF抗体,4 ℃孵育过夜,洗膜后加入相应的辣根过氧化物酶(HRP)标记的二抗,室温孵育2 h,电化学发光(ECL)显影。结果用凝胶图像软件分析系统对胶片扫描,与内参照β-actin进行比较。
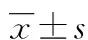
2 结 果
2.1TLR4对胰腺癌血管生成的影响LPS组的HUVECs增殖率、迁移数目和管腔形成个数分别为(139.2±12.6)%、48.1±9.1和47.8±9.6,均显著高于对照组的(99.5±9.3)%、40.3±6.7和31.5±5.3(P<0.05)。而TLR4-siRNA组的HUVECs增殖率、迁移数目和管腔形成个数分别为(60.2±8.7)%、31.3±4.5和17.2±3.3,均显著低于对照组(P<0.01);而TLR4-siRNA+LPS组的HUVECs增殖率、迁移数目和管腔形成个数分别为(88.8±9.1)%、35.6±5.2和26.8±5.1,均显著低于LPS组(P<0.01),经TLR4-siRNA预处理后,LPS促进HUVECs增殖、迁移和管腔形成的能力明显下降。
2.2p38MAPK信号通路在TLR4促胰腺癌血管生成中的作用 与对照组相比,SB203580组的HUVECs增殖率[(79.6±8.9)%]、迁移数目(21.6±4.3)和管腔形成个数(23.5±4.3)均显著减少(P<0.05);而SB203580+LPS组的HUVECs增殖率[(109.7±12.6)%]、迁移数目(31.8±5.7)和管腔形成个数(29.2±5.3)均显著低于LPS组(P<0.05),经SB203580阻断p38MAPK信号通路后,LPS促进HUVECs增殖、迁移和管腔形成的能力明显下降。
2.3TLR4对PANC-1细胞VEGF表达的影响 与对照组相比,经LPS作用后,尽管PANC-1细胞TLR4蛋白表达无明显变化,但VEGF、p-p38蛋白表达均明显增加,而TLR4-siRNA可明显抑制PANC-1细胞TLR4、VEGF、p-p38蛋白表达;且TLR4-siRNA可显著抑制LPS对VEGF、p-p38表达的诱导作用,见图1。
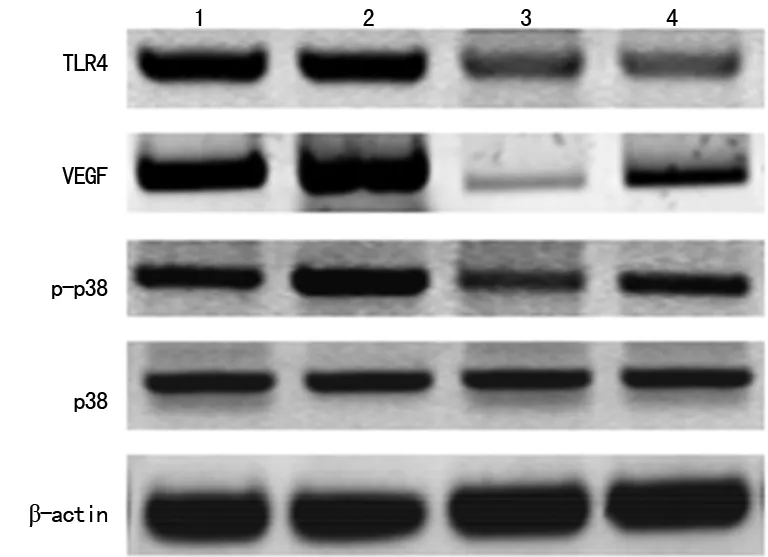
1:对照组;2:LPS组;3:TLR4-siRNA组;4:TLR4-siRNA+LPS组。
图1LPS、TLR4-siRNA对PANC-1细胞TLR4、VEGF、p38、p-p38蛋白表达的影响
2.4p38MAPK信号通路在TLR4促进PANC-1细胞表达VEGF中的作用 为了进一步验证TLR4蛋白可通过激活p38MAPK通路促进VEGF表达,本研究分别以LPS和SB203580作用于PANC-1细胞。Westernblot的结果显示,经SB203580阻断p38MAPK通路后,PANC-1细胞VEGF、p-p38蛋白表达均较对照组明显下降,且阻断p38MAPK通路可明显逆转LPS所诱导的VEGF、p-p38表达,见图2。
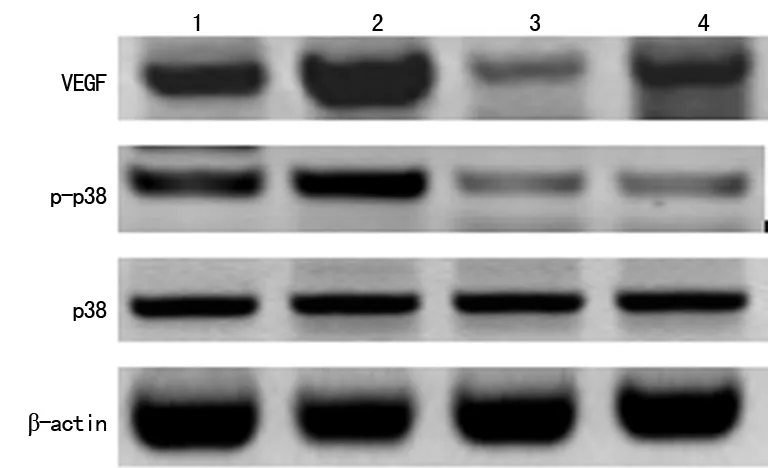
1:对照组;2:LPS组;3:SB203580组;4:SB203580+LPS组。
图2LPS、SB203580对PANC-1细胞VEGF、p38、p-p38蛋白表达的影响
3 讨 论
TLR4主要表达于与宿主防御功能有关的免疫细胞和内皮细胞,这样可以使TLR4更为方便地识别胞外细菌及其配体,诱导产生一系列的炎性介质从而产生强有力的炎症反应[8]。近年来研究发现,TLR4还在多种肿瘤细胞呈高表达,具有抑制肿瘤细胞凋亡,促进肿瘤细胞增殖、黏附、转移,以及免疫逃逸的作用[1-3,9]。已有的研究证实,TLR4在胰腺癌组织中高表达,且高表达的TLR4与胰腺癌的血管生成密切相关,提示TLR4在胰腺癌的发生与发展中起着重要的作用[2,10]。胰腺癌的生长、浸润和转移必须依赖肿瘤血管生成,抗血管生成已成为胰腺癌治疗研究的一个重要领域[11]。本研究发现,经LPS作用后的PANC-1细胞培养液可显著促进HUVECs细胞的增殖、迁移和管腔形成,而经TLR4-siRNA作用后的PANC-1细胞培养液可明显抑制HUVECs细胞的增殖、迁移和管腔形成,表明TLR4具有促进血管生成的作用。VEGF是目前发现的最为重要的促血管生成因子之一,在肿瘤的发展过程中起着重要的作用[12]。本研究发现,经LPS作用后,PANC-1细胞VEGF蛋白表达明显增加,而TLR4-siRNA可明显抑制VEGF蛋白表达,表明TLR4具有诱导VEGF表达的作用。Riddell等[13]通过对前列腺癌的研究也发现,TLR4具有调控VEGF表达的能力,可促进肿瘤血管的生成,然而TLR4促进VEGF表达的机制尚有待于进一步明确。
p38MAPK是丝裂原活化蛋白激酶家族成员之一,广泛存在于细胞中,是参与细胞生长、增殖、分化调节的重要信号转导通路。目前已证实,p38MAPK通路在多种肿瘤细胞内呈持续激活状态,持续激活的p38MAPK通路可诱导VEGF及IL-8等细胞因子的产生,从而在促进肿瘤血管生成过程发挥重要的作用[6-7]。本研究也发现,阻断p38MAPK通路后,PANC-1细胞VEGF蛋白表达显著下降,且培养液对HUVECs的增殖、迁移及管腔形成均有明显的抑制作用,同样证实p38MAPK通路可通过诱导VEGF表达,促进肿瘤血管生成。研究表明,TLR4可促进p38蛋白的磷酸化,激活p38MAPK通路,促进肿瘤细胞的生长;而使用RNA干扰技术沉默TLR4基因后,可抑制p38MAPK通路,促进肿瘤细胞的凋亡[14-15]。本研究发现,LPS可促进PANC-1细胞p-p38的表达,而TLR4-siRNA在抑制TLR4表达的同时可抑制p-p38的表达,表明TLR4具有激活胰腺癌细胞p38MAPK通路的作用。进一步的研究发现,阻断p38MAPK通路可明显阻断LPS对PANC-1细胞VEGF表达的诱导作用,并显著抑制LPS作用后PANC-1细胞培养液对HUVECs增殖、迁移和管腔形成的促进能力。这些结果表明,激活p38MAPK通路是TLR4诱导VEGF的表达,从而促进胰腺癌的血管生成的重要机制。
胰腺癌是严重危害人类健康的恶性肿瘤,阐明其发病机制并寻找有效的治疗靶点是目前迫切需要解决的重要课题。本研究表明,TLR4具有促进胰腺癌血管生成的作用,其机制与激活p38MAPK信号通路,诱导VEGF表达有关。但胰腺癌的发生、发展涉及多方面的复杂因素,TLR4的异常表达及其促血管生成可能只是其中的一种形式,其确切的分子机制尚有待于进一步研究。
[1]FuHY,LiC,YangW,etal.FOXP3andTLR4proteinexpressionarecorrelatedinnon-smallcelllungcancer:implicationsfortumorprogressionandescape[J].ActaHistochem,2013,115(2):151-157.
[2]满晓华,孙运良,龚燕芳,等.Toll样受体4在胰腺癌组织中的表达及其与肿瘤血管生成的关系[J].中华胰腺病杂志,2012,12(3):167-169.
[3]YuanX,ZhouY,WangW,etal.ActivationofTLR4signalingpromotesgastriccancerprogressionbyinducingmitochondrialROSproduction[J].CellDeathDis,2013,4(9):1-10.
[4]BenazziC,Al-DissiA,ChauCH,etal.Angiogenesisinspontaneoustumorsandimplicationsforcomparativetumorbiology[J].SciWorldJ,2014:919570.
[5]ShojaeiF.Anti-angiogenesistherapyincancer:currentchallengesandfutureperspectives[J].CancerLett,2012,320(2):130-137.
[6]LiuN,WuQ,WangY,etal.HelicobacterpyloripromotesVEGFexpressionviathep38MAPKMediatedCOX2PGE2pathwayinMKN45cells[J].MolMedRep,2014,10(4):2123-2129.
[7]TateCM,BlosserW,WyssL,etal.LY2228820dimesylate,aselectiveinhibitorofp38mitogen-activatedproteinkinase,reducesangiogenicendothelialcordformationinvitroandinvivo[J].JBiolChem,2013,288(9):6743-6753.
[8]Liaunardy-JopeaceA,GayNJ.Molecularandcellularregulationoftoll-likereceptor-4activityinducedbylipopolysaccharideligands[J].FrontImmunol,2014(5):473.
[9]TangX,ZhuY.TLR4signalingpromotesimmuneescapeofhumancoloncancercellsbyinducingimmunosuppressivecytokinesandapoptosisresistance[J].OncolRes,2012,20(1):15-24.
[10]孙运良,满晓华,王丽华,等.Toll样受体-4与胰腺癌侵袭和转移的关系[J].中国癌症杂志,2012,22(7):522-527.
[11]SilvestrisN,GnoniA,BrunettiAE,etal.Targettherapiesinpancreaticcarcinoma[J].CurrMedChem,2014,21(8):948-965.
[12]MatsumotoK,EmaM.RolesofVEGF-Asignallingindevelopment,regeneration,andtumours[J].JBiochem,2014,156(1):1-10.
[13]RiddellJR,BsharaW,MoserMT,etal.Peroxiredoxin1controlsprostatecancergrowththroughToll-Likereceptor4-dependentregulationoftumorvasculature[J].CancerRes,2011,71(5):1637-1646.
[14]WangLL,ZhuR,HuangZQ,etal.Lipopolysaccharide-inducedToll-likereceptor4signalingincancercellspromotescellsurvivalandproliferationinhepatocellularcarcinoma[J].DigDisSci,2013,58(8):2223-2236.
[15]LiuSL,YangJP,WangLA,etal.Tibiatumor-inducedcancerpaininvolvesspinalp38mitogen-activatedproteinkinaseactivationviaTLR4-dependentmechanisms[J].BrainRes,2010(1346):213-223.
Role of p38 MAPK signal pathway in TLR4 promoted angiogenesis of pancreatic cancer*
SunYunliang1,MaJianxia2△,ManXiaohua3,WuHongyu3
(1.DepartmentofGastroenterology,GanyuDistrictPeople′sHospital,Lianyungang,Jiangsu222100,China;2.DepartmentofGastroenterology,AffiliatedHuadongHospital,FudanUniversity,Shanghai200338,China;3.DepartmentofGastroenterology,AffiliatedChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China)
Objective To investigate the role of Toll like receptor-4 (TLR4) and p38 mitogen-activated protein kinase (p38 MAPK) signaling pathway in the angiogenesis of pancreatic neoplasms.Methods The in vitro cultured pancreatic cancer PANC-1 cells were treated with lipopolysaccharide (LPS),TLR4-siRNA and p38 MAPK signal pathway inhibitor SB203580.TLR4,vascular endothelial growth factor (VEGF), p-p38 protein expression of PANC-1 cells were detected by Western blot.The culture supernatants of PANC-1 cells after various factors treatment were collected for observing their effects on the proliferation,migration and tube formation of human umbilical vein endothelial cells (HUVECs).Results The proliferation rate,number of migration and tube formation of HUVECs in the LPS group were (139.2±12.6)%,48.1±9.1 and 47.8±9.6,respectively,which were significantly higher than those in the control group (P<0.05).The proliferation rate,number of migration and tube formation of HUVECs in the TLR4-siRNA group were (60.2±8.7)%,31.3±4.5 and 17.2±3.3,respectively,which were significantly lower than those in the control group (P<0.01).The proliferation rate [(79.6±8.9)],number of migration(21.6±4.3) and tube formation (23.5±4.3) of HUVECs in the SB203580 group were significantly lower than those in control group(P<0.05),moreover the proliferation rate,number of migration and tube formation of HUVECs in the TLR4-siRNA+LPS and SB203580+LPS groups were significantly lower than those in the LPS group(P<0.01).Compared with the control group,VEGF and p-p38 protein expression in the LPS group were significantly increased,and TLR4,VEGF and p-p38 protein expression in the TLR4-siRNA and SB203580 groups were decreased;moreover VEGF and p-p38 protein expression in the TLR4-siRNA+LPS and SB203580+LPS groups were significantly decreased compared with the LPS group.Conclusion TLR4 may promote the angiogenesis in pancreatic cancer,its mechanism is related with activating the p38 MAPK signaling pathway and promoting VEGF expression.
Toll-like receptor 4;pancreatic neoplasms;angiogenesis;p38 mitogen-activated protein kinases signaling pathway;vascular endothelial growth factor
��·基础研究
10.3969/j.issn.1671-8348.2017.02.005
连云港市卫生局科研项目(1427);江苏省卫生厅科研项目(Y201420)。
孙运良(1975-),副主任医师,博士,主要从事胰腺癌的发病机制与生物治疗方面研究。△
Email:yz_mjx@163.com。
R
A
1671-8348(2017)02-0161-04
2016-06-28
2016-10-02)

