人脂肪干细胞与不同浓度纤维蛋白胶的相容性研究*
阳水发,易阳艳,黄 艳,吴 舒,王朝慧
(南昌大学第二附属医院医疗美容科,南昌 330000)
人脂肪干细胞与不同浓度纤维蛋白胶的相容性研究*
阳水发,易阳艳△,黄 艳,吴 舒,王朝慧
(南昌大学第二附属医院医疗美容科,南昌 330000)
目的 研究人脂肪干细胞(ASCs)与不同浓度纤维蛋白胶支架的体外生物相容性。方法 获取人原代ASCs,鉴定后通过CCK-8试验检测纤维蛋白胶对ASCs的毒性。通过光镜直接观察和活细胞/死细胞(DEAD/LIVE)双标染色荧光观察ASCs分别与100.0、50.0、25.0、12.5mg/mL4组不同浓度纤维蛋白胶支架三维培养后ASCs的生长状况。结果CCK-8试验显示纤维蛋白胶对ASCs无明显毒性。通过光镜直接观察及DEAD/LIVE双荧光染色后观察显示ASCs与不同浓度纤维蛋白胶复合后细胞呈立体三维生长,ASCs增殖速率和健康程度(DEAD/LIVE值)随纤维蛋白浓度降低而提高,低于25.0mg/mL时细胞增殖速率和健康程度趋于良好。结论ASCs与纤维蛋白胶支架具有良好的体外生物相容性,纤维蛋白浓度低于25.0mg/mL为与ASCs三维培养的适宜浓度。
干细胞;脂肪类;纤维蛋白组织黏着剂;组织工程;支架;组织相容性
临床上因先天性畸形和获得性损伤所造成的软组织缺损的修复及美容需求的软组织填充是整形修复外科常见问题。目前临床采用注射透明质酸或胶原的方法存在填充效果维持时间短的弊端,假体植入存在填充效果不自然等缺点,自体脂肪移植由于缺乏微血管也存在再吸收率高的难题[1-2]。以脂肪干细胞(adipose-derived stem cells,ASCs)为种子细胞的脂肪组织工程为研究热点,特别是与可注射型支架材料为载体构建的组织工程脂肪具有极大的临床应用价值,有可能为解决这类问题提供优良的软组织填充材料,并且具有可稳定存活,有结构和功能双重修复作用,不需开放式外科手术,满足各种形状的填充需要等优点[3]。纤维蛋白胶由于其良好的可降解性和生物相容性等特性,被尝试用于包括组织工程等多个领域的研究[4-5]。在已有研究中,ASCs与纤维蛋白胶支架的三维培养模式缺乏直观的展示,对于ASCs与不同浓度纤维蛋白胶的生物相容性也缺乏研究,而这是纤维蛋白胶作为支架材料用于可注射型脂肪组织工程的重要参数[6]。因此,本研究将直观地显示ASCs复合纤维蛋白胶后三维培养下细胞生长状况,并摸索最适的纤维蛋白胶支架浓度,为以纤维蛋白胶为支架材料的可注射型脂肪组织工程的临床应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 组织材料 游离脂肪组织取自本科26~32岁健康女性腹部吸脂术后废弃的脂肪组织。术前已与患者谈话征得同意,研究经由医院伦理委员会批准。
1.1.2 主要试剂与仪器 低糖DMEM培养基、胎牛血清(FBS)、0.25%胰蛋白酶、0.02%乙二胺四乙酸(EDTA)购于美国Gibco公司;Ⅰ型胶原酶、地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、油红O染色剂、纤维蛋白原、凝血酶购于美国Sigma公司;鼠抗人CD34、CD45、CD49d、CD90、CD105、CD106多克隆抗体购于美国eBioscience公司;碘化丙啶(propidium iodide,PI)、钙黄绿素乙酰氧基甲酯(Calcein-AM)购于美国Invitrogen公司。CKX41型倒置相差显微镜、IX3型荧光倒置显微镜购于日本Olympus公司;BD FACSCALIBUR流式细胞仪购于美国BD公司;CO2培养箱、Multiskan Spectrum型多功能酶标仪购于美国Thermo公司。
1.2 方法
1.2.1 ASCs的分离培养与鉴定
1.2.1.1 ASCs的获取 取成人吸脂术后的脂肪组织10 mL,加入等体积1.0 mg/mL的Ⅰ型胶原酶溶液混匀后37 ℃恒温水浴消化40 min,定时摇匀。1 000 r/min离心5 min,去除上层油脂及液体成分,200目滤网过滤。10% FBS低糖DMEM培养基调整细胞浓度为(5~10)×105/L,接种至25 cm培养瓶中常规培养。48 h后首次换液,之后胰蛋白酶消化传代。传至第3代用。
1.2.1.2 流式细胞术检测ASCs表面抗原 取第3代ASCs,胰蛋白酶消化,1 000 r/min离心5 min,弃上清液,加少量磷酸盐缓冲液(PBS)吹打均匀,调整细胞浓度为1×109/L,将细胞悬液移入EP管(每管100 μL),每管分别加入两种不同荧光素标记的流式抗体各5 μL,以同型藻红蛋白标记的免疫球蛋白(PE-IgG)和异硫氰酸荧光素标记的免疫球蛋白(FITC-IgG)为阴性对照,室温避光孵育30 min,PBS洗涤两次以去除未结合的抗体,离心弃上清液后每管加500 μL PBS重悬均匀,上机行双荧光标记检测。
1.2.1.3 ASCs的成脂诱导和油红O染色 取第3代ASCs,胰蛋白酶消化,接种到置有盖玻片的6孔培养板上,待细胞贴壁融合较多时,将培养基更换为成脂诱导培养基[高糖DMEM,10% FBS,1 μmol/L地塞米松,10 μmol/L胰岛素,0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX),200 μmol/L吲哚美辛],阴性对照用10% FBS的完全培养基培养,每周换液2~3次。定期观察细胞形态变化,培养2周后取细胞爬片,PBS清洗后4%多聚甲醛固定5 min,洗涤后加入油红O工作液染色15 min,PBS洗涤两次后行显微镜观察。
1.2.2 纤维蛋白胶对ASCs毒性检测 ASCs消化后用含血清培养基调整为1×104/mL细胞悬液,按以下种板方式接种于96孔板中。空白支架组:用双联注射器各抽取50 μL的纤维蛋白原和凝血酶,注射入孔板底部形成100 μL纤维蛋白胶,不加细胞悬液。支架复合细胞组:同法形成100 μL纤维蛋白胶铺于板底,成胶后再每孔加入100 μL细胞悬液。对照组:每孔加入100 μL细胞悬液。每组5个复孔,共接种5块96孔板。分别在1、2、3、5、7 d各取出一板,于支架复合细胞组和对照组分别加入CCK-8 10 μL,孵育2 h,酶标仪检测450 nm处光密度(OD)值。实验组OD值=(支架复合细胞组OD值-空白支架组OD值)。将各点OD值用统计学作图软件在坐标纸上绘出实验组和对照组增殖曲线。
1.2.3 ASCs与不同浓度纤维蛋白胶支架复合后早期存活状况 将凝血酶用DMEM溶解为500 IU/mL的凝血酶溶液,用该溶液将ASCs制成约1×105/mL悬液。然后将纤维蛋白原分别溶解稀释为200.0、100.0、50.0、25.0 mg/mL 4组。通过双联注射器各抽取0.2 mL混合ASCs的凝血酶溶液和以上相应浓度的纤维蛋白原溶液,分别注入24孔板中,同法种板3块,纤维蛋白原终浓度被等比稀释为100.0、50.0、25.0、12.5 mg/mL 4组,待成胶后再各孔加含血清培养基1 mL培养24 h,光镜下观察4组中ASCs生长形态,存活数量差异,并且每组取3张照片通过两名实验者用photoshop点计数工具进行细胞计数,通过统计学作图软件制作柱状图。
1.2.4 ASCs与不同浓度纤维蛋白胶支架复合后期生长状况 将以上纤维蛋白原浓度为100.0、50.0、25.0、12.5 mg/mL的纤维蛋白胶+ASCs复合物于培养第5天取一块孔板,用PBS洗涤两遍,按说明书往孔板中加入含1/10体积2、4 μmol/L的Calcein-AM和PI的细胞培养基,置于37 ℃孵箱孵育15 min,再用PBS洗涤两遍。在荧光显微镜下,先使用490 nm激发波长观察绿色的活细胞,然后用545 nm激发波长观察红色的死细胞。观察各组细胞形态特征、活细胞/死细胞(DEAD/LIVE)数量。每组选取3个视野下拍摄的绿色荧光和红色荧光图片通过两名实验者用photoshop点计数工具进行细胞计数,通过统计学作图软件制作柱状图。
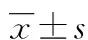
2 结 果
2.1ASCs光镜下形态学观察 第3代ASCs为典型的成纤维细胞样形态,呈细长梭形,有粗大的分支,核仁明显,细胞骨架伸展较大,细胞生长密集时呈现漩涡性,见图1。

A:100倍;B:200倍。
图1 第3代ASCs苏木素-伊红染色观察
2.2 流式细胞术检测ASCs表面抗原表达结果 选取的第3代ASCs经6种流式抗体结合后上机检测,结果显示ASCs高表达CD49d(94.8%),CD90(99.8%),CD105(99.8%),不表达或极低表达CD34(3.1%),CD45(2.9%),CD106(1.3%),见图2。

图2 第3代ASCs流式细胞术检测表面抗原
2.3ASCs的成脂诱导和油红O染色结果ASCs在成脂诱导培养基中诱导两周后脂滴形成较多,融合为较大脂滴,经油红O染色后可见脂滴被染成红色,见图3。

A:染色前;B:染色后。
图3ASCs成脂诱导2周油红O染色(倒置相差显微镜,×200)
2.4 纤维蛋白胶对ASCs增殖的影响检测结果 通过CCK-8检测实验组和对照组1、2、3、5、7dA值,间接反映两组细胞增殖情况,在坐标上绘成曲线,各时间点实验组和对照组组间差异无统计学意义(P=0.113、0.264、0.436、0.605、0.468),显示纤维蛋白胶对ASCs增殖无明显毒害影响,见图4。

图4 CCK-8检测实验组和对照组ASCs增殖曲线
2.5ASCs与不同浓度的纤维蛋白胶支架复合后早期存活状况 复合培养24h显示细胞伸展受到一定限制,细胞变成细长,呈三维立体生长,并可见部分未伸展出来的死细胞。组间可见明显差异,100.0、50.0mg/mL组中细胞形态极度变形,细胞伸展程度较小,并且活细胞数明显偏少,25.0、12.5mg/mL组细胞形态较为饱满规则,细胞伸出多个突起,细胞存活数明显增多。细胞计数显示随支架浓度降低ASCs存活率增高,25.0、12.5mg/mL组间差异无统计学意义(P=0.956),存活率趋于稳定,浓度低于25.0mg/mL时ASCs存活良好,为适宜浓度,见图5。

A:不同浓度的细胞支架复合物培养第24小时光镜观察(倒置相差显微镜,×100);B:点计数各组中ASCs细胞数。
图5ASCs与不同浓度的纤维蛋白胶复合后早期存活情况
2.6ASCs与不同浓度的纤维蛋白胶复合后期生长状况 以上支架细胞复合物培养第5天,DEAD/LIVE试剂盒染色后可清晰地观察到人ASCs在支架材料内的形态特征和生长状况。可见ASCs在支架材料中保持大致梭形外形,细胞突起明显较前增多。绿色荧光图片显示随着支架浓度的减低,细胞形态趋于正常培养形态,生长数量明显增多;红色荧光图片显示细胞凋亡随着支架浓度的减低逐渐减少。细胞点计数显示随纤维蛋白胶支架浓度降低,ASCs增殖速率明显增高,细胞健康程度(DEAD/LIVE)明显提高,25.0、12.5mg/mL两组间活细胞数差异无统计学意义(P=0.424),浓度低于25.0mg/mL时ASCs增殖速率和健康程度良好,为适宜浓度,见图6。

A:不同浓度的细胞支架复合物培养第5天DEAD/LIVE试剂盒染色观察(荧光倒置显微镜,×100);B:点计数DEAD/LIVE双染后各组细胞数。
图6ASCs与不同浓度的纤维蛋白胶复合后期生长情况
3 讨 论
脂肪组织工程的构建需要有合适的种子细胞,研究已经证实脂肪组织中含有大量ASCs[7-9]。由于脂肪组织量大,由此推测其可能是人体中最大的成体干细胞库。
研究显示扩增的ASCs表达间充质干细胞的表面标记物如CD90、CD105,表达黏附分子CD49d;缺乏造血系统标记物CD34、CD45,缺乏内皮细胞标记物CD31及免疫抗原标记组织相溶性抗原-DR(HLA-DR),缺乏血管内皮细胞黏附分子CD106[10-13],并且具有多向分化潜能[14-15]。本研究中获取的ASCs综合形态学特征、表面抗原标记和分化能力,符合ASCs的多种特性。
纤维蛋白胶为从血浆中制备的纤维蛋白原和凝血酶混合后模拟凝血反应最后通路聚合而成的纤维蛋白水凝胶。由于纤维蛋白胶具有良好的生物相容性和生物降解性,已经作为生物支架用于平滑肌、骨、软骨组织工程研究中[16-17]。另外,研究也显示纤维蛋白胶可以明显提高移植脂肪存活率和微血管化[18-19]。其次,交联的纤维蛋白可以支撑起细胞生长的立体的物理空间,使得细胞在其内呈现类似于体内生长时的三维生长模式。现有的研究已经表面,二维培养时细胞的黏附、增殖、基因表达均不同于立体三维培养[20-21],细胞处于三维培养将更接近细胞在体内的生长环境[22]。这些构成了纤维蛋白胶作为组织工程支架的理论基础。
本研究结果显示纤维蛋白胶对于二维培养下的ASCs的增殖没有明显影响,提示纤维蛋白胶对于二维培养的ASCs不产生直接的毒性作用,显示了与ASCs良好的生物相容性。将ASCs与纤维蛋白胶支架复合后三维培养,可见ASCs在纤维蛋白胶支架内沿着三维凝胶支架各个方向伸展。由于调节纤维蛋白聚合的浓度即可以产生不同的力学强度和纤维排列,因而不同浓度的纤维蛋白胶支架对于ASCs的三维生长具有重要影响,本研究结果也证实了这种显著差异。复合24h后光镜下观察显示100.0mg/mL、50.0mg/mL组中提示过高的浓度会使得细胞处于过大的力学压迫,限制了细胞生长空间,也使得细胞获取营养更加困难,造成了ASCs早期的大量死亡。25mg/mL、12.5mg/mL组细胞形态较为饱满规则,细胞伸出多个突起,细胞存活明显增多。早期总体表现为随支架浓度降低细胞存活增加,纤维蛋白浓度低于25.0mg/mL时ASCs存活良好,为适宜浓度。
DEAD/LIVE试剂盒是通过Calcein-AM和PI分别将活细胞胞质和死细胞核染成绿、红色,可进行细胞标记,也用于检测细胞存活率[23]。以上支架细胞复合物培养后期(第5天),DEAD/LIVE试剂盒染色后清晰地观察到ASCs在支架材料内的形态特征和生长状况。黄绿色荧光图片中显示随着支架浓度的减低,细胞增殖速率明显增高,细胞形态更符合正常培养形态;同一视野下红色荧光图片显示细胞凋亡数随着支架浓度的减低逐渐减少,显示细胞健康程度(LIVE/DEAD)明显升高。25.0、12.5mg/mL两组间差异无统计学意义,细胞生长趋于相似,亦提示纤维蛋白浓度低于25.0mg/mL时ASCs的增殖速率及健康程度均较为良好。
本研究结果显示ASCs与纤维蛋白胶具有良好的生物相容性,纤维蛋白胶支架可能作为脂肪组织工程优良的可注射型三维支架材料;不同浓度的纤维蛋白胶支架对于ASCs的生长影响具有显著差异,支架中纤维蛋白浓度低于25mg/mL为适宜浓度,由此为后续进行以纤维蛋白胶作为支架材料的脂肪组织工程研究提供了重要参数指导。
[1]ChangQ,LuF.Anovelstrategyforcreatingalargeamountofengineeredfattissuewithanaxialvascularpedicleandaprefabricatedscaffold[J].MedHypotheses,2012,79(2):267-270.
[2]TanziMC,FarèS.Adiposetissueengineering:stateoftheart,recentadvancesandinnovativeapproaches[J].ExpertRevMedDevices,2009,6(5):533-551.
[3]阳水发,易阳艳.脂肪干细胞构建可注射型组织工程脂肪的研究进展[J].中国修复重建外科杂志,2015,29(2):245-249.
[4]MurphyKC,FangSY,LeachJK.Humanmesenchymalstemcellspheroidsinfibrinhydrogelsexhibitimprovedcellsurvivalandpotentialforbonehealing[J].CellTissueRes,2014,357(1):91-99.
[5]CatelasI,SeseN,WuBM,etal.Humanmesenchymalstemcellproliferationandosteogenicdifferentiationinfibringelsinvitro[J].TissueEng,2006,12(8):2385-2396.
[6]张云松,高建华,鲁峰,等.人脂肪来源干细胞复合纤维蛋白胶构建可注射型工程化脂肪组织的实验研究[J].中华医学杂志,2008,88(38):2705-2709.
[7]ZukPA,ZhuM,MizunoH,etal.Multilineagecellsfromhumanadiposetissue:implicationsforcell-basedtherapies[J].TissueEng,2001,7(2):211-228.
[8]MizunoH,TobitaM,UysalAC.Concisereview:adipose-derivedstemcellsasanoveltoolforfutureregenerativemedicine[J].StemCells,2012,30(5):804-810.
[9]StremBM,ZhuM,AlfonsoZ,etal.Expressionofcardiomyocyticmarkersonadiposetissue-derivedcellsinamurinemodelofacutemyocardialinjury[J].Cytotherapy,2005,7(3):282-291.
[10]TahaMF,HedayatiV.Isolation,identificationandmultipotentialdifferentiationofmouseadiposetissue-derivedstemcells[J].TissueCell,2010,42(4):211-216.
[11]BianchiF,MaioliM,LeonardiE,etal.Anewnonenzymaticmethodanddevicetoobtainafattissuederivativehighlyenrichedinpericyte-likeelementsbymildmechanicalforcesfromhumanlipoaspirates[J].CellTransplant,2013,22(11):2063-2077.
[12]KoMS,JungJY,ShinIS,etal.Effectsofexpandedhumanadiposetissue-derivedmesenchymalstemcellsontheviabilityofcryopreservedfatgraftsinthenudemouse[J].IntJMedSci,2011,8(3):231-238.
[13]MiranvilleA,HeeschenC,SengenèsC,etal.Improvementofpostnatalneovascularizationbyhumanadiposetissue-derivedstemcells[J].Circulation,2004,110(3):349-355.
[14]杨平,尹烁,崔磊,等.脂肪干细胞向血管平滑肌细胞诱导的实验研究[J].中国修复重建外科杂志,2008,22(4):481-486.
[15]ChoiYS,MatsudaK,DustingGJ,etal.Engineeringcardiactissueinvivofromhumanadipose-derivedstemcells[J].Biomaterials,2010,31(8):2236-2242.
[16]IkariY,FujikawaK,YeeKO,etal.Alpha(1)-proteinaseinhibitor,alpha(1)-antichymotrypsin,oralpha(2)-macroglobulinisrequiredforvascularsmoothmusclecellspreadinginthree-dimensionalfibringel[J].JBiolChem,2000,275(17):12799-12805.
[17]MeinhartJ,FusseneggerM,HöblingW.Stabilizationoffibrin-chondrocyteconstructsforcartilageReconstruction[J].AnnPlastSurg,1999,42(6):673-678.
[18]KaraçalN,CobanogluU,AmbarciogluO,etal.Theeffectoffibringlueonfatgraftsurvival[J].JPlastReconstrAesthetSurg,2007,60(3):300-303.
[19]BeckerJC,DomschkeW,PohleT.Biologicalinvitroeffectsoffibringlue:fibroblastproliferation,expressionandbindingofgrowthfactors[J].ScandJGastroenterol,2004,39(10):927-932.
[20]NelsonWJ.Adaptationofcoremechanismstogeneratecellpolarity[J].Nature,2003,422(6933):766-774.
[21]TibbittMW,AnsethKS.Hydrogelsasextracellularmatrixmimicsfor3Dcellculture[J].BiotechnolBioeng,2009,103(4):655-663.
[22]KraehenbuehlTP,LangerR,FerreiraLS.Three-dimensionalbiomaterialsforthestudyofhumanpluripotentstemcells[J].NatMethods,2011,8(9):731-736.
[23]ZhouS,CuiZ,UrbanJ.Deadcellcountsduringserumcultivationareunderestimatedbythefluorescentlive/deadassay[J].BiotechnolJ,2011,6(5):513-518.
Compatibility between human adipose derived stem cells and different concentrations of fibrin gel*
YangShuifa,YiYangyan△,HuangYan,WuShu,WangZhaohui
(DepartmentofPlasticSurgery,SecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330000,China)
Objective To research the in vitro compatibility between adipose-derived stem cells (ASCs) and fibrin gel scaffold.Methods The human primary ASCs were obtained and identified.The toxicity of fibrin gel on ASCs was detected by CCK-8 test.The light microscopy and DEAD/LIVE double labelled staining fluorescence were used to observe the ASCs growth situation after three dimensional culture of ASCs with 4 concentrations of 100.0,50.0,25.0,12.5 mg/mL fibrin gel scaffold.Results The CCK-8 test showed no significant toxicity of fibrin gel on ASCs.The light microscopy and DEAD/LIVE double labelled staining fluorescence direct observation revealed that ASCs showed a stereo three-dimensional cell growth pattern after cultivation with fibrin gel scaffold,the ASCs proliferation rate and health degree(DEAD/LIVE value) were elevated with the fibrin concentration decrease,in the fibrin concentration less than 25 mg/mL,the cellular proliferation rate and health degree tended to be better.Conclusion ASCs and fibrin gel scaffold have favorable in vitro biocompatibility,and the fibrin gel concentration which is less than 25.0 mg/mL is appropriate for ASCs three-dimensional culture.
stem cells;fats;fibrin tissue adhesive;tissue engineering;scaffold;histocompatibility
��·基础研究
10.3969/j.issn.1671-8348.2017.02.006
江西省科技支撑计划(2010BSA15100,2010BSB00201);江西省自然科学基金(20151BAB205034)。
阳水发(1989-),在读硕士,主要从事组织工程和脂肪移植方面研究。△
E-mail:yyy0218@126.com。
R
A
1671-8348(2017)02-0165-04
2016-06-18
2016-09-26)

