电针干预慢性炎性痛大鼠痛情绪的前扣带皮层PKCζ调控机制
温存 杜俊英 房军帆 乐小琴 付桃芳 肖婷 邵晓梅 方剑乔
浙江中医药大学第三临床医学院 杭州 310053
电针干预慢性炎性痛大鼠痛情绪的前扣带皮层PKCζ调控机制
温存 杜俊英 房军帆 乐小琴 付桃芳 肖婷 邵晓梅 方剑乔
浙江中医药大学第三临床医学院 杭州 310053
[目的]观察电针对完全弗氏佐剂(Complete Freund's adjuvant,CFA)诱导的慢性炎性痛大鼠痛情绪行为的干预作用及其对前扣带皮层(Anterior Cingulate Cortex,ACC)内蛋白激酶Cζ(Protein Kinase C zeta,PKCζ)的调控。[方法]将健康雄性SD大鼠完全随机分为空白对照组(N组)、模型对照组(CFA组)和电针治疗组(EA组),每组8只。建立慢性炎性痛模型,选取双侧“足三里”、“昆仑”穴进行电针治疗,每日1次,连续3天,检测大鼠造模前及造模后ld、3d、7d、14d、21d、28d患侧足跖缩足阈(paw withdrawal thresholds,PWTs),观察大鼠痛觉超敏反应。用旷场试验和高架O迷宫实验分别观察大鼠造模后29d和30d情绪变化,免疫印迹法检测大鼠双侧ACC内PKCζ和磷酸化PKCζ(p-PKCζ)蛋白表达。[结果]造模前,各组大鼠PWTs差异无统计学意义(P>0.05);造模后CFA组大鼠各时点PWTs均明显下降,差异有统计学意义(P<0.01),EA组大鼠造模后28d PWTs明显高于CFA组,差异有统计学意义(P<0.05)。CFA组大鼠造模后29d中央区运动距离、进入中央区次数和中央区停留时间明显减少(P<0.05),EA组大鼠中央区运动距离、进入中央区次数和中央区停留时间显著增加,差异有统计学意义(P<0.01),CFA组造模后30d进入开放臂次数明显减少,差异有统计学意义(P<0.05)。CFA组患侧PKCζ和p-PKCζ蛋白表达均明显上升,差异有统计学意义(P<0.05),EA组大鼠双侧PKCζ和p-PKCζ蛋白表达无统计学意义(P>0.05)。[结论]电针可减轻慢性炎性痛大鼠痛感觉和痛情绪行为,但其机制可能不是通过调节ACC中PKCζ表达来实现。
慢性炎性痛;痛情绪;电针;足三里;昆仑;疼痛;前扣带皮层;PKCζ
国际疼痛学会认为,“疼痛是一种与组织损伤或潜在的损伤相关的不愉快的主观感觉和情绪体验”。疼痛包含感觉分辨和情绪反应两种成分,其中情绪反应又可分为原发性和继发性两个阶段。慢性疼痛是指持续时间超过半年以上的疼痛,是临床上常见的症状之一,此类疾病的患病率较高,目前大约存在20%~30%的人群正在遭受慢性疼痛的伤害[1,2],并且通常会伴有焦虑、抑郁等情绪障碍,逐步形成疼痛与痛情绪的恶性循环。
以往研究发现,电针对慢性炎性疼痛均有不同程度的镇痛效应[3,4],而目前电针的研究主要还是痛感觉层面上,电针对痛情绪的研究相对落后。近几十年的研究表明,前扣带皮层(Anterior Cingulate Cortex,ACC)作为情绪脑环路的重要枢纽,在慢性痛情绪反应中扮演着重要角色[5,6]。有学者研究发现,谷氨酸受体与痛情绪密切相关,蛋白激酶Cζ(Protein Kinase C zeta,PKCζ)作为N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate,NMDAR)等谷氨酸受体的激活和增强兴奋性物质[7],在情绪方面发挥一定作用。研究人员研究发现,运用蛋白激酶C(Protein Kinase C,PKC)PKC抑制剂可改善患者精神状态[8]。PKCζ是蛋白激酶家族PKC的成员之一,作为PKC非典型亚型蛋白,作者所在的团队研究发现,ACC脑区内PKCζ参与慢性炎性痛痛情绪的调制[9]415。本文将继续研究CFA诱导的慢性炎性痛痛情绪的变化情况,并运用电针治疗,观察其对慢性炎性痛大鼠痛情绪行为的干预作用及其对ACC 中PKCζ活化的调控作用,初步探索电针干预痛情绪的ACC区域PKCζ调控机制。
1 材料与方法
1.1 实验动物 清洁级健康雄性SD大鼠 (购自上海斯莱克实验动物有限公司)24只,体质量180±20g,由浙江中医药大学实验动物中心饲养,合格证号为SCXK(沪)2013-0016。饲养期间给予啮齿类动物标准颗粒饲料 (由实验动物中心提供)及自由摄食与饮水,温度(25±2)℃,湿度30%~40%,12h循环灯光 。
1.2 实验试剂及仪器 PKCζ抗体:美国Abcam公司,批号:ab59364;p-PKCζ抗体:美国Abcam公司,批号:ab62372;HRP标记的山羊抗兔二抗:美国Abcam公司,批号:ab6721;完全弗氏佐剂:美国Sigma公司,批号:SLBK1731V;HRP标记的GAPDH(14C10)抗体:Cell Signaling Technology公司,批号:3683;BCA蛋白浓度测定试剂盒:Beyotime公司,批号:P0010;Western blot ECL剂盒:Beyotime公司,批号:P0018;Western 及 IP细胞裂解液:Beyotime公司,批号:P0013;韩式穴位神经刺激仪:HANS-200A,联创科技南京济生医疗科技有限公司;华佗牌一次性针灸针:0.25mm×13mm,苏州医疗用品厂有限公司;凝胶成像系统:Image Quant LAS400型,德国GE公司;动物视频跟踪系统:SMART V 3.0,深圳市瑞沃德生命科技有限公司。
1.3 分组与造模 大鼠适应性喂养7d,完全随机分为空白对照组(N组)、模型对照组(CFA组)、电针治疗组(EA组)3组,每组8只。CFA组、EA组大鼠右后足足底皮下注射CFA(0.1ml/只),注射后24h局部出现炎症反应,以建立慢性炎性痛模型[9]416;N组大鼠右后足足底皮下注射同等剂量的生理盐水,以建立对照模型。
1.4 电针干预 造模后第28d检测机械缩足阈前EA组大鼠开始介入电针治疗。用0.25mm×13mm毫针针刺双侧“足三里”穴、“昆仑”穴,进针后连接LH韩式穴位神经刺激仪进行电针刺激。干预参数:疏密波,频率2/100Hz,强度起始1mA,10min后调为1.5mA,10min后再调为2mA,共30min,1次/d,连续处理3d。N组、CFA组不进行电针干预,仅给予和EA组相同的固定。1.5 足跖缩足阈(paw Withdrawal Thresholds,PWTs)实验于造模前、造模后 ld、3d、7d、14d、21d、28d 7个时点检测大鼠患足PWTs的变化,测量时间固定在9:00-17:00,环境温度为23℃左右。开始前先将大鼠放置于特定的铁丝网上(UGO),盖以透明有机玻璃照(20cm×20cm×15cm),适应环境直至大鼠安静(即停止梳毛和探索性活动),约15min。参考Chaplan[10]创建的经典up and down法用Von Frey纤维丝(0.4g、0.6g、1.0g、2.0g、4.0g、6.0g、8.0g、15.0g和26.0g)测量。首先从4.0g开始,将Von Frey纤维丝置于大鼠右后足足底中央区皮肤(避开足垫),轻微垂直用力至Von Frey丝弯曲成S形,刺激时间每次持续5-8s,间隔>2min,若大鼠出现缩足/逃逸行为则阳性反应,记为“X”,换小一级力度的Von Frey丝继续刺激;反之以“O”表示,换大一级力度的Von Frey丝继续刺激,直到出现第一对不同符号作为前两个有效符(即“XO”或“OX”)之后再连续重复测量四次,如可得到“OOOXXOOX”的序列,以10xf+kδ/10000公式(xf=最后一个有效符号所在的Von Frey纤维丝上的log值,k=阴性或阳性反映符号排列所代表的值,δ=所有刺激强度log均差,该实验中是0.231)计算痛阈值,若连续5次测量均为阴性反应则痛阈值为26g,反之若均为阳性反应则痛阈值为0.4g。
1.6 旷场实验测试 各组大鼠造模后29d电针干预结束后进行,操作间保持较暗的光线,避免直射光线,室温25度左右,湿度适宜,环境安静。先将待测大鼠放入实验环境中2h以适应环境,调整好摄像头,开始时将大鼠轻轻放入旷场实验箱正中格中(大鼠头部背对实验者)即进行摄像,记10min探索情况,用SMART V3.0动物视频跟踪系统进行分析。分析时将旷场划为16个格子,中间4个为中央区,其他12格为周围区,计算10min内大鼠在旷场内总运动距离、中央区运动距离、进入中央区次数和中央区停留时间。每只大鼠测量前用10%酒精清洗方箱内壁及底面以减少实验误差。
1.7 高架O迷宫试验测试 各组大鼠造模后30d电针干预结束后进行,环境要求及适应条件同旷场实验,开始时将大鼠迅速放置于迷宫闭合臂与开放臂交界处,其头面向开放臂,记录5min探索情况,使用SMART V3.0动物视频跟踪系统进行分析,分析时将高架O迷宫分成4个臂,2个为闭合臂,2个为臂,计算5min内大鼠在迷宫内的总运动距离、开放臂运动距离、进入开放臂的次数和开放臂停留时间百分比。每只大鼠测量前用10%酒精清洗方箱内壁及底面以减少实验误差。
1.8 免疫印迹法检测ACC内PKCζ、p-PKCζ水平所有组别大鼠在造模后30d高架O迷宫实验结束后立即处死并取材:大鼠行水合氯醛(0.35ml/100g)腹腔麻醉,参照 Paxinos-Watson大鼠脑立体定位图谱快速取得左右两侧ACC,4℃生理盐水经心脏灌注,直至流出液体为澄清液体。冰上剪取双侧ACC,立即经液氮速冻,-80℃冰箱中保存备用。各组双侧ACC分别放入离心管中称量,加入1ml预冷的裂解液(碧云天RIPA、蛋白酶抑制剂PMSF、磷酸酶抑制剂),每10mg新鲜组织加入100μl裂解液,冰浴中充分超生粉碎,4℃冰箱中静置0.5h后放入4℃高速离心机12000rpm离心10min,提取上清液测定量蛋白浓度。以20μg上样量为标准,根据各样本的总蛋白浓度,计算蛋白上样体积,加入等体积的2×上样缓冲液,98℃水浴变性10min,采用10%SDS-PAGE分离胶,5%浓缩胶SDSPAGE,室温聚合30min。电泳以每泳道20μg蛋白上样量,先加至80V,约 40min,再调至120V约1h20min。电泳结束后用PVDF膜进行半干转印:恒压15v,45min。转印完将PVDF膜放在5%脱脂奶粉室温封闭1h;加入相应一抗(用TBST缓冲液稀释):兔抗大鼠PKCζ单克隆抗体(1:500)、兔抗大鼠p-PKCζ单克隆抗体(1:1000)和兔抗大鼠GAPDH单克隆抗体(1: 1000),4℃孵育过夜,TBST缓冲液室温摇床上洗膜10min×3次;加入相应的辣根过氧化物酶标记山羊抗兔IgG(1:5000),二抗室温孵育1h,TBST缓冲液摇洗10min×3次;GAPDH直接显色,拍片,其余用TBST缓冲液摇洗10min×3次;用Western blot ECL显色液室温避光反应5min和ImageQuant LAS 4000凝胶图像分析系统进行拍片;Image Quant TL软件对目的蛋白条带和内参条带的灰度值进行分析,按相对灰度值=目的蛋白的灰度值/GAPDH灰度值,计算每组目的蛋白相对表达量。
1.9 统计学分析 采用SPSS17.0统计学软件处理,实验数据均以均数±标准误(x±s.e.m)表示。多组间比较采用单因素方差分析(ANOVA);组间两两比较,方差齐性时采用LSD检验,方差不齐时采用Dunnett’s T3检验;均以P<0.05作为差异有统计学意义的检验标准。
2 结果
2.1 电针对CFA大鼠患侧PWTs的影响 造模前各组间PWTs无明显差异(P>0.05)。 造模后1d,CFA组、EA组PWTs明显低于同时间点N组,差异有统计学意义(P<0.01),提示CFA成功诱发大鼠患侧足趾痛觉异常。造模后第3d、7d、14d、21d和28d,CFA组大鼠PWTs均明显低于N组,差异有统计学意义(P<0.01),说明造模后的28d之内大鼠一直处于CFA引起的痛觉异常过程中。 在造模后28d接受电针治疗后,EA 组PWTs明显高于同时点CFA组,差异具有统计学意义(P<0.01),但是与同期N组大鼠无差异。见图1。
2.2 旷场实验观察大鼠造模后不同时间点行为学变化及电针的干预 造模后29d,与N组相比,CFA组大鼠在旷场内中央区运动距离、进入中央区次数以及中央区停留时间明显减少,差异具有统计学意义(P<0.05),表明CFA组大鼠出现情绪异常。与CFA组相比,EA组大鼠在旷场内的中央区运动距离、中央区停留时间和进入中央区的次数明显增加,差异有统计学意义(P<0.01)。 三组大鼠总运动距离差异无统计学(P>0.05),表明大鼠造模前后与治疗前后探索能力无显著区别。见图2。
2.3 高架O迷宫观察造模后不同时间点行为学变化及电针的干预 造模后30d,与N组相比,CFA组大鼠进入开放臂次数明显减少,差异有统计学意义(P<0.05)。两组总运动距离、开放臂运动距离和开放臂停留时间百分比无统计学差异(P>0.05)。与CFA组相比,EA组各项指标均无明显统计学差异。见图3。
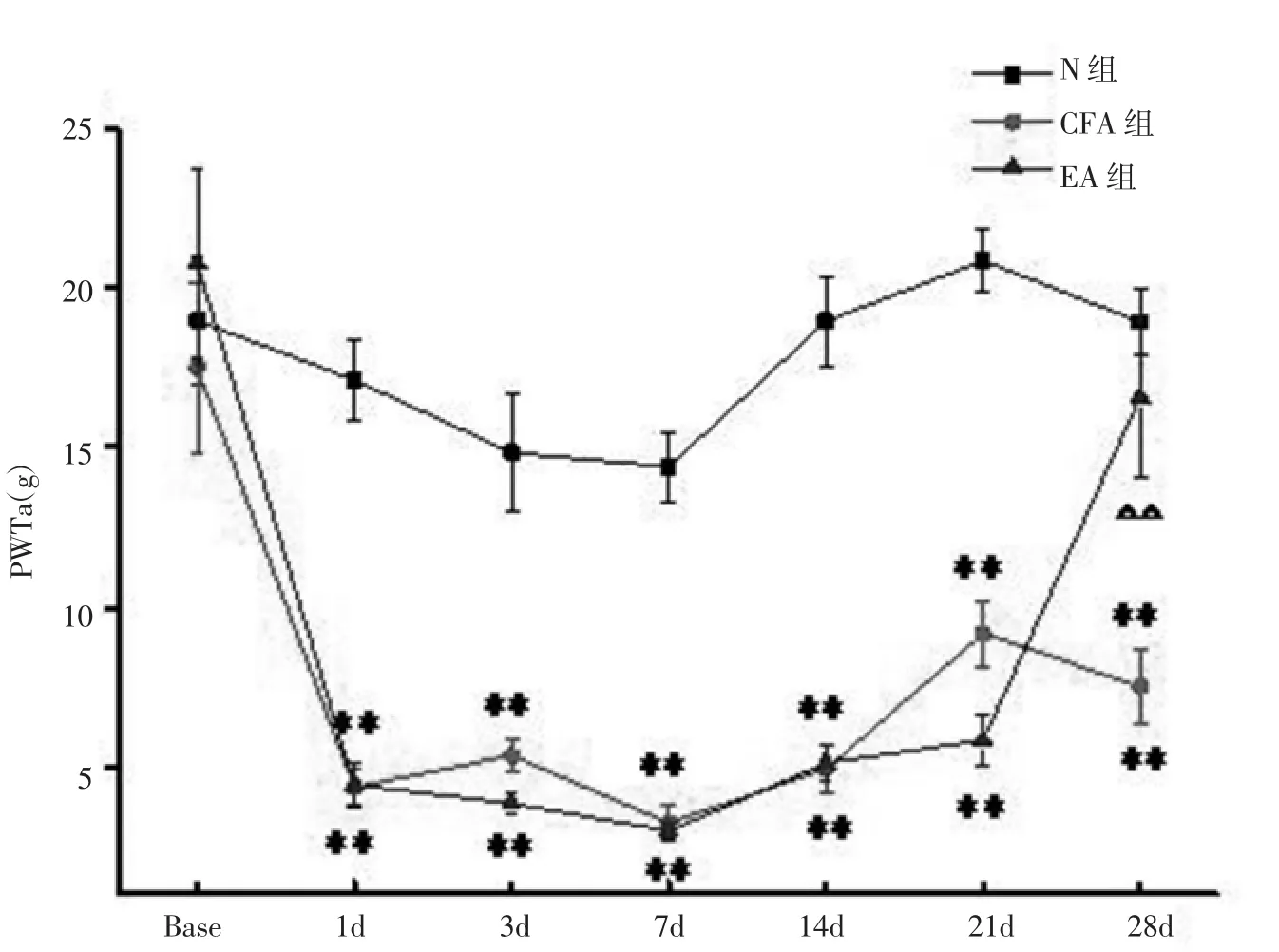
图1 各组大鼠患侧足跖缩足阈各时点变化情况(±s.e.m,g)Fig.1 Comparison of the ipsilateral PWTs of rats in each group at each time point(±s.e.m,g)
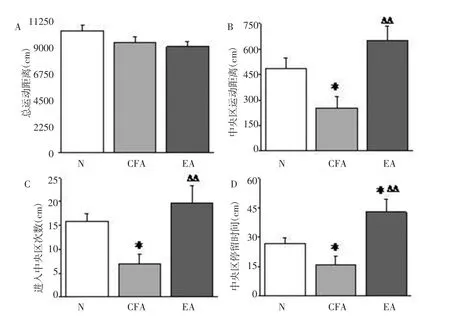
图2 D29电针对CFA大鼠旷场行为的影响Fig.2 Effect of EA on the open field test of rats on D29
2.4 电针对CFA大鼠双侧ACC内PKCζ和p-PKCζ蛋白表达的影响 可见大鼠双侧ACC PKCζ和p-PKCζ条带及其蛋白表达状图。造模后30d,与N组相比,CFA组大鼠患侧PKCζ和p-PKCζ蛋白表达明显上升,差异具有统计学意义(P<0.05)。其健侧PKCζ蛋白表达有所上升,但差异无统计学意义(P>0.05)。与CFA组相比,EA组的患侧PKCζ、p-PKCζ蛋白表达有下降表现,但无统计学意义(P>0.05);其健侧PKCζ、p-PKCζ蛋白表达差异无统计学意义(P>0.05)。见图4和图5。
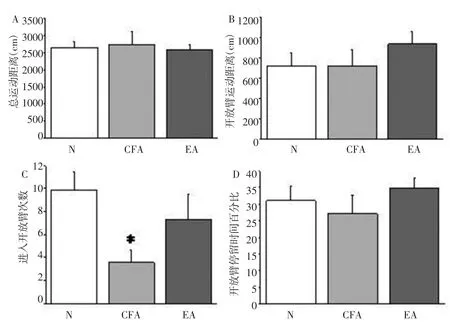
图3 D30电针对CFA大鼠高架O迷宫行为的影响Fig.3 Effect of EA on the elevated O maze test of rats on D30

图4 各组大鼠双侧ACC内PKCζ蛋白的相对表达Fig.4 Relative protein expression of PKCζ in bilateral ACC of rats in each group
3 讨论
近几年,CFA诱导的慢性炎性痛痛情绪改变相关研究得到了普遍的关注。足底注射CFA后可以产生持久而稳定的炎性痛疼痛,成为经典的慢性炎性痛模型。该模型伴发痛情绪行为学改变常见的实验方法有旷场实验、高架O迷宫或十字迷宫实验、糖水试验、社交实验、强迫游泳实验等。由于疼痛模型涵盖了痛觉和痛情绪两方面,因此评价需要从感觉和情绪两方面阐述。研究表明经典CFA注射模后1d缩足阈值达到最低,之后逐渐升高,至28d大鼠缩足阈值低于正常值[11]。另有研究表明CFA造模后2-4周大鼠出现痛情绪[12]。本实验研究结果显示在痛感觉层面,模后1d明显低于正常值,模后7d达到最低,至28d仍然持续疼痛,与经典模型的持续时间一致。在痛情绪层面,慢性炎性痛大鼠中央区运动距离下降、进入次数和停留时间减少,提示大鼠产生了痛情绪。然而在本研究中,大鼠在高架O迷宫中仅有进入中央区的次数减少,痛情绪产生不明显,分析大鼠可能于模后28d为痛情绪产生的高峰。上述结果成功诱导了大鼠慢性炎性痛痛情绪模型。
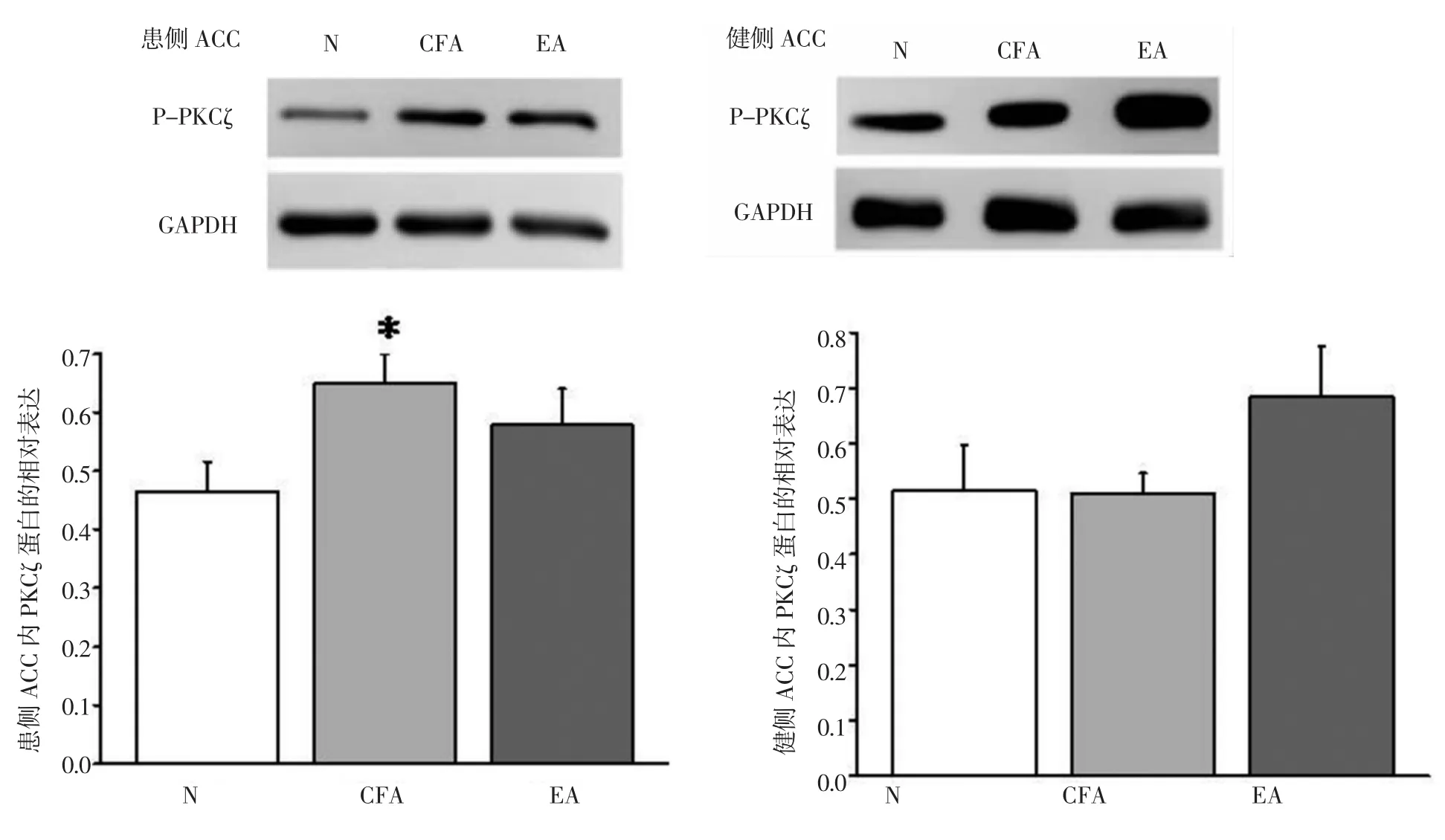
图5 各组大鼠双侧ACC内p-PKCζ蛋白的相对表达Fig.5 Relative protein expression of p-PKCζ in bilateral ACC of rats in each group
目前,在哺乳动物中发现PKC超家族12个亚型,根据不同亚型在结构和功能上的特点,可将PKC分为三组:经典型PKC(conventional PKC,cPKC)、新奇型PKC(novel PKC,nPKC)和非经典型PKC(atypical PKC,aPKC),其中PKCζ因其与人的PKCι和鼠的PKCλ结构相似,共同组成非典型PKC家族[13]。一般认为,PKC以非活性分布于细胞溶质中,当细胞接收刺激时产生三磷酸肌醇(IP3)和二酰甘油(DAG)。DAG使PKC从细胞浆转至细胞膜,IP3使内质网中的Ca2+浓度升高,Ca2+使PKC构象发生变化以利于其催化区的丝氨酸/苏氨酸位点被磷酸化从而导致PKC激活[14]。目前,多项研究表明PKC及其磷酸化形式p-PKC与情绪有关:有研究发现ACC注射PKCζ抑制剂ZIP可抑制神经损伤所致的痛情绪,但对神经病理性疼痛大鼠的痛阈无影响[15]。生理病理学研究发现神经素颗粒PKC磷酸化和谷氨酸受体PKC磷酸化在狂躁情绪中表达明显增加,而使用抗兴奋性药物能减缓狂躁情绪的发展,并且患者大脑组织中p-PKC表达也显著减少[16]。笔者之前的研究结果显示:PKCζ及与慢性炎性疼痛痛情绪密切相关。本实验研究观察到造模后30d,患侧PKCζ及其磷酸化形式蛋白p-PKCζ蛋白表达明显增多,说明PKCζ的活化参与了慢性炎性疼痛形成,而这种疼痛的形成可能与增加PKCζ表达有关。
电针被广泛用于各种疾病的治疗。临床上又以持续性或慢性疼痛治疗效果更佳。目前现有的电针镇痛效应和机制多从疼痛感觉的角度出发,主要通过离子通道、受体和相关神经递质或调节蛋白的分析来阐述机理[17,18]。近来,大量临床研究证明电针对不良情绪有良好的调节作用[19,20]。电针在缓解炎性痛的同时也缓解了大鼠的痛情绪[21,22]。本实验研究显示,CFA慢性炎性痛模型成功建立后29d,EA组大鼠在旷场内的中央区运动距离、中央区停留时间和进入中央区的次数明显增加(P<0.01)。表明电针在一定程度上可缓解CFA所致的痛情绪。本实验还检测了电针对CFA大鼠ACC 内PKCζ及其磷酸化形式蛋白表达的变化,结果显示电针组的相对表达量与模型组比较无统计学差异,原因可能有以下情况:①大鼠样本量不足导致实验结果有较大误差,从而不能检测到电针下调PKCζ和p-PKCζ蛋白表达的作用;②电针对PKCζ的干预作用可能不在ACC水平上。
综上所述,电针对慢性炎性痛痛情绪大鼠存在一定的调节作用,但其调节机制与ACC水平PKCζ蛋白高表达不相关。本实验研究电针对不同病理模型和动物不同生理状态下调节途径可能有所不同,究竟电针是否是通过ACC内PKCζ通路调节痛情绪还有待继续研究,今后本团队也将继续对慢性痛痛情绪行为及机制进行进一步研究,为临床治疗慢性痛引发的情绪障碍提供一定的科学依据。
References:
[1] Wong WS,Fielding R.The co-morbidity of chronic pain, insomnia,and fatigue in the general adult population of Hong Kong:Prevalence and associated factors[J].Journal of Psychosomatic Research,2012,73(1):28-34.
[2] 张文祥,倪家骧.慢性疼痛与抑郁焦虑关系的研究进展[J].疑难病杂志,2009,12(8):764-766. ZHANG Wenxiang,NI Jiaxiang.Research Progress on the relationship between chronic pain and depression and anxiety[J].Chinese Journal of Difficult and Complicated Cases,2009,12(8):764-766.
[3]杨金蓉,宋开源,梁繁荣,等.电针对佐剂性关节炎大鼠炎区炎症介质含量的影响 [J].成都中医药大学学报,1999,22 (1):48-49. YANG Jinrong,SONG Kaiyuan,LIANG Fanrong,et al. Effect of electroacupuncture on inflammatory media content in rats with adjuvant arthritis inflammation[J].Journal of Chengdu of Chinese medical University,1999,22(1):48-49.
[4]ZHANG Ruixin,LAO Lixing,REN Ke,et al.Mechanisms of Acupuncture-Electroacupuncture on Persistent Pain[J]. Anesthesiology,2011,120(2):482-503.
[5]CAO H,GAO YJ,REN WH,et al.Activation of extracellular signal-regulated kinase in the anterior cingulate cortex contributes to the induction and expression of affective pain[J].J Neurosci,2009,29(10):17-21.
[6] YAN N,GAO B,XU J,et al.Glutamatergic activation of anterior cingulate cortex mediates the affective component of visceral pain memory in rats[J].Neurobiol Learn Mem, 2012,97(1):64-156.
[7] 雷留根.痛厌恶“情绪”的神经机制——相关的中枢结构及谷氨酸受体[D].上海:中国科学院研究生院(上海生命科学院植物生理生态所),2004:37-41. LEI Liugen.Neural mechanisms of emotional pain-related central structure and glutamate receptors[D].Shanghai: Chinese Academy of Sciences(Institute of Plant Physiology&Ecology),2004:37-41.
[8]XIAO Z,Jaiswal M,Deng PY,et al.Requirement of phospho-lipase C and protein kinase C in cholecystokininmediated facilitation of NMDA channel function and anxiety-like behavior[J].Hippocampus,2012,22(6):1438-1450.
[9] 杜俊英,温存,邵晓梅,等.前扣带皮层区域磷酸激酶Czeta在弗氏完全佐剂致炎性痛大鼠情绪反应中的作用[J].中国实验动物学报,2016,24(4):415-421. DU Junying,WEN Cun,SHAO Xiaomei,et al.The role of PKCzeta-expression in the emotional response to complete Freund’s adjuvant-induced inflammatory pain[J]. ACTA Laboratorium Animalis Scientia Sinica,2016,24(4): 415-421.
[10]Chaplan S R,Bach F W,Pogrel J W,et a1.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Meth,1994,53(1):55-63.
[11]REN K,Ronald D.Inflammatory Models of Pain and Hyperalgesia[J].Ilar J,1999,40(3):111-118.
[12]刘志文.加巴喷丁对慢性炎性痛大鼠引起的认知功能改变和负性情绪的影响[D].长沙:中南大学湘雅二医院研究所, 2012:1-26. LIU Zhiwen.The Effect of Gabapentin Administration on theCognitiveFunction Changeand NegativeEmotion Caused by Chronic Inflammation Pain Rats[D].Changsha:Study The institute of Second Xiangya Hospital of Central South Univerdity,2012:1-26.
[13]WU Jing,Liu Shuye,Fan Zhijuan,et al.A novel and selective inhibitor of PKC ζ potently inhibits human breast cancer metastasis in vitro and in mice[J].Tumor Biology, 2016,37(6):8391-8401.
[14]Takaaki Hirai,Kazuhiro Chida.Protein Kinase Cζ(PKCζ): Activation Mechanisms and Cellular Functions[J].J Biochem,2003,133(3):1-7.
[15]Fabien Marchand,Richard D’Mello,Ping K Yip,et al. Specific involvement of atypical PKCζ/PKMζ in spinalpersistent nociceptive processing following peripheral inflammation in rat[J].Molecular Pain,2011,7(86):1-18.
[16]LIU Huan,LIU ShenBin,LI Qian,et al.Downregulation of Spinal G Protein-Coupled Kinase 2 Abolished the Antiallodynic Effect of Electroacupuncture[J].Evidence-Based Complementary and Alternative Medicine,2015(10):1-7.
[17]King T,Qu C,Okun A,et a1.Contribution of PKMζdependent and in dependent amplification to components of experimental neuropathic pain[J].Pain,2012,153(6): 1263-1273.
[18]梁宜,方剑乔,房军帆,等.中枢NMDA受体在疼痛中的作用及电针的干预研究[J].浙江中医药大学学报,2012,36(1): 109-112. LIANG yi,FANG Jianqiao,FANG Junfan,et al.Central NMDA in pain and intervention on ele-acupuncture[J]. Journal of Zhejiang Chinese Medical University,2012,36 (1):109-112.
[19]Kondo T,Kawamoto M.Acupuncture and moxibustion for stress-related disorders[J].Biopsychosoc Med,2014,8(1): 1-7.
[20]Chen J,Lin W,Wang S,et al.Acupuncture/electroacupuncture enhances anti-depressant effect of Seroxat:the Symptom Checklist-90 scores[J].Neural Regen Res, 2014,9(2):213-22.
[21]LiQ,Yue N,Liu SB,etal.Effects ofchronic electroacupuncture on depression-and anxiety-like behaviors in rats with chronic neuropathic pain[J].Evid Based Complement Alternat Med,2014(2014):158987.
[22]Zhang Y,Meng X,Li A,et al.Acupuncture alleviates the affective dimension of pain in a rat model of inflammatory hyperalgesia[J].Neurochem Res,2011,36(11):2104-2010.
The Regulated Mechanism of Electroacupuncture on Emotional Pain with PKCζ in Anterior Cingulated Cortex of Rats with CFA Chronic Inflam-matory Pain
WEN Cun,DU Junying,FANG Junfan,et al The Third Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou(310053),China
[Objective]To observe the intervention effect of electroacupuncture(EA)on pain-relative behaviour and it’s regulation of Protein Kinase C zeta (PKCζ)in anterior cingulated cortex(ACC)of rats with CFA chronic inflammatory pain.[Methods]Healthy male Sprague-Dawley(SD)rats were randomly divided into three groups:N group,CFA group and EA group,each group contained 8 rats.Rat chronic inflammatory pain model was established by CFA.EA was administered at bilateral points Zusanli(ST36)and Kunlun(BL60)once every day for consecutive 3 days.Paw withdraw thresholds(PWTs)were measured before CFA injection,as well as at 1,3,7,14,21,28 days after CFA injection.The open-field test and elevated-zero-maze test were respectively observed the emotional behavior of rats on 29d,30d.The protein expression of PKCζ and p-PKCζ in bilateral ACC was detected by western blot.[Result]There were no statistical significant differences of PWTs among the three groups before injecting CFA(P>0.05).PWTs in CFA group was significantly lower at every time after CFA injection(P<0.01).PWTs in EA group were significantly higher on 28d(P<0.05).The distances in central zone,entries in central zone and times in central zone in CFA group on 29d were significantly lower than N group,with differences of statistical meaning(P<0.05).The distances in central zone, entries in central zone and times in central zone in EA group were significantly higher(P<0.01).Entries in open arms in CFA group on 30d were significantly lower(P<0.05).The protein expression of PKCζ and p-PKCζ in ipsilateral ACC of CFA rats on 30d were increased with obvious significance(P<0.05).The expression of PKCζ and p-PKCζ in contralateral ACC of EA rats didn’t have statistical significance(P>0.05).[Conclusion]EA could relieve chronic inflammatory pain and pain-relative behaviour induced by CFA,but its mechanism might not be through adjusting the protein expression of PKCζ in ACC.
chronic inflammatory pain;emotional pain;electroacupuncture;Zusanli;Kunlun;pain;anterior cingulate cortex;PKCζ
R331
A
1005-5509(2017)01-0026-08
10.16466/j.issn1005-5509.2017.01.004
2016-09-30)
国家自然科学基金自助项目(81574056,81603690);浙江省自然科学基金(LQ15H270003);浙江省科技厅公益性(实验动物平台)(2016C37135);浙江省医药卫生科技项目一般项目(2015KYB281)
Fund projects:Program was supported by national natural science foundation(81574056,81603690);Natural Science Foundation of Zhejiang Province(LQ15H270003);Public Projects of Science Technology Department of Zhejiang Province(Laboratory animals Plant)(2016C37135);Projects of medical and health technology common program in Zhejiang Province(2015KYB281)
方剑乔,E-mail:fangjianqiao7532@163.com;邵晓梅,E-mail:751257894@qq.com

