基于“TLR4/NF-kB”信号通路研究“加味四妙丸”治疗急性痛风性关节炎大鼠的作用机制
袁晓范永升谢冠群朱飞叶冯晓红
1.浙江中医药大学附属第一医院 杭州 310006 2.浙江中医药大学
基于“TLR4/NF-kB”信号通路研究“加味四妙丸”治疗急性痛风性关节炎大鼠的作用机制
袁晓1范永升2谢冠群2朱飞叶2冯晓红1
1.浙江中医药大学附属第一医院 杭州 310006 2.浙江中医药大学
[目的]观察“加味四妙丸”治疗急性痛风性关节炎(acute gouty arthritis,AGA)大鼠的疗效,并基于“TLR4/NF-kB”信号通路探讨“加味四妙丸”作用机制。[方法]108只SD雄性大鼠,随机分为正常组、模型组、秋水仙碱组、“加味四妙丸”低、中、高剂量组,每组18只。除正常组外,其余大鼠参照Coderre造模方法膝关节腔注射尿酸钠悬浊液制作AGA模型,治疗4d后,计算各时间点受试关节肿胀指数,光学显微镜观察受试关节滑膜组织病理学变化,采用ELISA法检测关节腔冲洗液IL-1β、TNF-α的含量,免疫组化法检测关节滑膜组织TLR4、NF-kB、p-NF-kB蛋白表达,RT-PCR法检测滑膜组织TLR4mRNA表达。[结果]与正常组比较,模型组大鼠膝关节肿胀指数显著升高(P<0.01),关节滑膜组织炎性改变明显,滑膜组织中TLR4、NF-kB、p-NF-kB蛋白表达量和TLR4mRNA表达量显著上调(P<0.01),关节腔冲洗液中IL-1β、TNF-α含量显著升高(P<0.01);与模型组比较,“加味四妙丸”中、高剂量组大鼠治疗后关节肿胀指数显著下降(P<0.01),关节滑膜组织炎性改变明显减轻,滑膜组织中TLR4、NF-kB、p-NF-kB蛋白表达量和TLR4mRNA表达量均显著下调(P<0.01),关节腔冲洗液中IL-1β、TNF-α含量显著下降(P<0.01)。[结论]“加味四妙丸”可能通过抑制“TLR4/NF-kB”信号通路,从而抑制IL-1β、TNF-α的产生,起到治疗AGA的作用,且其疗效与药物剂量有一定相关性。
加味四妙丸;AGA;TLR4/NF-kB信号通路;剂量;范永升;名医经验
痛风(gout)是一种尿酸钠盐(monosodium urate,MSU)沉积所致的晶体相关性关节病,急性痛风性关节炎(acute gouty arthritis,AGA)为痛风的典型表现之一,是由于MSU析出并沉淀于关节腔内,导致大量炎性细胞浸润,从而引起患者关节剧烈疼痛、红肿及出现功能障碍。AGA常反复发作,后期易引起肾功能损害、关节畸形等,危害严重。近年来痛风的发病率逐年升高,目前我国的患病率约0.67%,且发病年龄也有所提前[1]。对于AGA的治疗,临床最常用的药物如秋水仙碱及糖皮质激素等均存在一定的毒副作用及不良反应,很大程度上限制了其临床运用[2]。
中医学在治疗AGA上具有独特的优势和方法。范永升教授系浙江中医药大学教授、博士生导师,第四批全国名老中医药专家学术经验继承工作指导老师,结合临床诊治经验,总结出“加味四妙丸”,即在经典方剂“四妙丸”基础上添加土茯苓、山慈菇等五味中药,全方清热燥湿、通络除痹,在AGA的治疗中取得了良好的临床疗效,但目前对于其作用机制研究尚少。近年来研究发现,在AGA的发病关节局部伴随着一些信号通路的激活或抑制,“TLR4/NF-kB”就是其中最重要的信号通路之一,该通路的激活、细胞因子IL-1β、TNF-α等的大量产生与AGA的发病及炎症表现密切相关[3]。本研究基于“TLR4/NF-kB”信号通路来探讨“加味四妙丸”治疗AGA的作用机制。
1 材料
1.1 实验动物 清洁级雄性SD大鼠108只,体质量(200±15)g,由浙江中医药大学动物实验中心购于中科院上海实验动物中心,实验动物许可证号:SYXK(浙)2013-0184。
1.2 主要试剂和药品 “加味四妙丸”由苍术15g、黄柏10g、薏苡仁20g、牛膝15g、泽泻12g、乌梢蛇9g、土茯苓15g、山慈菇15g、桂枝9g组成,所含中药均由浙江中医药大学附属第一医院中药房提供,并由药剂室将上述中药加8~10倍纯水浸泡30min,武火煎开后,再文火煎煮30min,过滤,剩余药渣加入3~5倍纯水再次煎25min,药液过滤后取过滤液,将2次过滤液浓缩成含生药浓度为1.2g·mL-1的药汁,分装灭菌。秋水仙碱(1mg/片,批号:H53021534),由昆药集团股份有限公司生产。尿酸钠悬浊液:电子天平称取微晶型MSU 2500mg(批号:108K5309,Sigma-Aldrich公司),用无菌生理盐水配制成25mg·mL-1的尿酸钠悬浊液,4℃冰箱保存,用前摇匀。IL-1β、TNF-α ELISA试剂盒(批号:P26017417、P17017418),购自CUSABIO公司;TLR-4抗体(批号:dw253469)、NF-kB(p65)抗体(批号:dw016352)、p-NF-kB(p65)抗体(批号:ap160988)均购自Affbiotech公司;Trizol购自Invitrogen公司(批号:123801);PrimeScriptTMRT reagent Kit with gDNA Eraser(PerfectRealTime)(批号:AK3702),SYBR Premix Ex TaqTM(Tli RNaseH Plus)(批号:AKA3301),均购自Takara公司。
1.3 主要仪器 显微镜(OLYMPUS,Japan),CMOS (OLYMPUS,Japan),LDZ5-2型离心机(北京离心机厂),RM2015型切片机(LEICA公司,Germany),MDF-382E型低温冰箱(三洋公司,Japan),恒温水浴箱(江苏太仓医用仪器厂),摊片机(湖北慧达仪器有限公司),MIR-153型干燥箱(三洋公司,Japan),多功能真彩色细胞图象分析管理系统(Media Cybernetics公司,America),医用微波炉(浙江临安爱迪仪器厂)。
2 方法
2.1 动物分组 SD大鼠在动物房适应性喂养1周后,随机分为6组:正常组、模型组、秋水仙碱组、“加味四妙丸”低剂量组、“加味四妙丸”中剂量组、“加味四妙丸”高剂量组(以下简称低、中、高剂量组),每组18只。
2.2 模型制备 参照Coderre造模方法[4]:固定大鼠,以大鼠右膝关节为中心,常规碘伏消毒,铺一次性手术洞巾,戴手术手套,正常组大鼠右膝关节外侧膝眼进针,用1mL注射器向关节腔内注射0.2mL生理盐水,其余5组以同样方法右膝关节每个关节注射0.2mL尿酸钠悬浊液。
2.3 药物干预方法 建立模型4h后,依据人-大鼠的体表面积转换系数,并结合前期研究,“加味四妙丸”低、中、高剂量组分别按成人剂量的4倍、8倍、12倍剂量取上述“加味四妙丸”浓缩液,用生理盐水稀释成混悬液灌胃;秋水仙碱组按秋水仙碱0.325mg/(kg·d)制成混悬液灌胃;正常组、模型组大鼠分别以生理盐水灌胃;各组大鼠灌胃量均为20mL·kg-1,分2次/d定时灌胃,连续4d。
2.4 检测指标及方法
2.4.1 关节肿胀指数 分别于造模前1h、造模后4h、48h及末次灌胃后4h,采用缚线法于大鼠受试膝关节同一部位测量周径,并计算各阶段肿胀指数。肿胀指数=〔测量时间点关节周径-初始周径(即造模前1h测得关节周径)〕/初始周径。
2.4.2 受试关节腔冲洗液细胞因子IL-1β、TNF-α含量检测 末次灌胃后4h,测量完受试关节周径后,用10%水合氯醛腹腔注射麻醉,以大鼠受试膝关节为中心,常规备皮,碘伏消毒,切开关节囊,用1mL生理盐水冲洗关节腔,然后收集关节腔冲洗液,采用酶联免疫试剂盒检测IL-1β、TNF-α的含量。
2.4.3 受试关节滑膜组织病理学观察 切取关节囊,分离关节滑膜组织。在每组大鼠中随机抽取3只大鼠的膝关节滑膜组织混样作为一个样本,采用4%中性多聚甲醛液充分固定后,冲洗标本梯度脱水、浸蜡、包埋,切4um薄片,HE染色,光学显微镜下观察关节滑膜组织病理变化。
2.4.4 受试膝关节滑膜组织TLR4、NF-kB、p-NF-kB免疫组化检测 将上述切片脱蜡、入水、热修复抗原后冷却至室温,PBS洗涤3次,滴加正常封闭液,室温20min后,先后滴加第一抗体(稀释比例为1:100)和生物素化第二抗体(IgG),切片上滴加辣根酶标记链霉卵白素工作液(S-A/HRP)、DAB显色、苏木素轻度复染、脱水、透明、中性树脂封片,最后采用美国多功能真彩色细胞图象分析管理系统分析,算出平均光密度值。
2.4.5 受试关节滑膜组织TLR4mRNA检测 采用荧光定量RT-PCR法,取受试关节滑膜组织,采用Trizol试剂盒提取关节滑膜组织总RNA,经变性琼脂糖凝胶电泳检验RNA的完整性,采用TakaRa公司的Prime ScriptTMRT reagent Kit with gDNA Eraser试剂盒及SYBR Premix Ex TaqTM合成模板cDNA和扩增目的基因cDNA片段(引物见表1),扩增结束后以GAPDH为内参基因,按下述公式计算ΔCt和ΔΔCt:ΔCt=Ct目的基因-Ct内参基因;ΔΔCt=(Ct实验组目的基因-Ct实验组内参基因)-(Ct对照组目的基因-Ct对照组内参基因),实验组目的基因与对照组目的基因的差异表达量(2-ΔΔCt)用下式计算:2-ΔΔCt=实验组目的基因/对照组目的基因。

表1 GAPDH和TLR4引物Tab.1 Forward and reverse primers for GAPDH and TLR4
2.5 统计学方法 采用SPSS17.0软件进行统计分析,计量资料用平均数±标准差(x±s)表示,多组数据比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠受试关节肿胀指数比较 造模后4h,与正常组比较,其余各组大鼠受试膝关节肿胀指数均增加,差异有统计学意义(P<0.01);造模后48h,与模型组比较,秋水仙碱组、中剂量组、高剂量组大鼠受试膝关节肿胀指数均减小,差异有统计学意义(P<0.05,P<0.01);末次灌胃后4h,与模型组比较,秋水仙碱组、中剂量组、高剂量组大鼠受试膝关节肿胀指数均显著减小,差异有统计学意义(P<0.01)。见表2。
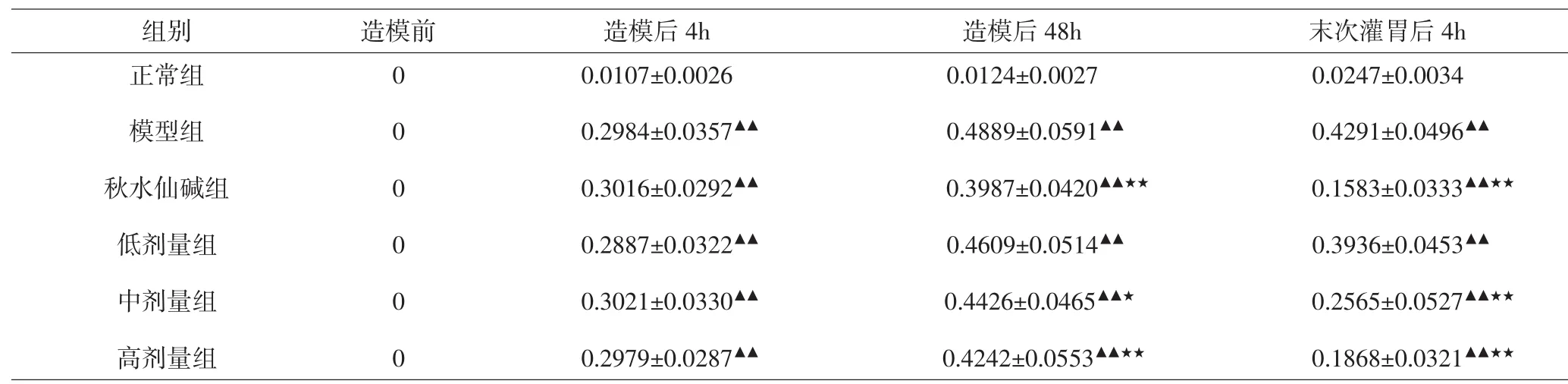
表2 各组大鼠不同时期膝关节肿胀指数比较(x±s)Tab.2 Comparison of the joint swelling index at different time in each group(x±s)
3.2 各组大鼠受试关节滑膜组织光镜观察结果 正常组大鼠膝关节滑膜组织结构清晰,滑膜细胞排列整齐,其间为胶原性间质,滑膜组织无炎性细胞浸润,无滑膜细胞增生和毛细血管充血、水肿;模型组滑膜炎症明显,出现滑膜组织明显水肿,滑膜细胞排列紊乱伴细胞增生,并出现毛细血管增生,伴有大量炎性细胞浸润等炎症表现;与模型组比较,秋水仙碱组及低、中、高剂量组滑膜炎症反应均有不同程度减轻,中、高剂量组与秋水仙碱组病变减轻程度相当,均较低剂量组更明显。见图1。
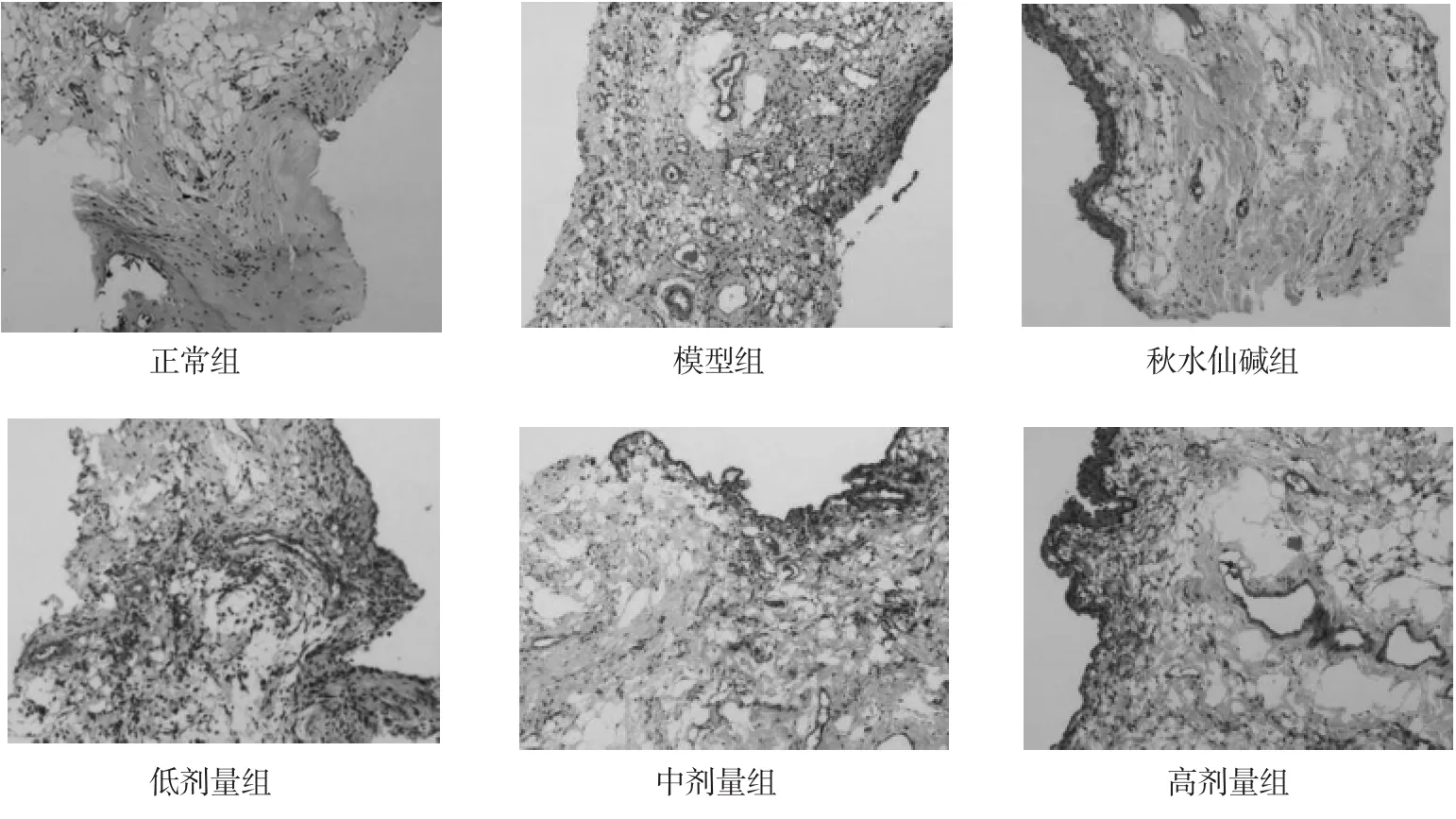
图1 各组大鼠受试膝关节滑膜组织病理结果(HE,400×)Fig.1 Pathological changes of Synovial tissues of the rats in each group(HE,400×)
3.3 各组大鼠受试关节腔冲洗液细胞因子IL-1β、TNF-α含量测定 与正常组比较,其余各组IL-1β和TNF-α均显著升高,差异有统计学意义(P<0.01);与模型组比较,秋水仙碱组、低剂量组、中剂量组、高剂量组IL-1β均降低,差异有统计学意义(P<0.05,P< 0.01);与模型组比较,秋水仙碱组、中剂量组、高剂量组TNF-α均显著降低,差异有统计学意义(P<0.01),低剂量组差异无统计学意义(P>0.05);与秋水仙碱组比较,高剂量组IL-1β和TNF-α差异均无统计学意义(P>0.05)。见表3。
表3 各组大鼠膝关节冲洗液IL-1β、TNF-α含量的比较(±s)Tab.3 Comparison of IL-1β and TNF-α in washing fluid of the joint cavity in each group(±s)

表3 各组大鼠膝关节冲洗液IL-1β、TNF-α含量的比较(±s)Tab.3 Comparison of IL-1β and TNF-α in washing fluid of the joint cavity in each group(±s)
注:与正常组比较,▲▲P<0.01;与模型组比较,★P<0.05,★★P<0.01;与秋水仙碱组比较,△△P<0.01。Note:Compared with normal group,▲▲P<0.01;compared with model group,★P<0.05,★★P<0.01;compared with colchicine group,△△P<0.01.
?
3.4 各组大鼠受试关节滑膜组织TLR4、NF-kB、p-NF-kB免疫组化检测结果 与正常组比较,模型组、低剂量组、中剂量组滑膜组织中TLR4、NF-kB表达量均显著增加,差异有统计学意义(P<0.01),模型组、低剂量组p-NF-kB表达显著增加,差异有统计学意义(P<0.01);与模型组比较,秋水仙碱组、中剂量组、高剂量组滑膜组织TLR4、NF-kB、p-NF-kB表达量均显著下调,差异有统计学意义(P<0.01),低剂量组TLR4、p-NF-kB表达量明显下调,差异有统计学意义(P<0.05),NF-kB表达量有下调趋势,但差异无统计学意义(P>0.05);秋水仙碱组TLR4、NF-kB、p-NF-kB表达量与高剂量组差异均无统计学意义(P>0.05)。见表4、图2~4。
3.5 各组大鼠受试关节滑膜组织TLR4mRNA检测结
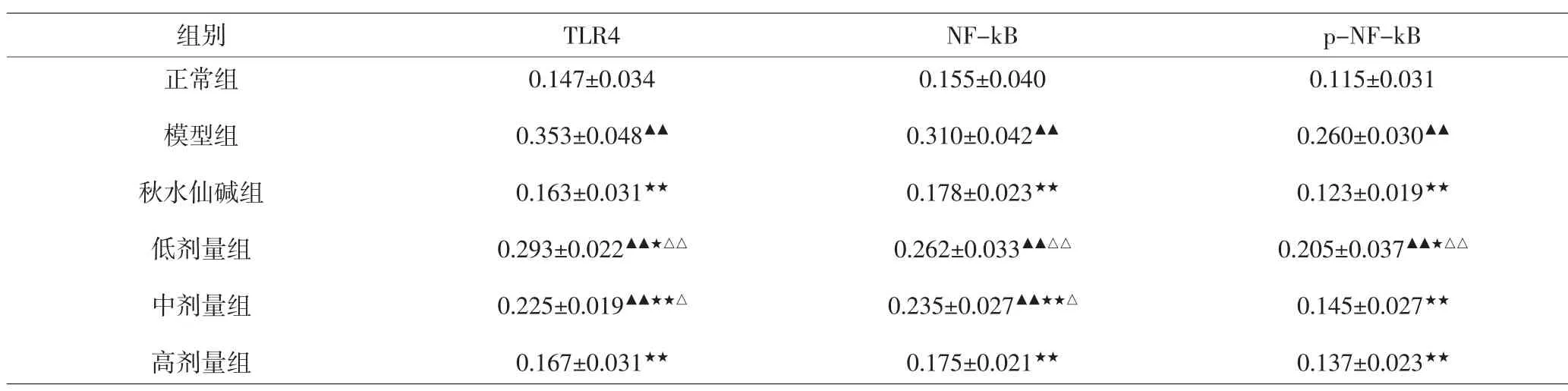
表4 各组大鼠TLR4、NF-kB、p-NF-kB比较(平均光密度值)(x±s)Tab.4 Comparison of expression levels of TLR4,NF-kB and p-NF-kB in synovial tissues in each group(MOD)(x±s)

图2 各组大鼠关节滑膜组织TLR4的表达(400×)Fig.2 The expression of TLR4 in the synovial tissues of the rats in each group(400×)

图3 各组大鼠关节滑膜组织NF-kBp65的表达(400×)Fig.3 The expression of NF-kBp65 in the synovial tissues of the rats in each group(400×)
果 与正常组比较,模型组、低剂量组、中剂量组TLR4mRNA相对表达量均上调,差异有统计学意义(P<0.05,P<0.01);与模型组比较,秋水仙碱组、低剂量组、中剂量组、高剂量组TLR4mRNA的相对表达量均下调,差异有统计学意义(P<0.05,P<0.01),其中秋水仙碱组与中剂量组、高剂量组间差异均无统计学意义(P>0.05)。见表5。
表5 各组大鼠关节滑膜组织中TRL4mRNA相对表达量的比较(±s)Tab.5 Comparison of expression levels of TLR4mRNA in synovial tissues of each group(±s)
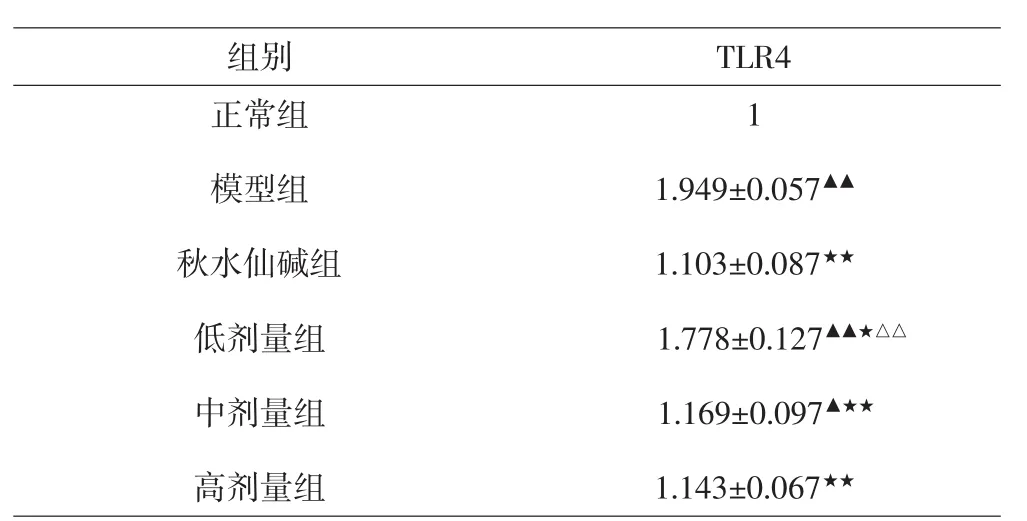
表5 各组大鼠关节滑膜组织中TRL4mRNA相对表达量的比较(±s)Tab.5 Comparison of expression levels of TLR4mRNA in synovial tissues of each group(±s)
注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,★P<0.05,★★P<0.01;与秋水仙碱组比较,△△P<0.01。Note:Compared with normal group,▲P<0.01,▲▲P<0.01;compared with model group,★P<0.05,★★P<0.01;compared with colchicine group,△△P<0.01.
组别 T L R 4正常组模型组秋水仙碱组低剂量组中剂量组高剂量组1 1 . 9 4 9 ± 0 . 0 5 7▲▲1 . 1 0 3 ± 0 . 0 8 7★★1 . 7 7 8 ± 0 . 1 2 7▲▲★△△1 . 1 6 9 ± 0 . 0 9 7▲★★1 . 1 4 3 ± 0 . 0 6 7★★
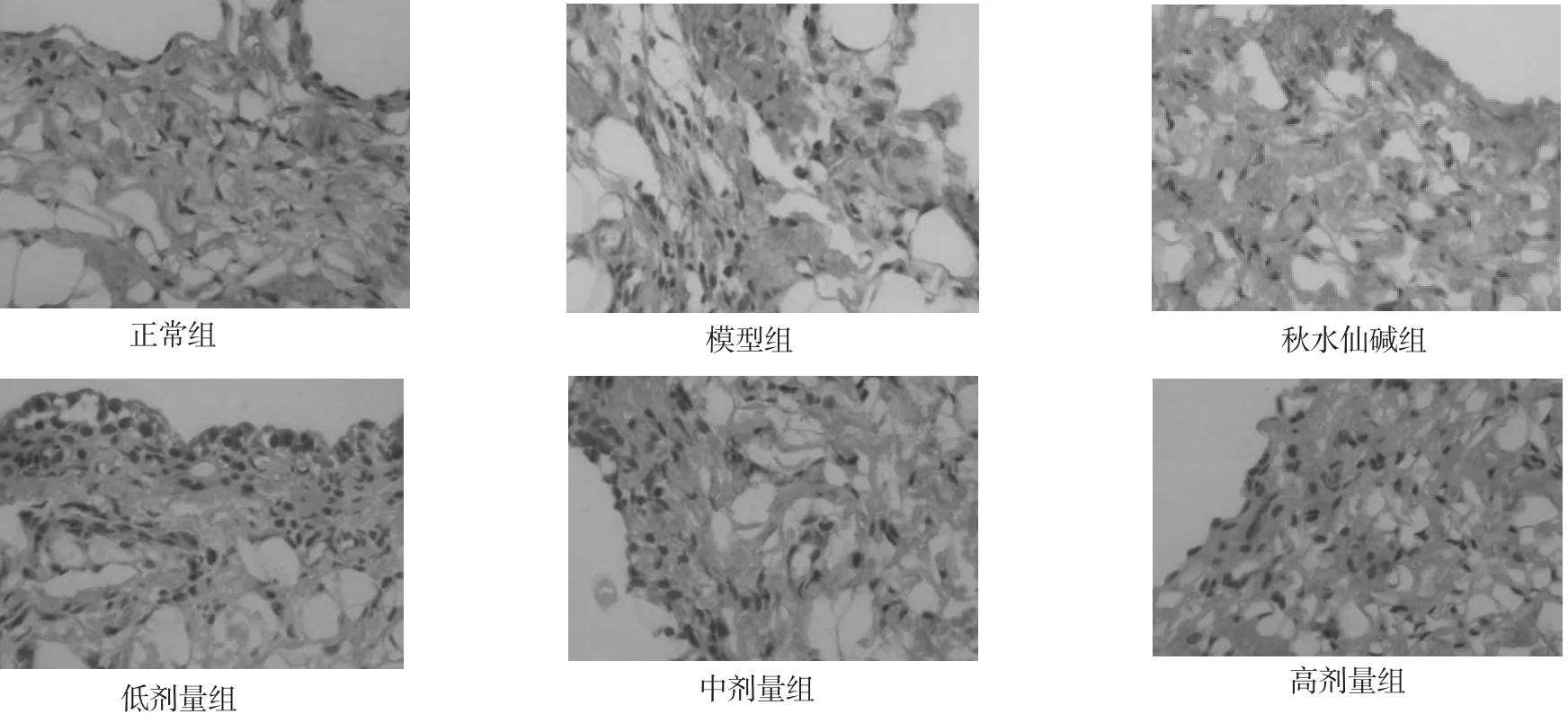
图4 各组大鼠关节滑膜组织p-NF-kBp65(Ser536)的表达(400×)Fig.4 The expression of p-NF-kBp65(Ser536)in the synovial tissues of the rats in each group(400×)
4 讨论
AGA是痛风最常见的临床表现之一,发作时以四肢远端关节非对称的红肿热痛为主要特征,常反复发作,后期易引起肾功能损害、关节畸形等,危害严重,且与高血压、高脂血症、动脉粥样硬化等疾病的发生也有密切相关性[5]。痛风目前尚无法根治,临床治疗目的是及时控制AGA急性发作并降低血尿酸水平,减少其复发。目前最常用于治疗的药物有秋水仙碱、非甾体抗炎药及糖皮质激素等,但由于上述西药存在诸多毒副作用及不良反应,很大程度上限制了其临床运用[2]。
中医学在治疗AGA上具有独特的优势和方法,中医学将AGA归于“痹症”范畴,认为湿毒内生是主要病机,清热燥湿是主要治则。“四妙丸”源起于《丹溪心法》,距今已有700多年的历史,由苍术、黄柏、薏苡仁和牛膝等四味中药组成。黄柏苦寒燥湿,善去下焦湿热;苍术燥湿健脾,清流洁源;牛膝补肝肾、祛风湿,引药下行;薏苡仁利湿舒筋。“加味四妙丸”在“四妙丸”基础上添加土茯苓、山慈菇、桂枝、乌梢蛇、泽泻等五味中药。土茯苓、山慈菇擅治湿热、利关节;桂枝通络除痹;乌梢蛇血肉有情之品,乃祛风通络、主治关节痹痛之良药;泽泻有利水渗湿、泄热之功效,与黄柏相须为用,清下焦湿热。全方清热燥湿、通络除痹,在AGA的治疗中具有良好的临床疗效,但对于其作用机制研究尚少。
近年来,“TLR4/NF-kB”信号通路被公认为与AGA的发病及炎症表现密切相关。TLRs(Toll样受体) (Toll-like receptor,TLR)属于模式识别受体家族,可识别病原相关分子模式,目前研究较多的是该家族的TLR4。研究发现,在AGA时,MSU能类似于外源性的佐剂一样作为危险信号被TLRs所识别,激活的TLRs可募集髓样分化因子(MyD88),之后相继活化IL-1受体相关激酶(IRAK)、TGF-β活化激酶(TAK1),进而激发IkB激酶级联反应,激活核转录因子NF-kB,从而启动与炎症免疫有关的细胞因子如IL-1β、TNF-α等基因的表达,最终产生大量IL-1β、TNF-α等炎性细胞因子[6-8]。成熟的IL-1β被认为是AGA时调节炎症的始动因素[9]:它通过激活IL-1受体使趋化因子和其他炎症调节因子发挥作用,导致大量中性粒细胞进入关节部位,促使AGA的炎症产生和发展[10];此外,IL-1β可激活破骨细胞使其分化,还能作用于神经元,触发机体对炎症所致疼痛的过度敏感[11]。而TNF-α又能通过相关信号通路促使IL-1、IL-8、PGE2等细胞因子分泌及中性粒细胞出现吞噬活性并释放氧自由基和蛋白水解酶,导致尿酸盐沉积处出现充血、水肿、大量炎症细胞浸润,并不断加重[12]。Liu-Bryan等[13]将基因敲除TLR-4-/-的同基因型的小鼠背部造囊,注射MSU模拟AGA,结果表明这些TLRs缺陷鼠的囊腔内中性粒细胞很少,体外试验发现MSU诱发的IL-1β、TNF-a表达也显著减少,进一步证实了“TLR4/NF-kB”信号通路与AGA的发病密切相关[14]。
本研究参照文献进行AGA大鼠造模,成模后观察不同剂量“加味四妙丸”对AGA大鼠关节肿胀指数、相关炎性细胞因子水平的影响及关节滑膜组织病理学改变;用免疫组化法检测TLR4、NF-kB、p-NF-kB蛋白的表达,RT-PCR检测TLR4mRNA的表达等情况,基于“TLR4/NF-kB”信号通路探讨“加味四妙丸”治疗AGA的作用机制,为进一步的临床应用提供实验依据。
研究结果显示:与正常组比较,模型组大鼠受试关节肿胀指数明显升高,光镜观察膝关节滑膜组织水肿、增生及炎性细胞浸润等炎性改变明显;免疫组化及RT-PCR等检测结果来看,模型组大鼠“TLR4/NF-kB”信号通路表达显著上调:关节滑膜组织中TLR4、NF-kB、p-NF-kB蛋白表达量和TLR4mRNA表达量均显著升高,关节腔冲洗液中IL-1β、TNF-α含量显著升高。与模型组比较,“加味四妙丸”中、高剂量组大鼠治疗后膝关节肿胀指数显著下降,滑膜组织炎性改变明显减轻,滑膜组织TLR4、NF-kB、p-NF-kB蛋白表达量和TLR4mRNA表达量均显著下调,关节腔冲洗液中IL-1β、TNF-α含量显著下降,其中,高剂量组下调程度与秋水仙碱组相当,作用强度强于中、低剂量组。
综上所述,本研究证明“加味四妙丸”能有效治疗AGA,减轻临床症状,其作用机制之一,可能是通过抑制“TLR4/NF-kB”信号通路,从而抑制IL-1β、TNF-α的产生,起到抗炎、镇痛的作用。同时,对“加味四妙丸”低、中、高不同剂量组的疗效比较表明,随着药物剂量的增加,其对“TLR4/NF-kB”信号通路的抑制作用及疗效均相应增强,说明“加味四妙丸”的疗效与药物剂量有一定相关性。本研究为更全面地阐释“加味四妙丸”的作用机制、进一步为寻找中药治疗AGA的作用靶点研究提供了客观的实验依据。
References:
[1] 中华医学会风湿病学分会.原发性痛风诊断和治疗指南[J].中华风湿病学杂志,2011,15(6):410-413. The Chinese Medical Association of Rheumatology.Guidelines for the Diagnosis and Treatment of Primary Gout[J]. Chinese Journal of Rheumatology,2011,15(6):410-413.
[2] 苏金梅,曾小峰.痛风的药物治疗进展[J].临床药物治疗杂志, 2014,12(4):13-17. SU Jinmei,ZENG Xiaofeng.Progress in the Pharmacotherapy of Gout[J].Clinical Medication Journal,2014,12 (4):13-17.
[3] 蒋莉,周京国,青玉凤,等.Toll样受体2和Toll样受体4及其信号通路在原发性痛风性关节炎发病机制中作用的研究[J].中华风湿病学杂志,2011,15(5):300-304. JIANG Li,ZHOU Jingguo,QING Yufeng,et al.The Role of TLR2,TLR4 and its Signal Pathway in Gouty Arthritis [J].Chinese Journal of Rheumatology,2011,15(5):300-304.
[4] 时乐,徐立.痛风性关节炎动物模型的研究现状与展望[J].中国实验动物学报,2006,14(1):71-74. SHI Le,XU li.Current Status and Prospect for Research on Animal Model of Urarthritis[J].Acta Laboratorium Animalis Scientia Sinica,2006,14(1):71-74.
[5] Doherty M,Jansen TL,Nuki G,et al.Gout:why is this curable disease so seldom Cured[J].Ann Rheum Dis,2012, 71(11):1765-1770.
[6] Nicotra L,Loram LC,Watkins LR,et al.Toll-like receptors inchronic pain[J].Exp Neurol,2012,234(2):316-329.
[7] Hur-Zong HSU,Si-Jin CHEN,Pei-Yi CHU,et al DZ, Cen SJ.Therapeutic effects of sesame oil on monosodium urate crystal induced acute inflammatory response in rats [J].Springer Plus,2013,2(1):659.
[8] 李荣华,蔡骏逸,欧志穗,等.痛风康Ⅱ号颗粒对急性痛风性关节炎TLRs/MyD88通路的影响[J].时珍国医国药,2015,26 (1):37-39. LI Ronghua,CAI Junyi,OU Zhisui,et al.Effect of “Tong Fengkang II Grain”on TLRs/MyD88 Pathway of Acute Gout Arthritis[J].Lishizhen Medicine and Materia Medica Research,2015,26(1):37-39.
[9] Mitroulis I,Kambas K,Ritis K.Neutrophils,IL-1β and gout:is there a link[J].Semin Immunopathol,2013,35(4):501.
[10]Ghaemi Oskouie F,Shi Y.The Role of Uric Acid as an Endogenous Danger Signal in Immunity and Inflammation [J].Curr Rheumatol Rep,2011,13(2):160-166.
[11]Alexander S,Thibaut De S.A pilot study of IL-1 inhibition by anakinra in acute gout[J].Arthritis Res&Ther, 2007(9):R28.
[12]梁翼,李敏,吴晓惠,等.IL-1β、IL-6、TNF-α与急性痛风性关节炎的相关性研究 [J],中国中医骨伤科杂志,2014,22(9): 14-16. LIANG Yi,LI Min,WU Xiaohui,et al.Correlation between IL-1β,IL-6,TNF-alpha and Acute Gouty Arthritis [J].Chinese Journal of Traditional Medical Traumatology& Orthopedics,2014,22(9):14-16.
[13]Liu-Bryan R,Scott P,Sydlaske A,et al.Innate immunity conferred by Toll-like receptors2 and 4 and myeloid differentiation factor 88 expression is pivotal to monosodium urate-monohydrate crystal-induced inflammation[J],Arthritis Rheum,2005,52(9):2936-2946.
[14]YF QING,QB ZHANG,JG ZHOU,et al.Changes in Toll-like receptor(TLR)4-NFkB-IL-1β signaling in male gout patients might be involved in the pathogenesis of primary gouty arthritis[J].Rheumatology International,2014, 34(2):213-220.
Study on the Mechanism of Treatment of Acute Gouty Arthritis Rats by"Modified Simiao Pill"Based on the"TLR4/NF-kB"Signal Pathway
YUAN Xiao1,FAN Yongsheng2,XIE Guanqun2,et al 1.The First Hospital Affiliated to Zhejiang University of TCM,Hangzhou(310006),China;2.Zhejiang University of TCM
[Objective]To observe the therapeutic effect of"Modified Simiao Pill"in the treatment of acute gouty arthritis(AGA)and to explore the mechanism of"Modified Simiao Pill"based on the"TLR4/NF-kB"signal pathway.[Methods]108 SD male rats were randomly divided into normal group,model group, colchicine group,"Modified Simiao Pill"low,medium and high dose groups,18 rats in each group.Except the normal group,the rest rats were established as AGA model by injecting monosodium urate(MUS)into the knee joint cavity according to Coderre method,after 4 days of treatment,the calculation of each time point tested joint swelling index,the pathological changes of synovial tissue were observed by optical microscope,and the content of IL-1βand TNF-αin joint cavity washing liquid was detected by ELISA method;Immunohistochemistry was applied to measure the expression of TLR4,NF-kB and p-NF-kB protein in synovial tissues.RT-PCR was used to detect the expression of TLR4mRNA in synovial tissues.[Results]Compared with the normal group,model group of rat knee joint swelling index was significantly increased(P<0.01),synovial tissue inflammatory changed obviously,and the expression of TLR4,NF-kB and p-NF-kB protein and TLR4mRNA in synovial tissue was significantly increased(P<0.01),the contents of IL-1βand TNF-α in the washing fluid of the joint cavity were significantly increased(P<0.01).Compared with the model group,"Modified Simiao Pill"high and medium dose group rats knee of joint swelling index decreased significantly(P<0.01),synovial tissue inflammatory changes were alleviated significantly,and the expression of TLR4,NF-kB and p-NF-kB protein and TLR4mRNA in synovial tissue was significantly decreased(P<0.01),the contents of IL-1β and TNF-α in the washing fluid of the joint cavity were significantly decreased(P<0.01).[Conclusion]"Modified Simiao Pill"may be through inhibiting the"TLR4/NF-kB"signaling pathway,thereby inhibiting the production of IL-1β and TNF-α to play a role in the treatment of AGA,and the therapeutic effect is in a dosage-dependent manner.
Modified Simiao Pill;AGA;TLR4/NF-kB signal pathway;dosage;FAN Yongsheng;experiences of famous doctor
R331
:A
1005-5509(2017)01-0017-08
10.16466/j.issn1005-5509.2017.01.003
2016-09-28)
浙江中医药大学校级科研基金重点项目(2015ZZ04)
Fund project:The key project of Zhejiang Chinese Medical University Research Fund(2015ZZ04)
范永升,E-mail:fyszjtcm@163.com

