新型N-芳基哌嗪取代苯并呋喃衍生物的合成
毛泽伟, 虎春艳, 陈文君, 余 珏, 林玉萍
(云南中医学院 中药学院,云南 昆明 650500)
·快递论文·
新型N-芳基哌嗪取代苯并呋喃衍生物的合成
毛泽伟, 虎春艳, 陈文君, 余 珏, 林玉萍*
(云南中医学院 中药学院,云南 昆明 650500)
以5-二甲氨基水杨醛和2-溴-4′-氟苯乙酮为原料,经缩合和取代反应制得中间体6-二乙氨基-2-[4′-(N-哌嗪基)苯甲酰基]苯并呋喃(2); 2与卤代烃反应合成了6个新型的N-芳基哌嗪取代苯并呋喃衍生物(4a~4f),收率76%~93%,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。
5-二甲氨基水杨醛; 2-溴-4′-氟苯乙酮;N-芳基哌嗪; 苯并呋喃衍生物; 合成
苯并呋喃类化合物是一类重要的芳杂环化合物,大都具有如抗氧化、抗炎和抗肿瘤等生物活性[1-3]。目前,化学工作者对该类化合物的构效关系的研究主要集中在2-取代苯并呋喃化合物[4-7]。
哌嗪是一类典型的杂环化合物,具有良好的生物活性,常用于药物分子的设计与合成。我们在前期研究[8-10]中发现,含N-芳基哌嗪片段的查尔酮化合物具有良好的细胞毒活性。在此基础上,将具有生理活性的N-芳基哌嗪引入到苯并呋喃分子中,通过对哌嗪环N—H进行衍生化,可能合成具有较高应用价值的先导化合物。
以5-二甲氨基水杨醛和2-溴-4′-氟苯乙酮为原料,经缩合和取代反应制得中间体6-二乙氨基-2-[4′-(N-哌嗪基)苯甲酰基]苯并呋喃(2); 2与卤代烃(3a~3f)反应合成了6个新型的N-芳基哌嗪取代苯并呋喃衍生物(4a~4f, Scheme 1),收率76%~93%,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。
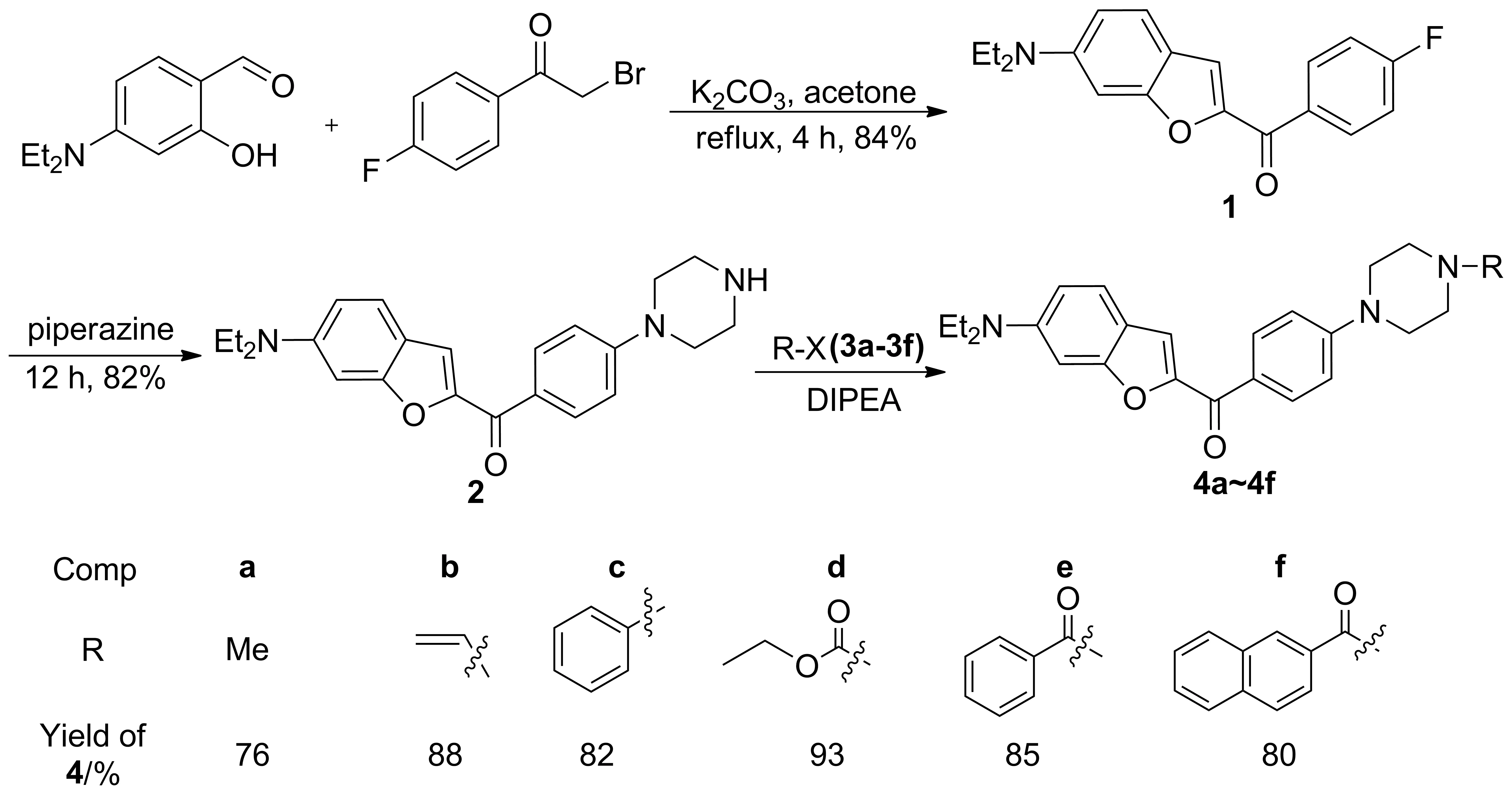
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker AM 300和Bruker AM 400型核磁共振仪(CDCl3为溶剂,TMS为内标);Auto Spec Premier P776型双聚焦三扇型磁质谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 1的合成[11]
在圆底烧瓶中加入5-二乙氨基水杨醛2.86 g(20 mmol), K2CO35.52 g(40 mmol)和丙酮60 mL,搅拌下分批加入2-溴-4′-氟苯乙酮4.34 g(20 mmol),回流反应4 h(TLC检测)。冷却至室温,浓缩,残余物加水80 mL,搅拌20 min,抽滤,滤饼依次用10%KOH溶液(20 mL)和水(3×20 mL)洗涤,真空干燥得黄褐色固体1 5.28 g,收率85%;1H NMRδ: 8.00(d,J=9.0 Hz, 2H), 7.49(d,J=8.7 Hz, 1H), 7.37(s, 1H), 6.95(d,J=9.0 Hz, 2H), 6.71~6.77(m, 2H), 3.47(q,J=7.1 Hz, 4H), 1.24(t,J=7.0 Hz, 6H);13C NMRδ: 181.86, 158.81, 151.09, 149.06, 131.47, 127.06, 123.48, 116.70, 116.51, 112.58, 110.04, 92.39, 45.83, 12.61。
(2) 2的合成
在圆底烧瓶中加入1 3.11 g(10 mmol),碳酸钾2.74 g(20 mmol),六水合哌嗪3.98 g(20 mmol)和无水DMF 30 mL,于110 ℃反应12 h(TLC检测)。倒入50 mL冷水中,用DCM(2×30 mL)萃取,合并萃取液,用无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(MeOH)/V(DCM)=1/50]纯化得褐色固体2;1H NMRδ: 8.02(d,J=9.0 Hz, 2H), 7.48(d,J=8.7 Hz, 1H), 7.38(s, 1H), 6.95(d,J=9.0 Hz, 2H), 6.72~6.78(m, 2H), 3.46(q,J=7.2 Hz, 4H), 3.35(t,J=4.8 Hz, 4H), 3.05(t,J=4.8 Hz, 4H), 1.90(s, 1H), 1.23(t,J=6.9 Hz, 6H);13C NMRδ: 181.94, 158.99, 154.37, 151.09, 149.06, 131.51, 128.06, 123.48, 116.76, 116.51, 113.71, 110.93, 93.16, 48.70, 45.99, 45.14, 12.63; HR-MS(ESI-TOF)m/z: Calcd for C23H27N3O2Na{[M+Na]+}400.199 5, found 400.199 5。
(3) 4a~4f的合成通法
在圆底烧瓶中加入2 112 mg(0.3 mmol), DCM 5 mL和CH3CN 5 mL,搅拌使其溶解;依次加入二异丙基乙胺(DIPEA)0.1 mL和卤代烃(3a~3f)0.36 mmol,搅拌下于室温反应5~12 h(TLC检测)。倒入30 mL水中,用DCM(3×10 mL)萃取,合并萃取液,用无水硫酸钠干燥,浓缩,残余物经硅胶柱层析[洗脱剂:V(MeOH)/V(DCM)=1/100]纯化得淡黄色固体4a~4f。
4a:1H NMRδ: 8.02(d,J=8.9 Hz, 2H), 7.47(d,J=8.8 Hz, 1H), 7.37(s, 1H), 6.94(d,J=8.9 Hz, 2H), 6.78(s, 1H), 6.73~6.75(dd,J=2.2 Hz, 2.2 Hz, 1H), 3.37~3.43(m, 8H), 2.58(t,J=5.2 Hz, 4H), 2.35(s, 3H), 1.22(t,J=7.0 Hz, 6H);13C NMRδ: 181.86, 158.99, 153.94, 151.22, 149.10, 131.53, 128.10, 123.45, 116.59, 113.75, 111.01, 93.27, 54.90, 47.56, 46.23, 45.14, 12.64。
4b:1H NMRδ: 8.02(d,J=8.7 Hz, 2H), 7.48(d,J=8.7 Hz, 1H), 7.38(s, 1H), 6.95(d,J=8.7 Hz, 2H), 6.78~6.72(m, 2H), 5.83~5.97(m, 1H), 5.26(d,J=15.0 Hz, 1H), 5.21(d,J=8.1 Hz, 1H), 3.37~3.46(m, 8H), 3.08(d,J=6.6 Hz, 2H), 2.63(t,J=5.1 Hz, 4H), 1.23(t,J=6.9Hz, 6H);13C NMRδ: 181.94, 158.98, 153.98, 151.11, 149.05, 134.75, 131.53, 128.03, 123.47, 118.60, 116.74, 116.51, 113.70, 110.93, 93.17, 61.86, 52.85, 47.57, 45.14, 12.63; HR-MS(ESI-TOF)m/z: Calcd for C26H31N3O2Na{[M+Na]+}440.230 8, found 440.230 7。
4c:1H NMRδ: 8.01(d,J=8.3 Hz, 2H), 7.46(d,J=8.8 Hz, 1H), 7.37~7.25(m, 6H), 6.91(d,J=8.5 Hz, 2H), 6.78(s, 1H), 6.74(d,J=6.7 Hz, 1H), 3.55(s, 2H), 3.43(q,J=8.8 Hz, 4H), 3.36(t,J=4.7 Hz, 4H), 2.60(t,J=4.4 Hz, 4H), 1.21(t,J=6.9 Hz, 6H);13C NMRδ: 181.79, 158.91, 153.97, 151.12, 149.00, 137.88, 131.47, 129.23, 128.39, 127.84, 127.29, 123.41, 116.58, 116.49, 113.57, 110.91, 93.14, 63.07, 52.81, 47.51, 45.07, 12.59。
4d:1H NMRδ: 8.01(d,J=8.7 Hz, 2H), 7.47(d,J=8.7 Hz, 1H), 7.37(s, 1H), 6.94(d,J=8.7 Hz, 2H), 6.77(s, 1H), 6.75(d,J=9.0 Hz, 1H), 4.24(q,J=6.9 Hz, 2H), 3.45(q,J=6.9 Hz, 8H), 3.27(s, 2H), 2.76(t,J=5.1 Hz, 4H), 1.31(t,J=7.2 Hz, 3H), 1.22(t,J=7.2 Hz, 6H);13C NMRδ: 181.91, 170.21, 158.97, 153.85, 151.06, 149.04, 131.50, 128.15, 123.47, 116.77, 113.79, 110.92, 93.12, 60.88, 59.46, 52.75, 47.47, 45.12, 14.37, 12.61; HR-MS(ESI-TOF)m/z: Calcd for C27H34N3O4{[M+Na]+}464.254 3, found 464.254 5。
4e:1H NMRδ: 8.03(d,J=9.0 Hz, 4H), 7.59(d,J=7.2 Hz, 1H), 7.45~7.50(m, 3H), 7.38(s, 1H), 6.96(d,J=9.0 Hz, 2H), 6.78(s, 1H), 6.77~6.73(dd,J=2.1 Hz, 2.1 Hz, 1H), 3.90(s, 2H), 3.48~3.39(m, 8H), 2.80(t,J=4.8 Hz, 4H), 1.24(t,J=7.2 Hz, 6H);13C NMRδ: 196.18, 181.89, 158.96, 153.88, 151.10, 149.05, 136.01, 133.52, 131.50, 128.73, 128.20, 123.45, 116.72, 116.50, 113.76, 110.94, 93.16, 64.36, 53.26, 47.50, 45.10, 12.61。
4f:1H NMRδ: 8.59(s, 1H), 8.09~7.97(m, 4H), 7.93(t,J=8.7 Hz, 2H), 7.64~7.54(m, 2H), 7.49(d,J=8.7 Hz, 1H), 7.39(s, 1H), 6.97(d,J=8.7 Hz, 2H), 6.78(s, 1H), 6.77~6.73(dd,J=2.1 Hz, 2.1 Hz, 1H), 4.04(s, 2H), 3.50~3.40(m, 8H), 2.85(t,J=5.1 Hz, 4H), 1.24(t,J=6.9 Hz, 6H);13C NMRδ: 196.21, 182.00, 159.02, 153.94, 149.11, 135.87, 132.60, 131.56, 129.96, 129.76, 128.80, 128.65, 128.21, 127.97, 127.03, 123.96, 123.49, 116.75, 116.57, 113.83, 110.99, 93.24, 64.56, 53.38, 47.60, 45.16, 12.66; HR-MS(ESI-TOF)m/z: Calcd for C35H35N3O3Na{[M+Na]+}568.257 0, found 568.256 9。
为优化4的合成条件,以4a的合成为例,考察了碱和溶剂对4a收率的影响。
仲胺与卤代烃一般在碱性条件下发生取代反应[12],常用的碱有Et3N, DIPEA,碳酸钾和碳酸铯等。考察了碱对4a收率的影响,结果见表1。由表1可见,碱对4a收率的影响很大,以DIPEA为碱,反应效果最好,收率最高(76%)。三乙胺碱性较弱,不利于哌嗪环N—H解离,收率较低。碳酸铯碱性太强,导致副反应发生,收率也降低。因此,选择DIPEA为碱。

表1 碱对4a收率的影响*
*溴代苯乙酮1.5 eq.其余反应条件同1.2(3)。
考察了溶剂对4a收率的影响,结果见表2。由表2可见,由于2在CH3CN中溶解性差,不利于反应进行。以DCM/CH3CN=1/1(V/V)为溶剂时,收率最高(76%)。因此,选用DCM/CH3CN(1/1,V/V)为溶剂。
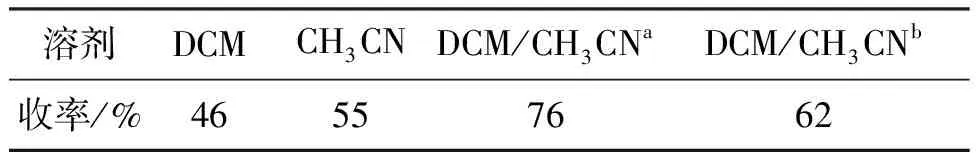
表2 溶剂对4a收率的影响
a1/1,V/V;b1/2,V/V。
以5-二甲氨基水杨醛和2-溴-4′-氟苯乙酮为原料,依次经缩合、取代及卤代烃反应合成了6个新型的N-芳基哌嗪取代苯并呋喃衍生物(4a~4f),收率76%~93%。以4a的合成为例,对反应条件进行了优化。结果表明:以DIPEA为碱,DCM/CH3CN(V/V=1/1)为溶剂,反应收率较高(76%)。
致谢:感谢云南中医学院中药学院“药学”和“彝药学”重点学科及云南省高校中药民族药质量标准研究重点实验室对本研究的支持。
[1] 王宝,赖宜生,张奕华. 苯并呋喃类化合物的生物活性及构效关系[J].药学进展,2008,32(8):351-356.
[2] Akgul Y Y, Anil H. Benzofurans and another constituent from seeds ofStyraxofficinalis[J].Phytochemistry,2003,63(8):939-943.
[3] Ho Y S, Duh J S, Jeng J H,etal. Griseofulvin potentiates antitumorigenesis effects of nocodazole through induction of apoptosis and G2/M cell cycle arrest in human colorectal cancer cells[J].Int J Cancer,2001,91(3):393-401.
[4] Na M, Hoang DM, Njamen D,etal. Inhibitory effect of 2-arylbenzofurans from erythrina addisoniae on protein tyrosine phosphatase-1B[J].Bioorg Med Chem Lett,2007,17(14):3868-3871.
[5] Hoang D M, Ngoc T M, Dat N T,etal. Protein tyrosine phosphatase 1B inhibitors isolated from Morusbombycis[J].Bioorg Med Chem Lett,2009,19:6759-6761.
[6] Yang X D, Wan W C, Deng X Y,etal. Design,synthesis and cytotoxic activities of novel hybrid compounds between 2-phenylbenzofuran and imidazole[J].Bioorg Med Chem Lett,2012,22:2726-2729.
[7] 朱红梅,秦俊虎,欧阳贵平. 新型含1,3,4-噻二唑基的苯并[4,5]呋喃[3,2-d]嘧啶类化合物的合成及其抗癌活性[J].合成化学,2015,23(8):693-696.
[8] 毛泽伟,郭文恋,姜圆,等. 新型2-苯甲酰基苯并呋喃类似物的合成[J].合成化学,2014,22(6):785-788.
[9] 毛泽伟,万春平,姜圆,等.N-杂环取代苯并呋喃衍生物的合成及抗肿瘤活性[J].中国药科大学学报,2015,46(1):58-61.
[10] Mao Z W, Zheng X, Qi Y,etal. Synthesis and biological evaluation of novel hybrid compounds between chalcone and piperazine as potential antitumor agents[J].RSC Adv,2016,6:7723-7727.
[11] Gullapalli K, Mogilisetti P, Ragam R,etal. An expedient synthesis of enantioenriched substituted 2-benzofuryl arylcarbinols via tandem rap-stoermer and asymmetric transfer hydrogenation reactions[J].Tetrahedron,2010,66:9814-9818.
Synthesis of Novel N-aryl Piperazine Substituted Benzofuran Derivatives
MAO Ze-wei, HU Chun-yan, CHEN Wen-jun, YU Jue, LIN Yu-ping*
(School of Traditional Chinese Medicine, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China)
The intermediate 6-diethylamino-2-[4′-(N-piperazinyl)benzoyl]benzofuran(2) was obtained by the reaction of condensation and substitution, using 5-diethylaminosalicylaldehyde and 2-bromo-4′-fluoroacetophenone as materials. Six novelN-aryl piperazine substituted benzofuran derivatives(4a~4f) with yields of 76%~93% were synthesized by the reaction of 2 with halohydrocarbons. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI-TOF).
5-diethylaminosalicylaldehyde; 2-bromo-4′-fluoroacetophenone;N-aryl piperazine; benzofuran derivative; synthesis
2016-07-01;
2016-09-20
云南省教育厅科学研究基金资助项目(2014Z119)
毛泽伟(1981-),男,汉族,湖北汉川人,讲师,主要从事有机合成的研究。 E-mail: ydmason@163.com
林玉萍,副教授, E-mail: 11217005@qq.com
O625.6
A
10.15952/j.cnki.cjsc.1005-1511.2017.01.16167

