含苯并咪唑和异噁唑结构席夫碱的合成及其抑菌活性
靳 飞, 万福贤, 昝宁宁, 姜 林
(山东农业大学 化学与材料科学学院,山东 泰安 271018)
·研究论文·
含苯并咪唑和异噁唑结构席夫碱的合成及其抑菌活性
靳 飞, 万福贤, 昝宁宁, 姜 林*
(山东农业大学 化学与材料科学学院,山东 泰安 271018)
根据活性亚结构拼接原理,以取代苯甲醛、盐酸羟胺、N-氯代丁二酰亚胺和2-苯并咪唑基乙腈等为原料,经肟化、氯代、环化及缩合反应,合成了一系列新型的含苯并咪唑和异噁唑结构的席夫碱化合物(5a~5h),收率60%~75%,其结构经1H NMR,13C NMR, IR和HR-MS表征。采用菌丝生长速率法测试了化合物对番茄灰霉菌和生菜菌核菌的抑菌活性。结果表明:在用药量为100 μg·mL-1时,苯环上含有氟原子或甲氧基的席夫碱(5c, 5d和5e)对生菜菌核菌显示出较好的活性,抑制率为71.3%~76.1%。
苯甲醛; 席夫碱; 苯并咪唑; 异噁唑; 合成; 抑菌活性
席夫碱类化合物因分子中含有亚胺基团(C=N)而表现出良好的生物活性,如抗病毒[1]、抗癌[2]、抗菌[3]、抗炎[4]、抗增生[5]等活性,成为药物化学研究的热点之一。此外,席夫碱作为配体与一些金属离子形成的配合物具有良好的催化性能,可用于不对称合成领域[6]。但是,目前席夫碱在农药领域的应用还较少。
苯并咪唑是一类重要的杂环化合物,其衍生物具有杀菌[7]、抗炎[8]、抗病毒[9]和降压[10]等广泛的生物活性。在苯并咪唑衍生物中,作为β2-微管蛋白抑制剂的多菌灵、苯菌灵和甲基硫菌灵,表现出高效、强内吸性和低毒性,是农业上常用的杀菌剂。另一方面,异噁唑也是一种具有良好生物活性的杂环化合物,该类化合物显示出抗病毒[11]、抑菌[12]、抗炎[13]和除草[14]等活性,如抗炎药物异噁噻酰胺、β-内酰胺类抗生素头孢噁唑、除草剂异噁草酮等。
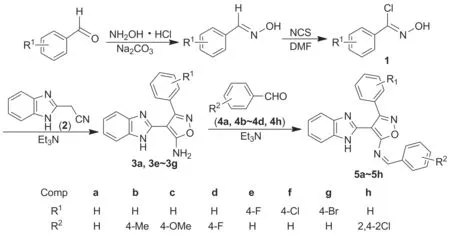
Scheme 1
借鉴有关席夫碱、苯并咪唑和异噁唑衍生物的合成及生物活性研究成果,结合本课题组在苯并咪唑和异噁唑类化合物的合成及杀菌活性研究的前期工作[15-16],本文根据活性亚结构拼接原理,以苯甲醛、盐酸羟胺、N-氯代丁二酰亚胺(NCS)、2-苯并咪唑基乙腈等为原料,经过肟化、氯代、环化及缩合4步反应,合成了8个新型的含苯并咪唑和异噁唑结构的席夫碱化合物(5a~5h, Scheme 1),其结构经1H NMR,13C NMR, IR和HR-MS表征,并测试了化合物对番茄灰霉菌和生菜菌核菌的抑制活性。
1 实验部分
1.1 仪器与试剂
X-5型数字熔点仪(温度未校正);Bruker 400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Nicolet 380型傅立叶变换红外光谱仪(KBr压片);Agilent 6410型三重四极杆串联质谱仪;GXZ型智能光照培养箱。
α-氯代苯甲醛肟(1)[17]和2-苯并咪唑基乙腈(2)[18]参考文献方法制备;其余所用试剂均为分析纯,百灵威化学有限公司或阿拉丁试剂有限公司。
1.2 合成
(1) 3-取代苯基-4-(2-苯并咪唑基)-5-氨基异噁唑(3)的合成通法
在圆底烧瓶中加入1 10 mmol、 2 1.58 g(10 mmol)和四氢呋喃15 mL,搅拌下加入三乙胺1.02 g(10 mmol),于室温反应5 h。加水20 mL,用二氯甲烷(3×20 mL)萃取,合并萃取液,依次用水洗涤、无水硫酸钠干燥,真空除去溶剂得棕色粗产物,经硅胶柱层析[洗脱剂:A=V(丙酮)/V(石油醚)=1/5]纯化得白色固体3。
3-苯基-4-(2-苯并咪唑基)-5-氨基异噁唑(3a): 产率77%, m.p.176.0~178.1 ℃;1H NMRδ: 4.18(s, 2H, NH2), 6.88~7.47(m, 9H, ArH), 11.52(br s, 1H, Benzimidazol-NH); IRν: 3 129, 3 015, 1 641, 1 609, 1 514, 1 448 cm-1; HR-MSm/z: Calcd for C16H12N4O{[M+H]+}277.108 9,found 277.108 5。
3-(4-氟苯基)-4-(2-苯并咪唑基)-5-氨基异噁唑(3e): 产率82%, m.p. 180.3~181.2 ℃;1H NMRδ: 4.16(s, 2H, NH2), 6.89~7.76(m, 8H, ArH), 12.60(br s, 1H, Benzimidazol-NH); IRν: 3 118, 3 017, 1 603, 1 514, 1 454 cm-1; HR-MSm/z: Calcd for C16H11N4OF{[M+H]+}295.098 9,found 295.098 5。
3-(4-氯苯基)-4-(2-苯并咪唑基)-5-氨基异噁唑(3f): 产率85%, m.p. 206.1~207.9 ℃;1H NMRδ: 4.19(s, 2H, NH2), 6.89~7.75(m, 8H, ArH), 12.63(br s, 1H, Benzimidazol-NH); IRν: 3 135, 3 015, 1 613, 1 596, 1 517, 1 451 cm-1; HR-MSm/z: Calcd for C16H11N4OCl{[M+H]+}311.070 0,found 311.070 2。
3-(4-溴苯基)-4-(2-苯并咪唑基)-5-氨基异噁唑(3g): 产率80%, m.p. 204.2~206.0 ℃;1H NMRδ: 4.15(s, 2H, NH2), 6.89~7.76(m, 8H, ArH), 12.59(br s, 1H, Benzimidazol-NH); IRν: 3 125, 3 018, 1 614, 1 588, 1 525, 1 450 cm-1; HR-MSm/z: Calcd for C16H11N4OBr{[M+H]+}355.019 4, found 355.019 8。
(2) 3-取代苯基-4-(2-苯并咪唑基)-5-取代苯亚胺基异噁唑(5)的合成通法
在圆底烧瓶中加入取代苯甲醛10 mmol, 3 10 mmol和无水乙醇15 mL,搅拌下加入催化量三乙胺,回流反应7~8 h。冷却至室温,加水25 mL,搅拌30 min,过滤,滤饼经硅胶柱层析(洗脱剂:A=1/10)纯化得白色固体5a~5h。
3-苯基-4-(2-苯并咪唑基)-5-苯亚胺基异噁唑(5a): 产率67%, m.p. 208.3~210.2 ℃;1H NMRδ: 7.08~7.89(m, 14H, ArH), 8.09(s, 1H, N=CH), 10.24(br s, 1H, Benzimidazol-NH);13C NMRδ: 165.8, 162.1, 154.6, 146.7, 145.5, 140.9, 133.4, 131.0, 130.4, 129.1, 128.3, 127.6, 124.5, 123.1, 122.2, 118.4, 114.0, 109.9, 99.8; IRν: 3 135, 3 024, 1 610, 1 590, 1 565, 1 496, 1 442 cm-1; HR-MSm/z: Calcd for C23H16N4O{[M+H]+}365.140 2, found 365.140 0。
3-苯基-4-(2-苯并咪唑基)-5-(4-甲基苯亚胺基)异噁唑(5b): 产率73%, m.p. 219.0~220.5 ℃;1H NMRδ: 2.21(s, 1H, CH3), 6.96~7.82(m, 13H, ArH), 7.94(s, 1H, N=CH), 10.20(br s, 1H, Benzimidazol-NH);13C NMRδ:165.1, 162.7, 151.8, 148.5, 145.7, 142.0, 137.2, 134.8, 131.4, 129.0, 128.4, 127.0, 124.7, 123.5, 120.8, 120.2, 117.3, 110.8, 102.7, 21.8; IRν: 3 148, 3 025, 1 600, 1 496, 1 448 cm-1; HR-MSm/z: Calcd for C24H18N4O {[M+H]+}379.155 9, found 379.156 7。
3-苯基-4-(2-苯并咪唑基)-5-(4-甲氧基苯亚胺基)异噁唑(5c): 产率69%, m.p. 223.1~224.8 ℃;1H NMRδ: 3.82(s, 1H, OCH3), 6.86~7.88(m, 13H, ArH), 8.04(s, 1H, N=CH), 9.80(br s, 1H, Benzimidazol-NH);13C NMRδ:167.3, 153.1, 152.5,147.2, 144.9, 139.7, 136.9, 5, 135.3, 133.8, 130.8, 130.1, 129.1, 128.4, 126.2, 124.5, 120.7, 119.4, 116.2, 102.6, 60.3; IRν: 3 130, 3 027, 1 607, 1 573, 1 514, 1 451 cm-1; HR-MSm/z: Calcd for C24H18N4O2{[M+H]+}395.150 8, found 395.150 4。
3-苯基-4-(2-苯并咪唑基)-5-(4-氟苯亚胺基)异噁唑(5d): 产率72%, m.p. 248.0~250.1 ℃;1H NMRδ: 7.04~7.84(m, 13H, ArH), 8.06(s, 1H, N=CH), 9.71(br s, 1H, Benzimidazol-NH);13C NMRδ:165.1, 162.6, 156.8, 151.6, 147.4, 146.6, 142.1, 134.5, 132.4, 131.3, 129.2, 125.9, 124.1, 123.7, 119.7, 116.5, 115.3, 110.7, 100.3; IRν: 3 120, 3 031, 1 610, 1 596, 1 510, 1 446 cm-1; HR-MSm/z: Calcd for C23H15N4OF{[M+H]+}383.130 8, found 383.130 2。
3-(4-氟苯基)-4-(2-苯并咪唑基)-5-苯亚胺基异噁唑(5e): 产率61%, m.p. 225.1~226.7 ℃;1H NMRδ: 7.01~7.85(m, 13H, ArH), 8.04(s, 1H, N=CH), 9.84(br s, 1H, Benzimidazol-NH);13C NMRδ: 165.3, 162.7, 149.1, 147.5, 143.2, 137.7, 134.8, 132.6, 130.1, 129.8, 128.9, 128.3, 125.2, 124.2, 123.5, 120.3, 119.2, 117.0, 116.8, 111.7, 101.1; IRν: 3 125, 3 037, 1 606, 1 568, 1 510, 1 448 cm-1; HR-MSm/z: Calcd for C23H15N4OF{[M+H]+}383.130 8, found 383.130 0。
3-(4-氯苯基)-4-(2-苯并咪唑基)-5-苯亚胺基异噁唑(5f): 产率75%, m.p. 224.2~225.8 ℃;1H NMRδ: 7.06~7.87(m, 13H, ArH), 8.15(s, 1H, N=CH), 9.04(br s, 1H, Benzimidazol-NH);13C NMRδ: 164.7, 162.0, 148.7, 146.8, 142.2, 141.3, 135.5, 134.4, 132.3, 130.2, 129.7, 129.4, 127.7, 124.7, 123.8, 119.8, 115.4, 111.2, 100.6; IRν: 3 141, 3 030, 1 615, 1 592, 1 571, 1 449 cm-1; HR-MSm/z: Calcd for C23H15N4OCl{[M+H]+}399.101 3, found 399.100 6。
3-(4-溴苯基)-4-(2-苯并咪唑基)-5-苯亚胺基异噁唑(5g): 产率69%, m.p. 228.5~229.8 ℃;1H NMRδ: 7.05~7.84(m, 13H, ArH), 8.12(s, 1H, N=CH), 10.92(br s, 1H, Benzimidazol-NH);13C NMRδ:164.7, 162.2, 148.7, 146.1, 142.5, 141.2, 134.7, 132.2, 129.7, 129.3, 128.4, 124.7, 123.7, 119.8, 116.5, 116.3, 115.2, 111.3, 100.7; IRν: 3 146, 3 034, 1 609, 1 587, 1 574, 1 487, 1 449 cm-1; HR-MSm/z: Calcd for C23H15N4OBr{[M+H]+}443.050 7, found 443.049 8。
3-(2,4-二氯苯基)-4-(2-苯并咪唑基)-5-苯亚胺基异噁唑(5h): 产率65%, m.p. 225.4~226.1 ℃;1H NMRδ: 7.05~7.81(m, 12H, ArH), 8.08(s, 1H, N=CH), 10.87(br s, 1H, Benzimidazol-NH);13C NMRδ:165.8, 161.7, 149.0, 146.2, 141.9, 139.4, 136.0, 133.0, 132.4, 130.6, 129.7, 128.6, 128.2, 127.6, 126.3, 124.7, 123.8, 119.8, 115.5, 111.7, 101.2; IRν: 3 139, 3 024, 1 610, 1 586, 1 488, 1 449 cm-1; HR-MSm/z: Calcd for C23H14N4OCl2{[M+H]+}433.062 3, found 433.063 1。
1.3 抑菌活性测试
采用菌丝生长速率法测定目标化合物的离体抑菌活性[19],以番茄灰霉菌(B.cinerea)和生菜菌核菌(S.sclerotiorum)为测试菌种。按培养基与药液体积比9 ∶1的比例制成含药培养基(马铃薯-葡萄糖-琼脂,PDA),溶解后制成浓度为100 μg·mL-1的PDA含药平板,将菌饼反接到含药平板中央,置于(25±1) ℃的培养箱中培养,测量菌落直径,每处理设3个重复组。以杀菌剂百菌清(Chlorothalonil)为对照药剂,按下式计算抑制率。
抑制率=[(D0-D1)/D0]×100%
式中:D0为对照菌落扩展直径,D1为处理菌落扩展直径
2 结果与讨论
2.1 表征
5a~5h的1H NMR谱中,苯并咪唑环上NH为活泼质子,显示出宽的单峰,位于δ9.04~10.92。甲亚胺基N=CH质子受N吸电子作用影响,δ较大,位于δ7.91~8.15,而苯环质子为多重峰,出现在δ6.96~7.89处。
IR分析表明,苯并咪唑环N—H的伸缩振动吸收峰位于3 120~3 148 cm-1,苯环上C—H伸缩振动吸收峰出现在3 016~3 037 cm-1,苯环(杂环)C=C和C=N的吸收峰分别出现在1 606~1 615 cm-1和1 586~1 596 cm-1处。
2.2 抑菌活性
5a~5h对病原菌的抑制率见表1。由表1可知,用药量为100 μg·mL-1时,5c和5d对灰霉菌的抑制率为54.0%和50.3%,显示出一定的抑菌活性。5c~5e对菌核菌的抑制率分别为75.1%, 76.1%和71.3%,表现出较好的抑菌活性,其活性与对照药剂百菌清(抑制率70.2%)相当。
从化合物的分子结构看,异噁唑环或苯亚甲胺基的苯环上含有取代基时(甲基除外),化合物的抑菌活性远高于苯环上无取代基的5a,有进一步优化结构的价值。
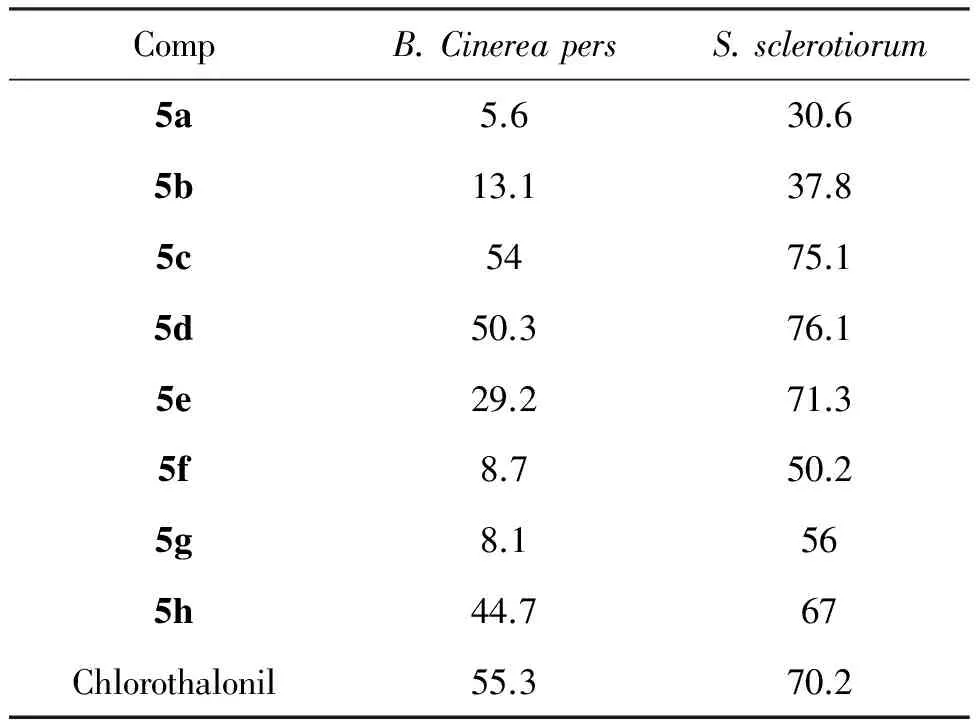
表1 5a~5h对病原菌的抑制率(%)
3 结论
设计并合成了8个新型的3-取代苯基-4-(2-苯并咪唑基)-5-取代苯亚胺基异噁唑类化合物。抑菌活性测试结果表明:苯环上含有氟原子或甲氧基的席夫碱(5c, 5d和5e)对生菜菌核菌有较高的抑制活性,其活性与对照药剂百菌清相当。该研究结果为设计新型的具有抑菌活性的席夫碱类化合物提供了有益参考。
[1] Kumar K S, Ganguly S, Veerasamy R,etal. Synthesis,antiviral activity and cytotoxicity evaluation of Schiff bases of some 2-phenyl quinazoline-4(3)H-ones[J].Eur J Med Chem,2010,45(11):5474-5479.
[2] Ali I, Haque A, Saleem K. Curcumin-I Knoevenagel’s condensates and their Schiff’s bases as anticancer agents:Synthesis,pharmacological and simulation studies[J].Bioorg Med Chem,2013,21(13):3808-3820.
[3] 姜羽佳,刘兴利,郑礼婷,等. 含1,2,4-三唑和席夫碱结构的新型吲哚衍生物的合成及其抗菌活性[J].合成化学,2014,22(4):463-470.
[4] Rakesh K P, Manukumar H M, Gowda D C.Schiff’s bases of quinazolinone derivatives:Synthesis and SAR studies of a novel series of potential anti-inflammatory and antioxidants[J].Bioorg Med Chem Lett,2015,21(5):1072-1077.
[5] Hranjec M, Starcevic K, Pavelic S K,etal. Synthesis,spectroscopic characterization and antiproliferative evaluationinvitroof novel Schiff bases related to benzimidazoles[J].Eur J Med Chem, 2011,46(6):2274-2279.
[6] 袁定重,陈碧波. 氧化石墨烯负载席夫碱钯催化剂的合成、表征及对Suzuki反应催化性能的研究[J].有机化学,2014,34(8):1630-1638.
[7] 邓平,吴敏. 新型香草醛缩苯并咪唑Schiff碱的合成及其抑菌活性[J].合成化学,2016,24(2):148-151.
[8] Achar K C, Hosamani K M, Seetharamareddy H R,etal.In-vivoanalgesic and anti-inflammatory activities of newly synthesized benzimidazole derivatives[J].Eur J Med Chem,2010,45(5):2048-2054.
[9] Tonelli M, Novelli F, Tasso B,etal. Antiviral activity of benzimidazole derivatives[J].Bioorg Med Chem,2014,22(17):4893-4908.
[10] Zhu W, Da Y, Wu D,etal. Design,synthesis and biological evaluation of new 5-nitro benzimidazole derivatives as AT1 antagonists with anti-hypertension activities[J].Bioorg Med Chem,2014,22(7):2294-2302.
[11] Bernard A M, Cabiddu M G, Montis SD,etal. Synthesis of new compounds with promising antiviral properties against group A and B human Rhinoviruses[J].Bioorg Med Chem,2014,22(15):4061-4066.
[12] Michalska K, Karpiuk I, Król M,etal. Recent development of potent analogues of oxazolidinone antibacterial agents[J].Bioorg Med Chem,2013,21(3):577-591.
[13] Pedada S R, Yarla N S, Pawan J,etal. Synthesis of new secretory phospholipase A2-inhibitory indole containing isoxazole derivatives as anti-inflammatory and anticancer agents[J].Eur J Med Chem,2016,112(1):282-297.
[14] 张峥,李忠. 异噁唑衍生物合成及其生物活性[J].农药研究与应用,2007,11(4):21-26.
[15] Jiang L, Wang M, Wan F,etal. Synthesis and biological activity of tri-substituted 1,2,4-triazoles bearing benzimidazole moiety[J].Phosphorus Sulfur and Silicon,2015,190(10):1599-1605.
[16] Liu F, Wang M, Teng X,etal. Synthesis and biological evaluation of novel 2-(substitutedisoxazol-4-yl)-5-arylamino-1,3,4-oxadiazoles[J].Res Chem Intermed,40(4):1575-1581.
[17] 宁国慧,赵温涛,边强,等. 3,5-二取代的异噁唑啉类衍生物的合成及杀菌活性研究[J].有机化学,2014,34(9):1800-1805.
[18] 宋华付,丁绍民. 2-乙氰基苯并咪唑的制备[J].染料与染色,2003,10(2):116-116.
[19] 孙家隆,慕卫. 农药学实验技术与指导[M].北京:化学工业出版社,2009:228-229.
Synthesis and Antifungal Activities of Novel Schiff Bases Bearing Benzimidazole and Isoxazole Moieties
JIN Fei, WAN Fu-xian, ZAN Ning-ning, JIANG Lin*
(College of Chemistry and Material Science, Shandong Agricultural University, Taian 271018, China)
According to the theory of active sub-structure connection, a series of Schiff bases(5a~5h) bearing benzimidazole and isoxazole moieties were synthesized by oximation, chlorination, cyclization and condensation reactions from substituted benzaldehyde, hydroxylamine hydrochloride,N-chlorosuccinimid and 2-benzimidazolyl acetonitrile. The structures were characterized by IR,1H NMR,13C NMR and HR-MS. All target compounds were tested forinvitroantifungal activities againstB.cinereaandS.sclerotiorumby the mycelium growth rate method, and the results indicated that the Schiff bases containing fluorine or methoxy moiety on benzene ring(5c, 5d and 5e) displayed good antifungal activities againstS.sclerotiorum, with inhibition rate of 71.3%~76.1% at concentration of 100 μg·mL-1.
benzaldehyde; Schiff base; benzimidazole; isoxazole; synthesis; antifungal activity
2016-04-08;
2016-11-10
山东省自然科学基金资助项目(ZR2014BM030)
靳飞(1989-),女,汉族,山东新泰人,硕士研究生,主要从事农药化学研究。
姜林,教授, Tel. 0538-8248768, E-mail: jiangl@sdau.edu.cn
O626; O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2017.01.16097

